1.本发明涉及食品安全检测技术领域,具体地,涉及一种抗米酵菌酸的单克隆抗体及其应用。
背景技术:
2.唐菖蒲伯克霍尔德菌椰毒致病变种(burkholderia gladioli pv.cocovenenans,bgc)容易污染谷类制品(发酵玉米面、糯玉米汤圆等)、变质银耳,产生次级代谢产物米酵菌酸(bongkrekic acid,米酵菌酸),米酵菌酸是一种强呼吸毒素,主要靶器官是肝、脑、肾等脏器,一旦中毒会因呼吸衰竭而死亡,据不完全统计,自2014年以来,我国由米酵菌酸引起的食物中毒事件高达几十余次,误食后病死率高达50%及以上。
3.针对米酵菌酸检测,仪器分析法需要昂贵的仪器、专业的人员操作与维护、复杂前处理,色谱时间长并且无法实现现场快速检测。而免疫分析法是基于抗原与抗体特异性结合反应的分析技术,适合现场筛选、简单、快速、成本低,是目前常用的食品安全快速检测技术。中国专利已经公开了一种食品中米酵菌酸的检测方法及其应用,其elisa方法灵敏度为50μg/kg;以及一种食品中米酵菌酸的检测方法及其应用,胶体金免疫层析法方法检测限为5μg/kg;刘秀梅建立的酶联免疫分析方法检测线性范围在103~105μg/l(刘秀梅,文卫华.米酵菌酸单克隆抗体细胞株的建立[j].卫生研究,1996,025(004):239-241.)。对于现有技术来说,还未能达到对米酵菌酸的高灵敏度的免疫检测,随着近几年米酵菌酸中毒事件频发,灵敏度更高的免疫分析方法是必要的;另外酶联免疫分析方法裸眼对于同一颜色变化深浅辨别能力有限,而胶体金免疫层析法存在假阳性。
技术实现要素:
[0004]
本发明的目的是为了克服现有技术的上述不足,提供一种高灵敏米酵菌酸抗体人工抗原及其应用。
[0005]
本发明的第一个目的是提供一种分泌抗米酵菌酸的单克隆抗体的杂交瘤细胞株。
[0006]
本发明的第二个目的是提供一种抗米酵菌酸的单克隆抗体。
[0007]
本发明的第三个目的是提供所述的杂交瘤细胞株在建立米酵菌酸的检测方法和/或制备米酵菌酸的检测试剂盒中的应用。
[0008]
本发明的第四个目的是提供所述的单克隆抗体在建立米酵菌酸的检测方法和/或制备米酵菌酸的检测试剂盒中的应用。
[0009]
本发明的第五个目的是提供一种米酵菌酸的检测方法。
[0010]
本发明的第六个目的是提供一种检测米酵菌酸的免疫学试剂盒,
[0011]
为了实现上述目的,本发明是通过以下方案予以实现的:
[0012]
本发明通过将结构式如式(i)所示的米酵菌酸半抗原偶联到载体蛋白上,成功制备得到两种人工抗原,利用式(ii-1)所示的米酵菌酸完全抗原1免疫动物,制备能分泌抗米酵菌酸抗体的杂交瘤细胞,利用式(ii-2)所示的米酵菌酸完全抗原2作为包被原进一步建
立米酵菌酸的免疫检测方法。本发明所制备的人工抗原、特异性抗体以及以此为基础的所建立的免疫分析法灵敏度高,可补充目前灵敏度低的需求。其中酶联免疫方法对米酵菌酸的线性检测范围为9.72~32.98ng/ml,检测限为5.79ng/ml;其中双模式-比色荧光传感器分析方法中,多色比色法对米酵菌酸检测的线性检测范围为11.29~30.46ng/ml,检测限为8.45ng/ml,提高可视化检测的准确性,而荧光法对米酵菌酸检测的线性检测范围为8.49~46.19ng/ml,检测限为4.78ng/ml,两者的结合由于它们的独立响应和相互确认而显示出对目标物的优异检测性能。双模式就是为了相互验证对目标物检测的准确性,避免一种检测方法对目标物检测的偶然性。另外,多色比色方法中不同目标物浓度可以相应多种丰富颜色变化,避免了裸眼对单一颜色的辨别差异,提高可视化检测的准确性;荧光和多色比色双模式检测米酵菌酸,由于荧光法和多色比色法独立响应和相互确认而显示出对目标物的优异检测性能。
[0013]
因此本发明要求保护一种抗分泌米酵菌酸的单克隆抗体的杂交瘤细胞株,所述杂交瘤细胞株于2021年5月12日保藏于中国典型培养物保藏中心,保藏编号为:cctcc no.c2021127。
[0014]
一种抗米酵菌酸的单克隆抗体,所述米酵菌酸的单克隆抗体由所述的杂交瘤细胞株分泌。
[0015]
所述的杂交瘤细胞株在建立米酵菌酸的检测方法和/或制备米酵菌酸的检测试剂盒中的应用。
[0016]
所述的单克隆抗体在建立米酵菌酸的检测方法和/或制备米酵菌酸的检测试剂盒中的应用。
[0017]
本发明还提供一种金纳米粒子的制备方法,包括以下步骤:
[0018]
配制种子液:柠檬酸钠溶液与氯金酸溶液,充分混合,其中氯金酸和柠檬酸钠的摩尔比1:30~40;
[0019]
配制生长液;氯金酸溶液、硝酸盐溶液和抗坏血酸溶液,充分混合,其中氯金酸、硝酸盐和抗坏血的摩尔比1:1~2:5~10;
[0020]
混合:制备得到的将种子液和制备得到的生长液中,充分混合,体积比为1:10~15,溶液由淡黄色变成灰蓝色,即得。
[0021]
优选地,配制种子液:柠檬酸钠溶液与氯金酸溶液,充分混合,其中氯金酸和柠檬酸钠的摩尔比1:30;
[0022]
配制生长液;氯金酸溶液、硝酸盐溶液和抗坏血酸溶液,充分混合,其中氯金酸、硝酸盐和抗坏血的摩尔比1:1.5:5;
[0023]
混合:制备得到的将种子液和制备得到的生长液中,充分混合,体积比为1:10,溶液由淡黄色变成灰蓝色,即得。
[0024]
一种金纳米粒子,所述金纳米粒子是以所述制备方法制备得到的。
[0025]
以及一种荧光碳点的制备方法,n,n-二甲基甲酰胺为溶剂的柠檬酸和尿素混合溶液,160~200℃反应4~6h,其中柠檬酸和尿素质量比为1:2~4。
[0026]
优选地,n,n-二甲基甲酰胺为溶剂的柠檬酸和尿素混合溶液,160℃反应5h,其中柠檬酸和尿素质量比为1:3。
[0027]
一种荧光碳点,所示荧光碳点是以所述制备方法得到制备得到的。
[0028]
本发明还要求保护一种检测米酵菌酸的免疫学方法,使用所述的单克隆抗体作为检测抗体。
[0029]
优选地,所述检测方法为间接竞争检测法检测抗原,以结构式如(ii)所示化合物作为包被原,
[0030][0031]
更优选地,所述检测方法为间接竞争检测法检测抗原,以结构式如(ii-2)所示化合物作为包被原,
[0032][0033]
进一步更优选地,包括以下步骤:
[0034]
以所述的单克隆抗体作为检测抗体;
[0035]
以结构式如(ii-2)所示化合物作为包被原包被固相载体;
[0036]
洗涤并封闭固相载体;
[0037]
将梯度浓度的米酵菌酸标准液和检测抗体加入封闭后的固相载体,孵育;
[0038]
洗涤固相载体;
[0039]
向洗涤后的固相载体中加入酶标二抗;
[0040]
利用tmb进行显色反应,检测吸光值。
[0041]
再一步更有选地,包括以下步骤:
[0042]
1.包被:用ph 9.6碳酸缓冲液将以结构式(ii-2)所示的米酵菌酸完全抗原2作为包被原稀释至1μg/ml,加入酶标板孔中,100μl/孔,37℃充分反应;
[0043]
2.洗涤:倾去孔内液体,洗板2次,拍干孔中液体;
[0044]
3.封闭:每孔加入200μl封闭液,37℃封闭2h,甩干孔内液体,倒置于干燥;
[0045]
4.加样及孵育:将米酵菌酸稀释成系列梯度浓度的标准液,从100ng/ml开始1.3倍梯度稀释,一共稀释12个浓度(100ng/ml、76.9ng/ml、59.2ng/ml、45.5ng/ml、35.0ng/ml、20.7ng/ml、15.9ng/ml、12.3ng/ml、7.3ng/ml、4.3ng/ml、3.3ng/ml、2.5ng/ml),每孔加50μl,然后加入10ng/ml所述单克隆抗体50μl,37℃充分反应,洗板5次,拍干孔中液体;
[0046]
5.加二抗:每孔加入100μl稀释5000倍的hrp-羊抗鼠,37℃水浴箱中反应30min后,洗板5次,拍干孔中液体;
[0047]
6.显色:每孔加入100μl tmb底物液,置于37℃反应10min
[0048]
7.终止:加入50μl体积分数10%h2so4终止显示反应;
[0049]
8.测定:用酶联免疫检测仪测定各孔a450 nm的吸光值。
[0050]
进一步更优选地,包括以下步骤:
[0051]
以所述的单克隆抗体作为检测抗体;
[0052]
以结构式如(ii-2)所示化合物作为包被原包被固相载体;
[0053]
洗涤并封闭固相载体;
[0054]
将梯度浓度的米酵菌酸标准液和检测抗体加入封闭后的固相载体,孵育;
[0055]
洗涤固相载体;
[0056]
向洗涤后的固相载体中加入酶标二抗;
[0057]
tmb底物液加入固相载体,得到预显色体系;
[0058]
预显色体系与所述荧光碳点混合,检测620nm的荧光强度;
[0059]
预显色体系与10%h2so4混合终止反应,之后与ctab、所述金纳米粒子、和碘化钾混匀,检测400nm~800nm的吸光度。
[0060]
再一步更有选地,包括以下步骤:
[0061]
1.包被:用ph 9.6碳酸缓冲液将以结构式(ii-2)所示的米酵菌酸完全抗原2作为包被原稀释至1μg/ml,加入酶标板孔中,100μl/孔,37℃充分反应;
[0062]
2.洗涤:倾去孔内液体,洗板2次,拍干孔中液体;
[0063]
3.封闭:每孔加入200μl封闭液,37℃封闭2h,甩干孔内液体,倒置于干燥;
[0064]
4.加样及孵育:将米酵菌酸稀释成系列梯度浓度的标准液,从1000ng/ml开始1.3倍梯度,一共稀释12个浓度(100ng/ml、76.9ng/ml、59.2ng/ml、45.5ng/ml、35.0ng/ml、20.7ng/ml、15.9ng/ml、12.3ng/ml、7.3ng/ml、4.3ng/ml、3.3ng/ml、2.5ng/ml),每孔加50μl,然后加入10ng/ml所述单克隆抗体50μl,37℃充分反应,洗板5次,拍干孔中液体;
[0065]
5.加二抗:每孔加入100μl稀释5000倍的hrp-羊抗鼠,37℃水浴箱中反应30min后,洗板5次,拍干孔中液体;
[0066]
6.显色:每孔加入100μl tmb底物液,置于37℃反应10min,得到预显色体系;
[0067]
7.取得到预显色体系100μl,加入50μl所述红色荧光碳点溶液,测仪在540nm测定各孔620nm的荧光强度;
[0068]
8.取得到预显色体系100μl,加入50μl体积比10~15%h2so4终止液终止反应;
[0069]
9.向步骤8终止反应的体系加入含有50~100μl 0.1~0.2m ctab溶液、50~100μl所述金纳米粒子溶液、50~100μl 0.02~0.04m碘化钾中,室温充分反应,检测400nm~800nm测定各孔的吸光度。
[0070]
本发明还要求保护一种检测米酵菌酸的免疫学试剂盒,含有所述的单克隆抗体。
[0071]
优选地,还含有结构式如(ii)所示化合物作为包被原,
[0072][0073]
优选地,还含有结构式如(ii-2)所示化合物作为包被原,
[0074]
更优选地,还含终止液h2so4、tmb底物液。
[0075]
更优选地,还含有所述金纳米粒子、和/或所述荧光碳点。
[0076]
进一步优选地,还含有ctab溶液、和/或碘化钾溶液。
[0077]
更进一步优选地,还含有0.1~0.2m ctab溶液、和/或0.02~0.04m碘化钾溶液。
[0078]
与现有技术相比,本发明具有以下有益效果:
[0079]
本发明提供了一种单克隆抗体,其由于2021年5月12日保藏于中国典型培养物保藏中心,保藏编号为:cctcc no.c2021127的杂交瘤细胞分泌,以此为基础的所建立的免疫分析法灵敏度高,可补充目前灵敏度低的需求。其中酶联免疫方法对米酵菌酸的线性检测范围为9.72~32.98ng/ml,检测限为5.79ng/ml;其中双模式-比色荧光传感器分析方法中,多色比色法对米酵菌酸检测的线性检测范围为11.29~30.46ng/ml,检测限为8.45ng/ml,提高可视化检测的准确性,而荧光法对米酵菌酸检测的线性检测范围为8.49~46.19ng/ml,检测限为4.78ng/ml,两者的结合由于它们的独立响应和相互确认而显示出对目标物的优异检测性能。
附图说明
[0080]
图1为米酵菌酸完全抗原1(如式(ii-1)所示)鉴定图。
[0081]
图2为米酵菌酸完全抗原2(如式(ii-2)所示)鉴定图。
[0082]
图3为米酵菌酸单克隆抗体的elisa竞争标准曲线图。
[0083]
图4为不同长径比金纳米颗粒形貌及颜色。
[0084]
图5为红色荧光碳点形貌、粒径、激发波长和发射波长。
[0085]
图6为双模式-比色荧光传感器示意图。
[0086]
图7为发明制备的金纳米星的波长和颜色随米酵菌酸浓度变化关系图。
[0087]
图8为发明制备的碳点的荧光强度随米酵菌酸浓度变化关系图。
[0088]
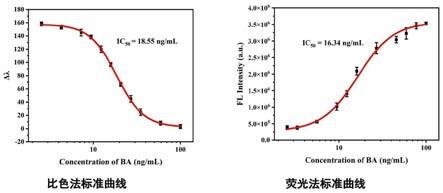
图9为米酵菌酸单克隆抗体的荧光和多色比色双模式传感器标准曲线图。
具体实施方式
[0089]
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0090]
实施例1米酵菌酸完全抗原的制备
[0091]
一、实验方法
[0092]
1、米酵菌酸完全抗原1(式(ii-1)所示)的制备
[0093]
将0.9mg米酵菌酸(结构式如式(i)所示)溶于900μl乙磺酸中,接着搅拌下加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺,室温下避光搅拌4h,获得活化后的半抗原,称为a液。其中,米酵菌酸半抗原(结构式如式i所示)、乙磺酸、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺的摩尔比为1:1:1.5:1.5,
[0094][0095]
将10mg牛乳铁蛋白(lf)溶解在ph 9.6碳酸缓冲液中,其牛乳铁蛋白浓度为5mg/ml,称为b液。
[0096]
在冰浴搅拌下将上述a液体滴加到b液中,a液中半抗原与所述b液中的所述载体蛋白的摩尔比为25:1。滴加后,用3m naoh将ph调节至9.5。避光反应过夜,并经过透析纯化后获得如式(ii-1)所示米酵菌酸完全抗原。
[0097][0098]
2、米酵菌酸完全抗原2(式(ii-2)所示)的制备
[0099]
将10mg卵清蛋白(ova)溶解在ph 9.6碳酸缓冲液中,其牛乳铁蛋白浓度为5mg/ml,称为c液。
[0100]
在冰浴搅拌下将上述a液体滴加到c液中,a液中半抗原与所述c液中的所述载体蛋白的摩尔比为25:1。滴加后,用3m naoh将ph调节至9.5。避光反应过夜,并经过透析纯化后获得如式(ii-2)所示米酵菌酸完全抗原。
[0101][0102]
二、实验结果
[0103]
通过分别扫描半抗原(结构式如式(i)所示)、米酵菌酸完全抗原1(结构式如式(ii-1)所示)、米酵菌酸完全抗原2(结构式如式(ii-2)所示)及载体蛋白溶液在紫外区(200~400nm)的吸收光。如图1和图2所示,米酵菌酸完全抗原1(结构式如式(ii-1)和米酵菌酸完全抗原2(结构式如式(ii-2)所示)的紫外吸收特征峰相对于原载体蛋白,均具有一定程度红移或蓝移,证明米酵菌酸完全抗原1(结构式如式(ii-1)和米酵菌酸完全抗原2(结构式如式(ii-2)所示)制备成功。
[0104]
实施例2抗米酵菌酸单克隆抗体制备
[0105]
一、实验方法
[0106]
取6~8周龄bal b/c小鼠(北京维通利华实验动物技术有限公司),将制备的浓度为1mg/ml式(ii-1)所示米酵菌酸完全抗原1免疫抗原与弗氏完全佐剂等量混合,完全乳化后,注射小鼠腹部和背部,每只小鼠注射100μl。第一次免疫采用弗氏完全佐剂,后加强免疫采用弗氏不完全佐剂,每隔3周免疫一次,一共加强免疫4次。第三次加强免疫后一周从尾部静脉取血检效价和抑制。第四次加强免疫后,选取效价和抑制率都较高的小鼠进行细胞融合,融合前3天加倍剂量强化免疫一次。
[0107]
将小鼠骨髓瘤sp2/0细胞与脾细胞以5:1的比例混合,在50%peg下融合,洗涤、离心后以hat培养基悬浮,接种于24孔培养板中,在37℃5%的co2培养箱中培养5天后以hat培养基半换液,第10天全部换成ht培养基。待板内细胞长至培养孔面积的1/3时,间接elisa法筛选细胞阳性孔,筛选时以结构式(ii-2)所示的米酵菌酸完全抗原2作为包被抗原。阳性孔进一步用间接elisa鉴定筛选,有限稀释法克隆至大约每孔《1个细胞,10天后检测为阳性且竞争较好的单克隆孔所得细胞株即为分泌单克隆抗体的细胞株。杂交瘤细胞扩大培养后,将细胞株收集起来,注射小鼠腹部,每只小鼠注射1ml,7天后取小鼠腹水进行纯化,得到单克隆抗体。
[0108]
二、实验结果
[0109]
结果如表1所示,以结构式(ii-2)所示的米酵菌酸完全抗原2作为包被原,包被浓
度1μg/ml,药物浓度100ng/ml。
[0110]
表1小鼠抗血清表征:
[0111] 效价抑制1号小鼠8k71.2%2号小鼠16k66.0%3号小鼠16k75.1%
[0112]
因此选择选择效价和抑制最好的3号小鼠得到的单克隆抗体进行后续检测方法的建立检测方法,分泌该单克隆抗体的杂交瘤细胞株命名为a5。杂交瘤细胞株a5于2021年5月12日保藏于中国典型培养物保藏中心,中国武汉,保藏编号为:cctcc no.c2021127。
[0113]
实施例3酶联免疫分析方法的建立及特异性检测
[0114]
一、实验方法
[0115]
(一)取实施例2的杂交瘤细胞株a5分泌的中效价和抑制最好的3号小鼠制备得到的单克隆抗体建立标准曲线,包被原的工作浓度为1000ng/ml,采用三组平行试验(n=3)。
[0116]
抗血清间接竞争检测方法建立标准曲线的步骤如下:
[0117]
1.包被
[0118]
用ph 9.6碳酸缓冲液将以结构式(ii-2)所示的米酵菌酸完全抗原2作为包被原稀释至1μg/ml,加入酶标板孔中,100μl/孔,37℃水浴箱中过夜;
[0119]
2.洗涤
[0120]
倾去孔内液体,洗板机洗板2次,拍干孔中液体;
[0121]
3.封闭
[0122]
每孔加入200μl封闭液,37℃封闭2h,甩干孔内液体,倒置于37℃烘箱中1h备用;
[0123]
4.加样及孵育
[0124]
将米酵菌酸稀释成系列梯度浓度的标准液,从1000ng/ml开始1.3倍梯度,一共稀释12个浓度(100ng/ml、76.9ng/ml、59.2ng/ml、45.5ng/ml、35.0ng/ml、20.7ng/ml、15.9ng/ml、12.3ng/ml、7.3ng/ml、4.3ng/ml、3.3ng/ml、2.5ng/ml),每孔加50μl,然后加入10ng/ml抗体(实施例2的杂交瘤细胞株a5分泌的单克隆抗体)的稀释液50μl,37℃水浴箱中反应40min后,洗板机洗板5次,拍干孔中液体;
[0125]
5.加二抗
[0126]
每孔加入100μl稀释5000倍的hrp-羊抗鼠,37℃水浴箱中反应30min后,洗板机洗板5次,拍干孔中液体;
[0127]
6.显色
[0128]
每孔加入100μl tmb底物液,置于37℃水浴箱中显色10min;
[0129]
7.终止
[0130]
每孔加入50μl体积分数为10%h2so4终止液;
[0131]
8.测定
[0132]
用酶联免疫检测仪测定各孔a450 nm的吸光值;
[0133]
9.计算
[0134]
用origin8.5计算抑制曲线的ic10、ic20、ic50、ic80值;
[0135]
(二)特异性检测
[0136]
利用上一步的方法对市面上常见的毒素进行检测,以评价该检测方法的特异性。
[0137]
交叉反应率r(%)如下所示:
[0138]
r(%)=ic50(米酵菌酸)/ic50(其他常见毒素)
×
100%。
[0139]
二、实验结果
[0140]
标准曲线见图3。所得酶联免疫法标准曲线的ic50值为17.90ng/ml,检测限为(ic10)5.79ng/ml,线性检测范围为9.72~32.98ng/ml。
[0141]
特异性检测如表2所示,结果显示,制备的单克隆抗体有较好的特异性,与市面上常见的毒素没有交叉。
[0142]
表2
[0143]
[0144][0145]
实施例4金纳米粒子的合成
[0146]
一、实验方法
[0147]
采用种子生长诱导法合成,合成步骤如下:
[0148]
1.配制种子液
[0149]
将柠檬酸钠溶液加入氯金酸溶液,混合加热80~100℃搅拌3min,其中氯金酸和柠檬酸钠的摩尔比1:30。
[0150]
2.配制生长液
[0151]
将氯金酸溶液、硝酸盐溶液和抗坏血酸溶液混合搅拌2min,其中氯金酸、硝酸盐和抗坏血的摩尔比1:1.5:5。
[0152]
3.混合
[0153]
将种子液加到生长液中,体积比为1:10,混合搅拌2~3min,溶液由淡黄色变成灰蓝色,就可以得到金纳米粒子。
[0154]
二、实验结果
[0155]
得到如图4所示的金纳米粒子,同样的比例下,不同粒径金纳米粒子有不同的形貌和颜色:蓝色的金纳米粒子类似星星的形状,周围有较多的犄角,粒径较大;紫色的金纳米粒子犄角变短,粒径居中;红色的金纳米粒子基本没有犄角,呈圆形,粒径最小。
[0156]
实施例5红色荧光碳点的合成
[0157]
一、实验方法
[0158]
采用一步水热法合成,合成步骤如下:
[0159]
1.用10ml n,n-二甲基甲酰胺溶解柠檬酸和尿素,其中,柠檬酸用量为1~2g,尿素用量对应为3~6g,柠檬酸和尿素质量比为1:3。
[0160]
2.将上一步的混合液转移到反应釜,160℃加热5h。
[0161]
二、实验结果
[0162]
制备得到如图5所示的碳点。从图5a可以碳点看出分散均匀,而图5b是图5a其中一个碳点的高分辨电镜图,晶格条纹清晰可见,晶格间距为0.21nm,图5c为碳点粒径分布,在1.75nm~4.25nm之间,从图5d可以看出碳点的激发波长(ex)为540nm,发射波长(em)为620nm。
[0163]
实施例6荧光和多色比色双模式传感器检测米酵菌酸的方法
[0164]
荧光和多色比色双模式检测米酵菌酸的方法原理图如图6所示,首先间接竞争检测法中检测体系待测的样品抗原米酵菌酸的量会影响底物tmb
+
的量,进一步:
[0165]
对于荧光法:底物tmb
+
在波长为650nm有紫外吸收峰,与碳点(cds)的荧光发射光谱有重合,基于内滤效应,底物tmb
+
可吸收cds发射波长的能量,具体的:检测体系待测样品中米酵菌酸的量跟tmb
+
的量成反比,而cds的荧光强度又随tmb
+
的量增加而降低,从而可以通过测定cds的荧光强度对米酵菌酸含量进行定量。
[0166]
对于在多色比色法:蓝色的tmb
+
由于与10%h2so4发生氧化反应,变成黄色tmb
2+
,进一步黄色tmb
2+
和纳米金星在表面活性剂ctab存在下发生氧化还原反应(tmb
2+
+2au=tmb+2au
+
),纳米金星的粒径因此不断变小,而不同粒径的纳米金星在可见光下显现的颜色是不一样的,从而改变待测的体系的溶液颜色。具体的:检测体系待测样品中米酵菌酸的量跟tmb
+
的量成反比,而tmb
+
的量决定tmb
2+
的量,纳米金星的粒径又随tmb
2+
的量增加而变短,从而可以通过测定待测的体系的吸光度对米酵菌酸含量进行定量。
[0167]
一、实验方法
[0168]
取实施例2的杂交瘤细胞株a5分泌的中效价和抑制最好的3号小鼠制备得到的单克隆抗体建立标准曲线,包被原(以结构式(ii-2)所示的米酵菌酸完全抗原2)的包被浓度为1000ng/ml,采用三组平行试验(n=3)。
[0169]
检测步骤如下:
[0170]
1.步骤1~5同实施例3酶联免疫方法抗血清间接竞争检测步骤;
[0171]
6.显色:每孔加入tmb底物液200μl,置于37℃水浴箱中显色10min;
[0172]
7.取步骤6显色后的溶液100μl,加入50μl实施例5制备得到的10m红色荧光碳点溶液,用酶联免疫检测仪在540nm测定各孔620nm的荧光强度;
[0173]
8.取步骤6显色后的溶液100μl,加入50μl 10%h2so4终止液终止反应;
[0174]
9.向步骤8终止反应的体系加入到含有50μl 0.1~0.2m ctab溶液、50μl实施例4制备得到的50mm金纳米粒子溶液、50μl 0.02m碘化钾中,反应10min,酶联免疫检测仪在400nm~800nm测定各孔的吸光度。
[0175]
二、实验结果
[0176]
碳点的荧光强度随米酵菌酸浓度变化关系图7所示;金纳米粒子的波长和颜色随
米酵菌酸浓度变化如图8所示。
[0177]
标准曲线见图9。其中多色比色法的检测限为8.45ng/ml,线性检测范围为11.29~30.46ng/ml;荧光法的检测限为4.78ng/ml,线性检测范围为8.49~46.19ng/ml。
[0178]
实施例7一种荧光和多色比色双模式传感器检测米酵菌酸的试剂盒
[0179]
一、组成
[0180]
抗米酵菌酸的单克隆抗体:由于2021年5月12日保藏于中国典型培养物保藏中心,保藏编号为:cctcc no.c2021127的杂交瘤细胞株分泌;
[0181]
包被原:结构式如(ii-2)所示化合物,
[0182][0183]
终止液(体积分数10%的h2so4)、金纳米粒子、荧光碳点、ctab溶液、和碘化钾溶液;
[0184]
其中金纳米粒子是按照实施例4的方法制备得到的,荧光碳点是按照实施例5的方法制备得到的。
[0185]
二、使用方法
[0186]
同实施例6。
[0187]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
