1.本发明涉及一种通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,及其中间体和制备方法,以及在制备治疗与btk活性或表达量相关疾病的药物中的应用。
背景技术:
2.布鲁顿酪氨酸蛋白激酶(btk,bruton’s tyrosine kinase)是非受体蛋白酪氨酸激酶tec家族的成员,是b细胞抗原受体(bcr)信号通路中的关键调节因子,分布在淋巴系统、造血及血液系统中。btk突变会引起下游肿瘤细胞的增殖、分化以及血管生成等信号通路的激活,会导致x连锁无丙种球蛋白血症、非霍奇金淋巴瘤(nhl)与许多b细胞恶性肿瘤,包括慢性淋巴细胞性白血病(cll)、套细胞淋巴瘤以及弥漫大b细胞淋巴瘤。由于主要在b细胞和髓细胞中表达,btk是一种靶向性和安全性较好的靶点。
3.基于btk靶点开发的的小分子靶向药物,为包括慢性淋巴细胞性白血病(cll)、套细胞淋巴瘤以及弥漫大b细胞淋巴瘤等b细胞类肿瘤的治疗提供了一条全新的途径。目前针对该靶点已批准上市的药物包括依鲁替尼、acalabrutinib和泽布替尼等均为不可逆抑制剂,其btk结合位点往往发生c481s突变,导致药物活性下降从而产生耐药性。因此,开发更多的btk抑制剂,克服c481s突变产生的耐药性问题,对突变型和野生型btk都有较好的抑制作用,同时也需提高btk的选择性,避免其他毒副作用。
技术实现要素:
4.本发明的目的就是提供一种能够抑制btk的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,及其中间体和制备方法,以及在制备治疗与btk活性或表达量相关疾病的药物中的应用。
5.本发明提供一种通式(i)所述的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,其中
[0006][0007]
在一些实施方案中,环c选自c
3-12
碳环基、3至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、nr
1a
s(=o)2r
1b
、-s(=o)2nr
1ar1b
、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-12
碳环基、4至12元杂环基,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0008]
在一些实施方案中,环c选自c
3-7
单环碳环基、c
4-12
并环碳环基、c
5-12
螺环碳环基、
(ch2)
n-c
5-10
螺环碳环基、-(ch2)
n-c
5-10
元桥环碳环基或-c(=o)r
1a
,所述的碳环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、c
1-4
烷氧基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基的取代基所取;
[0014]
在一些实施方案中,r1选自环丙基、环丁基、环戊基、环己基、选自环丙基、环丁基、环戊基、环己基、-ch
2-环丙基、-ch
2-环丁基、-ch
2-环戊基、-ch
2-环己基、-ch2‑‑
氮杂环丁基、-ch
2-氮杂环戊基、-ch
2-氮杂环己基、-ch
2-哌啶基、-ch
2-吗啉基、-ch
2-哌嗪基、-ch
2-氧杂环丁基、-ch
2-氧杂环戊基、-ch
2-氧杂环己基、-c(o)-环丙基、-c(o)-环丁基、-c(o)-环戊基、-c(o)-环己基、-c(o)-氮杂环丁基、-c(o)-氮杂环戊基、-c(o)-氮杂环己基、-c(o)-哌啶基、-c(o)-吗啉基、-c(o)-哌嗪基、-c(o)-氧杂环丁基、-c(o)-氧杂环戊基、-c(o)-氧杂环己基、-c(o)-ch2nh2、-c(o)ch2nhch3、-c(o)ch2n(ch3)2、-c(o)-ch
2-氮杂环丁基或-c(o)-ch
2-氮杂环戊基,所述的环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、哌嗪基、吗啉基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、ch2oh、ch2f、nh2、nhch3、n(ch3)2、甲基、乙基、甲氧基的取代基所取代;
[0015]
在一些实施方案中,r
1a
选自c
3-12
饱和碳环基、4至12元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0016]
在一些实施方案中,r
1a
选自c
3-10
饱和碳环基、4至10元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0017]
在一些实施方案中,r
1a
选自环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基、氧杂环丁基、氧杂环戊基、氧杂环己基或-(ch2)
m-nr
1ar1b
,所述环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、nh2、nhch3、n(ch3)2、ch2oh、ch2f、甲基、乙基、环丙基、环丁基或甲氧基的取代基所取代;
[0018]
在一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-6
烷基、c
3-12
碳环基、4至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;
[0019]
在一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-10
螺环碳环基、c
5-10
桥环碳环基、4至6元单环杂环基、4至10元并环杂环基、5至10
元螺环杂环基、5至10元桥环杂环基、c
6-10
芳基或5至10元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;
[0020]
在一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基或3至6元单环杂环基,所述的烷基、碳环基或杂环基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0021]
在一些实施方案中,r
1a
、r
1b
各自独立的选自h、甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基,所述的甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代;
[0022]
在一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成4至12元的杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0023]
在一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成4至6元单环杂环基、5至11元的螺环杂环基、4至10元的并环杂环基或5至10元的桥环杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0024]
在一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成取代的或者未取代的以下取代基之一:氮杂环丁基、氮杂环戊基、氮杂环己基、代基之一:氮杂环丁基、氮杂环戊基、氮杂环己基、当被取代时,任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代;
[0025]
在一些实施方案中,r2选自h、oh、卤素、c
1-6
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-6
烷氧基、c
1-6
烷氧基烷基或c
3-12
碳环基或4至12元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0026]
在一些实施方案中,r2选自h、oh、卤素、c
1-4
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-4
烷氧基、c
1-4
烷氧基烷基或c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0027]
在一些实施方案中,r2选自-nr
1ar1b
;
[0028]
在一些实施方案中,r2选自nh2;
[0029]
在一些实施方案中,环a选自c
6-12
芳基或5至12元杂芳基,所述的芳基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0030]
在一些实施方案中,环a选自苯基或5至6元杂芳基,所述的苯基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0031]
在一些实施方案中,环a选自苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基,所述的苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基任选进一步被0至4个ra取代;
[0032]
在一些实施方案中,环a选自取代或者未取代的以下取代基之一:在一些实施方案中,环a选自取代或者未取代的以下取代基之一:当被取代时,任选进一步被0至4个ra取代;
[0033]
在一些实施方案中,ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
3-6
环烷基,所述的烷基、烯基、炔基、烷氧基、环烷基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
1-6
烷氧基烷基的取代基所取代;
[0034]
在一些实施方案中,ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基或c
3-6
环烷基,所述的烷基、炔基、烷氧基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0035]
在一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基,所述的甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基任选进一步被0至4个选自h、f、oh、氰基、nh2、甲基、乙基、cf3、环丙基、环丁基、环戊基、环己基或甲氧基的取代基所取代;
[0036]
在一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、cf3、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基;
[0037]
在一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基;
[0038]
在一些实施方案中,m选自c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个r
m1
取代;
[0039]
在一些实施方案中,m选自亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个r
m1
取代;
[0040]
在一些实施方案中,m选自亚甲基、亚乙基或亚丙基;
[0041]
在一些实施方案中,m选自亚甲基;
[0042]
在一些实施方案中,r
m1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基;
[0043]
在一些实施方案中,r
m1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基;
[0044]
在一些实施方案中,r
m1
各自独立的选自h、f、oh、氰基、nh2、甲基、乙基或cf3;
[0045]
在一些实施方案中,q选自-c(=o)nr
q-或-nrqc(=o)-,左侧与环b直接连接;
[0046]
在一些实施方案中,q选自-c(=o)nh-,左侧与环b直接连接;
[0047]
在一些实施方案中,rq选自h、c
1-6
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0048]
在一些实施方案中,rq选自h、c
1-4
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷
基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0049]
在一些实施方案中,rq选自h、甲基、乙基、异丙基、丙基、环丙基、环丁基、环戊基、环己基、
[0050]
在一些实施方案中,环b选自c
6-12
芳基或5至12元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0051]
在一些实施方案中,环b选自苯基或5至6元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0052]
在一些实施方案中,y选自键或c
1-6
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0053]
在一些实施方案中,y选自键或c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0054]
在一些实施方案中,y选自键、亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个选自h、f、cl、br、oh、氰基、nh2、cf3、ch2oh、ch2f、甲基、乙基、异丙基、环丙基、甲氧基、乙氧基或异丙氧基的取代基所取代;
[0055]
在一些实施方案中,环b选自苯基、吡唑基、吡咯基、咪唑基、呋喃基、噻吩基、噻唑基、噁唑基、异噁唑基、三氮唑基、1,2,4-噁二唑基、吡啶基、哒嗪基、吡嗪基或嘧啶基;
[0056]
在一些实施方案中,r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-6
烷基、n(c
1-6
烷基)2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
1-6
氘代烷氧基、-x-c
3-12
碳环基或-x-4-12元杂环基,所述的烷基、烯基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-6
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子;
[0057]
在一些实施方案中,r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-4
烷基、n(c
1-4
烷基)2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
1-4
氘代烷氧基、-x-c
3-10
碳环基或-x-4至10元杂环基,所述的烷基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-4
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子;
[0058]
在一些实施方案中,r3各自独立的选自h、f、cl、br、i、oh、=o、氰基、nh2、nhch3、n(ch3)2、甲基、乙基、异丙基、叔丁基、环丙基、环丁基、环戊基、环己基、-o-环丙基、-o-环丁基、-o-环戊基、-o-环己基、乙炔基、-ocd3、甲氧基、乙氧基或异丙氧基,所述的甲基、乙基、异丙基、环丙基、环丁基、环戊基、环己基、乙炔基、甲氧基、乙氧基或异丙氧基任选进一步被0至4个选自h、f、oh、=o、氰基、nh2、cf3、ch2oh、ch2f、甲基、甲氧基、乙氧基或异丙氧基的取代基所取代;
[0059]
在一些实施方案中,x选自键、-nr
x-、-o-或-s-;
[0060]
在一些实施方案中,x选自键或-o-;
[0061]
在一些实施方案中,r
x
选自h或c
1-6
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0062]
在一些实施方案中,r
x
选自h或c
1-4
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0063]
在一些实施方案中,n、p各自独立的选自0、1、2、3或4;
[0064]
在一些实施方案中,m选自1、2、3或4;
[0065]
在一些实施方案中,n选自0、1、2。
[0066]
作为本发明的第一种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0067]
环c选自c
3-12
碳环基、3至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、nr
1a
s(=o)2r
1b
、-s(=o)2nr
1ar1b
、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-12
碳环基、4至12元杂环基,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0068]
r1选自-c(=o)r
1a
或-(ch2)
n-c
3-12
碳环基,所述的碳环基任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、c
1-6
烷氧基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基的取代基所取代;
[0069]r1a
选自c
3-12
饱和碳环基、4至12元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0070]r1a
、r
1b
各自独立的选自h、c
1-6
烷基、c
3-12
碳环基、4至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;
[0071]
或者r
1a
、r
1b
与其直接连接的原子形成4至12元的杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0072]
r2选自h、oh、卤素、c
1-6
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-6
烷氧基、c
1-6
烷氧基烷基或c
3-12
碳环基或4至12元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0073]
环a选自c
6-12
芳基或5至12元杂芳基,所述的芳基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0074]
ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
3-6
环烷基,所述的烷基、烯基、炔基、烷氧基、环烷基任选进一步被0至4个选自h、卤素、oh、
=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
1-6
烷氧基烷基的取代基所取代;
[0075]
q选自-c(=o)nr
q-或-nrqc(=o)-,左侧与环b直接连接;
[0076]rq
选自h、c
1-6
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0077]
m选自c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个r
m1
取代;
[0078]rm1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基;
[0079]
y选自键或c
1-6
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0080]
环b选自c
6-12
芳基或5至12元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0081]
r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-6
烷基、n(c
1-6
烷基)2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
1-6
氘代烷氧基、-x-c
3-12
碳环基或-x-4-12元杂环基,所述的烷基、烯基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-6
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子;x选自键、-nr
x-、-o-或-s-;
[0082]rx
选自h或c
1-6
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代;
[0083]
n、p各自独立的选自0、1、2、3或4;
[0084]
m选自1、2、3或4。
[0085]
作为本发明的第二种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0086]
环c选自c
3-7
单环碳环基、c
4-12
并环碳环基、c
5-12
螺环碳环基、c
5-12
元桥环碳环基、3至7元单环杂环基、4至12元并环杂环基、5至12元螺环杂环基、5至12元的桥环杂环基、c
6-12
芳基或5至12元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、c
1-4
烷基、c
2-4
炔基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;
[0087]
环a选自苯基或5-6元杂芳基,所述的苯基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0088]
ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基或c
3-6
环烷基,所述的烷基、炔基、烷氧基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0089]
环b选自苯基或5至6元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子;
[0090]rx
选自h或c
1-4
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0091]
其余取代基的定义与本发明方案一一致。
[0092]
作为本发明的第三种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0093]
r1选自-(ch2)
n-c
3-10
碳环基或-c(=o)r
1a
,所述的碳环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、c
1-4
烷氧基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基的取代基所取代;
[0094]r1a
选自c
3-10
饱和碳环基、4至10元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0095]r1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-10
螺环碳环基、c
5-10
桥环碳环基、4至6元单环杂环基、4至10元并环杂环基、5至10元螺环杂环基、5至10元桥环杂环基、c
6-10
芳基或5至10元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;
[0096]
或者r
1a
、r
1b
与其直接连接的原子形成4至6元单环杂环基、5至11元的螺环杂环基、4至10元的并环杂环基或5至10元的桥环杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0097]
r2选自h、oh、卤素、c
1-4
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-4
烷氧基、c
1-4
烷氧基烷基或c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;
[0098]
m选自c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个r
m1
取代;
[0099]rm1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基;
[0100]
y选自键或c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0101]rq
选自h、c
1-4
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0102]
r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-4
烷基、n(c
1-4
烷基)2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
1-4
氘代烷氧基、-x-c
3-10
碳环基或-x-4至10元杂环基,所述的烷基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-4
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子;
[0103]
x选自键或-o-;
[0104]
其余取代基的定义与本发明方案一或二任意一种一致。
[0105]
作为本发明的第四种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0106]
环a选自苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基,所述的苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基任选进一步被0至4个ra取代;
[0107]
环c选自c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-11
螺环碳环基、c
5-12
元桥环碳环基、3至6元单环杂环基、4至10元并环杂环基、5至11元螺环杂环基、5至12元的桥环杂环基、c
6-10
芳基或5至10元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、c
1-4
烷基、c
2-4
炔基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子;r1选自c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-10
螺环碳环基、c
5-10
元桥环碳环基或-c(=o)r
1a
,所述的碳环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代;
[0108]r1a
选自环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基、氧杂环丁基、氧杂环戊基、氧杂环己基或-(ch2)
m-nr
1ar1b
,所述环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、nh2、nhch3、n(ch3)2、ch2oh、ch2f、甲基、乙基、环丙基、环丁基或甲氧基的取代基所取代;
[0109]
r2选自-nr
1ar1b
;
[0110]r1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基或3至6元单环杂环基,所述的烷基、碳环基或杂环基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子;m选自亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个r
m1
取代;
[0111]rm1
各自独立的选自h、f、oh、氰基、nh2、甲基、乙基或cf3;
[0112]
n选自0、1或2;
[0113]
其余取代基的定义与本发明方案一、二或三中任意一种一致。
[0114]
作为本发明的第五种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0115]
环b选自苯基、吡唑基、吡咯基、咪唑基、呋喃基、噻吩基、噻唑基、噁唑基、异噁唑基、三氮唑基、1,2,4-噁二唑基、吡啶基、哒嗪基、吡嗪基或嘧啶基;
[0116]
r3各自独立的选自h、f、cl、br、i、oh、=o、氰基、nh2、nhch3、n(ch3)2、甲基、乙基、异丙基、叔丁基、环丙基、环丁基、环戊基、环己基、-o-环丙基、-o-环丁基、-o-环戊基、-o-环己基、乙炔基、-ocd3、甲氧基、乙氧基或异丙氧基,所述的甲基、乙基、异丙基、环丙基、环丁基、
环戊基、环己基、乙炔基、甲氧基、乙氧基或异丙氧基任选进一步被0至4个选自h、f、oh、=o、氰基、nh2、cf3、ch2oh、ch2f、甲基、甲氧基、乙氧基或异丙氧基的取代基所取代;
[0117]
环c选自取代的或者未取代的以下取代基之一:环丙基、环丁基、环戊基、环已基、苯基、吡咯基、呋喃基、吡唑基、噻唑基、咪唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、氮杂环丁基、氮杂环戊基、哌啶基、吗啉基、哌嗪基、氧杂环丁基、氧杂环戊基、氧杂环己基、3-氮杂双环[3.2.1]辛烷基、3-氧杂双环[3.2.1]辛烷基、8-氮杂双环[3.2.1]辛烷基、8-氧杂双环[3.2.1]辛烷基、2-氮杂双环[2.2.1]庚烷基、2-氧杂双环[2.2.1]庚烷基、3-氮杂双环[3.3.1]壬烷基、3-氧杂双环[3.3.1]壬烷基、6-氮杂双环[3.1.1]庚烷基、6-氧杂双环[3.1.1]庚烷基、[3.1.1]庚烷基、
[0118]
其左侧与y直接相连,当被取代时,任选进一步被0至4个选自h、f、cl、br、i、oh、氰基、=o、cf3、nh2、n(ch3)2、nhch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、羟甲基、甲基、乙基、异丙基、叔丁基、乙炔基、甲氧基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基的取代基所取代;y选自键、亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个选自h、f、cl、br、oh、氰基、nh2、cf3、ch2oh、ch2f、甲基、乙基、异丙基、环丙基、甲氧基、乙氧基或异丙氧基的取代基所取代;
[0119]r1a
、r
1b
各自独立的选自h、甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基,所述的甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代;
[0120]
或者r
1a
、r
1b
与其直接连接的原子形成取代的或者未取代的以下取代基之一:氮杂环丁基、氮杂环戊基、氮杂环己基、环丁基、氮杂环戊基、氮杂环己基、当被取代时,任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代;
[0121]
r2选自nh2;
[0122]
m选自亚甲基、亚乙基或亚丙基;
[0123]
ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基,所述的甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基任选进一步被0至4个选自h、f、oh、氰基、nh2、甲基、乙基、cf3、环丙基、环丁基、环戊基、环己基或甲氧基的取代基所取代;
[0124]rq
选自h、甲基、乙基、异丙基、丙基、环丙基、环丁基、环戊基、环己基、
[0125]
其余取代基的定义与本发明方案一、二、三或四中任意一种一致。
[0126]
作为本发明的第六种实施方案,前述通式(i)所示的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,
[0127]
m选自亚甲基;
[0128]
q选自-c(=o)nh-,左侧与环b直接连接;
[0129]
环a选自取代或者未取代的以下取代基之一:取代或者未取代的以下取代基之一:当被取代时,任选进一步被0至4个ra取代;
[0130]
ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、cf3、ch2oh、ch2f、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基;
[0131]
r1选自环丙基、环丁基、环戊基、环己基、选自环丙基、环丁基、环戊基、环己基、-ch
2-环丙基、-ch
2-环丁基、-ch
2-环戊基、-ch
2-环己基、-ch2‑‑
氮杂环丁基、-ch
2-氮杂环戊基、-ch
2-氮杂环己基、-ch
2-哌啶基、-ch
2-吗啉基、-ch
2-哌嗪基、-ch
2-氧杂环丁基、-ch
2-氧杂环戊基、-ch
2-氧杂环己基、-c(o)-环丙基、-c(o)-环丁基、-c(o)-环戊基、-c(o)-环己基、-c(o)-氮杂环丁基、-c(o)-氮杂环戊基、-c(o)-氮杂环己基、-c(o)-哌啶基、-c(o)-吗啉基、-c(o)-哌嗪基、-c(o)-氧杂环丁基、-c(o)-氧杂环戊基、-c(o)-氧杂环己基、-c(o)-ch2nh2、-c(o)ch2nhch3、-c(o)ch2n(ch3)2、-c(o)-ch
2-氮杂环丁基或-c(o)-ch
2-氮杂环戊基,所述的环丙基、环丁基、环戊基、环己基、氮杂环戊基,所述的环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、哌嗪基、吗啉基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、ch2oh、ch2f、nh2、nhch3、n(ch3)2、甲基、乙基、甲氧基的取代基所取代;
[0132]
其余取代基的定义与本发明方案一、二、三、四或五中任意一种一致。
[0133]
本发明涉及一种下述化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,其中该化合物选自如下结构之一:
[0134]
[0135]
[0136]
[0137][0138]
本发明涉及通式(i)的一些实施方案中,环c选自c
3-12
碳环基、3至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、nr
1a
s(=o)2r
1b
、-s(=o)2nr
1ar1b
、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-12
碳环基、4至12元杂环基,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0139]
本发明涉及通式(i)的一些实施方案中,环c选自c
3-7
单环碳环基、c
4-12
并环碳环基、c
5-12
螺环碳环基、c
5-12
元桥环碳环基、3至7元单环杂环基、4至12元并环杂环基、5至12元螺环杂环基、5至12元的桥环杂环基、c
6-12
芳基或5至12元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、c
1-4
烷基、c
2-4
炔基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子。
[0140]
本发明涉及通式(i)的一些实施方案中,环c选自c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-11
螺环碳环基、c
5-12
元桥环碳环基、3至6元单环杂环基、4至10元并环杂环基、5至11元螺环杂环基、5至12元的桥环杂环基、c
6-10
芳基或5至10元杂芳基,所述的碳环基、杂环基、芳基或杂芳基任选进一步被0至4个选自h、卤素、氰基、=o、-nr
1ar1b
、-or
1a
、-c(=o)r
1a
、-nr
1a
c(=o)r
1b
、-c(=o)nr
1ar1b
、c
1-4
烷基、c
2-4
炔基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子。
[0141]
本发明涉及通式(i)的一些实施方案中,环c选自取代的或者未取代的以下取代基之一:环丙基、环丁基、环戊基、环已基、苯基、吡咯基、呋喃基、吡唑基、噻唑基、咪唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、氮杂环丁基、氮杂环戊基、哌啶基、吗啉基、哌嗪基、氧杂环丁基、氧杂环戊基、氧杂环己基、3-氮杂双环[3.2.1]辛烷基、3-氧杂双环[3.2.1]辛烷基、8-氮杂双环[3.2.1]辛烷基、8-氧杂双环[3.2.1]辛烷基、2-氮杂双环[2.2.1]庚烷基、2-氧杂双环[2.2.1]庚烷基、3-氮杂双环[3.3.1]壬烷基、3-氧杂双环[3.3.1]壬烷基、6-氮杂双环[3.1.1]庚烷基、6-氧杂双环[3.1.1]庚烷基、氧杂双环[3.1.1]庚烷基、氧杂双环[3.1.1]庚烷基、其左侧与y直接相连,当被取代时,任选进一步被0至4个选自h、f、cl、br、i、oh、氰基、=o、cf3、nh2、n(ch3)2、nhch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、羟甲基、甲基、乙基、异丙基、叔丁基、乙炔基、甲氧基、环丙基、
环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基的取代基所取代。
[0142]
本发明涉及通式(i)的一些实施方案中,r1选自-c(=o)r
1a
或-(ch2)
n-c
3-12
碳环基,所述的碳环基任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、c
1-6
烷氧基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基的取代基所取代。
[0143]
本发明涉及通式(i)的一些实施方案中,r1选自-(ch2)
n-c
3-10
碳环基或-c(=o)r
1a
,所述的碳环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、c
1-4
烷氧基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基的取代基所取。
[0144]
本发明涉及通式(i)的一些实施方案中,r1选自-(ch2)
n-c
3-6
单环碳环基、-(ch2)
n-c
4-10
并环碳环基、-(ch2)
n-c
5-10
螺环碳环基、-(ch2)
n-c
5-10
元桥环碳环基或-c(=o)r
1a
,所述的碳环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、c
1-4
烷氧基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基的取代基所取。
[0145]
本发明涉及通式(i)的一些实施方案中,r1选自环丙基、环丁基、环戊基、环己基、-ch
2-环丙基、-ch
2-环丁基、-ch
2-环戊基、-ch
2-环己基、-ch2‑‑
氮杂环丁基、-ch
2-氮杂环戊基、-ch
2-氮杂环己基、-ch
2-哌啶基、-ch
2-吗啉基、-ch
2-哌嗪基、-ch
2-氧杂环丁基、-ch
2-氧杂环戊基、-ch
2-氧杂环己基、-c(o)-环丙基、-c(o)-环丁基、-c(o)-环戊基、-c(o)-环己基、-c(o)-氮杂环丁基、-c(o)-氮杂环戊基、-c(o)-氮杂环己基、-c(o)-哌啶基、-c(o)-吗啉基、-c(o)-哌嗪基、-c(o)-氧杂环丁基、-c(o)-氧杂环戊基、-c(o)-氧杂环己基、-c(o)-ch2nh2、-c(o)ch2nhch3、-c(o)ch2n(ch3)2、-c(o)-ch
2-氮杂环丁基或-c(o)-ch
2-氮杂环戊基,所述的环丙基、环丁基、环戊基、环己基、基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、哌嗪基、吗啉基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、ch2oh、ch2f、nh2、nhch3、n(ch3)2、甲基、乙基、甲氧基的取代基所取代。
[0146]
本发明涉及通式(i)的一些实施方案中,r
1a
选自c
3-12
饱和碳环基、4至12元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-6
烷基)2、nhc
1-6
烷基、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0147]
本发明涉及通式(i)的一些实施方案中,r
1a
选自c
3-10
饱和碳环基、4至10元杂环基或-(ch2)
m-nr
1ar1b
,所述的碳环基、杂环基或-ch
2-任选被0至4个选自h、卤素、oh、氰基、nh2、n(c
1-4
烷基)2、nhc
1-4
烷基、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0148]
本发明涉及通式(i)的一些实施方案中,r
1a
选自环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基、氧杂环丁基、氧杂环戊基、氧杂环己基或-(ch2)
m-nr
1ar1b
,所述环丙基、环丁基、环戊基、环已基、氮杂环丁基、氮杂环戊基、氮杂环己基、哌啶基、吗啉基、哌嗪基或-ch
2-任选进一步被0至4个选自h、f、cl、br、oh、氰基、cf3、nh2、nhch3、n(ch3)2、ch2oh、ch2f、甲基、乙基、环丙基、环丁基或甲氧基的取代基所取代。
[0149]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-6
烷基、c
3-12
碳环基、4至12元杂环基、c
6-12
芳基或5至12元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子。
[0150]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基、c
4-10
并环碳环基、c
5-10
螺环碳环基、c
5-10
桥环碳环基、4至6元单环杂环基、4至10元并环杂环基、5至10元螺环杂环基、5至10元桥环杂环基、c
6-10
芳基或5至10元杂芳基,所述的烷基、碳环基、杂环基、芳基或杂芳基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基或杂芳基含有1至4个选自o、s、n的杂原子。
[0151]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
各自独立的选自h、c
1-4
烷基、c
3-6
单环碳环基或3至6元单环杂环基,所述的烷基、碳环基或杂环基任选被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0152]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
各自独立的选自h、甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基,所述的甲基、乙基、丙基、异丙基、环丙基、环丁基、环戊基、环己基、氧杂环丁基、氧杂环戊基、氧杂环己基或吗啉基任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代。
[0153]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成4至12元的杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0154]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成4至6元单环杂环基、5至11元的螺环杂环基、4至10元的并环杂环基或5至10元的桥环杂环基,所述的杂环基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基、c
1-6
烷氧基或3至10元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0155]
本发明涉及通式(i)的一些实施方案中,r
1a
、r
1b
与其直接连接的原子形成取代的或者未取代的以下取代基之一:氮杂环丁基、氮杂环戊基、氮杂环己基、
当被取代时,任选被0至4个选自h、f、cl、br、oh、氰基、nh2、ch2f、cf3、甲基、乙基、环丙基或甲氧基的取代基所取代。
[0156]
本发明涉及通式(i)的一些实施方案中,r2选自h、oh、卤素、c
1-6
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-6
烷氧基、c
1-6
烷氧基烷基或c
3-12
碳环基或4至12元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0157]
本发明涉及通式(i)的一些实施方案中,r2选自h、oh、卤素、c
1-4
烷基或-nr
1ar1b
,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、-nr
1ar1b
、c
1-4
烷氧基、c
1-4
烷氧基烷基或c
3-6
碳环基或4至6元杂环基的取代基所取代,所述的杂环基含有1至4个选自o、s、n的杂原子。
[0158]
本发明涉及通式(i)的一些实施方案中,r2选自-nr
1ar1b
。
[0159]
本发明涉及通式(i)的一些实施方案中,r2选自nh2。
[0160]
本发明涉及通式(i)的一些实施方案中,环a选自c
6-12
芳基或5至12元杂芳基,所述的芳基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子。
[0161]
本发明涉及通式(i)的一些实施方案中,环a选自苯基或5至6元杂芳基,所述的苯基或杂芳基任选进一步被0至4个ra取代,所述的杂芳基含有1至4个选自o、s、n的杂原子。
[0162]
本发明涉及通式(i)的一些实施方案中,环a选自苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基,所述的苯基、吡啶基、哒嗪基、嘧啶基或吡嗪基任选进一步被0至4个ra取代。
[0163]
本发明涉及通式(i)的一些实施方案中,环a选自取代或者未取代的以下取代基之一:
[0164]
当被取代时,任选进一步被0至4个ra取代。
[0165]
本发明涉及通式(i)的一些实施方案中,ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
3-6
环烷基,所述的烷基、烯基、炔基、烷氧基、环烷基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基或c
1-6
烷氧基烷基的取代基所取代。
[0166]
本发明涉及通式(i)的一些实施方案中,ra各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基或c
3-6
环烷基,所述的烷基、炔基、烷氧基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代。
[0167]
本发明涉及通式(i)的一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基,所述的甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基任选进一步被0至4个选自h、f、oh、氰基、nh2、甲基、乙基、cf3、环丙基、环丁基、环戊基、环己基或甲氧基的取代基所取代。
[0168]
本发明涉及通式(i)的一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、cf3、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基。
[0169]
本发明涉及通式(i)的一些实施方案中,ra各自独立的选自h、f、cl、br、i、oh、氰基、nh2、甲基、乙基、丙基、异丙基、乙炔基、甲氧基、环丙基、环丁基、环戊基或环己基。
[0170]
本发明涉及通式(i)的一些实施方案中,m选自c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个r
m1
取代。
[0171]
本发明涉及通式(i)的一些实施方案中,m选自亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个r
m1
取代。
[0172]
本发明涉及通式(i)的一些实施方案中,m选自亚甲基、亚乙基或亚丙基。
[0173]
本发明涉及通式(i)的一些实施方案中,m选自亚甲基。
[0174]
本发明涉及通式(i)的一些实施方案中,r
m1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基。
[0175]
本发明涉及通式(i)的一些实施方案中,r
m1
各自独立的选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基。
[0176]
本发明涉及通式(i)的一些实施方案中,r
m1
各自独立的选自h、f、oh、氰基、nh2、甲基、乙基或cf3。
[0177]
本发明涉及通式(i)的一些实施方案中,q选自-c(=o)nr
q-或-nrqc(=o)-,左侧与环b直接连接。
[0178]
本发明涉及通式(i)的一些实施方案中,q选自-c(=o)nh-,左侧与环b直接连接。
[0179]
本发明涉及通式(i)的一些实施方案中,rq选自h、c
1-6
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代。
[0180]
本发明涉及通式(i)的一些实施方案中,rq选自h、c
1-4
烷基或c
3-6
环烷基,所述的烷基或环烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代。
[0181]
本发明涉及通式(i)的一些实施方案中,rq选自h、甲基、乙基、异丙基、丙基、环丙基、环丁基、环戊基、环己基、
[0182]
本发明涉及通式(i)的一些实施方案中,y选自键或c
1-6
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代。
[0183]
本发明涉及通式(i)的一些实施方案中,y选自键或c
1-4
亚烷基,所述的亚烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代。
[0184]
本发明涉及通式(i)的一些实施方案中,y选自键、亚甲基、亚乙基或亚丙基,所述的亚甲基、亚乙基或亚丙基任选进一步被0至4个选自h、f、cl、br、oh、氰基、nh2、cf3、ch2oh、ch2f、甲基、乙基、异丙基、环丙基、甲氧基、乙氧基或异丙氧基的取代基所取代。
[0185]
本发明涉及通式(i)的一些实施方案中,环b选自c
6-12
芳基或5至12元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子。
[0186]
本发明涉及通式(i)的一些实施方案中,环b选自苯基或5至6元杂芳基,所述的杂芳基含有1至4个选自o、s、n的杂原子。
[0187]
本发明涉及通式(i)的一些实施方案中,环b选自苯基、吡唑基、吡咯基、咪唑基、呋喃基、噻吩基、噻唑基、噁唑基、异噁唑基、三氮唑基、1,2,4-噁二唑基、吡啶基、哒嗪基、吡嗪基或嘧啶基。
[0188]
本发明涉及通式(i)的一些实施方案中,r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-6
烷基、n(c
1-6
烷基)2、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
1-6
氘代烷氧基、-x-c
3-12
碳环基或-x-4-12元杂环基,所述的烷基、烯基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
1-6
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-6
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子。
[0189]
本发明涉及通式(i)的一些实施方案中,r3各自独立的选自h、卤素、oh、=o、氰基、cooh、nh2、nhc
1-4
烷基、n(c
1-4
烷基)2、c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
1-4
氘代烷氧基、-x-c
3-10
碳环基或-x-4至10元杂环基,所述的烷基、炔基、烷氧基、碳环基或杂环基任选进一步被0至4个选自h、卤素、oh、=o、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
2-4
炔基、c
1-4
烷氧基、c
3-6
环烷基、4-7元杂环烷基或c
1-4
烷氧基烷基的取代基所取代,所述的杂环基或杂环烷基含有1至4个选自o、s、n的杂原子。
[0190]
本发明涉及通式(i)的一些实施方案中,r3各自独立的选自h、f、cl、br、i、oh、=o、氰基、nh2、nhch3、n(ch3)2、甲基、乙基、异丙基、叔丁基、环丙基、环丁基、环戊基、环己基、-o-环丙基、-o-环丁基、-o-环戊基、-o-环己基、乙炔基、-ocd3、甲氧基、乙氧基或异丙氧基,所述的甲基、乙基、异丙基、环丙基、环丁基、环戊基、环己基、乙炔基、甲氧基、乙氧基或异丙氧基任选进一步被0至4个选自h、f、oh、=o、氰基、nh2、cf3、ch2oh、ch2f、甲基、甲氧基、乙氧基或异丙氧基的取代基所取代。
[0191]
本发明涉及通式(i)的一些实施方案中,x选自键、-nr
x-、-o-或-s-。
[0192]
本发明涉及通式(i)的一些实施方案中,x选自键或-o-。
[0193]
本发明涉及通式(i)的一些实施方案中,r
x
选自h或c
1-6
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-6
烷基、卤素取代的c
1-6
烷基、羟基取代的c
1-6
烷基、c
3-6
环烷基或c
1-6
烷氧基的取代基所取代。
[0194]
本发明涉及通式(i)的一些实施方案中,r
x
选自h或c
1-4
烷基,所述的烷基任选进一步被0至4个选自h、卤素、oh、氰基、nh2、c
1-4
烷基、卤素取代的c
1-4
烷基、羟基取代的c
1-4
烷基、c
3-6
环烷基或c
1-4
烷氧基的取代基所取代。
[0195]
本发明涉及通式(i)的一些实施方案中,n、p各自独立的选自0、1、2、3或4。
[0196]
本发明涉及通式(i)的一些实施方案中,m选自1、2、3或4。
[0197]
本发明涉及通式(i)的一些实施方案中,n选自0、1或2。
[0198]
本发明涉及一种药物组合物,包括本发明所述的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,以及要学上可接受的载体。
[0199]
本发明涉及一种本发明所述的化合物或者其立体异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶在用于制备治疗与btk活性或表达量相关疾病的药物中的应用,优选用于制备肿瘤药物中的应用。
[0200]
除非有相反的陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0201]
本发明所述基团和化合物中所涉及的碳、氢、氧、硫、氮或f、cl、br、i均包括它们的
同位素情况,及本发明所述基团和化合物中所涉及的碳、氢、氧、硫或氮任选进一步被一个或多个它们对应的同位素所替代,其中碳的同位素包括
12
c、
13
c和
14
c,氢的同位素包括氕(h)、氘(d,又叫重氢)、氚(t,又叫超重氢),氧的同位素包括
16
o、
17
o和
18
o,硫的同位素包括
32
s、
33
s、
34
s和
36
s,氮的同位素包括
14
n和
15
n,氟的同位素包括
17
f和
19
f,氯的同位素包括
35
cl和
37
cl,溴的同位素包括
79
br和
81
br。
[0202]“卤素”是指f、cl、br或i。
[0203]“卤素取代的”是指f、cl、br或i取代,包括但不限于1至10个选自f、cl、br或i的取代基所取代,1至6个选自f、cl、br或i的取代基所取代,1至4个选自f、cl、br或i的取代基所取代。“卤素取代的”简称为“卤代”。
[0204]“烷基”是指取代的或者未取代的直链或支链饱和脂肪族烃基,包括但不限于1至20个碳原子的烷基、1至8个碳原子的烷基、1至6个碳原子的烷基、1至4个碳原子的烷基。非限制性实施例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、新丁基、叔丁基、正戊基、异戊基、新戊基、正己基及其各种支链异构体;本文中出现的烷基,其定义与本定义一致。烷基可以是一价、二价、三价或四价。
[0205]“杂烷基”指取代的或者未取代的烷基中的1个或多个(包括但不限于2、3、4、5或6个)碳原子被杂原子(包括但不限于n、o或s)替换。非限制性实施例包括-x(ch2)v-x(ch2)v-x(ch2)v-h(v为1至5的整数,x各自独立的选自键或杂原子,杂原子包括但不限于n、o或s,且至少有1个x选自杂原子,且杂原子中的n或s可被氧化成各种氧化态)。杂烷基可以是一价、二价、三价或四价。
[0206]“亚烷基”是指取代的或者未取代的直链和支链的二价饱和烃基,包括-(ch2)
v-(v为1至10的整数),亚烷基实施例包括但不限于亚甲基、亚乙基、亚丙基和亚丁基等。
[0207]“亚杂烷基”是指取代的或者未取代的亚烷基中的1个或多个(包括但不限于2、3、4、5或6个)碳原子被杂原子(包括但不限于n、o或s)替换。非限制性实施例包括-x(ch2)v-x(ch2)v-x(ch2)v-,v为1至5的整数,x各自独立的选自键、n、o或s,且至少有1个x选自n、o或s。
[0208]“环烷基”是指取代的或者未取代的饱和的碳环烃基,通常有3至10个碳原子,非限制性实施例包括环丙基、环丁基、环戊基、环己基或环庚基等。本文中出现的环烷基,其定义如上所述。环烷基可以是一价、二价、三价或四价。
[0209]“杂环烷基”是指取代的或者未取代的饱和的含有杂原子的环烃基,包括但不限于3至10个原子、3至8个原子,包含1至3个选自n、o或s的杂原子,杂环烷基的环中选择性取代的n、s可被氧化成各种氧化态。杂环烷基可以连接在杂原子或者碳原子上,杂环烷基可以连接在芳香环上或者非芳香环上,杂环烷基可以连接有桥环或者螺环,非限制性实施例包括环氧乙基、氮杂环丙基、氧杂环丁基、氮杂环丁基、四氢呋喃基、四氢-2h-吡喃基、二氧戊环基、二氧六环基、吡咯烷基、哌啶基、咪唑烷基、噁唑烷基、噁嗪烷基、吗啉基、六氢嘧啶基、哌嗪基。杂环烷基可以是一价、二价、三价或四价
[0210]“烯基”是指取代的或者未取代的直链和支链的不饱和烃基,其具有至少1个,通常有1、2或3个碳碳双键,主链包括但不限于2至10个、2至6个或2至4个碳原子,烯基实施例包括但不限于乙烯基、烯丙基、1-丙烯基、2-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、1-甲基-1-丁烯基、2-甲基-1-丁烯基、2-甲基-3-丁烯基、1-己烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、1-甲基-1-戊烯基、2-甲基-1-戊烯
基、1-庚烯基、2-庚烯基、3-庚烯基、4-庚烯基、1-辛烯基、3-辛烯基、1-壬烯基、3-壬烯基、1-癸烯基、4-癸烯基、1,3-丁二烯、1,3-戊二烯、1,4-戊二烯和1,4-己二烯等;本文中出现的烯基,其定义与本定义一致。烯基可以是一价、二价、三价或四价。
[0211]“炔基”是指取代的或者未取代的直链和支链的一价不饱和烃基,其具有至少1个,通常有1、2或3个碳碳三键,包括但不限于在主链包括2至10个碳原子、2至6个碳原子、2至4个碳原子,炔基实施例包括但不限于乙炔基、炔丙基、1-丙炔基、2-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、4-戊炔基、1-甲基-1-丁炔基、2-甲基-1-丁炔基、2-甲基-3-丁炔基、1-己炔基、2-己炔基、3-己炔基、4-己炔基、5-己炔基、1-甲基-1-戊炔基、2-甲基-1-戊炔基、1-庚炔基、2-庚炔基、3-庚炔基、4-庚炔基、1-辛炔基、3-辛炔基、1-壬炔基、3-壬炔基、1-癸炔基、4-癸炔基等;炔基可以是一价、二价、三价或四价。
[0212]“烷氧基”是指取代的或者未取代的-o-烷基。非限制性实施例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、正戊氧基、正己氧基、环丙氧基和环丁氧基。
[0213]“碳环基”或“碳环”是指取代的或未取代的饱和或不饱和的芳香环或者非芳香环,芳香环或者非芳香环可以是3至8元的单环、4至12元双环或者10至15元三环体系,碳环基可以连接在芳香环上或者非芳香环上,芳香环或者非芳香环任选为单环、桥环或者螺环。非限制性实施例包括环丙烷、环丁烷、环戊烷、环己烷、环庚烷、1-环戊基-1-烯基、1-环戊基-2-烯基、1-环戊基-3-烯基、环己基、1-环己基-2-烯基、1-环己基-3-烯基、环己烯基、苯环、萘环、“碳环基”或“碳环”可以是一价、二价、三价或四价。
[0214]“杂环基”或“杂环”是指取代的或未取代的饱和或不饱和的芳香环或者非芳香环,芳香环或者非芳香环可以是3至8元的单环、4至12元双环或者10至15元三环体系,且包含1个或多个(包括但不限于2、3、4或5个)个选自n、o或s的杂原子,杂环基的环中选择性取代的n、s可被氧化成各种氧化态。杂环基可以连接在杂原子或者碳原子上,杂环基可以连接在芳香环上或者非芳香环上,杂环基可以连接有桥环或者螺环,非限制性实施例包括环氧乙基、氮杂环丙基、氧杂环丁基、氮杂环丁基、1,3-二氧戊环基、1,4-二氧戊环基、1,3-二氧六环基、氮杂环庚基、吡啶基、呋喃基、噻吩基、吡喃基、n-烷基吡咯基、嘧啶基、吡嗪基、哒嗪基、咪唑基、哌啶基、吗啉基、硫代吗啉基、1,3-二噻基、二氢呋喃基、二氢吡喃基、二噻戊环基、四氢呋喃基、四氢吡咯基、四氢咪唑基、四氢噻唑基、四氢吡喃基、苯并咪唑基、苯并吡啶基、吡咯并吡啶基、苯并二氢呋喃基、吡咯基、吡唑基、噻唑基、噁唑基、吡嗪基、吲唑基、苯并噻吩基、苯并呋喃基、苯并吡咯基、苯并咪唑基、苯并噻唑基、苯并噁唑基、苯并吡啶基、苯并嘧啶基、苯并吡嗪基、哌嗪基、氮杂二环[3.2.1]辛烷基、氮杂二环[5.2.0]壬烷基、氧杂三环[5.3.1.1]十二烷基、氮杂金刚烷基、氧杂螺[3.3]庚烷基、[5.3.1.1]十二烷基、氮杂金刚烷基、氧杂螺[3.3]庚烷基、“杂环基”或“杂环”可以是一价、二价、三价或四价。
[0215]“螺环”或“螺环基”是指取代的或未取代的单环之间共用一个原子(称螺原子)的多环基团,螺环体系中环原子的个数包括但不限于含有5至20个、6至14个、6至12个、6至10个,其中一个或多个环可以含有0个或多个(包括但不限于1、2、3或4)双键,且任选可以含有0至5个选自n、o或s(=o)n的杂原子。
[0216]“螺环”或“螺环基”可以是一价、二价、三价或四价。
[0217]“并环”或“并环基”是指系统中的每个环与体系中的其他环共享毗邻的一对原子的多环基团,其中一个或多个环可以含有0个或多个(包括但不限于1、2、3或4)双键,且可以是取代的或未取代,并环体系中的各个环可以含0至5个杂原子或含有杂原子的基团(包括但不限于选自n、s(=o)n或o,n为0、1或2)。并环体系中环原子的个数包括但不限于5至20个,5至14个,5至12个,5至10个。非限定性实例包括:个,5至14个,5至12个,5至10个。非限定性实例包括:“并环”或“并环基”可以是一价、二价、三价或四价。
[0218]“桥环”或“桥环基”是指取代的或未取代的含有任意两个不直接连接的原子的多环基团,可以含有0个或多个双键,并环体系中的任意环可以含0至5个选自杂原子或含有杂原子的基团(包括但不限于n、s(=o)n或o,其中n为0、1、2)。环原子个数包括但不限于5至20个、5至14个、5至12个或5至10个。非限定性实例包括
立方烷、金刚烷。“桥环”或“桥环基”可以是一价、二价、三价或四价。
[0219]“碳螺环”、“螺环碳环基”、“螺碳环基”或者“碳螺环基”是指环体系仅有碳原子组成的“螺环”。本文中出现的“碳螺环”、“螺环碳环基”、“螺碳环基”或者“碳螺环基”,其定义与螺环一致。
[0220]“碳并环”、“并环碳环基”、“并碳环基”或者“碳并环基”是指环体系仅有碳原子组成的“并环”。本文中出现的“碳并环”、“并环碳环基”、“并碳环基”或者“碳并环基”,其定义与并环一致。
[0221]“碳桥环”、“桥环碳环基”、“桥碳环基”或者“碳桥环基”是指环体系仅有碳原子组成的“桥环”。本文中出现的“碳桥环”、“桥环碳环基”、“桥碳环基”或者“碳桥环基”,其定义与桥环一致。
[0222]“杂单环”、“单环杂环基”或“杂单环基”是指单环体系的“杂环基”或“杂环”,本文中出现的杂环基、“单环杂环基”或“杂单环基”,其定义与杂环一致。
[0223]“杂并环”、“杂并环基”“并环杂环基”或“杂并环基”是指含有杂原子的“并环”。本文中出现的杂并环、“杂并环基”“并环杂环基”或“杂并环基”,其定义与并环一致。
[0224]“杂螺环”、“杂螺环基”、“螺环杂环基”或“杂螺环基”是指含有杂原子的“螺环”。本文中出现的杂螺环、“杂螺环基”、“螺环杂环基”或“杂螺环基”,其定义与螺环一致。
[0225]“杂桥环”、“杂桥环基”、“桥环杂环基”或“杂桥环基”是指含有杂原子的“桥环”。本文中出现的杂桥环、“杂桥环基”、“桥环杂环基”或“杂桥环基”,其定义与桥环一致。
[0226]“芳基”或“芳环”是指取代的或者未取代的具有单环或稠合环的芳香族烃基,芳香环中环原子个数包括但不限于6至18、6至12或6至10个碳原子。芳基环可以稠合于饱和或不饱和的碳环或杂环上,其中与母体结构连接在一起的环为芳基环,非限制性实施例包含苯环、萘环、“芳基”或“芳环”可以是一价、二价、三价或四价。当为二价、三价或四价时,连接位点位于芳基环上。
[0227]“杂芳基”或“杂芳环”是指取代或未取代的芳香族烃基,且含有1至5个选杂原子或含有杂原子的基团(包括但不限于n、o或s(=o)n,n为0、1、2),杂芳香环中环原子个数包括但不限于5至15、5至10或5至6个。杂芳基的非限制性实施例包括但不限于吡啶基、呋喃基、噻吩基、吡啶基、吡喃基、n-烷基吡咯基、嘧啶基、吡嗪基、哒嗪基、咪唑基、苯并吡唑、苯并咪唑、苯并吡啶、吡咯并吡啶等。所述杂芳基环可以稠合于饱和或不饱和的碳环或杂环上,其
中与母体结构连接在一起的环为杂芳基环,非限制性实施例包含本文中出现的杂芳基,其定义与本定义一致。杂芳基可以是一价、二价、三价或四价。当为二价、三价或四价时,连接位点位于杂芳基环上。
[0228]“5元环并5元杂芳环”是指5并5元的稠合杂芳环,2个并环中至少有1个环含有1个以上的杂原子(包括但不限于o、s或n),整个基团具有芳香性,非限制实施例包括了吡咯并吡咯环、吡唑并吡咯环、吡唑并吡唑环、吡咯并呋喃环、吡唑并呋喃环、吡咯并噻吩环、吡唑并噻吩环。
[0229]“5并6元杂芳环”是指5并6元的稠合杂芳环,2个并环中至少有1个环含有1个以上的杂原子(包括但不限于o、s或n),整个基团具有芳香性,非限制实施例包括了苯并5元杂芳基、6元杂芳环并5元杂芳环。
[0230]“取代”或“取代的”是指被1个或多个(包括但不限于2、3、4或5个)取代基所取代,取代基包括但不限于h、f、cl、br、i、烷基、环烷基、烷氧基、卤代烷基、硫醇、羟基、硝基、巯基、氨基、氰基、异氰基、芳基、杂芳基、杂环基、桥环基、螺环基、并环基、羟基烷基、=o、羰基、醛、羧酸、甲酸酯、-(ch2)
m-c(=o)-ra、-o-(ch2)
m-c(=o)-ra、-(ch2)
m-c(=o)-nrbrc、-(ch2)ms(=o)nra、-(ch2)
m-烯基-ra、ord或-(ch2)
m-炔基-ra(其中m、n为0、1或2)、芳基硫基、硫代羰基、硅烷基或-nrbrc等基团,其中rb与rc独立选自包括h、羟基、氨基、羰基、烷基、烷氧基、环烷基、杂环基、芳基、杂芳基、磺酰基、三氟甲磺酰基,作为选择,rb与rc可形成五或六元环烷基或杂环基。
[0231]“含有1至5个选自o、s、n的杂原子”是指含有1、2、3、4或5个选自o、s、n的杂原子。
[0232]“0至x个选自
…
取代基所取代”是指被0、1、2、3
…
x个选自
…
取代基所取代,x选自1至10之间的任意整数。如“0至4个选自
…
取代基所取代”是指被0、1、2、3或4个选自
…
取代基所取代。如“0至5个选自
…
取代基所取代”是指被0、1、2、3、4或5个选自
…
取代基所取代。如“杂桥环任选进一步被0至4个选自h或f的取代基所取代”是指杂桥环任选进一步被0、1、2、3或4个选自h或f的取代基所取代。
[0233]
x-y元的环(x选自小于y大于3的整数,y选自4至12之间的任意整数)包括了x+1、x+2、x+3、x+4
…
y元的环。环包括了杂环、碳环、芳环、芳基、杂芳基、环烷基、杂单环、杂并环、杂螺环或杂桥环。如“4-7元杂单环”是指4元、5元、6元或7元的杂单环,“5-10元杂并环”是指5元、6元、7元、8元、9元或10元的杂并环。
[0234]“任选”或“任选地”是指随后所描述的事件或环境可以但不必须发生,该说明包括该事件或环境发生或不发生的场合。如:“任选被f取代的烷基”指烷基可以但不必须被f取代,说明包括烷基被f取代的情形和烷基不被f取代的情形。
[0235]“药学上可接受的盐”或者“其药学上可接受的盐”是指本发明化合物保持游离酸或者游离碱的生物有效性和特性,且所述的游离酸通过与无毒的无机碱或者有机碱,所述的游离碱通过与无毒的无机酸或者有机酸反应获得的盐。
[0236]“药物组合物”是指一种或多种本发明所述化合物、或者其立体异构体、互变异构体、氘代物、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶和其它化学组分形成的混合物,其中,“其它化学组分”是指药学上可接受的载体、赋形剂和/或一种或多种其它治疗
剂。
[0237]“载体”是指不会对生物体产生明显刺激且不会消除所给予化合物的生物活性和特性的材料。
[0238]“赋形剂”是指加入到药物组合物中以促进化合物给药的惰性物质。非限制性实施例包括碳酸钙、磷酸钙、糖、淀粉、纤维素衍生物(包括微晶纤维素)、明胶、植物油、聚乙二醇类、稀释剂、成粒剂、润滑剂、粘合剂和崩解剂。
[0239]“前药”是指可经体内代谢转化为具有生物活性的本发明化合物。本发明的前药通过修饰本发明化合物中的氨基或者羧基来制备,该修饰可以通过常规的操作或者在体内被除去,而得到母体化合物。当本发明的前药被施予哺乳动物个体时,前药被割裂形成游离的氨基或者羧基。
[0240]“共晶”是指活性药物成分(api)和共晶形成物(ccf)在氢键或其他非共价键的作用下结合而成的晶体,其中api和ccf的纯态在室温下均为固体,并且各组分间存在固定的化学计量比。共晶是一种多组分晶体,既包含两种中性固体之间形成的二元共晶,也包含中性固体与盐或溶剂化物形成的多元共晶。
[0241]“动物”是指包括哺乳动物,例如人、陪伴动物、动物园动物和家畜,优选人、马或者犬。
[0242]“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体和构象异构体。
[0243]“互变异构体”是指分子中某一原子在两个位置迅速移动而产生的官能团异构体,如酮式-烯醇式异构和酰胺-亚胺醇式异构等。
[0244]“任选”或“任选地”或“选择性的”或“选择性地”是指随后所述的事件或状况可以但未必发生,该描述包括其中发生该事件或状况的情况及其中未发生的情况。例如,“选择性地被烷基取代的杂环基”是指该烷基可以但未必存在,该描述包括其中杂环基被烷基取代的情况,及其中杂环基未被烷基取代的情况。
[0245]“ic
50”是对指定的生物过程(或该过程中的某个组分比如酶、受体、细胞等)抑制一半时所需的药物或者抑制剂的浓度。
具体实施方式
[0246]
为了完成本发明的目的,根据本领域技术人员已知的有机合成技术,从市售的化学品和/或化学文献中描述的化合物开始,制备本文所述反应中使用的化合物“商业上可用的化学品”是从标准的商业来源获得的,包括上海阿拉丁生化科技股份有限公司,上海麦克林生化科技有限公司,sigma-aldrich,阿法埃莎(中国)化学有限公司,梯希爱(上海)化成工业发展有限公司,安耐吉化学,上海泰坦科技股份有限公司,科龙化工,百灵威科技有限公司等。
[0247]
本领域的参考书和专著,详细介绍了可用于制备本文所述化合物的反应物的合成,或提供了描述该制备方法的文章以供参考。这些参考书和专著包括:“synthetic organic chemistry”,john wiley&sons,inc.,new york;s.r.sandler et al.,“organic functional group preparations,”2nd ed.,academic press,new york,1983;h.o.house,“modern synthetic reactions”,2nd ed.,w.a.benjamin,inc.menlo park,
calif.1972;t.l.gilchrist,“heterocyclic chemistry”,2nd ed.,john wiley&sons,new york,1992;j.march,“advanced organic chemistry:reactions,mechanisms and structure”,4th ed.,wiley interscience,new york,1992;fuhrhop,j.and penzlin g.“organic synthesis:concepts,methods,starting materials”,second,revised and enlarged edition(1994)john wiley&sons isbn:3 527-29074-5;hoffman,r.v.“organic chemistry,an intermediate text”(1996)oxford university press,isbn 0-19-509618-5;larock,r.c.“comprehensive organic transformations:a guide to functional group preparations”2nd edition(1999)wiley-vch,isbn:0-471-19031-4;march,j.“advanced organic chemistry:reactions,mechanisms,and structure”4th edition(1992)john wiley&sons,isbn:0-471-60180-2;otera,j.(editor)“modern carbonyl chemistry”(2000)wiley-vch,isbn:3-527-29871-1;patai,s.“patai’s 1992guide to the chemistry of functional groups”(1992)interscience isbn:0-471-93022-9;solomons,t.w.g.“organic chemistry”7th edition(2000)john wiley&sons,isbn:0-471-19095-0;stowell,j.c.,“intermediate organic chemistry”2nd edition(1993)wiley-interscience,isbn:0-471-57456-2;“industrial organic chemicals:starting materials and intermediates:an ullmann’s encyclopedia”(1999)john wiley&sons,isbn:3-527-29645-x,in 8volumes;“organic reactions”(1942-2000)john wiley&sons,in over 55volumes;and“chemistry of functional groups”john wiley&sons,in 73volumes.
[0248]
通过美国化学会化学文摘社制备的已知化学物质的索引,可以选择性地识别特定和类似的反应物,这些索引可在大多数公共图书馆和大学图书馆以及在线获得。已知但在目录中不可商购的化学品可选地由定制化学合成工厂制备,其中许多标准化学供应工厂(例如,上面列出的那些)提供定制合成服务。制备和选择本文所述化合物的药用盐的参考文献是p.h.stahl&c.g.wermuth“handbook of pharmaceutical salts”,verlag helvetica chimica acta,zurich,2002.
[0249]
以下实施例详细说明本发明的技术方案,但本发明的保护范围包括但是不限于此。
[0250]
化合物的结构是通过核磁共振(nmr)或(和)质谱(ms)来确定的。nmr位移(δ)以10-6(ppm)的单位给出。nmr的测定是用(bruker avance iii 400和bruker avance 300)核磁仪,测定溶剂为氘代二甲基亚砜(dmso-d6),氘代氯仿(cdcl3),氘代甲醇(cd3od),内标为四甲基硅烷(tms);
[0251]
ms的测定用(agilent 6120b(esi)和agilent 6120b(apci));
[0252]
hplc的测定使用agilent 1260dad高压液相色谱仪(zorbax sb-c18 100
×
4.6mm,3.5μm);
[0253]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,薄层色谱法(tlc)使用的硅胶板采用的规格是0.15mm-0.20mm,薄层层析分离纯化产品采用的规格是0.4mm-0.5mm;
[0254]
柱层析一般使用烟台黄海硅胶200-300目硅胶为载体;
[0255]
本发明的己知起始原料可以采用或按照本领域已知的方法来合成,或可购买于泰
{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide;
[0277][0278]
第一步:4-(甲磺酰氧基)哌啶-1-羧酸叔丁酯(1b)
[0279]
tert-butyl 4-(methanesulfonyloxy)piperidine-1-carboxylate
[0280][0281]
将4-羟基哌啶-1-羧酸叔丁酯1a(5.00g,24.84mmol),三乙胺(3.77g,37.26mmol)溶解在30ml二氯甲烷中,冰水浴下滴加入甲磺酰氯(3.41g,29.81mmol),加完后自然回到室温搅拌1小时。反应结束后,加入50ml水萃取。有机相用无水硫酸钠干燥,粗品用硅胶柱色谱分离提纯(乙酸乙酯/石油醚(v/v)=1:10),浓缩得到标题化合物,黄色油状物(1b)(6.5g,产率93.66%)。
[0282]
第二步:(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)硼酸(1e)
[0283]
(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)boronic acid
[0284][0285]
将化合物5-氟-2-甲氧基苯甲酸1c(0.71g,4.10mmol)和4-氨甲基苯基硼酸盐酸盐(1d)(0.92g,4.92mmol),n-甲基咪唑(0.84g,10.25mmol)加入到15ml干燥dmf中,冰水浴下分批加入o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(2.87g,10.25mmol),自然升到室温搅拌1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(pe:ea=1:1)得到目标化合物1e(0.94g,产率:74.89%)。
[0286]
lcms m/z=304.1[m+h]
+
[0287]
第三步:5-氨基-3-溴-1h-吡唑-4-碳腈(1g)
[0288]
5-amino-3-bromo-1h-pyrazole-4-carbonitrile
[0289][0290]
将化合物5-氨基-1h-吡唑-4-碳腈(1f)(1.0g,9.25mmol)溶解到15ml干燥dmf中,室温下分批加入nbs(2.47g,13.88mmol),加完后室温搅拌3小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(pe:ea=2:1)得到目标化合物(1g)(1.30g,产率:75.15%)。
[0291]
lcms m/z=187.0[m+h]
+
[0292]
第四步:4-(5-氨基-3-溴-4-氰基-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(1h)
[0293]
tert-butyl 4-(5-amino-3-bromo-4-cyano-1h-pyrazol-1-yl)piperidine-1-carboxylate
[0294][0295]
将化合物5-氨基-3-溴-1h-吡唑-4-碳腈(1g)(1.0g,5.35mmol),4-(甲磺酰氧基)哌啶-1-羧酸叔丁酯(1b)(1.79g,6.42mmol),碳酸铯(2.61g,8.02mmol)溶解到15ml干燥dmf中,室温下搅拌过夜。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(pe:ea=2:1)得到目标化合物1h(0.90g,产率:45.46%)。
[0296]
lcms m/z=370.1[m+h]
+
[0297]
第五步:4-(5-氨基-4-氰基-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(1i)
[0298]
tert-butyl 4-(5-amino-4-cyano-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazol-1-yl)piperidine-1-carboxylate
[0299][0300]
将化合物4-(5-氨基-3-溴-4-氰基-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(1h)(0.50g,1.35mmol),(4-(5-氟-2-甲氧基苯甲酰胺)甲基)苯基)硼酸(1e)(0.53g,1.76mmol),碳酸铯(0.92g,2.82mmol),pd(dppf)cl2(103.4mg,0.14mmol)加入到10ml二氧六环和水(v/v=5:1)混合溶剂中,氮气置换3次,加热到110度反应3小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物(1i)(0.42g,产率:56.69%)。
[0301]
lcms m/z=549.2[m+h]
+
[0302]
第六步:5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(哌啶-4-基)-1h-吡唑-4-甲酰胺(1j)
[0303]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(piperidin-4-yl)-1h-pyrazole-4-carboxamide
[0304][0305]
将化合物4-(5-氨基-4-氰基-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-1-基)哌啶-1-羧酸叔丁酯(1i)(100mg,0.18mmol)溶于5ml硫酸中(90%),加热到100度反应1小时,将反应液冷却到室温,在冰水浴下调节ph=10,ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物(1j)(0.06g,产率:70.5%)。
[0306]
lcms m/z=467.2[m+h]
+
[0307]
第七步:5-氨基1-(1-(3,3-二氟环丁烷羰基)哌啶-4-基)-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺;(化合物1)
[0308]
5-amino-1-(1-(3,3-difluorocyclobutanecarbonyl)piperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide;
[0309][0310]
将化合物1j(46.6mg,0.10mmol)和3,3-二氟环丁烷-1-羧酸(13.6mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物液相制备分离得到目标化合物1(0.012g,产率:20.54%)。制备条件:仪器及制备柱:采用waters 2767制备液相,制备柱型号xbridge c18,5μm,内径
×
长度=19mm
×
250mm。
[0311]
制备方法:粗品用dmf溶解,并用0.45μm滤膜过滤,制备成样品液。
[0312]
流动相体系:乙腈/(含0.05%氨水)水。梯度洗脱:乙腈含量30%-75%,洗脱时间15min。
[0313]
lcms m/z=585.3[m+h]
+
[0314]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.54
–
7.46(s,4h),7.28
–
7.21(m,1h),7.16(dd,1h),4.69
–
4.60(m,3h),4.42
–
4.31(m,1h),4.04
–
3.97(m,1h),3.95(s,3h),3.30
–
3.20(m,2h),2.92
–
2.72(m,5h),2.10
–
1.91(m,4h).
[0315]
实施例2
[0316]
5-氨基-1-(1-(2-(二甲氨基)乙酰基)哌啶-4-基)-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物2)
[0317]
5-amino-1-(1-(2-(dimethylamino)acetyl)piperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0318][0319]
将(1j)(46.6mg,0.10mmol)和n,n-二甲基甘氨酸(10.3mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物2(0.01g,产率:18.14%)。
[0320]
lcms m/z=552.3[m+h]
+
[0321]1h nmr(400mhz,cd3od)δ7.60(dd,1h),7.54
–
7.46(m,4h),7.28
–
7.21(m,1h),7.16(dd,1h),4.71
–
4.61(m,3h),4.46
–
4.35(m,1h),4.35
–
4.20(m,2h),3.95(s,3h),3.87
–
3.77(m,1h),3.30
–
3.22(m,1h),2.99
–
2.85(m,7h),2.20
–
1.94(m,4h).
[0322]
实施例3
[0323]
5-氨基-1-(1-环丙烷羰基哌啶-4-基)-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物3)
[0324]
5-amino-1-(1-cyclopropanecarbonylpiperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0325][0326]
将化合物(1j)(46.6mg,0.10mmol)和环丙基甲酸(8.5mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物3(0.015g,产率:28.03%)。
[0327]
lcms m/z=535.2[m+h]
+
[0328]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.54
–
7.45(m,4h),7.27
–
7.21(m,1h),7.16(dd,1h),4.70
–
4.59(m,3h),4.54
–
4.44(m,1h),4.44
–
4.32(m,1h),3.95(s,3h),2.89
–
2.74
(m,1h),2.22
–
1.89(m,6h),0.94
–
0.76(m,4h).
[0329]
实施例4
[0330]
5-氨基-1-(1-(3,3-二甲基环丁烷羰基)哌啶-4-基)-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物4)
[0331]
5-amino-1-(1-(3,3-dimethylcyclobutanecarbonyl)piperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0332][0333]
将化合物(1j)(46.6mg,0.10mmol)和3,3-二甲基环丁基甲酸(12.8mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物4(0.015g,产率:25.98%)。
[0334]
lcms m/z=577.3[m+h]
+
[0335]
实施例5
[0336]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(2r)-1-甲基吡咯烷-2-羰基]哌啶-4-基)-1h-吡唑-4-甲酰胺(化合物5)
[0337]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(2r)-1-methylpyrrolidine-2-carbonyl]piperidin-4-yl)-1h-pyrazole-4-carboxamide
[0338][0339]
将化合物(1j)(46.6mg,0.10mmol)和(2r)-1-甲基吡咯烷-2-羧酸(12.9mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物5(0.018g,产率:31.14%)。
[0340]
lcms m/z=578.3[m+h]
+
[0341]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.54
–
7.43(m,4h),7.29
–
7.21(m,1h),7.16(dd,1h),4.73
–
4.62(m,3h),4.47
–
4.33(m,1h),4.11
–
3.91(m,5h),3.51
–
3.39(m,1h),3.30
–
3.22(m,1h),2.94
–
2.75(m,2h),2.70
–
2.60(m,3h),2.53
–
2.38(m,1h),2.13
–
1.95(m,7h).
[0342]
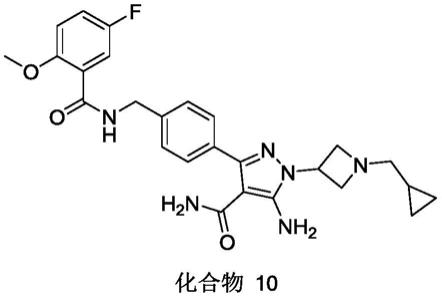
实施例6
[0343]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(2s)-1-甲基吡咯烷-2-羰基]哌啶-4-基)-1h-吡唑-4-甲酰胺(化合物6)
[0344]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(2s)-1-methylpyrrolidine-2-carbonyl]piperidin-4-yl)-1h-pyrazole-4-carboxamide
[0345][0346]
将化合物(1j)(46.6mg,0.10mmol)和(2s)-1-甲基吡咯烷-2-羧酸(12.9mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物6(0.017g,产率:29.41%)。
[0347]
lcms m/z=578.3[m+h]
+
[0348]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.54
–
7.43(m,4h),7.29
–
7.21(m,1h),7.16(dd,1h),4.73
–
4.62(m,3h),4.47
–
4.33(m,1h),4.11
–
3.83(m,5h),3.45
–
3.36(m,1h),3.30
–
3.20(m,1h),2.94
–
2.69(m,2h),2.67
–
2.57(m,3h),2.49
–
2.37(m,1h),2.13
–
1.95(m,7h).
[0349]
实施例7
[0350]
5-氨基-1-(1-环丁烷基-3-基)-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物7)
[0351]
5-amino-1-(1-cyclobutanecarbonylazetidin-3-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0352][0353]
第一步:3-[(全氟丁烷磺酰基)氧基]氮杂环丁烷-1-羧酸叔丁酯(7b)
[0354]
tert-butyl 3-[(nonafluorobutanesulfonyl)oxy]azetidine-1-carboxylate
[0355][0356]
将中间体n-boc-3-羟基氮杂环丁烷(7a)(5.00g,28.87mmol),三乙胺(3.77g,37.26mmol)溶解在30ml二氯甲烷中,冰水浴下滴加入全氟丁基磺酰氟(9.59g,31.75mmol),加完后自然回到室温搅拌3小时。反应结束后,加入50ml水萃取。有机相用无水硫酸钠干燥,过滤,浓缩得到标题化合物,黄色油状(7b)(12.0g,产率91.31%),直接用于下一步。
[0357]
第二步:3-(5-氨基-3-溴-4-氰基-1h-吡唑-1-基)氮杂环丁烷-1-羧酸叔丁酯(7d)
[0358]
tert-butyl 3-(5-amino-3-bromo-4-cyano-1h-pyrazol-1-yl)azetidine-1-carboxylate
[0359][0360]
将化合物5-氨基-3-溴-1h-吡唑-4-碳腈(1g)(1.0g,5.35mmol),3-[(全氟丁烷磺酰基)氧基]氮杂环丁烷-1-羧酸叔丁酯(7b)(2.19g,6.42mmol),碳酸铯(2.61g,8.02mmol)溶解到15ml干燥dmf中,室温下搅拌过夜。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层
析分离(pe:ea=2:1),得到目标化合物(7d)(0.56g,产率:30.60%)。
[0361]
lcms m/z=342.1[m+h]+
[0362]1h nmr(400mhz,dmso-d6)δ7.06(s,2h),5.13
–
5.02(m,1h),4.25
–
4.13(m,2h),4.10
–
3.96(m,2h),1.40(s,9h).
[0363]
第三步:3-(5-氨基-4-氰基-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-1-基)壬二酸-1-羧酸叔丁酯(7e)
[0364]
tert-butyl 3-(5-amino-4-cyano-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazol-1-yl)azetidine-1-carboxylate
[0365][0366]
将化合物3-(5-氨基-3-溴-4-氰基-1h-吡唑-1-基)氮杂环丁烷-1-羧酸叔丁酯(7d)(0.50g,1.46mmol),(4-(5-氟-2-甲氧基苯甲酰胺)甲基)苯基)硼酸(1e)(0.50g,1.75mmol),碳酸铯(0.92g,2.82mmol),pd(dppf)cl2(103.4mg,0.14mmol)加入到10ml二氧六环和水(v/v=5:1)混合溶剂中,氮气置换3次,加热到110度反应3小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物(7e)(0.55g,产率:72.31%)。
[0367]
lcms m/z=421.1[m-100]+
[0368]
第四步:5-氨基-1-(氮杂环丁烷-3-基)-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-甲酰胺(7f)
[0369]
5-amino-1-(azetidin-3-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0370][0371]
将化合物7e(400mg,0.76mmol)溶于10ml硫酸中(90%),加热到100度反应1小时,将反应液冷却到室温,在冰水浴下调节ph=10,ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物7f(0.29g,产率:86.08%)。
[0372]
lcms m/z=439.1[m+h]+
[0373]
第五步:5-氨基-1-(1-环丁烷基-3-基)-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物7)
[0374]
5-amino-1-(1-cyclobutanecarbonylazetidin-3-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0375][0376]
将化合物7f(44.0mg,0.10mmol)和环丁烷羧酸(10.05mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物7(0.020g,产率:38.29%)。
[0377]
lcms m/z=521.2[m+h]
+
[0378]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.57
–
7.47(m,4h),7.28
–
7.21(m,1h),7.16(dd,1h),5.23
–
5.13(m,1h),4.67(s,2h),4.59
–
4.49(m,2h),4.42
–
4.31(m,2h),3.95(s,3h),3.26
–
3.14(m,1h),2.33
–
2.21(m,2h),2.19
–
2.07(m,2h),2.05
–
1.92(m,1h),1.90
–
1.80(m,1h).
[0379]
实施例8
[0380]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-(1-氟环丙烷羰基)氮杂环丁烷-3-基)-1h-吡唑-4-甲酰胺(化合物8)
[0381]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-(1-fluorocyclopropanecarbonyl)azetidin-3-yl)-1h-pyrazole-4-carboxamide
[0382][0383]
将化合物7f(44.0mg,0.10mmol)和1-氟环丙烷-1-羧酸(10.40mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物8(0.013g,产率:24.79%)。
[0384]
lcms m/z=525.2[m+h]
+
[0385]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.59
–
7.48(m,4h),7.28
–
7.21(m,1h),7.16(dd,1h),5.32
–
5.22(m,1h),4.93
–
4.84(m,2h),4.68(s,2h),4.53
–
4.43(m,2h),3.96(s,3h),1.37
–
1.23(m,4h).
[0386]
实施例9
[0387]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(1r,2r)-2-氟环丙烷羰基]氮杂环丁烷-3-基)-1h-吡唑-4-甲酰胺(化合物9)
[0388]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(1r,2r)-2-fluorocyclopropanecarbonyl]azetidin-3-yl)-1h-pyrazole-4-carboxamide
[0389][0390]
将化合物7f(44.0mg,0.10mmol)和(1r,2r)-2-氟环丙烷-1-羧酸(10.40mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物9(0.010g,产率:19.07%)。
[0391]
lcms m/z=525.2[m+h]
+
[0392]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.58
–
7.47(m,4h),7.28
–
7.21(m,1h),7.16(dd,1h),5.29
–
5.19(m,1h),4.93
–
4.85(m,1h),4.76
–
4.70(m,2h),4.67(s,2h),4.49
–
4.36(m,2h),3.95(s,3h),1.88
–
1.78(m,1h),1.72
–
1.60(m,1h),1.15
–
1.04(m,1h).
[0393]
实施例10
[0394]
5-氨基-1-(1-(环丙基甲基)氮杂环丁烷-3-基)-3-(4-{[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物10)
[0395]
5-amino-1-(1-(cyclopropylmethyl)azetidin-3-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0396][0397]
将化合物7f(44.0mg,0.10mmol)和环丙烷甲醛(14.10mg,0.2mmol)溶于5ml干燥dma中,室温下搅拌继续反应1小时后加入三乙酰氧基硼氢化钠(63.5mg,0.3mmol)。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物10(0.010g,产率:20.32%)。
[0398]
lcms m/z=493.2[m+h]
+
[0399]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.59
–
7.49(m,4h),7.29
–
7.21(m,1h),7.17(dd,1h),5.25
–
5.35(m,1h),4.68(s,2h),4.57
–
4.42(m,4h),3.97(s,3h),3.13(d,2h),1.06
–
0.97(m,1h),0.70
–
0.62(m,2h),0.41
–
0.33(m,2h).
[0400]
实施例11
[0401]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(1s,2s)-2-氟环丙烷羰基]氮杂环丁烷-3-基)-1h-吡唑-4-甲酰胺(化合物11)
[0402]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(1s,2s)-2-fluorocyclopropanecarbonyl]azetidin-3-yl)-1h-pyrazole-4-carboxamide
[0403][0404]
将化合物7f(44.0mg,0.10mmol)和(1s,2s)-2-氟环丙烷-1-羧酸(10.40mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物11(0.015g,产率:28.57%)。
[0405]
lcms m/z=525.2[m+h]
+
[0406]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.58
–
7.47(m,4h),7.28
–
7.21(m,1h),7.16(dd,1h),5.29
–
5.19(m,1h),4.93
–
4.85(m,1h),4.76
–
4.70(m,2h),4.68(s,2h),4.49
–
4.36(m,2h),3.95(s,3h),1.88
–
1.78(m,1h),1.72
–
1.60(m,1h),1.16
–
1.03(m,1h).
[0407]
实施例12
[0408]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(1r,2s)-2-氟环丙烷羰基]氮杂环丁烷-3-基)-1h-吡唑-4-甲酰胺(化合物12)
[0409]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(1r,2s)-2-fluorocyclopropanecarbonyl]azetidin-3-yl)-1h-pyrazole-4-carboxamide
[0410][0411]
将化合物7f(44.0mg,0.10mmol)和(1r,2s)-2-氟环丙烷-1-羧酸(10.40mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物12(0.017g,产率:32.36%)。
[0412]
lcms m/z=525.2[m+h]
+
[0413]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.60
–
7.48(m,4h),7.28
–
7.22(m,1h),7.16(dd,1h),5.29
–
5.20(m,1h),4.87
–
4.73(m,3h),4.68(s,2h),4.46
–
4.32(m,2h),3.96(s,3h),2.17
–
2.00(m,1h),1.50
–
1.36(m,1h),1.30
–
1.17(m,1h).
[0414]
实施例13
[0415]
5-氨基-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1-(1-[(1s,2r)-2-氟环丙烷羰基]氮杂环丁烷-3-基)-1h-吡唑-4-甲酰胺(化合物13)
[0416]
5-amino-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1-(1-[(1s,2r)-2-fluorocyclopropanecarbonyl]azetidin-3-yl)-1h-pyrazole-4-carboxamide
[0417][0418]
将化合物7f(44.0mg,0.10mmol)和(1s,2r)-2-氟环丙烷-1-羧酸(10.40mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物13(0.017g,产率:32.36%)。
[0419]
lcms m/z=525.2[m+h]
+
[0420]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.60
–
7.48(m,4h),7.28
–
7.22(m,1h),7.16(dd,1h),5.29
–
5.20(m,1h),4.86
–
4.72(m,3h),4.68(s,2h),4.44
–
4.32(m,2h),3.96(s,3h),2.17
–
2.03(m,1h),1.50
–
1.37(m,1h),1.30
–
1.19(m,1h).
[0421]
实施例14
[0422]
5-氨基-1-(1-(2,2-二氟环丙烷羰基)氮杂环丁烷-3-基)-3-(4-[(5-氟-2-甲氧基苯基)甲酰胺]甲基}苯基)-1h-吡唑-4-甲酰胺(化合物14)
[0423]
5-amino-1-(1-(2,2-difluorocyclopropanecarbonyl)azetidin-3-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide
[0424][0425]
将化合物7f(44.0mg,0.10mmol)和2,2-二氟环丙烷-1-羧酸(12.2mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物14(0.018g,产率:33.18%)。
[0426]
lcms m/z=543.2[m+h]
+
[0427]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.59
–
7.47(m,4h),7.28
–
7.20(m,1h),7.16(dd,1h),5.29
–
5.20(m,1h),4.77
–
4.65(m,4h),4.49
–
4.37(m,2h),3.96(s,3h),2.66
–
2.55(m,1h),2.06
–
1.94(m,1h),1.84
–
1.73(m,1h).
[0428]
实施例15
[0429]
5-氨基-1-[1-(1-氟环丙烷羰基)-4-哌啶基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物15)
[0430]
5-amino-1-[1-(1-fluorocyclopropanecarbonyl)-4-piperidyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0431][0432]
将化合物1j(46.6mg,0.10mmol)和1-氟环丙烷羧酸(10.4mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物15(0.01g,产率:18.14%)。
[0433]
lcms m/z=553.3[m+h]
+
[0434]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.56
–
7.37(m,5h),7.36
–
7.29(m,1h),7.21
–
7.15(m,1h),6.39(s,2h),4.60
–
4.27(m,5h),3.89(s,3h),3.22
–
2.88(m,2h),2.02
–
1.76(m,4h),1.34
–
1.11(m,4h).
[0435]
实施例16
[0436]
5-氨基-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]-1-[1-(四氢呋喃-3-羰基)-4-哌啶基]吡唑-4-甲酰胺(化合物16)
[0437]
5-amino-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]-1-[1-(tetrahydrofuran-3-[0438]
carbonyl)-4-piperidyl]pyrazole-4-carboxamide
[0439][0440]
将化合物1j(46.6mg,0.10mmol)和3-四氢呋喃甲酸(11.6mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物16(0.015g,产率:28.03%)。
[0441]
lcms m/z=565.3[m+h]
+
[0442]
实施例17
[0443]
5-氨基-1-[1-(1-氨基环丙烷羰基)-4-哌啶基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物17)
[0444]
5-amino-1-[1-(1-aminocyclopropanecarbonyl)-4-piperidyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0445][0446]
将化合物1j(46.6mg,0.10mmol)和boc-1-氨基环丙基甲酸(20.1mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml淬灭),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,重新将残留物溶解在3ml 4n盐酸二氧六环溶液中搅拌1小时,用氨甲醇调ph至8,减压浓缩,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物17(0.015g,产率:25.98%)。
[0447]
lcms m/z=550.2[m+h]
+
[0448]1h nmr(400mhz,dmso-d6)δ8.80(t,1h),7.50(dd,1h),7.47
–
7.37(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.38(s,2h),4.59
–
4.31(m,5h),3.89(s,3h),3.04
–
2.80(m,2h),2.34
–
[0449]
2.18(m,2h),1.95
–
1.77(m,4h),0.87
–
0.78(m,2h),0.69
–
0.59(m,2h).
[0450]
实施例18
[0451]
5-氨基-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]-1-[1-(氧代烷-3-羰基)-4-哌啶基]吡唑-4-甲酰胺(化合物18)
[0452]
5-amino-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]-1-[1-(oxetane-3-carbonyl)-4-piperidyl]pyrazole-4-carboxamide
[0453]
[0454]
将化合物1j(46.6mg,0.10mmol)和氧烷-3-羧酸(10.2mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取((20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物18(0.018g,产率:31.14%)。
[0455]
lcms m/z=551.2[m+h]
+
[0456]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.53
–
7.43(m,4h),7.29
–
7.21(m,1h),7.16(dd,1h),4.90
–
4.83(m,4h),4.72
–
4.60(d,3h),4.41
–
4.30(m,1h),4.27
–
4.18(m,1h),3.95(s,3h),3.66
–
3.58(d,1h),3.23
–
3.11(m,1h),2.89
–
2.77(m,1h),2.06
–
1.89(m,4h).
[0457]
实施例19
[0458]
5-氨基-1-[1-[(1s,2r)-2-氟环丙烷羰基]-4-哌啶基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物19)
[0459]
5-amino-1-[1-[(1s,2r)-2-fluorocyclopropanecarbonyl]-4-piperidyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0460][0461]
将化合物1j(46.6mg,0.10mmol)和(1s,2r)-2-氟环丙烷-1-羧酸(10.4mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物19(0.017g,产率:29.41%)。
[0462]
lcms m/z=553.3[m+h]
+
[0463]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.51(dd,1h),7.48
–
7.37(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.38(s,2h),4.93
–
4.63(m,1h),4.54(m,2h),4.53
–
4.31(m,3h),3.89(s,3h),3.30
–
3.14(m,1h),2.77
–
2.57(m,2h),2.01
–
1.64(m,4h),1.44
–
1.30(m,1h),1.21
–
1.06(m,1h).
[0464]
实施例20
[0465]
5-氨基-1-[1-[(1r,2r)-2-氟环丙烷羰基]-4-哌啶基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物20)
[0466]
5-amino-1-[1-[(1r,2r)-2-fluorocyclopropanecarbonyl]-4-piperidyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0467][0468]
将化合物1j(46.6mg,0.10mmol)和(1r,2r)-2-氟环丙烷-1-羧酸(10.4mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取((20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物20(0.017g,产率:29.41%)。
[0469]
lcms m/z=553.3[m+h]
+
[0470]1h nmr(400mhz,dmso-d6)δ8.80(t,1h),7.51(dd,1h),7.49
–
7.36(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.38(s,2h),5.03
–
4.79(m,1h),4.54(d,2h),4.51
–
4.30(m,3h),3.89(s,3h),3.26
–
3.12(m,1h),2.81
–
2.68(m,1h),2.26
–
2.08(m,1h),2.06
–
1.61(m,4h),1.57
–
1.44(m,1h),1.05
–
0.94(m,1h).
[0471]
中间体21e的合成:
[0472]
(r)-5-氨基-3-(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(吡咯烷-3-基)-1h-吡唑-4-羧酰胺21e的合成
[0473]
(r)-5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-(pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0474]
第一步:
[0475]
tert-butyl(s)-3-((methylsulfonyl)oxy)pyrrolidine-1-carboxylate
[0476]
(s)-3-((甲磺酰基)氧基)吡咯烷-1-羧酸叔丁酯:
[0477][0478]
将化合物21a(20g,10.69mmol)溶于150ml二氯甲烷中,加入三乙胺(44ml,32.01mmol),冰浴下缓慢加入甲基磺酰氯(9.9ml,12.83mmol),反应过夜。待原料反应完全
(pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0495]
(r)-5-氨基-3-(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(吡咯烷-3-基)-1h-吡唑-4-羧酰胺
[0496][0497]
将化合物21d(1g,1.88mmol)用5ml 90%的浓硫酸溶解,然后升温至90℃,搅拌反应1.5小时。反应结束后冷却至室温,然后将反应液缓慢滴加入氨水溶液中,调节ph至8-9,乙酸乙酯萃取3次,有机相用无水硫酸钠干燥,过滤后,减压浓缩。经柱层析纯化得到目标化合物21e,灰色固体(550mg,收率:65%)。
[0498]
lcms m/z=453.2[m+h]
+
[0499]
实施例21
[0500]
(r)-5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(1-(1-氟环丙烷-1-羰基)吡咯烷-3-基)-1h-吡唑-4-羧酰胺(化合物21)
[0501]
(r)-5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-(1-(1-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0502][0503]
将化合物21e(37mg,0.082mmol)和化合物1-氟环丙烷-1-羧酸(8mg,0.074mmol)溶于3ml n,n-二甲基甲酰胺中,加入二异丙基乙胺(0.04ml,0.246mmol),室温下加入o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(47mg,0.123mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)得到化合物21,淡黄色固体(20mg,收率:45%)。
[0504]
lcms m/z=539.2[m+h]
+
[0505]1h nmr(400mhz,dmso-d6)δ8.80(t,1h),7.51(dd,1h),7.48
–
7.37(m,4h),7.35
–
7.30(m,1h),7.18(dd,1h),6.43(s,2h),5.02
–
4.87(m,1h),4.54(d,2h),4.12
–
3.92(m,2h),3.89(s,3h),3.81
–
3.60(m,2h),2.40
–
2.18(m,2h),1.30
–
1.16(m,4h).
[0506]
实施例22
[0507]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((r)-1-((1r,2r)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物22)
[0508]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((r)-1-((1r,2r)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0509][0510]
将化合物21e(45mg,0.100mmol)和化合物(1r,2r)-2-氟环丙烷-1-羧酸(9mg,0.090mmol)溶于3ml n,n-二甲基甲酰胺中,加入二异丙基乙胺(0.05ml,0.300mmol),室温下加入o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(57mg,0.149mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)得到化合物22,白色固体(26mg,收率:48%)。
[0511]
lcms m/z=539.2[m+h]
+
[0512]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.50(dd,1h),7.48
–
7.36(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.44(d,2h),5.04
–
4.77(m,2h),4.54(d,2h),4.03
–
3.83(m,4h),3.79
–
3.70(m,1h),3.67
–
3.55(m,1h),3.46
–
3.37(m,1h),2.42
–
2.22(m,2h),2.08
–
1.96(m,1h),1.59
–
1.48(m,1h),1.06
–
0.92(m,1h).
[0513]
实施例23
[0514]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((r)-1-((1s,2r)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物23)
[0515]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((r)-1-((1s,2r)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0516][0517]
将化合物21e(45mg,0.100mmol)和化合物(1s,2r)-2-氟环丙烷-1-羧酸(9mg,0.090mmol)溶于3ml n,n-二甲基甲酰胺中,加入二异丙基乙胺(0.05ml,0.300mmol),室温下加入o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(57mg,0.149mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)得到化合物23,白色固体(28mg,收率:52%)。
[0518]
lcms m/z=539.2[m+h]
+
[0519]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.50(dd,1h),7.49
–
7.37(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.43(d,2h),5.04
–
4.87(m,1h),4.87
–
4.64(m,1h),4.54(d,2h),4.13
–
3.85(m,4h),3.79
–
3.66(m,1h),3.62
–
3.53(m,1h),3.41
–
3.33(m,1h),2.42
–
2.29(m,2h),2.28
–
2.02(m,1h),1.49
–
1.33(m,1h),1.19
–
1.06(m,1h).
[0520]
实施例24
[0521]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((r)-1-((1r,2s)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物24)
[0522]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((r)-1-((1r,2s)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0523][0524]
将化合物21e(54mg,0.119mmol)和化合物(1r,2s)-2-氟环丙烷-1-羧酸(11mg,0.107mmol)溶于4ml n,n-二甲基甲酰胺中,加入1-甲基咪唑(0.02ml,0.242mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(51mg,0.180mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)得到化合物24,白色固体(39mg,收率:60%)。
[0525]
lcms m/z=539.2[m+h]
+
[0526]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.53
–
7.48(m,1h),7.48
–
7.43(m,2h),7.43
–
7.38(m,2h),7.36
–
7.29(m,1h),7.18(dd,1h),6.43(d,2h),5.05
–
4.63(m,2h),4.54(d,2h),4.13
–
3.85(m,4h),3.81
–
3.65(m,1h),3.64
–
3.52(m,1h),3.44
–
3.34(m,1h),2.43
–
2.28(m,2h),2.28
–
2.20(m,1h),1.49
–
1.31(m,1h),1.19
–
1.06(m,1h).
[0527]
实施例25
[0528]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((r)-1-((1r,2s)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物25)
[0529]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((r)-1-((1r,2s)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0530][0531]
将化合物21e(53mg,0.117mmol)和化合物(1s,2s)-2-氟环丙烷-1-羧酸(11mg,0.107mmol)溶于4ml n,n-二甲基甲酰胺中,加入1-甲基咪唑(0.02ml,0.242mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(51mg,0.180mmol),反应3h。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)得到化合物25,白色固体(38mg,收率:60%)。
[0532]
lcms m/z=539.2[m+h]
+
[0533]1h nmr(400mhz,dmso-d6)δ8.85
–
8.74(m,1h),7.51(dd,1h),7.49
–
7.37(m,4h),7.36
–
7.29(m,1h),7.18(dd,1h),6.43(d,2h),5.06
–
4.75(m,2h),4.54(d,2h),4.15
–
3.84(m,4h),3.83
–
3.73(m,1h),3.71
–
3.62(m,1h),3.61
–
3.34(m,1h),2.43
–
2.21(m,2h),2.09
–
1.97(m,1h),1.59
–
1.46(m,1h),1.05
–
0.94(m,1h).
[0534]
中间体26e的合成:
[0535]
(s)-5-氨基-3-(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(吡咯烷-3-基)-1h-吡唑-4-羧酰胺26e的合成
[0536]
(s)-5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-(pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0537][0538]
第一步:
[0539]
tert-butyl(r)-3-((methylsulfonyl)oxy)pyrrolidine-1-carboxylate(26b)
[0540]
(r)-3-((甲磺酰基)氧基)吡咯烷-1-羧酸叔丁酯:
[0541][0542]
将化合物26a(20g,10.69mmol)溶于150ml二氯甲烷中,加入三乙胺(44ml,32.01mmol),冰浴下缓慢加入甲基磺酰氯(9.9ml,12.83mmol),反应过夜。待原料反应完全后加入150ml饱和碳酸氢钠溶液稀释反应,十分钟后分离有机层,水相用40ml二氯甲烷萃取
2次,合并有机相,然后用磷酸二氢钾溶液洗涤3次,有机相用无水硫酸钠干燥,过滤后,减压浓缩得到目标化合物26b,黄色油状液体(26g,收率:92%)。
[0543]
第二步:
[0544]
tert-butyl(s)-3-(5-amino-3-bromo-4-cyano-1h-pyrazol-1-yl)pyrrolidine-1-carboxylate(26c)
[0545]
(s)-3-(5-氨基-3-溴-4-氰基-1h-吡唑-1-基)吡咯烷-1-羧酸叔丁酯
[0546][0547]
将化合物26b(20.7g,78.0mmol)和5-氨基-3-溴-1h-吡唑-4-腈(7.29g,39mmol)溶于100ml n,n-二甲基甲酰胺中,加入碳酸铯(50.8g,156mmol),70℃下搅拌反应过夜。反应结束后加入150ml水稀释反应,70ml乙酸乙酯萃取3次,然后合并有机相,用水洗涤有机相3次,无水硫酸钠干燥,过滤后,减压浓缩。经柱层析纯化得到目标化合物26c,褐色固体(3.6g,收率:36.8%)。
[0548]
lcms m/z=357.1[m+h]
+
[0549]
第三步:
[0550]
tert-butyl(s)-3-(5-amino-4-cyano-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1h-pyrazol-1-yl)pyrrolidine-1-carboxylate(26d)
[0551]
(s)-3-(5-氨基-4-氰基-3-(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1h-吡唑-1-基)吡咯烷-1-羧酸叔丁酯
[0552][0553]
将化合物26c(3.3g,9.3mmol)和(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)硼酸(3.37g,11.11mmol)加入封管中,用150ml 1,4-二氧六环溶解,然后加入[1,1'-双(二苯基膦基)二茂铁]二氯化钯(0.68g,0.93mmol)和碳酸铯(6.1g,18.6mmol),110℃下搅拌反应4小时。反应结束后减压浓缩后,加入100ml水稀释反应,乙酸乙酯萃取3次,有机相用无水硫酸钠干燥,过滤后,减压浓缩。经柱层析纯化得到目标化合物26d,黑色固体(2.3g,收率:42%)。
[0554]
lcms m/z=435.2[m-100]
+
[0555]
第四步:
[0556]
(s)-5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-(pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide(26e)
[0557]
(s)-5-氨基-3-(4-((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(吡咯烷-3-基)-1h-吡唑-4-羧酰胺
[0558][0559]
将化合物26d(4.75g,8.89mmol)用15ml 90%的浓硫酸溶解,然后升温至90℃,搅拌反应1.5小时。反应结束后冷却至室温,然后将反应液缓慢滴加入氨水溶液中,调节ph至8-9,乙酸乙酯萃取3次,有机相用无水硫酸钠干燥,过滤后,减压浓缩。经柱层析纯化得到目标化合物26e,灰色固体(2.5g,收率:62%)。
[0560]
lcms m/z=453.2[m+h]
+
[0561]
实施例26
[0562]
(s)-5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-(1-(1-氟环丙烷-1-羰基)吡咯烷-3-基)-1h-吡唑-4-羧酰胺(化合物26)
[0563]
(s)-5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-(1-(1-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0564][0565]
将化合物26e(100mg,0.22mmol)和化合物1-氟环丙烷-1-羧酸(23mg,0.22mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物26,白色固体(35mg,收率:29%)。
[0566]
lcms m/z=539.2[m+h]
+
[0567]
实施例27
[0568]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((s)-1-((1s,2s)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物27)
[0569]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((s)-1-((1s,2s)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0570][0571]
将化合物26e(0.1mg,0.22mmol)和化合物(1s,2s)-2-氟环丙烷-1-羧酸(23mg,0.22mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3h。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物27,白色固体(30mg,收率:25%)。
[0572]
lcms m/z=539.2[m+h]
+
[0573]
实施例28
[0574]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((s)-1-((1r,2s)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物28)
[0575]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((s)-1-((1r,2s)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0576][0577]
将化合物26e(0.1mg,0.22mmol)和化合物(1r,2s)-2-氟环丙烷-1-羧酸(23mg,0.22mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3小时。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物28,白色固体(37mg,收率:30%)。
[0578]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.56
–
7.42(m,4h),7.28
–
7.20(m,1h),7.16(dd,1h),5.04
–
4.87(m,1h),4.86
–
4.62(m,3h),4.17
–
3.78(m,6h),3.76
–
3.46(m,1h),2.58
–
2.20(m,3h),1.52
–
1.34(m,1h),1.33
–
1.17(m,1h).
[0579]
lcms m/z=539.2[m+h]
+
[0580]
实施例29
[0581]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((s)-1-((1r,2r)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物29)
[0582]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((s)-1-((1r,2r)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0583][0584]
将化合物26e(0.1mg,0.22mmol)和化合物(1r,2s)-2-氟环丙烷-1-羧酸(23mg,0.22mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3h。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物29,白色固体(41mg,收率:33%)。
[0585]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.55
–
7.41(m,4h),7.28
–
7.20(m,1h),7.16(dd,1h),5.03
–
4.70(m,2h),4.69
–
4.61(m,2h),4.17
–
3.52(m,7h),2.57
–
2.27(m,2h),2.06
–
1.94(m,1h),1.74
–
1.61(m,1h),1.11
–
1.00(m,1h).
[0586]
lcms m/z=539.2[m+h]
+
[0587]
实施例30
[0588]
5-氨基-3-(4-(((5-氟-2-甲氧基苯甲酰胺基)甲基)苯基)-1-((s)-1-((1s,2r)-2-氟环丙烷-1-羰基)吡咯烷酮-3-基)-1h-吡唑-4-羧酰胺(化合物30)
[0589]
5-amino-3-(4-((5-fluoro-2-methoxybenzamido)methyl)phenyl)-1-((s)-1-((1s,2r)-2-fluorocyclopropane-1-carbonyl)pyrrolidin-3-yl)-1h-pyrazole-4-carboxamide
[0590][0591]
将化合物26e(0.1mg,0.22mmol)和化合物(1r,2s)-2-氟环丙烷-1-羧酸(23mg,0.22mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3h。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物30,白色固体(23mg,收率:19%)。
[0592]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.56
–
7.43(m,4h),7.30
–
7.20(m,1h),7.16
(dd,1h),5.04
–
4.86(m,1h),4.86
–
4.62(m,3h),4.17
–
3.77(m,6h),3.76
–
3.49(m,1h),2.57
–
2.22(m,3h),1.50
–
1.35(m,1h),1.31
–
1.18(m,1h).
[0593]
lcms m/z=539.2[m+h]
+
[0594]
实施例31
[0595]
5-氨基-1-[(3s)-1-(2,2-二氟环丙烷羰基)吡咯烷-3-基]-3-(4-{[((5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-羧酰胺(化合物31)
[0596]
5-amino-1-[(3s)-1-(2,2-difluorocyclopropanecarbonyl)pyrrolidin-3-yl]-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide.
[0597][0598]
将化合物26e(0.1mg,0.22mmol)和化合物2,2-二氟环丙烷-1-羧酸(23mg,0.189mmol)溶于3ml n,n-二甲基甲酰胺中,n-甲基咪唑(0.07ml,0.884mmol),室温下加入n,n,n',n'-四甲基氯甲脒六氟磷酸盐(124mg,0.44mmol),反应3h。待原料反应完全后加入20ml水稀释反应,然后用10ml乙酸乙酯萃取3次,合并有机相,水洗有机相3次,然后用无水硫酸钠干燥有机相,过滤后,减压浓缩。经柱层析分离纯化(dcm/meoh=20/1)后送制备得到化合物31,白色固体(32mg,收率:25%)。
[0599]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.54
–
7.44(m,4h),7.28
–
7.20(m,1h),7.16(dd,1h),5.07
–
4.87(m,1h),4.66(s,2h),4.15
–
3.78(m,6h),3.78
–
3.51(m,1h),2.88
–
2.72(m,1h),2.59
–
2.30(m,2h),2.07
–
1.96(m,1h),1.82
–
1.68(m,1h).
[0600]
lcms m/z=557.2[m+h]
+
[0601]
实施例32
[0602]
5-氨基-1-(1-环丁基哌啶-4-基)-3-(4-{[((5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-羧酰胺(化合物32)
[0603]
5-amino-1-(1-cyclobutylpiperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxyphenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide.
[0604][0605]
第一步:
[0606]
n-(4-(5-氨基-4-氰基-1-(哌啶-4-基)-1h-吡唑-3-基)苄基)-5-氟-2-甲氧基苯甲酰胺盐酸盐(32a)
[0607]
n-(4-(5-amino-4-cyano-1-(piperidin-4-yl)-1h-pyrazol-3-yl)benzyl)-5-fluoro-2-methoxybenzamide hydrochloride.
[0608][0609]
将化合物1i(1.0g,1.82mmol)于室温下溶于10ml盐酸1,4-二氧六环溶液中,反应3h。待原料反应完全后,直接减压旋干得到灰白色的固体32a(1.1g粗品),直接用于下一步反应。
[0610]
lcms m/z=449.2[m+h]+
[0611]
第二步:
[0612]
n-[(4-(5-氨基-4-氰基-1-(1-环丁基哌啶-4-基)-1h-吡唑-3-基)苯基)甲基]-5-氟-2-甲氧基苯甲酰胺(32b)
[0613]
n-[(4-(5-amino-4-cyano-1-(1-cyclobutylpiperidin-4-yl)-1h-pyrazol-3-yl)phenyl)methyl]-5-fluoro-2-methoxybenzamide.
methoxy phenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide.
[0628][0629][0630]
第一步:
[0631]
n-[(4-(5-氨基-4-氰基-1-(1-(环丙基甲基)哌啶-4-基)-1h-吡唑-3-基)苯基)甲基]-5-氟-2-甲氧基苯甲酰胺(33a)
[0632]
n-[(4-(5-amino-4-cyano-1-(1-(cyclopropylmethyl)piperidin-4-yl)-1h-pyrazol-3-yl)phenyl)methyl]-5-fluoro-2-methoxybenzamide.
[0633][0634]
将两个原料32a(0.1g,0.21mmol)和环丁酮(0.1ml,1.34mmol)溶于5ml n,n-二甲基甲酰胺中,随后加入无水硫酸镁(200mg),并滴加冰醋酸(0.01ml,0.17mmol)。氮气置换气三次,体系加热至70度反应1小时。加入乙酰氧基硼氢化钠(0.14g,0.66mmol),继续保持该温度反应2小时。待原料反应结束后,体系冷却至室温。加入50ml乙酸乙酯稀释,滴加5ml水猝灭反应,随后加入饱和碳酸氢钠调节ph至碱性。用15ml洗有机相3次。有机相干燥旋干,柱层析(dcm:meoh=20:1)得到粘稠液体产品33a(68mg,收率:61%)。
[0635]
lcms m/z=503.3[m+h]
+
[0636]
第二步:
[0637]
5-氨基-1-(1-(环丙基甲基)哌啶-4-基)-3-(4-{[((5-氟-2-甲氧基苯基)甲酰胺基]甲基}苯基)-1h-吡唑-4-羧酰胺(化合物33)
[0638]
5-amino-1-(1-(cyclopropylmethyl)piperidin-4-yl)-3-(4-{[(5-fluoro-2-methoxy phenyl)formamido]methyl}phenyl)-1h-pyrazole-4-carboxamide.
[0639][0640]
将原料33a(68mg,0.14mmol)溶于5ml二甲基亚砜中,置于冰浴下3min,加入1ml双氧水,于冰浴下向混合体系中缓慢滴加溶于1ml水的naoh(11mg,0.28mmol)溶液。滴加完毕后,待体系不明显放热后,升至室温反应2h。待反应结束后,加入10ml水稀释,用30ml乙酸乙酯萃取水相三次,有机相干燥旋干,柱层析(dcm:meoh=20:1)得到粘稠液体产品33(18mg,收率:25%)。
[0641]1h nmr(400mhz,cd3od)δ7.61(dd,1h),7.53
–
7.46(m,4h),7.29
–
7.21(m,1h),7.16(dd,1h),4.67(s,2h),4.32
–
4.22(m,1h),3.96(s,3h),3.57
–
3.48(m,2h),2.79
–
2.67(t,4h),2.38
–
2.24(m,2h),2.13
–
2.04(m,2h),1.08
–
0.96(m,1h),0.71
–
0.63(m,2h),0.34
–
0.27(m,2h).
[0642]
lcms m/z=521.2[m+h]
+
[0643]
实施例34
[0644]
5-氨基-1-[[(3r)-1-(3,3-二甲基环丁烷羰基)吡咯烷-3-基]甲基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物34)
[0645]
5-amino-1-[[(3r)-1-(3,3-dimethylcyclobutanecarbonyl)pyrrolidin-3-yl]methyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0646][0647]
第一步:叔丁基(3r)-3-(甲基磺酰氧基甲基)吡咯烷-1-羧酸酯(34b)
[0648]
tert-butyl(3r)-3-(methylsulfonyloxymethyl)pyrrolidine-1-carboxylate
[0649]
将中间体叔丁基(3r)-3-(羟甲基)吡咯烷-1-羧酸酯34a(5.00g,24.84mmol),三乙
胺(3.77g,37.26mmol)溶解在30ml二氯甲烷中,冰水浴下滴加入甲磺酰氯(3.41g,29.81mmol),加完后自然回到室温搅拌1h。反应结束后,加入50ml水萃取。有机相用无水硫酸钠干燥,粗品用硅胶柱色谱分离提纯(乙酸乙酯/石油醚(v/v)=1:10),浓缩得到标题化合物,黄色油状(34b)(6.5g,产率93.66%)。
[0650]
第二步:叔丁基(3r)-3-[(5-氨基-3-溴-4-氰基-吡唑-1-基)甲基]吡咯烷-1-羧酸盐(34c)
[0651]
tert-butyl(3r)-3-[(5-amino-3-bromo-4-cyano-pyrazol-1-yl)methyl]pyrrolidine-1-carboxylate
[0652][0653]
将化合物1g(1.0g,5.35mmol),和34a(1.79g,6.42mmol),碳酸铯(2.61g,8.02mmol)溶解到15ml干燥dmf中,100℃下搅拌1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(pe:ea=2:1)得到目标化合物34c(0.90g,产率:45.46%)。
[0654]
lcms m/z=371.1[m+h]
+
[0655]
第三步:叔丁基(3r)-3-[[5-氨基-4-氰基-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-1-基]甲基]吡咯烷-1-羧酸酯(34d)
[0656]
tert-butyl(3r)-3-[[5-amino-4-cyano-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazol-1-yl]methyl]pyrrolidine-1-carboxylate
[0657][0658]
将化合物34c(0.50g,1.35mmol)和1e(0.53g,1.76mmol),碳酸铯(0.92g,2.82mmol),pd(dppf)cl2(103.4mg,0.14mmol)加入到10ml二氧六环和水(v/v=5:1)混合溶剂中,氮气置换3次,加热到110℃反应3小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物34d(0.42g,产率:56.69%)。
[0659]
lcms m/z=493.2[m-56]
+
[0660]
第四步:5-氨基-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]-1-[[(3r)-吡咯烷-3-基]甲基]吡唑-4-甲酰胺(34e)
[0661]
5-amino-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]-1-[[(3r)-pyrrolidin-3-yl]methyl]pyrazole-4-carboxamide
[0662][0663]
将化合物34d(100mg,0.18mmol)溶于5ml硫酸中(90%),加热到90℃反应1小时,将反应液冷却到室温,在冰水浴下调节ph=10,ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物34e(0.06g,产率:70.5%)。
[0664]
lcms m/z=467.2[m+h]
+
[0665]
第五步:5-氨基-1-[[(3r)-1-(3,3-二甲基环丁烷羰基)吡咯烷-3-基]甲基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物34)
[0666]
5-amino-1-[[(3r)-1-(3,3-dimethylcyclobutanecarbonyl)pyrrolidin-3-yl]methyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0667][0668]
将化合物34e(46.6mg,0.10mmol)和3,3-二甲基环丁烷-1-羧酸(13.6mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.8mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水淬灭(50ml),ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1),得到目标化合物34,白色固体(0.012g,产率:20.54%)。
[0669]
lcms m/z=577.3[m+h]
+
[0670]
实施例35
[0671]
5-氨基-1-[[(3r)-1-(2,2-二氟环丙烷羰基)吡咯烷-3-基]甲基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物35)
[0672]
5-amino-1-[[(3r)-1-(2,2-difluorocyclopropanecarbonyl)pyrrolidin-3-yl]methyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物37)
[0685]
5-amino-1-[[(3r)-1-[(1s,2s)-2-fluorocyclopropanecarbonyl]pyrrolidin-3-yl]methyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0686][0687]
将化合物34e(46.6mg,0.10mmol)和(1s,2s)-2-氟环丙烷-1-羧酸(10.04mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水50ml淬灭,ea萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物37(0.01g,产率:18.14%)。
[0688]
lcms m/z=553.2[m+h]
+
[0689]1h nmr(400mhz,dmso-d6)δ8.86
–
8.75(m,1h),7.54
–
7.37(m,5h),7.37
–
7.29(m,1h),7.22
–
7.15(m,1h),6.44
–
6.35(m,2h),4.99
–
4.75(m,1h),4.54(d,2h),4.02
–
3.93(m,2h),3.89(s,3h),3.81
–
3.71(m,1h),3.56
–
3.34(m,2h),3.28
–
3.12(m,1h),2.86
–
2.59(m,1h),2.07
–
1.87(m,2h),1.84
–
1.59(m,1h),1.58
–
1.45(m,1h),1.03
–
0.90(m,1h).
[0690]
实施例38
[0691]
5-氨基-1-[[(3r)-1-(1-氟环丙烷基)吡咯烷-3-基]甲基]-3-[4-[[(5-氟-2-甲氧基-苯甲酰基)氨基]甲基]苯基]吡唑-4-甲酰胺(化合物38)
[0692]
5-amino-1-[[(3r)-1-(1-fluorocyclopropanecarbonyl)pyrrolidin-3-yl]methyl]-3-[4-[[(5-fluoro-2-methoxy-benzoyl)amino]methyl]phenyl]pyrazole-4-carboxamide
[0693][0694]
将化合物34e(46.6mg,0.10mmol)和1-氟环丙烷-1-羧酸(10.04mg,0.1mmol)溶于5ml干燥dmf中,室温下加入n-甲基咪唑(12.3mg,0.15mmol),o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸酯(42mg,0.15mmol),继续反应1小时。反应液加水50ml淬灭,ea
萃取(20ml
×
3),合并有机相,饱和食盐水洗(20ml
×
3),无水硫酸钠干燥,过滤,滤液减压除去溶剂,残留物柱层析分离(dcm:ch3oh=10:1)得到目标化合物38,白色固体(0.01g,产率:18.14%)。
[0695]
lcms m/z=553.2[m+h]
+
[0696]1h nmr(400mhz,dmso-d6)δ8.81(t,1h),7.51(dd,1h),7.48
–
7.37(m,4h),7.37
–
7.29(m,1h),7.18(dd,1h),6.40(s,2h),4.54(d,2h),3.99(d,2h),3.89(s,3h),3.85
–
3.69(m,1h),3.60
–
3.44(m,2h),3.43
–
3.14(m,1h),2.78
–
2.57(m,1h),2.07
–
1.85(m,1h),1.82
–
1.60(m,1h),1.30
–
1.11(m,4h)。
[0697]
生物测试例
[0698]
1.细胞增殖抑制活性
[0699]
oci-ly10细胞培养基为rpmi1640+10%fbs,培养于37℃、5%co2孵箱中。细胞铺板96孔板。oci-ly10细胞10000个/孔,每孔90μl,于37℃、5%co2条件下培养过夜。第二天每孔加入10μl不同浓度的受试化合物。每个浓度设3复孔,最后一列为dmso溶媒对照组,在37℃、5%co2条件下继续培养72小时。72小时后,每孔加入50μl检测试剂(cell viability assay,promega,g7573),混匀2分钟,室温孵育10分钟,envision2104读板仪(perkinelmer)测定荧光信号值。抑制率使用式(1)计算,其中rlu compound为药物处理组的读数,rlu control为溶剂对照组的平均值,rlu blank为无细胞孔平均值。应用graphpad prism软件,计算ic
50
值。
[0700]
ir(%)=(1
–
(rlu compound
–
rlu blank)/(rlu control
–
rlu blank))
×
100%(式1)
[0701]
结论:本发明实施例化合物对oci-ly10细胞增殖具有良好的抑制活性,其中化合物21、23对oci-ly10细胞增殖的抑制活性小于100nm。
[0702]
2.体外btk c481s激酶检测实验
[0703]
激酶btk c481s(carna,cat.no 08-547)配制成2.5
×
的激酶溶液,底物fam-p2(gl biochem,cat.no.112394)与atp((sigma,cat.no.a7699-1g)配制成2.5
×
的底物溶液。在384孔板中加入5μl不同浓度的化合物,加入10μl 2.5
×
的激酶溶液,室温孵育10分钟。加入10μl 2.5
×
的底物溶液,与28℃孵育适当时间后,加入30μl终止液终止反应,使用caliper ez reader2仪器检测。运用xlfit excel add-in version 5.4.0.8软件计算ic
50
值。
[0704]
结论:本发明实施例化合物对btk c481s激酶具有良好的抑制活性,其中化合物1、2、4、7-26、28-33、35、37对btk c481s激酶的抑制活性小于100nm,例如化合物22、23、25对btk c481s激酶的抑制活性分别为7.8nm、8.7nm和5.5nm。
