1.本发明属于植物育种技术领域,具体涉及一种利用幼胚获得鸢尾种间杂交后代的培养基及其应用。
背景技术:
2.鸢尾属(iris l.)植物既可观花也可观叶,是著名的宿根花卉,具有重要的观赏、生态、药用及经济价值。我国是全球鸢尾属植物的主要分布中心,因此培育具有自主知识产权且具我国特色的鸢尾品种是资源保护和利用的重要措施。远缘杂交是植物种质创新和品种改良的重要途径之一,远缘杂交后代具有杂种优势,可获得抗性强、观赏价值高的植物新种质。然而大多数鸢尾因种间障碍远缘杂交很难得到后代,阻碍了优质种质的获得。
3.远缘杂交障碍可分为受精前障碍和受精后障碍。研究表明,鸢尾中远缘杂交受精后障碍主要表现为胚乳败育致杂种胚败育和受精后幼胚发育不完整致杂交种子发育不全两种障碍类型。yabuya(1985)等对燕子花和溪荪的种间正反交研究发现杂交种子胚乳的退化导致杂种幼胚败育;黄苏珍(1996)等对17个组合的鸢尾种间杂交研究发现,种间杂交亲和力极弱,杂交种子的出苗率极低,且杂种苗生长不良。幼胚拯救技术是在幼胚败育前及时取出幼胚,并接种到适宜幼胚正常生长的培养基上,促使幼胚生长为正常植株的有效途径,然而,目前利用该技术创制鸢尾远缘杂交后代尚不成熟,韩耀祖(2013)报道鸢尾幼胚在添加各种不同浓度激素的培养基上基本不萌发。
4.针对现有技术的不足,如何提供一种利用幼胚获得鸢尾种间杂交后代的培养基及其应用是本领域亟待解决的问题。
技术实现要素:
5.本发明公开了一种利用幼胚获得鸢尾种间杂交后代的培养基及其应用。本发明能够克服鸢尾种间杂交受精后障碍,使幼胚成活率达95%以上,极大地提高了鸢尾远缘杂交育种成功率,并缩短了鸢尾远缘杂交育种周期。。
6.为了实现上述目的,本发明采用如下技术方案:
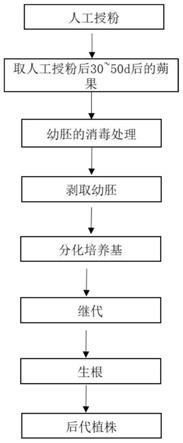
7.人工杂交授粉:挑选花器管发育正常的德国鸢尾、香根鸢尾和大粗根鸢尾为亲本,取母本植株上次日可开放的花苞进行去雄、套袋,1-2d后待柱头发育成熟,取当天开花父本上的成熟花粉进行人工授粉;
8.人工授粉的具体操作为:于上午9:00-11:00,用干净的镊子夹住成熟花药的基部取下花药,然后将花药涂抹在母本已去雄花朵的柱头上,授粉后继续套袋隔离,间隔1d后重复授粉1次;
9.幼胚消毒:选择授粉30-50d后的蒴果,用10%的家用洗洁精浸泡10min,流水冲洗30min,置于超净工作台,用75%的酒精浸泡2min,无菌水清洗2-3次,再用100%的酒精浸泡1min,在火焰上烧干酒精后备用;
10.幼胚剥离:用解剖刀剖开蒴果,取出种子,用解剖针挑破种子萌发孔,用手轻轻挤
出幼胚,由于此时的胚乳尚未完全硬化,种胚可以轻易挤出,此步骤注意手要经常用75%的酒精消毒,防止污染;
11.一种利用幼胚获得鸢尾种间杂交后代的不定芽诱导培养基,包括:ms+tdz1.0-1.5mg/l+naa 0.2mg/l+蔗糖30g/l,ph5.8;
12.优选的,所述不定芽诱导培养基为固体培养基;
13.优选的,所述固体培养基为琼脂固体培养基;
14.优选的,琼脂使用量为5.5-6g/l;
15.一种利用幼胚获得鸢尾种间杂交后代的培养基组合,包括:
16.不定芽诱导培养基:ms+tdz 1.0-1.5mg/l+naa 0.2mg/l+蔗糖30g/l,ph5.8;
17.继代培养基:ms+tdz 0.5mg/l+naa 0.1mg/l+蔗糖30g/l,ph5.8;
18.生根培养基:ms+naa 0.1mg/l+蔗糖30g/l,ph5.8;
19.优选的,所述不定芽诱导培养基、继代培养基和生根培养基为固体培养基;
20.优选的,所述固体培养基为琼脂固体培养基;
21.优选的,不定芽诱导培养基、继代培养基和生根培养基为固体培养基中琼脂使用量为5.5-6g/l;
22.一种利用幼胚获得鸢尾种间杂交生根幼苗的方法,包括以下步骤:
23.(1)诱导培养:将杂交授粉后30-50d的幼胚接种到权利要求1或2所述的不定芽诱导培养基中培养;
24.(2)继代培养:将步骤1)中诱导的不定芽接种到权利要求2所述的继代培养基中培养;
25.优选的,将得到的不定芽进行继代培养,可在短时间内获得大量性状一致的后代植株;
26.(3)生根培养:将步骤2)中2-3cm的不定芽转接到权利要求2所述的生根培养基中进行生根诱导;
27.优选的,其特征在于,所述步骤(1)-(3)中培养条件为温度25
±
2℃、光周期12h/d、光照度1500~2000lux;
28.一种利用幼胚获得鸢尾种间杂交后代的幼苗方法,除所述诱导培养、继代培养和生根培养外,还包括炼苗培养,方法如下:
29.待不定芽的根长至1-2cm,打开组培瓶盖练苗2-3d,然后清洗根部培养基,移栽到穴盘并置于人工气候箱中培养;
30.优选的,其特征在于,所述移栽到穴盘并置于人工气候箱中培养的条件如下:
31.移栽基质为泥炭:蛭石=1:1,温度为25~28℃,光周期为12h/d,湿度为60%,光照度1500-2000lux;
32.优选的,诱导培养、继代培养和生根培养的培养时间为30-60d;
33.优选的,上述利用幼胚获得鸢尾种间杂交的亲本为德国鸢尾、香根鸢尾和大粗根鸢尾中的任意一种或多种;
34.综上所述,本发明公开了一种利用幼胚获得鸢尾种间杂交后代的培养基及其应用。通过特制的培养基和和芽诱导、继代、生根、移栽方法相结合对杂交鸢尾幼胚进行培养,不仅可克服鸢尾种间杂交受精后障碍而获得鸢尾种间杂交后代,而且经过继代、生根、移栽
可快速获得后代株系,大幅提高了鸢尾远缘杂交幼胚的成活率和远缘杂交的成功率,极大地缩短了鸢尾远缘杂交的育种周期。
附图说明
35.图1:香根鸢尾
‘
variegata gold’与德国鸢尾
‘
the black douglas’杂交蒴果(a)及形成的种皮增厚、胚乳发育不良的种子(b)和形成的正常杂交胚(c);
36.图2:香根鸢尾
‘
variegata gold’与德国鸢尾
‘
the black douglas’杂交幼胚诱导形成的不定芽;
37.图3:香根鸢尾
‘
variegata gold’与德国鸢尾
‘
the black douglas’杂交幼胚通胚拯救获得的后代植株;
38.图4:鸢尾胚的培养流程。
具体实施方式
39.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
40.实施例1
41.1)人工杂交授粉:挑选花器管发育正常的香根鸢尾
‘
variegata gold’和德国鸢尾
‘
the black douglas’为父本和母本,取母本植株上次日可开放的花苞进行去雄、套袋,1-2d后待柱头发育成熟,取当天开花的父本上的成熟的花粉进行人工授粉,具体操作为:于上午9:00-11:00,用干净的镊子夹住成熟花药的基部取下花药,然后将花药涂抹在母本已去雄花朵的柱头上,授粉后继续套袋隔离,间隔1d后重复授粉1次。
42.2)幼胚消毒:采集授粉35-40d后的蒴果,先经10%的家用洗洁精浸泡10min,然后流水冲洗30min后,置于超净工作台,先用75%的酒精浸泡2min,无菌水清洗2次,再用100%的酒精浸泡1min,在火焰上烧干酒精后备用;
43.3)幼胚拯救培养:用解剖刀剖开蒴果,取出种子,用解剖针挑破种子萌发孔,用手轻轻挤出幼胚,由于此时的胚乳尚未完全硬化,种胚可以轻易挤出,此步骤注意手要经常用75%的酒精消毒,防止污染。将幼胚接种到不定芽诱导培养基上,培养基为:ms+tdz1.0 mg/l+naa0.2 mg/l+蔗糖30g/l+琼脂6g/l ph5.8。培养条件为:温度25
±
2℃、光周期12h/d、光照度1500~2000lux。
44.4)继代:将步骤3诱导的不定芽接种到继代培养基上进行扩繁,继代培养基配方为:ms+tdz 0.5mg/l+naa 0.1mg/l蔗糖30g/l+琼脂6g/l ph5.8;
45.5)生根:将长至2-3cm的不定芽转接到生根培养基上进行生根诱导,生根培养基配方为:ms+naa0.1 mg/l+蔗糖30g/l+琼脂6g/l ph5.8;
46.6)移栽:待不定芽的根长至1-2cm,打开组培瓶盖练苗2-3d后,取出清洗根部的培养基,移栽到穴盘中,置于人工气候箱中培养,获得香根鸢尾
‘
variegata gold’和德国鸢尾
‘
the black douglas’的种间杂交后代材料。
47.实施例2
48.本实施例与实施例1大体相同,不同点在于:(1)亲本材料为花器管正常发育的大粗根鸢尾(iris tigridia var.fortis y.t.zhao)和德国鸢尾
‘
秋月’为母本和父本;(2)采集授粉30-35d后的蒴果进行消毒处理。接种于诱导培养基上形成不定芽,通过继代、生根和移栽得到大粗根鸢尾(iris tigridia var.fortis y.t.zhao)和德国鸢尾
‘
秋月’的种间杂交后代材料。
49.实施例3
50.采集授粉后25d、30d、35d、40d、45d、50d的幼胚进行诱导,其他步骤与实施例1中相同,通过观察不同胚龄幼胚、胚乳的状态及统计接种30后的幼胚不定芽诱导率,确定幼胚拯救的适宜胚龄,结果如表1所示。
51.表1不同胚龄的幼胚、胚乳状态及不同胚龄幼胚对诱导率的影响
[0052][0053]
由表1可以看出,35d前的幼胚透明、水渍状,还未完全发育,25d的幼胚的诱导率为0,30d的幼胚诱导率仅为19.3%;随着胚龄的增加,幼胚逐渐发育完全,到35d时,幼胚的诱导率达到85.8%;到40d时,幼胚的诱导率达到96.3%;但随着胚龄的增加,胚乳逐渐成熟变硬,幼胚的剥取难度增大,幼胚易损伤,到50d时,胚乳已完全硬化,很难剥离出完整的幼胚。
[0054]
实施例4
[0055]
采用实施例1中的处理方法,其区别在于步骤(4)中培养基植物激素的含量不同,分别于接种后30d统计不定芽诱导率、不定芽诱导状态,结果如表2所示。
[0056]
表2不同激素浓度对杂交幼胚不定芽诱导的影响
[0057]
[0058][0059]
由表2可以看出,不添加任何激素的ms培养基上幼胚能萌发(图3),但不能增殖。而随着6-ba浓度及tdz浓度的提高,诱导不定芽数增多,但当6-ba和tdz浓度增加到1.5mg/l以上时,诱导出的不定芽呈水渍状;当6-ba浓度为0.5mg/l时,幼胚能形成1-2个芽,芽基部有粗壮的短根,亦不能继续增殖;当6-ba浓度为1.0mg/l及tdz浓度为0.5mg/l时,幼胚能诱导出3-5个不定芽丛,基部有黄色愈伤组织,幼胚增殖系数低;而当tdz浓度为1.0mg/l,幼胚能诱导出大于5个芽点的不定芽丛(图2),增殖系数高,因此适宜不定芽诱导的培养基配方为添加1.0mg/ltdz和0.2mg/lnaa的ms培养基。
[0060]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0061]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
