1.本发明属于技术领域,具体涉及一种多花黄精加工或预加工方法及其在调节黄精多糖和免疫刺激活性中的应用。
背景技术:
2.多花黄精是福建省特色的药食同源类食品。黄精食用前必须通过热处理去除其对舌头和喉咙的刺激性。热处理可使黄精中核心功能组分多糖含量降低近一半,而多糖的减少可能严重限制其有效的营养功能。同时,黄精的生产多基于传统的中药炮制经验,无规范化技术标准,这是多花黄精食品产业的瓶颈所在。
3.黄精产值高,有助于提高经济收入,同时黄精为林下种植,可充分提高土地利用率。多糖是多花黄精中的核心营养功能成分,其对于机体免疫调节、抗疲劳、调节糖脂代谢等起着重要作用。但是,关于多花黄精的多糖的免疫活性的研究均基于鲜黄精。虽然,鲜多花黄精多糖具有免疫活性,但是鲜黄精具有麻舌性,且刺激喉咙,不适合直接食用。因此,多花黄精需要适当的加工。目前黄精加工普遍基于传统加工方式,常用的“九蒸九制”方法,包括反复蒸煮、晒,达到软糯甜香的口。
4.但是,“九蒸九制”其弊端包括耗时长,无标准化加工模式,加工过程会严重破坏多糖,并可能影响其免疫刺激活性。研究表明,加工后的黄精多糖含量几乎减半,而多糖的减少可能严重限制其有效的营养功能,但黄精在加工过程中多糖结构变化及免疫刺激活性的变化机制尚不清楚,而常被忽略。同时,传统加工方式可使得黄精变得乌黑,实际为美拉德反应,其糖化反应的终产物5-羟甲基-2-糠醛含量在加工过程中急剧上升,而5-羟甲基-2-糠醛具有一定毒性。因此,将黄精广泛应用于食品领域,其关键在于系统化解析加工过程中黄精活性物质的变化,这也是目前药食同源食物应用需要攻克的关键点。因此,结合分析加工过程中多糖结构变化以及其营养活性变化,将为黄精加工提供新思路。
技术实现要素:
5.本发明的目的在于克服现有技术的不足之处,提供了一种多花黄精加工或预加工方法及其在调节黄精多糖和免疫刺激活性中的应用,解决了上述背景技术中传统加工过程影响其免疫活性的问题。
6.本发明解决其技术问题所采用的技术方案是:提供了一种多花黄精加工方法,将多花黄精清洗后切成2-5mm的薄片,于40-60℃干燥6-16小时;干燥后进行蒸制,蒸制时间不大于4小时;蒸制后于40-60℃下干燥6-16小时。
7.本发明提供了一种低浓度下具备免疫调节作用的多花黄精制品,采用上述的方法加工而成的片状制品,所述低浓度指不大于2μg/ml,多花黄精的多糖含量大于60.0mg/g。
8.或采用上述的方法预加工而成的片状制品,并干燥,再由片状制品通过进一步的精加工:在不超过80℃的温度下提取2小时,得到黄精多糖。
9.本发明提供了一种黄精多糖,采用上述的方法加工而成的片状制品,再由片状制
品内提取黄精多糖,所述黄精多糖为含有糖醛酸的酸性多糖,其中单糖组成包括木糖、半乳糖、葡萄糖、半乳糖醛酸及阿拉伯糖。
10.本发明提供了一种避免鲜黄精加工过程中免疫刺激活性被破坏的方法,将多花黄精清洗后切成2-5mm的薄片,于40-60℃干燥;干燥后进行蒸制,蒸制时间不大于4小时,改变多糖组成、维持粒径和分子量,蒸制后于40-60℃下干燥6-16小时。
11.通过控制蒸制时间为2-4小时,将鲜黄精中β构型果糖中性多糖转化为含有糖醛酸的酸性多糖,其中单糖组成包括木糖、半乳糖、葡萄糖、半乳糖醛酸及阿拉伯糖。
12.通过控制蒸制时间为2-4小时,实现黄精多糖在低浓度下对raw264.7巨噬细胞吞噬活性、分泌一氧化氮量、tnf-α量、il-6的提升;所述低浓度指不大于2μg/ml。
13.本发明提供了一种加工过程中调节黄精多糖的方法,其特征在于:通过将多花黄精清洗后切成2-5mm的薄片,于40-60℃干燥6-16小时;干燥后进行蒸制,蒸制时间2-4小时,蒸制后于40-60℃下干燥6-16小时;所述黄精多糖中β构型果糖中性多糖转化为含有糖醛酸的酸性多糖。其中单糖组成包括木糖、半乳糖、葡萄糖、半乳糖醛酸及阿拉伯糖。
14.本发明提供了一种多花黄精加工过程中低浓度下促进巨噬细胞分泌一氧化氮的方法,其特征在于:将多花黄精清洗后切成2-5mm的薄片,与60℃干燥;干燥后进行单次蒸制,蒸制时间为2-4小时;蒸制后于60℃下干燥过夜,最后研磨成粉;所述低浓度指不大于6.25μg/ml。
15.本技术方案与背景技术相比,它具有如下优点:
16.本发明打破了传统“九蒸九晒”的技术模式,通过不高于60℃温度的干燥以及控时长的蒸制预加工,避免了传统加工过程中,多花黄精的多糖分子化学结构及其在溶液行为发生了复杂的反应,导致了其免疫刺激活性发生下降的弊端。
附图说明
17.图1为多花黄精蒸制过程中的表观变化;
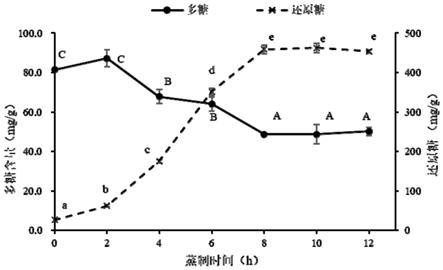
18.图2为多花黄精蒸制过程中多糖及还原糖含量的变化;不同字母代表组内具有显著性差异(p《0.05);
19.图3为不同蒸制时间的多花黄精多糖的红外光谱;
20.图4为不同蒸制时间的多花黄精多糖的表观分子量的变化;
21.图5为不同蒸制时间的多花黄精多糖的单糖组成;
22.图6为不同蒸制时间的多花黄精多糖平均粒径;不同字母代表组内具有显著性差异(p《0.05);
23.图7为不同蒸制时间多花黄精多糖粘度;
24.图8为不同蒸制时间多花黄精多糖刚果红配合物在不同氢氧化钠浓度下的最大吸收波长;
25.图9为不同蒸制时间的多花黄精多糖对于小鼠巨噬细胞raw264.6存活率的影响;同一浓度下,不同字母代表组内具有显著性差异(p《0.05);
26.图10为不同蒸制时间的多花黄精多糖对于小鼠巨噬细胞raw264.6形态的影响(多糖浓度为25μg/ml,反应时间24小时);
27.图11不同蒸制时间的多花黄精多糖对于小鼠巨噬细胞raw264.6吞噬活性的影响,
同一浓度下,不同字母代表组内具有显著性差异(p《0.05);
28.图12为多花黄精多糖免疫刺激活性:一氧化氮释放(no);同一浓度下,不同字母代表组内具有显著性差异(p《0.05);
29.图13为多花黄精多糖免疫刺激活性:肿瘤坏死因子释放量(tumor necrosis factor-α,tnf-α);同一浓度下,不同字母代表组内具有显著性差异(p《0.05)。
30.图14为多花黄精多糖免疫刺激活性:白细胞介素6(interleukin 6,il-6);同一浓度下,不同字母代表组内具有显著性差异(p《0.05);
31.图15为蒸制4小时的多花黄精多糖免疫刺激活性:一氧化氮释放量(nitric oxide,no);不同字母代表组内具有显著性差异(p《0.05);
32.图16为蒸制4小时的多花黄精多糖免疫刺激活性:肿瘤坏死因子(tnf-α)释放量;不同字母代表组内具有显著性差异(p《0.05)。
33.图17为不同提取温度和时间对于多花黄精多糖免疫刺激活性的影响:一氧化氮释放量;不同字母代表组内具有显著性差异(p《0.05);
具体实施方式
34.下述实施例多花黄精根茎(野生)采自福建省邵武市,由邵武市山乘山生态农业开发有限公司提供。raw 264.7细胞购于中科院细胞库(上海)。dmem培养基及胎牛血清购于上海sigma公司。elisa试剂盒(tnf-α)购于武汉cusabio公司。其他试剂均为分析级。
35.下述实施例通过精准控制加工方式,分析多花黄精中活性物质的动态变化,从而解析黄精加工过程中引起多糖变化的关键控制点;通过深入鉴定加工过程中黄精多糖产物结构,系统解析加工过程中黄精多糖聚合及降解变化;进一步结合体外细胞学方法,明确不同加工方式的黄精多糖作用位点,明确加工方式对于黄精多糖免疫刺激活性的影响,定向挖掘获得了高效加工方式。
36.实施例1
37.(1)将新鲜多花黄精块茎初步冲洗后,进一步刷洗除去表皮泥沙等杂质得到洗净后的黄精;
38.(2)将步骤(1)洗净后的多花黄精切片,切片厚度约3mm;
39.(3)将步骤(2)的多花黄精切片于50℃的烘箱中烘干12小时;
40.(4)将步骤(3)烘干后的多花黄精切片于常压蒸制总时间2小时。
41.(5)将步骤(4)常压蒸制后的多花黄精切片于60℃的烘箱中烘干12小时即获得含有比鲜黄精多糖免疫活性更高的多花黄精制品。
42.实施例2
43.(1)将新鲜多花黄精块茎初步冲洗后,进一步刷洗除去表皮泥沙等杂质得到洗净后的黄精;
44.(2)将步骤(1)洗净后的多花黄精切片,切片厚度约5mm;
45.(3)将步骤(2)的多花黄精切片于60℃的烘箱中烘干16小时;
46.(4)将步骤(3)烘干后的多花黄精切片于常压蒸制总时间4小时。
47.(5)将步骤(4)常压蒸制后的多花黄精切片于60℃的烘箱中烘干16小时即获得含有比鲜黄精多糖免疫活性更高的多花黄精制品。
48.实施例3
49.(1)将新鲜多花黄精块茎初步冲洗后,进一步刷洗除去表皮泥沙等杂质得到洗净后的黄精;
50.(2)将步骤(1)洗净后的多花黄精切片,切片厚度约3mm;
51.(3)将步骤(2)的多花黄精切片于50℃的烘箱中烘干16小时;
52.(4)将步骤(3)烘干后的多花黄精切片于常压蒸制总时间1小时。
53.(5)将步骤(4)常压蒸制后的多花黄精切片于50℃的烘箱中烘干12小时后,重复步骤(4)4次,总蒸制时间达到4小时。
54.(6)将步骤(5)即50℃的烘箱中烘干12小时后,即获得含有比鲜黄精多糖免疫活性更高的多花黄精制品。
55.实施例4
56.(1)将新鲜多花黄精块茎初步冲洗后,进一步刷洗除去表皮泥沙等杂质得到洗净后的黄精;
57.(2)将步骤(1)洗净后的多花黄精切片,切片厚度约3mm;
58.(3)将步骤(2)的多花黄精切片于55℃的烘箱中烘干12小时;
59.(4)将步骤(3)烘干后的多花黄精切片于常压蒸制总时间2小时。
60.(5)步骤(4)于55℃的烘箱中烘干12小时后,重复步骤(4)2次,总蒸制时间达到4小时。
61.(6)将步骤(5)即55℃的烘箱中烘干12小时后,即获得含有比鲜黄精多糖免疫活性更高的多花黄精制品。
62.将实施例1和实施例2制得的多花黄精制品及鲜黄精(对照组1)、蒸制6小时多花黄精(对照组2)、蒸制8小时后的多花黄精(对照组3)、蒸制10小时多花黄精(对照组4)、蒸制12小时多花黄精(对照组5)、市售黄精1(对照组6)、市售黄精2(对照组7)、市售黄精3(对照组8)、市售黄精4(对照组9)烘干至恒重,进行下述测定:
63.一、黄精多糖含量的测定
64.精确称取0.2g黄精粉末,加入40ml的80%(v/v)的乙醇于80℃提取1小时后离心(6000r/min,10min),弃上清液,沉淀采用20ml 80%乙醇冲洗2次,离心后弃上清液。随后,加入40ml去离子水于80℃提取1小时,离心(6000r/min,10min)取上清液,重复2次,离心,合并上清液后移至100ml容量瓶中定容,即为黄精多糖提取液。黄精多糖含量采用苯酚-硫酸法测定,精确量取0.4ml一定稀释后的黄精多糖提取液,加入0.2ml的6%的苯酚溶液及1ml浓硫酸,摇匀冷却后于490nm处测定吸光值。以葡萄糖质量浓度(0-0.1mg/ml)为横坐标,吸光度为纵坐标绘制标准曲线,测定黄精中多糖的含量。
65.表1:不同多花黄精样品中多糖含量
[0066] 样本多糖含量mg/g实施例1蒸制2小时87.254
±
4.190实施例2蒸制4小时67.815
±
3.597对照组1鲜多花黄精81.430
±
0.459对照组2蒸制6小时64.027
±
3.477对照组3蒸制8小时48.640
±
0.226
对照组4蒸制10小时48.757
±
5.002对照组5蒸制12小时50.155
±
2.004对照组6市售黄精134.830
±
3.530对照组7市售黄精248.010
±
4.580对照组8市售黄精333.010
±
3.180对照组9市售黄精421.640
±
0.630
[0067]
结果表明,采用本发明方法制备的多花黄精多糖含量高,较好保留多花黄精原有的多糖含量。
[0068]
二、还原糖含量的测定
[0069]
精确称量3g黄精粉末,加入30ml的95%乙醇,置于80℃水浴锅中醇提1小时后离心(10000r/min,10min),取上清液,重复上述操作一次,合并两次上清液于100ml容量瓶中定容,即得到醇提溶液。将醇提后剩余的渣,加入40ml的去离子水,置于80℃水浴锅中水提1小时后离心(10000r/min,10min),取上清液,重复水提操作一次,合并两次提取溶液于100ml容量瓶并定容到100ml,即得到水提溶液。黄精还原糖测定方法采用硝基水杨酸法(dns法),精确量取0.5ml一定稀释后的黄精醇提、水提溶液,加入0.5ml dns试剂(18.2%的酒石酸钾钠,0.63%的3,5-二硝基水杨酸,2.1%的nao小时,静置1周后使用),于沸水浴中反应5min,冷却后于540nm处测定吸光值,以葡萄糖浓度(0-1mg/ml)为横坐标,吸光度为纵坐标,得到标准曲线,以测定黄精中还原糖含量。还原糖总量为黄精醇提液及水溶液中还原糖含量总和。
[0070]
三、黄精多糖的分离纯化
[0071]
不同处理的多花黄精首先加入体积分数为85%乙醇(1:10,w/v)于80℃搅拌2小时,除去色素,小分子有机化合物等。过滤及干燥后,多花黄精多糖采用80℃热水提取(1:10,w/v)2小时。离心(5000r/min,20分钟)后,上清液加入4倍的乙醇进行沉淀多花黄精多糖。获取的黄精多糖沉淀复溶于水,采用sevag法去除蛋白。随后,上清液加入4倍的乙醇进行沉淀多花黄精多糖。获取的黄精多糖冷冻干燥。
[0072]
四、多花黄精多糖的结构分析
[0073]
1、紫外可见光光谱(uv)
[0074]
配制1mg/ml的多糖溶液。随后,采用紫外-可见光分光光度计(uv1800,岛津)扫描多糖溶液(190nm到400nm)。
[0075]
2、傅里叶变换红外光谱(ft-ir)
[0076]
取多糖样品(2mg)与干燥的溴化钾研磨混合(1:200,w/w),随后压制成片。红外光谱扫描范围为400cm-1
to 4000cm-1
(ft-ir tensor 27,bruker)。
[0077]
3、相对分子量的测定
[0078]
分别精确称取7种多糖2.5mg,溶于0.5ml超纯水中,充分混匀后,使用0.22μm滤膜过滤,再利用配备有tsk gel g4000 pwxl柱(7.8mm i.d.
×
30cm)和elsd蒸发光检测器的高效液相色谱来测定寡糖的分子量。标准品为葡聚糖,其分子量分别为1kda、5kda、12kda、25kda、50kda和120kda。
[0079]
4、绝对分子量测定
[0080]
分子量分布的测定采用文献方法的多角度光散射结合凝胶渗透色谱进行测定。检
测器采用k5格和小时e
–
ne激光(λ=690nm)及差示光检测器(optilab dsp)。柱子为tsk-gel g 4000pwxl,toso小时,日本)。流动相为0.1m叠氮化钠溶液,流速为0.5ml/min。浓度通过示差显示器根据dn/dc=0.15进行计算。数据分析采用astra软件(版本:5.3.4,美国怀特公司)。
[0081]
5、单糖组分分析
[0082]
多糖样品加入4m三氟乙酸,氮吹排出瓶内空气,于120℃水解4小时,待冷却后,氮吹干燥水解液,除去过量三氟乙酸,加超纯水定容后,稀释适当倍数,0.22μm滤膜过滤,进样。采用离子色谱(ics-3000,dionex,美国)进行测定。分析柱为carbo pactmpa 20(3
×
150mm,dionex,美国),同时连接保护柱carbo pactmpa 20biolctm(3
×
30mm)流动相包括超纯水(流动相a)250mm氢氧化钠溶液(流动相b)和1m醋酸钠(流动相c),流速为0.5ml/min。测定过程采用2个程序,分别测定不同的单糖。梯度洗脱条件如下:条件(1)0
–
20min,99%a,1%b;20
–
20.1min,94%a,1%b,5%c;20.1
–
35min,79%a,,1%b,20%c;35
–
45min,20%a,80%b;45
–
55min,99%a,1%b。条件(2):0
–
20min,94.0%a,6.0%b;20
–
20.1min,89.0%a,6.0%b,5.0%c;20.1
–
35min,74%a,6%b,20%c;35
–
45min,20%a,80%b;45
–
55min,94%a,6%b。单糖的含量通过响应因子来定量。单糖定性通过与标准品的峰位置进行比较确定。
[0083]
6、流变性质
[0084]
精确配制5mg/ml的7种多糖溶液。多糖溶液室温放置5小时使其充分溶解。表观粘度采用流变仪(mcr302,anton paar)进行测定。测定条件如下:温度20℃;采用直径为60mm,锥角度0.5
°
的锥板;使用稳态剪切模式,以剪切速率(0.1s-1
到100s-1
)为自变量,测定多糖溶液的表观粘度。
[0085]
7、粒径分布
[0086]
精确配制1mg/ml的7种多糖溶液,充分溶解后,采用马尔文纳米粒度仪测定其粒径分布。测定温度为25℃,每个样品重复3次。
[0087]
8、刚果红试验
[0088]
采用刚果红方法鉴定黄精多糖的三股螺旋结构。分别称取7种多糖样品5mg,配制成1mg/ml。取多糖溶液,再加入等体积的100μm的刚果红试剂,涡旋混匀。以蒸馏水作为对照。然后分别在每支管中逐渐滴加10mol/l的nao小时溶液,使混合液的nao小时浓度分别为0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5mol/l,涡旋混匀,然后用紫外分光光度计扫描(uv-1800,岛津),测定混合液在400-600nm范围的最大吸收波长。
[0089]
五、不同蒸制时间的黄精多糖对巨噬细胞的免疫调节活性研究
[0090]
1、细胞培养
[0091]
小鼠巨噬细胞raw264.7(scsp-5036)于dmem完全培养基(含10%的胎牛血清、1%的双抗。置于37℃,5%co2的培养箱中培养。每天观察细胞生长状况,并及时更换新鲜培养基。
[0092]
2、细胞存活率
[0093]
黄精多糖对于巨噬细胞的存活率的影响采用cck-8法测定。取巨噬细胞计数后,播种密度为2
×
104个/孔的密度,按照100μl/孔播种于96孔细胞板中,过夜培养。随后,加入不同浓度的7种黄精多糖溶液100μl。空白对照组及阳性对照组分别加入100μl的dmem完全培养基及含有lps(2μg/ml)的dmem完全培养基。继续培养24小时后,小心弃去上清液,加入100
μl含有cck-8的新鲜培养基,继续培养2小时。培养结束后于405nm测定吸光值。每一个样品设6个复孔。
[0094]
3、吞噬活性
[0095]
细胞播种及样品反应同3.6.2。样品培养结束后,小心弃去上清液,每一孔加入100μl的0.1%的中性红溶液,37℃培养1小时后,小心弃去上清液,并用pbs缓冲液洗涤细胞2次。每一孔加入100μl的0.01%冰醋酸-无水乙醇(1:1,v/v)细胞裂解液。室温静置2小时后,待细胞完全裂解后于540nm处测定吸光值。
[0096]
4、一氧化氮(no)、肿瘤坏死因子(tnf-α)及白细胞介素(il-6)释放量
[0097]
细胞播种及样品反应同3.6.2。样品培养结束后,取上清液,测定按照试剂盒方法,测定上清液中no、tnf-α及il-6含量。
[0098]
5、raw 264.7细胞形态的观察细胞播种及样品反应同3.6.2。样品培养结束后,于倒置显微镜下观察细胞形态。
[0099]
六、不同提取温度和提取时间对于多花黄精多糖的影响
[0100]
一般多糖的提取采用沸水(100℃)提取。但由于多花黄精多糖对于温度较为敏感。为了测试提取温度对于多花黄精多糖的影响,采用不同温度(60℃,80℃,100℃)及不同时间(2小时,6小时,12小时)进行黄精多糖的提取。提取后的多糖离心(5000r/min,20分钟)后,上清液加入4倍的乙醇进行沉淀多花黄精多糖。获取的黄精多糖冷冻干燥。采用五所描述的方法,对其免疫活性(以no释放量为主)进行测定。
[0101]
七、统计学分析
[0102]
统计学方法用spss 23.0软件行统计学处理。计量数据以平均值
±
sd表示,采用one-way anova方差分析,事后比较采用邓肯分析,p《0.05为差异具有统计学意义。
[0103]
八、结论
[0104]
1、蒸制时间对于黄精表观的影响
[0105]
如图1所示,随着蒸制时间增加,多花黄精逐渐变黑。本研究使用多黄精干品,低水分活度下,更容易发生美拉德反应,因此于8小时蒸制后,黄精迅速变黑。
[0106]
2、蒸制时间对于黄精营养活性物质含量的影响
[0107]
如图2所示,多花黄精蒸制2小时后,多糖含量开始显著下降,蒸制8小时并趋于平稳,蒸制12小时,多花黄精中多糖含量下降了38.41%。同时,还原糖含量在蒸制过程显著升高,并于8小时趋于平稳。研究结果表明,在蒸制过程中,多花黄精多糖降解为小分子单糖,因此还原糖含量增加。黄精中多糖含量的下降可能与温度和时间有关,由于还原糖的含量与黄精的甜度有关,黄精在蒸制8小时后,还原糖含量达到最高并趋于平稳,因此,继续延长蒸制时间,对于黄精的感官品质无提升作用。黄精中具有还原性的果糖、葡萄糖、半乳糖是随着蒸制时间增加但后期减少,并趋于稳定。前期,可能由于多糖或者寡聚糖降解,导致还原糖含量迅速增加,蒸制后期由于美拉德反应,单糖有所损失。由于还原糖的含量与黄精的甜度有关。因此,黄精不适于多次的蒸晒,导致糖分降低,影响黄精的感官品质。
[0108]
市售4种黄精制品,多糖含量分别为21.64
±
0.63mg/g、33.01
±
3.18mg/g、34.83
±
3.53mg/g、48.01
±
4.58mg/g。均低于本方法制备的多花黄精多糖含量。
[0109]
3、紫外可见光光谱
[0110]
从多花黄精中分离纯化的黄精多糖无蛋白(260-280nm)典型吸收峰。
[0111]
4、ft-ir
[0112]
如图3所示,鲜黄精多糖中具有β构型的果糖。但蒸制2小时后,β构型的果糖结构特征峰消失,说明其果聚糖结构分解。并且随着蒸制时间的增加,糖醛酸含量增加。研究结果说明,蒸制可改变多花黄精多糖的结构。
[0113]
4、相对分子量
[0114]
如图4所示为不同蒸制时间多花黄精多糖的示差检测器下的图谱。鲜黄精多糖相对分子量为2.08kda,而热加工后,在鲜黄精多糖峰的基础上,出现了新的多糖峰,多糖分子量显著增加2-4小时为107.4-108.3kda,。超过6小时,鲜多花黄精多糖的特征峰消失。6-8小时为110.0kda,而10小时后,多糖降低至103.4kda,12小时为96.9kda。研究结果表明,在蒸制过程中,多糖分子量显著增加,存在多糖聚合反应。但蒸制时间过长(≥10小时),多花黄精多糖存在降解的趋势。
[0115]
5.绝对分子质量
[0116]
采用多重光散射测定的多糖绝对分子量。如表1所示。蒸制2小时多糖发生降解,峰1分子量变小,而峰2分子量相对于鲜多花黄精增加,可能发生聚合。蒸制4小时,峰1和峰2的分子量均显著增加。但是蒸制超过6小时后,多花黄精分子量显著降低,并低于鲜黄精多糖。随着蒸制时间继续延长,分子量继续下降。
[0117]
表2多花黄精多糖在蒸制过程中的绝对分子量(mw)变化
[0118]
单位:da峰1峰20小时3.348
×
1053.552
×
1032小时4.175
×
1051.322
×
1044小时1.163
×
1067.769
×
1046小时1.533
×
10
5-8小时1.124
×
10
5-10小时9.547
×
10
4-12小时6.71
×
10
4-[0119]
6、单糖组成
[0120]
如图5所示,鲜多花黄精的以中性多糖为主,组成以葡萄糖(54.47%)、木糖(36.95%)为主,还有半乳糖(7.24%)及阿拉伯糖(1.34%)不含糖醛酸。鲜黄精中果糖含量高,由于本方法采用的tfa强酸水解,强酸下果糖容易转化为葡萄糖或甘露糖。因此,在实验测定中,葡萄糖含量较高,为果糖转化而来。蒸制后,多花黄精多糖的糖醛酸含量先增加后降低,结果于ft-ir一致。木糖含量先显著增加,但是蒸制6小时后,木糖含量随后降低。蒸制≥2小时后,相比于鲜黄精多糖,加工后的黄精多糖中葡萄糖含量显著降低。半乳糖蒸制随着蒸制时间增加,尤其是蒸制6小时后,半乳糖含量显著增加。加工后的黄精多糖中的阿拉伯糖含量也相比于鲜黄精多糖中的含量显著增加。
[0121]
7、粒径分布
[0122]
多糖的粒径采用激光粒度仪进行测定。如图6所示,随着蒸制增加(0-4小时)的多花黄精多糖的粒径逐渐增加,结果与分子量检测结果一致。而蒸制时间≥6小时后,黄精多糖的粒径显著下降。结果说明,黄精多糖在蒸制过程中降解的同时重新形成新的多糖聚集体。但随着蒸制时间的增加,多糖聚集体出现解聚的趋势,形成粒径较小的多糖结构。
[0123]
8、表观粘度
[0124]
多糖的溶液行为例如粘度,是重要的特性之一。表观粘度与多糖结构(例如分子量)、链构象(例如三股螺旋结构)相关。如图7所示,蒸制2小时及4小时后的黄精多糖粘度显著高于鲜黄精以及其他蒸制时间。在蒸制过程中,由于酸性的多糖形成,多糖发生了聚合,引起多糖粘度显著增加。
[0125]
9、三股螺旋结构
[0126]
多糖的生物活性与其三股螺旋结构有关。刚果红实验可用于检测多糖的链结构,具有三股螺旋结构的多糖与其形成的络合物的最大吸收波长,相比于刚果红会产生红移。如图8所示,不同蒸制时间的多花黄精多糖均随着氢氧化钠浓度增高而发生红移,而蒸制4小时的多花黄精多糖红移现象较其他蒸制时间的配合物明显,结果说明本方案蒸制能够保留原有多花黄精多糖的三股螺旋结构。
[0127]
10、蒸制时间对于多花黄精多糖免疫活性的影响
[0128]
巨噬细胞是单核巨噬细胞系统主要的组成部分,不仅能够启动先天性免疫(非特异性免疫)应答,而且还能参与细胞免疫(特异性免疫)应答。活化的巨噬细胞能够吞噬侵入体内的多种病原微生物、处理和呈递抗原,同时能够合成和分泌多种趋化因子以及细胞因子从而提高机体的抗感染以及免疫防御能力。
[0129]
11、多花黄精多糖对于raw264.7巨噬细胞存活率的影响
[0130]
如图10采用cck-8法评价多花黄精多糖对于巨噬细胞增殖能力的影响。与对照组相比,不同蒸制时间的多花黄精多糖在不同浓度下,均对细胞无毒性,并且能够显著提高增殖率。
[0131]
12、多花黄精多糖对于raw264.7巨噬细胞形态的影响
[0132]
如图11所示,对照组中正常的raw264.7巨噬细胞为圆形,非常少部分的细胞为梭状。过阳性lps激活后的细胞,大部分细胞为多边形或树支状态,并形成伪足。在与多花多糖共同培养的过程中,蒸制0小时,2小时,4小时,及6小时的多花黄精多糖引起巨噬细胞的变化与lps阳性组相似。而8小时,10小时,12小时的多花多糖组中,细胞的变化形态较少,说明蒸制时间较长的多糖对于巨噬细胞的激活水平较低。
[0133]
13、花黄精多糖对于raw264.7巨噬细胞吞噬活性的影响
[0134]
如图12采用中性红吞噬法评价多花黄精多糖对于巨噬细胞吞噬活性的影响。与对照组相比,不同蒸制时间的多花黄精多糖在不同浓度下,均能够提高细胞的吞噬活性。
[0135]
14、花黄精多糖对于raw264.7巨噬细胞分泌一氧化氮(no)的影响
[0136]
被激活的巨噬细胞能够分泌no和多种细胞因子(例如tnf-α、il-6等)参与机体的免疫反应,因此no、tnf-α、il-6可以用来评价生物活性物质免疫调节作用的指标。如图13所示,不同加工方式的黄精多糖在中高浓度下(50-200μg/ml)时,与对照相比,能够显著提高培养液中的no浓度。但是在低浓度下(3.125-6.25μg/ml)蒸制6小时、8小时、10小时、12小时对no的分泌促进与对照组无显著性差异。然而蒸制2小时及蒸制4小时的多花黄精多糖在(3.125-200μg/ml)保持较高no释放量,并显著高于鲜黄精多糖及蒸制6-12小时的多糖。
[0137]
15、多花黄精多糖对于raw264.7巨噬细胞分泌tnf-α及il-6的影响
[0138]
如图14所示,多花黄精多糖对于raw264.7巨噬细胞分泌tnf-α的影响趋势与no释放相似。不同加工方式的黄精多糖在中高浓度下(100μg/ml及25μg/ml)时,能够显著提高培
养液中的tnf-α浓度。但是在低浓度下(6.25μg/ml)蒸制10小时、12小时对tnf-α的分泌促进与对照组无显著性差异。然而蒸制2小时及蒸制4小时的多花黄精多糖在(6.25-100μg/ml)保持较高tnf-α释放量,并显著高于其他多糖。研究结果说明,适当的加工有助于提高黄精多糖的免疫刺激活性,然后随着蒸制时间增加(≥6小时),其免疫刺激活性显著降低。
[0139]
16、蒸制4小时的黄精多糖对于raw264.7巨噬细胞分泌no、tnf-α的影响
[0140]
如图15及16蒸制4小时后的多花黄精多糖对于raw264.7巨噬细胞分泌no、tnf-α最低有效浓度2μg/ml、1μg/ml。
[0141]
17、提取温度和时间对于多糖结构的影响
[0142]
如图17所示,煮制的温度和时间对于黄精多糖的免疫刺激活性有一定影响(以no释放浓度计算)。60℃及80℃提取多糖提取时间为12小时会显著降低其免疫刺激活性。而100℃提取超过6小时会降低其免疫刺激活性(以no释放浓度计算)。因此,提取黄精多糖避免高温、长时间提取。同时,传统工艺采用长时间煮制方法加工黄精,可能对黄精多糖的免疫活性会产生较大破坏,因此需要避免长时间煮制。
[0143]
另外,本实验采用80℃提取2小时,对于黄精多糖产生的影响小。
[0144]
加工过程对于多花黄精营养功能组分的含量及活性具有重大影响。多花黄精在蒸制过程中,其多糖同时发生了降解及聚合的复杂反应。蒸制2小时内,多糖含量虽然无显著性变化,但鲜黄精多糖中的果聚糖结构已经发生降解,同时形成含有糖醛酸结构的酸性多糖。同时,木糖、阿拉伯糖、半乳糖、半乳糖醛酸含量显著增加,葡萄糖含量显著降低。而由于酸性多糖的形成,其分子间的相互作用力,促使其多糖相互之间聚合,形成大分子结构。蒸制时间4小时,多糖含量虽然开始显著下降,但是多糖粒径逐渐增加,说明多糖在降解的同时,重新形成多糖聚合体。但是,随着蒸制时间增加6小时,多糖结构发生解聚,分子量、粒径降低显著下降。同时,多糖单糖组成发生变化,木糖含量显著下降、半乳糖含量下降。蒸制8小时,多糖含量不再继续下降,但是其多糖分子量显著下降,说明其分子结构进一步发生的降解。并且单糖结构发生变化,半乳糖醛酸、木糖含量下降,而半乳糖含量上升。
[0145]
结合细胞活性实验,在蒸制的2小时及4小时,多糖的免疫活性显著高于鲜黄精,因此,适当的加工有助于提高多花黄精多糖的免疫刺激活性。多花黄精加工过程中,免疫刺激活性的增加,可能与酸性多糖的形成聚集体有关,同时分子量增加、单糖组成结构变化有关。但延长蒸制时间至6小时后,多花黄精多糖的免疫刺激活性显著下降。其免疫活性下降可能与分子量现多糖粒径显著下降及多糖聚集体解聚有关。蒸制10小时后,多花黄精多糖在低浓度下则无免疫刺激活性,这可能与其分子结构进一步发生降解有关系。
[0146]
因此,在加工过程中,多花黄精的多糖分子化学结构及其在溶液行为发生了复杂的反应,导致了其免疫刺激活性发生显著变化。由此可见,本方案在多花黄精食品生产过程中,打破传统“九蒸九晒”工艺,采用不超过4小时的蒸制时间,能够实现:
[0147]
1.保持多糖含量高,避免在加工中严重破坏。
[0148]
2.使多糖结构发生变化进而活性发生变化:
[0149]
a.多糖从中性多糖转变为酸性多糖(单糖组成变化),提高糖醛酸含量,同时避免过度加工使得糖醛酸含量及木糖含量显著下降。
[0150]
b.分子量(表观和绝对):表观分子量显著增加;绝对分子量(2个组分)均增加。避免了后续过度加工,表观和绝对分子量显著下降的问题,且避免绝对分子量中,第二个组分
消失。
[0151]
c.粒径:粒径显著增加,但避免了传统工艺过度加工后,粒径显著下降。
[0152]
d.粘度:其实由粒径和分子量引起的:粘度显著增加,避免过度加工后,粘度显著下降。
[0153]
e.保留了原有的三股螺旋结构。
[0154]
3.由于结构引起的免疫活性显著变化:(1)高于鲜黄精的200μg/ml;(2)高于作为对比的市售过度加工的黄精。
[0155]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
