1.本发明属于细胞制备技术领域,尤其涉及一种发酵植物外泌体的制备方法。
背景技术:
2.植物在发酵过程中,利用微生物进行发酵,将植物的大分子物质,经过微生物转化成为能被人体肠道直接吸收的小分子成分,使植物成为更快吸收、定量疗效的新型植物提取物,以达到对植物加工生产的效果,植物发酵过程中可将其中的营养物质转化成氨基酸等对人类健康有益的成分。酵素是常见的一种发酵食品,有酵素原液和粉末酵素,通过将蔬菜、水果、糙米等植物经发酵制成液体,可以有效提高产品的附加值,而且,植物发酵液中含有丰富的酵素、维生素、矿物质、氨基酸等营养成分,可以起到净化排毒、调整体质、调理肠胃、改善消化、降血脂、降血糖等作用,受到了消费者的广泛喜爱。
3.目前,食品技术领域中所用的植物发酵技术是传统的技术,得到的发酵液较普通,对发酵后物质的活性成分也不明确,缺少一种创新的发酵技术得到新型的植物发酵液,通过靶向发酵后的得到的相应植物发酵液,开发创新的发酵工艺和发酵物。
技术实现要素:
4.针对现有技术中存在的问题,本发明提供了一种发酵植物外泌体的制备方法。
5.为实现上述发明目的,本发明采用下述技术方案予以实现:
6.一种发酵植物外泌体的制备方法,包括如下步骤:
7.(1)破碎:将植物原料与缓冲液投入破碎设备中破碎10-60min,得到破碎后的植物原浆;
8.(2)酶解:将所述植物原浆转移至酶解罐中,加入酸度调节剂将植物原浆ph调至4.5-5.5,然后加入酶制剂酶解后得到中间体;
9.(3)混料调配:向所述中间体中加入酸度调节剂,溶解并搅拌混合均匀,使所述酶解罐中物料ph调至5.5-6.5;
10.(4)灭酶提取:所述酶解罐中物料升温至80-100℃,保持15-30min进行灭酶提取;
11.(5)发酵培养:将灭酶提取后的物料降温至20-30℃,按照所需发酵的植物外泌体,添加发酵菌粉进行发酵,发酵总酸控制在12-16g/l以内,发酵ph控制在4.5以下,得到植物发酵液;
12.(6)离心:发酵结束后,将所述植物发酵液进行离心得到发酵植物外泌体。
13.优选地,步骤(5)后还包括杀菌步骤:将所述植物发酵液进行超高温瞬灭菌,灭菌温度为135℃,灭菌时间为4-15s。
14.优选地,步骤(1)中原料与缓冲液的重量比为1:1-1:10。
15.步骤(1)中植物包括葡萄、胡萝卜、树莓、金银花、红石榴(石榴)、血橙、苹果、大枣、覆盆子、莲子、桃仁、甘薯、荔枝、番茄、冬瓜、菠萝、白菜、苦瓜、芥蓝、茄子、茼蒿、芒果、火龙果、梅子、菠菜、空心菜、南瓜、玉米、马铃薯、金针菇、山药、香菇、黑豆、芋头、青梅、沙棘、枸
杞、枇杷、西芹、丝瓜、杨桃、莲雾、花椰菜、番薯叶、甜菜根、芦笋、青椒、银耳、佛手瓜、豌豆苗、雪里红、西番莲、猕猴桃、柑橘、诺丽果、奇异果、肉桂、昆布、草莓、荷叶、黑果枸杞、甘草、葛根、橄榄、接骨木莓、洛神花、玫瑰茄、朝鲜蓟、黑加仑、红参、决明子、郁李仁、角豆、茶叶、余甘子、山竹、桑叶、黑大豆、白云豆、海藻、桑叶、大麦苗、生姜、大蒜、大葱、洋葱、葡萄柚、西兰花、黄瓜、姜黄、蔓越莓、橙子、秋葵、西红柿、木瓜、芡实、莲藕、柴胡、地黄、苦参、雪菊、五味子、紫苏子、杏仁、山楂、桃仁、百香果、白豆蔻、红豆蔻、山药、南瓜、香菜、胡萝卜、芹菜、桃子、樱桃、橙子、柠檬、小茴香、玫瑰花、丹参、西洋参、人参、党参、黄芪、甘草、黄精、藿香、苍术、石斛、红景天、藏红花、罗汉果、玫瑰茄、芦荟、绿茶、竹叶、玛卡、百合、薰衣草、罗勒、薄荷、马齿苋、金纽扣花或山茶花。
16.优选地,步骤(2)中酶解温度为40-60℃,酶解时间为60-120min。酶制剂在一定的温度条件下,经过特定时间酶解作用,可使得酶发挥最佳酶解效果。温度过低,酶制剂无法发挥最大效价;温度过高,酶制剂会因高温而失活,在酶解过程中无法发挥酶制剂作用;时间过短,酶制剂酶解作用不充分;时间过久,酶解过分,会使有益物质被过度酶解,失去有益物质原有功效。
17.优选地,步骤(2)中酸度调节剂包括柠檬酸、柠檬酸钠、柠檬酸钾、dl-苹果酸、dl-苹果酸钠、dl-酒石酸、乳酸、氢氧化钙、氢氧化钾、乳酸钙、乳酸钾中的一种或多种。所述酸度调节剂包括但不限定于gb 2760《食品安全国家标准食品添加剂使用标准》中功能为酸度调节剂的食品添加剂中的一种或多种。酸度调节剂亦称ph调节剂,是用以维持或改变食品酸碱度的物质。主要用以控制食品所需的酸化剂、碱剂以及具有缓冲作用的盐类。
18.优选地,步骤(2)中酶制剂包括果胶酶、纤维素酶、淀粉酶、乳糖酶、β-葡聚糖酶中的一种或多种。酶制剂是具有特殊催化功能的生物制品,是由动物或植物的可食或非可食部分直接提取,或由传统或通过基因修饰的微生物(包括但不限于细菌、放线菌、真菌菌种)发酵、提取制得,用于食品加工,主要作用是催化食品加工过程中的各类化学反应,改进食品加工方法,如改进食品风味、提高食品质量、酶解作用产生新物质、提高发酵或提高速度和产品得率等。
19.优选地,步骤(5)中发酵菌粉包括酵母菌、乳杆菌、青春双歧杆菌、动物双歧杆菌、两歧双歧杆菌、短双歧杆菌、婴儿双歧杆菌、长双歧杆菌、乳杆菌属、嗜酸乳杆菌、干酪乳杆菌、卷曲乳杆菌、保加利亚乳杆菌、德氏乳杆菌乳亚种、发酵乳杆菌、格氏乳杆菌、瑞士乳杆菌、约氏乳杆菌、副干酪乳杆菌、植物乳杆菌、罗伊氏乳杆菌、鼠李糖乳杆菌、唾液乳杆菌、发酵乳杆菌、短双歧杆菌、凝结芽孢杆菌、嗜热链球菌、小牛葡萄球菌、木糖葡萄球菌、肉葡萄球菌中的一种或多种。
20.优选地,步骤(5)中发酵温度为25-35℃;发酵时间为20-24h。菌粉是菌种粉末,在菌种发酵和培养过程中,选择合适的营养成分和生活环境,在菌种的存活率中占据主导地位。其中温度和时间是影响菌种发酵的两个主要因素,当发酵温度高于菌种最适宜生长温度,菌种会被杀死,无法起到发酵作用;当发酵温度低于菌种最适宜生长温度,菌种代谢活性受抑制,则出现抑菌作用,出现发酵不充分,影响产品品质。发酵时间过短,未达到发酵终点,产品中有益物质未被全部释放出。发酵时间过常,出现发酵过度,过度发酵会使产品酸度提升,影响产品口感。
21.优选地,步骤(6)中离心步骤为:将植物发酵液于4℃,4500
×
g离心20min,去除较
大残渣,此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀;10000
×
g再次离心60min,离心后的所述中间层液体保留其上层溶液,所述上层溶液为所述发酵植物外泌体。
22.若所需样品为固体粉末剂型,则需对以上所得液体发酵植物外泌体进行冻干工艺,具体参数步骤如下:将液体发酵植物外泌体,与填充剂复配,形成均一溶液,将此溶液注入模具中,进行预冻0.5~3h,然后转入冻干机中,在0.01-10mbar,-50℃至4℃的条件下冷冻干燥5-10h,即得到发酵植物外泌体粉末。所述填充剂包括甘露醇、木糖醇、海藻糖、抗性糊精、麦芽糊精、赤藓糖醇、低聚异麦芽糖醇、葡萄糖中的一种或多种。
23.本发明提供一种发酵植物外泌体,所述外泌体由上述制备方法制备而成。
24.相对于现有技术,本发明的有益效果在于:
25.本发明一种发酵植物外泌体的制备方法,通过发酵工艺制备得到新型的食品原料发酵植物外泌体,与传统植物外泌体的制备方法不同,发酵植物外泌体需通过酶解、发酵两个重要环节实现,通过酶制剂在特定温度和时间下的酶解作用,发挥最佳酶解效果,通过发酵菌粉在特定温度和时间下的发酵作用达到一定的酸度,得到的发酵植物外泌体由植物细胞分泌得到。发酵植物外泌体中所含功效物质较常见植物外泌体,因发酵将大分子物质分解成为小分子物质,因此分子量更小;经过发酵可彻底解除有害毒性,达到减毒增效和改善口感的作用。
具体实施方式
26.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
27.实施例1
28.一种发酵葡萄外泌体的制备方法,包括以下步骤:
29.(1)原辅料清洗:将葡萄用4℃纯净水清洗除去表面泥土,备用。
30.(2)破碎:将葡萄与缓冲液按1:1投入榨汁机,破碎10min,得到破碎后的葡萄原浆。
31.(3)酶解:将所述葡萄原浆转移至酶解罐中,加入柠檬酸和柠檬酸钠将原浆ph调至4.5,然后加入淀粉酶和果胶酶,升温至40℃,酶解60min得到中间体。
32.(4)混料调配:向酶解得到的中间体中,通过在线混料机加入碳酸氢钠,溶解并搅拌混合均匀,将发酵初始ph调至5.5。
33.(5)灭酶提取:将酶解罐中的物料升温至80℃,并维持15min进行灭酶提取。
34.(6)杀菌:将酶解罐中的物料进行杀菌,本发明采用超高温瞬灭菌,灭菌温度为135℃,灭菌时间为4s。
35.(7)发酵培养:杀菌将物料降温至20℃左右,添加酵母菌、乳杆菌,在25℃下发酵20h,发酵总酸控制在13g/l,发酵ph控制在4.4,得到葡萄发酵液。
36.(8)离心:将得到的葡萄发酵液进行离心,将葡萄发酵液于4℃,4500
×
g离心20min此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀,将中间层液体于4℃,10000
×
g离心60min,保留上层液体,即得到液体发酵葡萄外泌体。
37.实施例2
38.一种发酵胡萝卜外泌体的制备方法,包括以下步骤:
39.(1)原辅料清洗:将胡萝卜用4℃纯净水清洗除去表面泥土备用。
40.(2)破碎:将胡萝卜与缓冲液按1:1投入榨汁机,破碎60min,得到破碎后的胡萝卜原浆。
41.(3)酶解:将所述胡萝卜原浆转移至酶解罐中,加入柠檬酸钾和dl-苹果酸将原浆ph调至5.5,然后加入纤维素酶和乳糖酶,升温至60℃,酶解120min得到中间体。
42.(4)混料调配:向酶解得到的中间体中,通过在线混料机加入碳酸氢钠,溶解并搅拌混合均匀,将发酵初始ph调至6.5。
43.(5)灭酶提取:将酶解罐中的物料升温至100℃,并维持30min进行灭酶提取。
44.(6)杀菌:将酶解罐中的物料进行杀菌,本发明采用超高温瞬灭菌,灭菌温度为135℃,灭菌时间为15s。
45.(7)发酵培养:杀菌后,将物料降温至28℃左右,添加动物双歧杆菌、两歧双歧杆菌,在35℃下发酵24h,发酵总酸控制在15g/l,发酵ph控制在4.3,得到胡萝卜发酵液。
46.(8)离心:将胡萝卜发酵液进行离心,将胡萝卜发酵液于4℃,4500
×
g离心20min,去除较大残渣,此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀;将得到的中间层液体,4℃,10000
×
g离心60min,保留上层液体,即得到液体发酵胡萝卜外泌体。
47.(9)冻干:将部分得到的液体发酵胡萝卜外泌体,与甘露醇复配,形成均一溶液,将此溶液注入模具中,进行预冻1.5h,然后转入冻干机中,在5mbar,-30℃下冷冻干燥7h,即得到发酵胡萝卜外泌体粉末。
48.实施例3
49.一种发酵树莓外泌体的制备方法,包括以下步骤:
50.(1)原辅料清洗:将树莓用4℃纯净水清洗除去表面泥土备用。
51.(2)破碎:将树莓与缓冲液按1:1投入榨汁机,破碎20min,得到破碎后的树莓原浆。
52.(3)酶解:将所述树莓原浆转移至酶解罐中,加入dl-酒石酸和乳酸将原ph调至5.0,然后加入乳糖酶,升温至60℃,酶解120min得到中间体。
53.(4)混料调配:向酶解得到的中间体中,通过在线混料机加入碳酸氢钠,溶解并搅拌混合均匀,将发酵初始ph调至6.0。
54.(5)灭酶提取:将酶解罐中的物料升温至85℃,并维持20min进行灭酶提取。
55.(6)杀菌:将酶解罐中的物料进行杀菌,本发明采用超高温瞬灭菌,灭菌温度为135℃,灭菌时间为6s。
56.(7)发酵培养:杀菌后,将物料降温至22℃,添加短双歧杆菌,在27℃下发酵21h,发酵总酸控制在14g/l,发酵ph控制在4.3,得到树莓发酵液。
57.(8)离心:将得到的树莓发酵液进行离心,将树莓发酵液于4℃,4500
×
g离心20min,去除较大残渣,此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀;将得到的中间层液体,4℃,10000
×
g离心60min,保留上层液体,即得到液体发酵树莓外泌体。
58.(9)冻干:将部分得到的液体发酵树莓外泌体,与甘露醇复配,形成均一溶液,将此溶液注入模具中,进行预冻1.5h,然后转入冻干机中,在5mbar,-30℃下冷冻干燥7h,即得到
发酵树莓外泌体粉末。
59.实施例4
60.一种发酵金银花外泌体的制备方法,包括以下步骤:
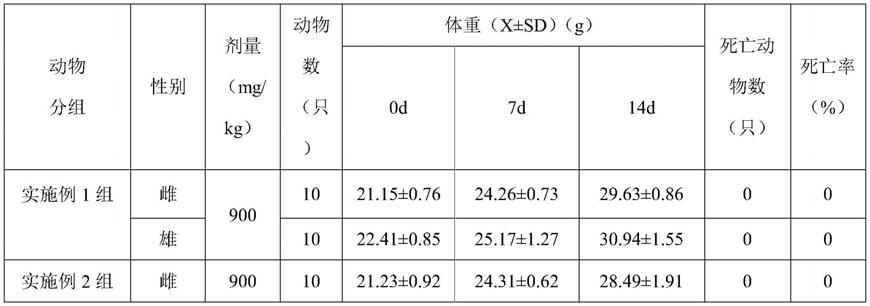
61.(1)原辅料清洗:将金银花用4℃纯净水清洗除去表面泥土备用。
62.(2)破碎:将金银花与缓冲液按1:1投入榨汁机,破碎30min,得到破碎后的金银花原浆。
63.(3)酶解:将所述植物原浆转移至酶解罐中,加入dl-苹果酸钠将原浆ph调至4.8,然后加入β-葡聚糖酶,升温至45℃,酶解120min得到中间体。
64.(4)混料调配:向酶解得到的中间体中,通过在线混料机加入碳酸氢钠,溶解并搅拌混合均匀,将发酵初始ph调至5.8。
65.(5)灭酶提取:将酶解罐中的物料升温至90℃,并维持25min进行灭酶提取。
66.(6)杀菌:将酶解罐中的物料进行杀菌,本发明采用超高温瞬灭菌,灭菌温度为135℃,灭菌时间为10s。
67.(7)发酵培养:杀菌后,将物料降温至25℃,添加嗜酸乳杆菌、干酪乳杆菌,在30℃下发酵22h,发酵总酸控制在15g/l,发酵ph控制在4.4,得到金银花发酵液。
68.(8)离心:将得到的金银花发酵液进行离心,将金银花发酵液于4℃,4500
×
g离心20min,去除较大残渣,此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀;将得到的中间层液体,4℃,10000
×
g离心60min,保留上层液体,即得到液体发酵金银花外泌体。
69.(9)冻干:将部分得到的液体发酵金银花外泌体,与甘露醇复配,形成均一溶液,将此溶液注入模具中,进行预冻1.5h,然后转入冻干机中,在5mbar,-30℃下冷冻干燥7h,即得到发酵金银花外泌体粉末。
70.实施例5
71.一种发酵山竹外泌体的制备方法,包括以下步骤:
72.(1)原辅料清洗:将山竹用4℃纯净水清洗除去表面泥土备用。
73.(2)破碎:将山竹与缓冲液按1:1投入榨汁机,破碎30min,得到破碎后的山竹原浆。
74.(3)酶解:将所述山竹原浆转移至酶解罐中,加入乳酸、氢氧化钙将原浆ph调至4.8,然后加入果胶酶,升温至45℃,酶解120min得到中间体。
75.(4)混料调配:向酶解得到的中间体中,通过在线混料机加入碳酸氢钠,溶解并搅拌混合均匀,将发酵初始ph调至5.8。
76.(5)灭酶提取:将酶解罐中的物料升温至90℃,并维持25min进行灭酶提取。
77.(6)杀菌:将酶解罐中的物料进行杀菌,本发明采用超高温瞬灭菌,灭菌温度为135℃,灭菌时间为10s。
78.(7)发酵培养:杀菌后,将物料降温至25℃,添加卷曲乳杆菌、保加利亚乳杆菌,在30℃下发酵22h,发酵总酸控制在15g/l,发酵ph控制在4.4,得到山竹发酵液。
79.(8)离心:将得到的山竹发酵液进行离心,将山竹发酵液于4℃,4500
×
g离心20min,去除较大残渣,此时溶液分为三层,上层为较轻的残渣,中间层为具有各植物颜色的透明溶液,下层为少量沉淀;将得到的中间层液体,4℃,10000
×
g离心60min,保留上层液体,即得到液体发酵山竹外泌体。
80.(9)冻干:将部分得到的液体发酵山竹外泌体,与甘露醇复配,形成均一溶液,将此溶液注入模具中,进行预冻1.5h,然后转入冻干机中,在5mbar,-30℃下冷冻干燥7h,即得到发酵山竹外泌体粉末。
81.实施例6发酵植物外泌体的安全性验证
82.本发明提供的发酵植物外泌体,选取实施例1组和实施例2组对小鼠进行急性经口毒性试验。每组筛选雌、雄小鼠各10只,雌雄分笼饲养,设定正常组和高剂量组两组实验,观察14天,分别在0天、7天、14天记录相关数据,结果见表1和表2。
83.喂饲方法:实施例1组直接喂养液体发酵葡萄外泌体,5ml/天;实施例2组将发酵胡萝卜外泌体粉末用纯净水溶解后喂饲,1.5g冻干粉/天,1.5g冻干粉溶解在10ml水中。
84.表1急性经口毒性正常组试验结果
[0085][0086][0087]
表2急性经口毒性高剂量组试验结果
[0088][0089]
数据显示,在本试验条件下,灌胃给予试验动物实施例所得样品,动物在灌胃后精神状态良好,行为正常,体重正常增长,无不良反应,死亡率为0%,证实实施例1发酵葡萄外泌体和实施例2发酵胡萝卜外泌体、实施例3发酵石榴外泌体、实施例4发酵树莓外泌体、实施例5发酵山竹外泌体是无毒、安全的,符合《生物学安全性评价》要求急性毒性实验结果属无毒级结果。
[0090]
实施例7发酵植物外泌体进行含量检测和粒径鉴定
[0091]
1、蛋白含量测定(bca法测蛋白浓度)
[0092]
原理:bca蛋白浓度检测,是根据吸光值推算出蛋白浓度的一种方法。碱性条件下,蛋白将cu
2+
还原为cu
+
,cu
+
与bca试剂形成紫颜色的络合物,两分子bca螯合一个cu
+
。将该水溶性复合物在562nm处的吸光值,与标准曲线对比,即可计算待测蛋白的浓度。
[0093]
实验步骤:
[0094]
1)标准品准备:
[0095]
bca标准品(试剂盒配备)原液浓度为20mg/ml,用生理盐水稀释到5mg/ml进行使用。然后将a液(试剂盒配备)与b液(试剂盒配备)按照体积比50:1进行配制,得到a/b混合液,充分混匀避光保存备用。
[0096]
2)标准曲线绘制:
[0097]
按表1在96孔酶标板中加入对应试剂,向各孔中加入200μl bca a/b混合液(即显色液)。将酶标板在振荡器上振荡30s,37℃放置30min,然后在562nm下比色测定。以蛋白含量为纵坐标,以吸光值为横坐标,绘制标准曲线。
[0098]
表3标准曲线参数
[0099]
孔号12345678标准品溶液(μl)01248121620
生理盐水(μl)2019181612840对应蛋白浓度(mg/ml)00.0250.50.10.20.30.40.5
[0100]
3)样品制备和测定:
[0101]
稀释待测样品至合适浓度,使样品稀释液总体积为20μl,加入200μl bca a/b混合液(即显色液),将酶标板在振荡器上振荡30s,37℃放置30min,以标准曲线1号管做参比,在562nm下比色测定,记录吸光值。
[0102]
4)计算:
[0103]
根据所测样品的吸光值,在标准曲线上即可查得相应的蛋白含量(μg),除以样品稀释液总体积(20μl),乘以样品稀释倍数即为样品实际浓度(μg/μl)。5)结果:
[0104]
表4发酵植物外泌体浓度(μg/μl)
[0105][0106][0107]
表4发酵植物外泌体浓度结果显示:发酵葡萄外泌体浓度为0.01086μg/μl,发酵胡萝卜外泌体浓度0.01103μg/μl,发酵石榴外泌体浓度为0.009527μg/μl,发酵树莓外泌体浓度为0.01435μg/μl,发酵山竹外泌体浓度为0.01246μg/μl。
[0108]
实施例8发酵植物外泌体进行功效验证
[0109]
1、发酵葡萄外泌体抗氧化功效验证
[0110]
1)自由基清除能力
[0111]
取2ml实施例1中的发酵葡萄外泌体及2ml浓度为0.1mmol/l的dpph无水乙醇溶液,加入到同一试管中,均匀混合,于室温下黑暗处放置30min,在517nm处测定其吸光度值,记录为a1;2ml无水乙醇与2mldpph溶液,加入到同一试管中,均匀混合,于室温下黑暗处放置30min,在517nm处测定其吸光度值,记录为a0;2ml发酵葡萄外泌体与2ml无水乙醇,加入到同一试管中,均匀混合,于室温下黑暗处放置30min,在517nm处测定其吸光度值,记录为a2,每组平行三次。按下列公式计算dpph自由基清除率:
[0112]
dpph自由基清除率(%)=(a
0-(a
1-a2))/a0×
100%
[0113]
结果如表5所示,可以看出发酵葡萄外泌体dpph自由基清除率达到73.7%,具有清除自由基能力。
[0114]
表5发酵葡萄外泌体自由基清除能力
[0115]
发酵植物外泌体品种dpph自由基清除率(%)发酵葡萄外泌体73.7
±
6.2%
[0116]
2)抗氧化抗衰老活性
[0117]
细胞培养及处理:在96孔板的每孔中接入3000个人表皮成纤维细胞(hfb)(p3-p7
代)后在培养箱中培养24小时(5%co2,37℃),24h后更换为含有终浓度为10μg/ml维生素c(正对照组)、实施例1中发酵葡萄外泌体处理,处理1h后继续加入过氧化氢溶液,使其终浓度为800μmol/l,接着培养72h。同时设置无任何添加的空白对照组和阴性对照组。
[0118]
cck8法测量细胞增值活性:培养72h后,吸出培养液并用pbs缓冲液洗一次,接着加入含有10%cck-8的培养液,在细胞培养箱中避光培养2h。接着使用酶标仪在450nm波长处检测od值,通过如下公式计算细胞增殖活力:
[0119]
细胞增殖活力百分率(%)=od实验孔/od对照孔
×
100%
[0120]
结果如表6所示,从表6可以看出:对使用过氧化氢处理后的hfb细胞中添加相同浓度的维生素c和实施例1中发酵葡萄外泌体后,均可以使细胞增殖活力增强,抑制过氧化氢造成的细胞氧化损伤。细胞增殖活力百分率:h2o2+发酵葡萄外泌体》h2o2+维生素c组,说明本发明实施例1中发酵葡萄外泌体的增殖受氧化损伤细胞的活性能力优于维生素c。
[0121]
表6抗氧化抗衰老活性
[0122]
组别细胞增殖活力百分率(%)空白组100
±
4.2h2o2组44.9
±
4.6h2o2+维生素c组53.4
±
5.0h2o2+发酵葡萄外泌体组72.7
±
7.3
[0123]
2、发酵胡萝卜外泌体抗蓝光功效验证
[0124]
采用人角质形成细胞为模型,分别设定空白组、损伤组、实施例2发酵胡萝卜外泌体组,共3组试验。实验设定组别及参数条件如表7所示:
[0125]
表7抗蓝光实验设定组别及参数条件
[0126][0127]
表8抗蓝光实验结果
[0128][0129][0130]
结果如表8所示,可以看出空白组吸光度为0.42,损伤组吸光度为0.37,发酵胡萝卜外泌体组吸光度为0.45,吸光度越高代表细胞活性越高,因此,与损伤组相比,发酵胡萝卜外泌体组具有较好细胞活性,表示抗蓝光效果较佳。
[0131]
以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何在本技术揭露的技术范围内的变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
