1.本发明涉及含有有效成分以及表面活性剂的制剂。
背景技术:
2.在外用药和化妆品等领域,已经开发了用于使药物等有效成分经皮吸收的技术。有效成分的经皮吸收的过程可能受到皮肤屏障功能、代谢等的影响,已知这些影响因药物的不同而不同。
3.以下专利文献1公开了一种芯壳结构体,其包括含有有效成分的芯部、含有hlb值为4~14的表面活性剂的壳部。所述表面活性剂具有碳原子数为7~15的饱和烃基或碳原子数为7~17的不饱和烃基。
4.现有技术文献
5.专利文献
6.专利文献1:国际公开第2018/147333号
技术实现要素:
7.本发明所要解决的技术问题
8.包含如专利文件1所述的芯壳结构体的制剂在经皮吸收有效成分时,具有优异的即效性。然而,根据专利文献1的制剂,如果要提高有效成分的经皮吸收性或即效性,则有时皮肤刺激性会变强。因此,存在将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至更高的水平的需求。
9.本发明的目的在于提供一种可以将有效成分的经皮吸收性、进行经皮吸收时的即效性、皮肤刺激性的降低均提升至高水平的制剂。
10.解决技术问题的技术手段
11.本发明涉及的制剂包含基剂及芯壳结构体,所述芯壳结构体具有含有有效成分的芯部和含有表面活性剂的壳部,所述芯部为固体,所述表面活性剂含有脂肪酸结合数为2以上的化合物和脂肪酸结合数为1的化合物,所述表面活性剂中的所述脂肪酸结合数为2以上的化合物的比例为5重量%以上、75重量%以下。
12.在本发明涉及的制剂的一个特定方案中,所述表面活性剂中的所述脂肪酸结合数为2以上的化合物的比例为10重量%以上、70重量%以下。
13.本发明涉及的制剂的其他的特定方案中,所述脂肪酸结合数为2以上的化合物包含:2个以上的脂肪酸与多元醇形成的酯以及2个以上的脂肪酸与糖或糖衍生物形成的酯中的至少一种。
14.本发明涉及的制剂的另外的其他特定方案中,所述脂肪酸结合数为2以上的化合物包含:2个以上的脂肪酸与丙三醇形成的酯以及2个以上的脂肪酸与脱水山梨糖醇形成的酯中的至少一种。其中,更优选所述脂肪酸结合数为2以上的化合物包含2个以上的脂肪酸与丙三醇形成的酯。
15.本发明涉及的制剂的另外的其他特定方案中,所述表面活性剂的hlb值的加权平均值为4以上、14以下。
16.本发明涉及的制剂的另外的其他特定方案中,所述表面活性剂具有碳原子数为7~15的饱和烃基,或碳原子数为7~17的不饱和烃基。
17.本发明涉及的制剂的另外的其他特定方案中,所述有效成分和所述表面活性剂的质量比(有效成分:表面活性剂)为1:0.1~1:10。
18.本发明涉及的制剂的另外的其他特定方案中,所述基剂为油性基剂。
19.发明的效果
20.根据本发明,可以提供一种可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至高水平的制剂。
附图说明
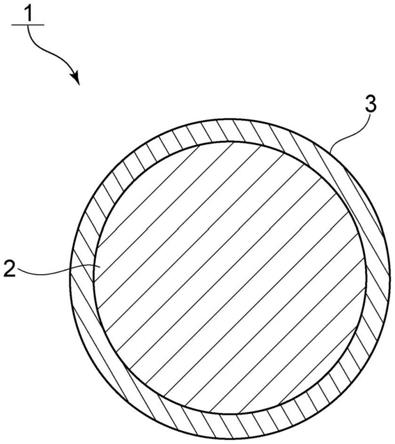
21.[图1]图1是表示本发明的一个实施方式涉及的芯壳结构体的示意性截面图。
[0022]
[图2]图2是药物皮肤透过试验单元的示意性截面图。
[0023]
[图3]图3是用于说明滞后时间的测定方法的模式图。
[0024]
本发明的具体实施方式
[0025]
以下,对本发明的详细内容进行说明。
[0026]
本发明的制剂包含基剂、芯壳结构体。所述芯壳结构体具有含有有效成分的芯部和含有表面活性剂的壳部。所述芯部为固体。所述表面活性剂含有脂肪酸结合数为2以上的化合物及脂肪酸结合数为1的化合物。此外,本发明中,所述表面活性剂中的脂肪酸结合数为2以上的化合物的比例为5重量%以上、75重量%以下。
[0027]
本发明的制剂由于具备所述的技术特征,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至高水平。
[0028]
以往,如果要提高有效成分的经皮吸收性或即效性,则有时皮肤刺激性会变强。
[0029]
本发明的发明人着眼于表面活性剂中的脂肪酸结合数,发现,通过使表面活性剂包含脂肪酸结合数为2以上的化合物及脂肪酸结合数为1的化合物,特别是通过将表面活性剂中的脂肪酸结合数为2以上的化合物的比例设为5重量%以上、75重量%以下,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至高水平。
[0030]
需要说明的是,本说明书中,表面活性剂中的脂肪酸结合数为2以上的化合物的比例,例如,可以通过凝胶渗透色谱(gpc)测定。具体而言,以通过gpc得到的已知脂肪酸结合数小于2以及2以上的比率的表面活性剂的溶出曲线为标准曲线,特定出比率未知的脂肪酸结合数为小于2的化合物及脂肪酸结合数为2以上的化合物的峰,从它们的峰的强度求出比例。例如,表面活性剂包含甘油单酯和甘油二酯时,可以确定出甘油单酯和甘油二酯的峰,从其峰的强度求出甘油二酯的比例(脂肪酸结合数为2以上的化合物的比例)。同样地,也可以从其峰的强度求出甘油单酯的比例(脂肪酸结合数为1的化合物的比例)。
[0031]
以下,将对构成本发明的制剂的各成分进行更详细的说明。
[0032]
(有效成分)
[0033]
本发明的制剂含有有效成分。作为有效成分的具体例,并无特别限制,例如可列举:痴呆治疗药、抗癫痫药、抗抑郁药、抗帕金森氏病药、抗过敏药、抗癌药、糖尿病治疗药、
降压药、呼吸器官疾病药物、ed治疗药物、皮肤疾病药物、局部麻醉药等。需要说明的是,有效成分可以单独使用,也可以组合使用两种以上。
[0034]
更具体而言,可列举:美金刚、多奈哌齐、苯海拉明、伐地那非、奥曲肽、利凡斯的明、加兰他敏、硝酸甘油、利多卡因、芬太尼、雄性激素类、雌性激素类、尼古丁、氯米帕明、纳呋拉啡、美托洛尔、非索罗定、坦度螺酮、贝前列素钠、他替瑞林、鲁拉西酮、奈法唑酮、利福昔明、贝尼地平、多沙唑嗪、尼卡地平、福莫特罗、洛美利嗪、氨氯地平、特立帕肽、布拉地新、色甘酸、利西拉肽、艾塞那肽、利拉鲁肽、兰瑞肽、胰高血糖素、催产素、降钙素、依降钙素、格拉默、利塞膦酸、双氯芬酸或抗坏血酸酸等、以及上述物质的药学上可接受的盐等。
[0035]
作为药学上可接受的盐,并无特别限制,可以采用酸性盐或碱性盐的任一者。作为酸性盐的例子,可列举:盐酸盐、氢溴酸盐、硫酸盐、硝酸盐、磷酸盐等无机盐、乙酸盐、丙酸盐、酒石酸盐、富马酸盐、马来酸盐、苹果酸、柠檬酸盐、甲磺酸盐、苯磺酸盐或对甲苯磺酸盐等有机盐。此外,作为碱性盐的例子,可列举:钠盐、钾盐等碱金属盐、钙盐和镁盐等碱土类金属盐等。作为具体的有效成分的盐,例如,可列举:盐酸美金刚、盐酸多奈哌齐、酒石酸卡巴拉汀、氢溴酸加兰他敏、盐酸氯米帕明、盐酸苯海拉明、盐酸纳氟呋啶、酒石酸美托洛尔、富马酸非索罗定、盐酸伐地那非水合物、盐酸纳氟芬、柠檬酸坦度螺酮、贝拉普罗钠、盐酸鲁拉西酮、盐酸奈法唑酮、盐酸贝尼地平、甲磺酸多沙唑嗪、盐酸尼卡地平、富马酸福莫特罗、盐酸奥美利嗪、苯磺酸氨氯地平等。
[0036]
作为化妆品所混合的有效成分,只要是需要其渗经皮肤的物质即可,并无特别限制,例如,可列举:维生素c、维生素e等维生素成分、透明质酸、神经酰胺、胶原蛋白等保湿成分、氨甲环酸、熊果苷等美白成分、米诺地尔等毛发生长成分、fgf(成纤维细胞生长因子)、egf(表皮细胞生长因子)等美容成分、或其盐和衍生物等。
[0037]
有效成分优选为亲水性。有效成分是亲水性药物时,通被用作需要全身作用或局部作用的药物。
[0038]
有效成分优选易于经皮吸收的药物。有效成分,并无特别限定,优选辛醇水分配系数为-2~6的化合物。在该情况下,有效成分的皮肤透过性进一步提高。从更进一步提高有效成分的皮肤透过性的观点出发,辛醇水分配系数优选为-1以上,更优选为0以上。另外,有效成分的辛醇水分配系数优选为4以下,更优选为1以下。有效成分的辛醇水分配系数在所述上限值以下时,有效成分的皮肤透过性更进一步提高。
[0039]
需要说明的是,本发明中,辛醇水分配系数通过如下方式求出:将有效成分添加到含有辛醇和ph7的水性缓冲溶液的烧瓶中后,振荡,从各相中的有效成分的浓度得到。具体而言,可以通过以下公式进行计算:辛醇水分配系数=log
10
(辛醇相中浓度/水相中浓度)。
[0040]
本发明中,有效成分的分子量无特别限制。有效成分的分子量优选为250g/mol以上,更优选为300g/mol以上、优选为7500g/mol以下,更优选为6500g/mol以下,进一步优选为1500g/mol以下。
[0041]
本发明的制剂中的有效成分的含量,虽然也取决于有效成分的种类,例如,作为原料重量,优选为1重量%以上、40重量%以下,更优选为5重量%以上、30重量%以下。原料重量是以制剂中包含的全部原料的总重量为基准的值。
[0042]
需要说明的是,本发明的制剂中,作为有效成分,根据需要,可以含有2种以上的有效成分。
[0043]
(表面活性剂)
[0044]
本发明中,表面活性剂包含脂肪酸结合数为2以上的化合物。脂肪酸结合数为2以上的化合物是指,在分子内具有2个以上的来源于脂肪酸的结构的化合物。
[0045]
作为这样的脂肪酸结合数为2以上的化合物,例如,可以举出2个以上的脂肪酸与多元醇的酯、2个以上的脂肪酸与糖或糖衍生物的酯等。
[0046]
作为多元醇,例如,可以举出:丙三醇、聚丙三醇、聚氧乙烯丙三醇等。作为2个以上的脂肪酸与多元醇的酯,无特别限制,优选2个以上的脂肪酸与丙三醇的酯。
[0047]
此外,作为糖或糖衍生物,可以举出:蔗糖、脱水山梨糖醇、聚氧乙烯脱水山梨糖醇等。作为2个以上的脂肪酸与糖的酯,无特别限制,但优选2个以上的脂肪酸与蔗糖的酯,或2个以上的脂肪酸与脱水山梨糖醇的酯。
[0048]
上述的脂肪酸结合数为2以上的化合物中,更优选2个以上的脂肪酸与丙三醇的酯、或2个以上的脂肪酸与脱水山梨糖醇的酯。此时,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至更高的水平。
[0049]
作为脂肪酸结合数为2以上的化合物,无特别限制,但优选为脂肪酸结合数为2以上、4以下的化合物,更优选为脂肪酸结合数为2以上、3以下的化合物,进一步优选为脂肪酸结合数为2的化合物。此时,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至更高的水平。
[0050]
作为脂肪酸结合数为2以上的化合物,特别优选2个脂肪酸与丙三醇的酯(甘油二酯),或2个脂肪酸与脱水山梨糖醇的酯,更特别优选2个脂肪酸与丙三醇的酯(甘油二酯)。此时,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至更高的水平。
[0051]
需要说明的是,脂肪酸结合数为2以上的化合物可以单独使用1种,也可以多种组合使用。
[0052]
作为构成脂肪酸结合数为2以上的化合物的脂肪酸,可以举出:己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、山嵛酸、十一碳烯酸、蓖麻油酸、油酸、亚油酸、亚麻酸、蓖麻油酸、芥酸、牛脂、猪脂、椰子油、棕榈油、棕榈仁油、橄榄油、菜籽油、米糠油、大豆油、蓖麻油等。它们可以单独使用1种,也可以多种组合使用。
[0053]
作为脂肪酸结合数为2以上的化合物的具体例,可以举出:甘油二辛酸酯、甘油二癸酸酯、甘油二硬脂酸酯、二甘油三异硬脂酸酯、聚甘油二硬脂酸酯、聚甘油二异硬脂酸酯、十甘油三异硬脂酸酯、聚甘油三油酸酯、十甘油五硬脂酸酯、聚甘油五油酸酯、聚氧乙烯甘油三异硬脂酸酯、脱水山梨糖醇二硬脂酸酯、脱水山梨糖醇倍半硬脂酸酯、脱水山梨糖醇三硬脂酸酯、脱水山梨糖醇倍半油酸酯、脱水山梨糖醇三油酸酯、聚氧乙烯脱水山梨糖醇三硬脂酸酯、聚氧乙烯脱水山梨糖醇三油酸酯。
[0054]
本发明中,表面活性剂中的脂肪酸结合数为2以上的化合物的比例为5重量%以上、优选为10%重量以上,更优选为20重量%以上,进一步优选为25重量%以上、特别优选为30重量%以上、为75重量%以下,优选为70重量%以下,更优选为65重量%以下,进一步优选为60重量%以下。表面活性剂中的脂肪酸结合数为2以上的化合物的比例在所述下限值以上时,在经皮吸收时,可以更进一步提高即效性。此外,表面活性剂中的脂肪酸结合数为2以上的化合物的比例在所述上限值以下时,可以更进一步降低皮肤刺激性。
[0055]
作为以所述的比例包含脂肪酸结合数为2以上的化合物表面活性剂,例如,可以使用市售的表面活性剂。此外,可以使用脂肪酸结合数为2以上的化合物的比例不同的多种的市售品,将脂肪酸结合数为2以上的化合物的比例调整至所述范围内再使用。
[0056]
因此,表面活性剂中包含的除了脂肪酸结合数为2以上的化合物以外的成分包含在市售品的表面活性剂中,例如,可以举出甘油单酯等脂肪酸结合数为1的化合物。
[0057]
本发明中,表面活性剂中的脂肪酸结合数为1的化合物的比例优选为10重量%以上,更优选为20%重量以上,进一步优选为30重量%以上、优选为95重量%以下,更优选为80重量%以下,进一步优选为70重量%以下。表面活性剂中的脂肪酸结合数为1的化合物的比例在所述下限值以上时,更易于提高有效成分的经皮吸收性、即效性。此外,表面活性剂中的脂肪酸结合数为1的化合物的比例在所述上限值以下时,更进一步易于降低皮肤刺激性。
[0058]
当然,在本发明的制剂中,可以进一步含有其他的表面活性剂。其他的表面活性剂可以是非离子性表面活性剂、阴离子性表面活性剂、阳离子性表面活性剂或两性表面活性剂中的任一种。
[0059]
本发明中,表面活性剂的hlb值优选为4以上、14以下。
[0060]
本发明中的hlb(hydrophile lypophile balance的简称)值是表示乳化剂是亲水性还是亲油性的指标,其是0~20的值。hlb值越小,表示亲油性越强。
[0061]
本发明中,hlb值通过下述griffin式算出。
[0062]
hlb值=20
×
{(亲水部分的分子量)/(全分子量)}
[0063]
hlb值的加权平均值,例如可以使用以下的算出式来算出。
[0064]
比如有hlb值为a、b、c的表面活性剂,各个表面活性剂的重量为x、y、z时的加权平均值的算出式为:(xa+yb+zc)
÷
(x+y+z)。
[0065]
表面活性剂的hlb值,或包含多种的表面活性剂时hlb值的加权平均值优选为4以上、14以下,更优选为5以上、12以下。在这种情况下,在经皮吸收时,可以更进一步提高即效性。
[0066]
表面活性剂可以具有烷基等的饱和烃基及烯基或炔基等的不饱和烃基中的至少一种。
[0067]
饱和烃基中的碳原子数优选为7以上、15以下,更优选为7以上、11以下。在这种情况下,在经皮吸收时,可以更进一步提高即效性。
[0068]
不饱和烃基中的碳原子数优选为7以上、17以下,更优选为7以上、13以下,进一步优选为7以上、11以下。在这种情况下,在经皮吸收时,可以更进一步提高即效性。
[0069]
表面活性剂含有多个烃基时,将该表面活性剂所含有的比例最多的烃基作为表面活性剂的烃基。
[0070]
特别是,表面活性剂含有碳原子数不同的多个烃基时,将该表面活性剂所含有的比例最多的烃基的碳原子数作为表面活性剂的烃基的碳原子数。
[0071]
此外,含有多种的表面活性剂时,将多种的表面活性剂中所含有的比例最多的烃基的碳原子数作为本发明的表面活性剂中的烃基的碳原子数。
[0072]
本发明中,表面活性剂的含量可以在可以发挥本发明的效果的范围内适宜设定,但作为原料重量,优选为重量2%~40重量%,更优选为5重量%~30重量%。原料重量是以
制剂中包含的全原料的总重量为基准的值。
[0073]
本发明中,有效成分和表面活性剂的质量比(有效成分:表面活性剂)的下限值优选为1:0.1以上,更优选为1:0.3以上,进一步优选为1:0.5以上。有效成分和表面活性剂的质量比(有效成分:表面活性剂)的上限值优选为1:10以下,更优选为1:5以下,进一步优选为1:2以下。特别是,本发明中,有效成分和表面活性剂的质量比(有效成分:表面活性剂)优选为1:0.1~1:10,更优选为1:0.5~1:10,进一步优选为1:0.5~1:5,特别优选1:0.5~1:2。此时,在在经皮吸收时,可以更进一步提高即效性。
[0074]
(芯壳结构体)
[0075]
本发明的制剂包含具有含有有效成分的芯部和含有表面活性剂的壳部的芯壳结构体。因此,可以将有效成分的经皮吸收性、经皮吸收时的即效性、皮肤刺激性的降低均提升至更高的水平。
[0076]
本发明中,芯部和壳部可以通过分子间力等而相互结合,形成集合体。当然,从更进一步提高有效成分的经皮吸收性、即效性的观点出发,优选芯部的表面的至少一部分被壳部所包覆。
[0077]
更具体而言,优选芯部的表面的30%以上被壳部包覆,更优选为50%以上,进一步优选为70%以上,进一步优选为85%以上、特别优选为95%以上、最优选为99%以上。当然,芯部的表面可以被壳部完全包覆。由于芯壳结构体具有所述结构,例如,适用于皮肤时,可以更进一步提高芯部中所含有的有效成分的经皮吸收性、即效性。
[0078]
所述芯部是固体。芯部是固体,因此可以更进一步提高在下述的基剂相中的稳定性。此外,在此时下,通过将芯壳结构体分散于油相的基剂相中,可以形成具有s/o(solid in oil)型结构的制剂。
[0079]
需要说明的是,如后述制备方法一栏所说明,可以通过干燥w/o乳液以除去溶剂(水性溶剂和油性溶剂)而得到芯壳结构体,因此,芯部是固体(所述s/o(solid in oil)类型的s)。需要说明的是,优选通过干燥w/o乳液的步骤,将水分实质上完全除去。更具体而言,例如,通过卡尔-费休(karlfischer)法测量的水含量优选为5重量%以下,更优选为2重量%以下,进一步优选为1重量%以下,特别优选为0.5重量%以下。因此,芯壳结构体不同于w/o乳液。
[0080]
参考附图说明本发明的芯壳结构体的一例。
[0081]
图1是表示本发明的一个实施形态的芯壳结构体的示意性截面图。
[0082]
如图1所示,芯壳结构体1包括芯部2和壳部3。芯部2的表面被壳部3包覆。
[0083]
当然,芯壳结构体的形状不限于这样的球形粒子。芯壳结构体可以是具有杆状、立方状、透镜状、胶束状、片状、六边形状、二元胞状、海绵状或海胆状的粒子,也可以是不规则形状的粒子。如上所述,芯壳结构体的形状并无特别限制。如上所述,优选芯部的表面的至少一部分被壳部包覆。
[0084]
此外,芯壳结构体的尺寸并无特别限制。从更进一步提高有效成分的经皮吸收性、即效性的观点出发,芯壳结构体的平均尺寸可以优选为1nm~100μm。
[0085]
需要说明的是,本发明中,芯壳结构体的平均尺寸是通过溶剂(例如,角鲨烷等)分散时的动态光散射法计算数均粒径而得到的。
[0086]
本发明的制剂中的芯壳结构体的含有比例,无特别制限,但可以优选为10质量%
以上、70质量%以下,更优选为20质量%以上、50质量%以下。
[0087]
本发明中,芯壳结构体中的芯部和壳部的质量比(芯部:壳部)的下限值优选为1:0.1以上,更优选为1:0.3以上,进一步优选为1:0.5以上。芯部和壳部的质量比(芯部:壳部)的上限值优选为1:10以下,更优选为1:5以下,进一步优选为1:2以下。此外,本发明中,芯壳结构体中的芯部和壳部的质量比(芯部:壳部),无特别限制,优选为1:0.1~1:10,更优选为:0.5~1:10,进一步优选为1:0.5~1:5,特别优选为1:0.5~1:2。此时,可以更进一步提高有效成分的经皮吸收性、即效性。
[0088]
其它的添加成分;
[0089]
芯壳结构体除了有效成分以及表面活性剂之外,可以进一步含有至少1种其他的成分。作为其他的成分,无特别限制,例如,可以举出:稳定剂、经皮吸收促进剂、皮肤刺激降低剂、防腐剂、或镇痛剂等。
[0090]
稳定剂具有稳定粒子结构的作用。作为稳定剂,并无特别限制,例如,可列举:多糖类、蛋白质、亲水性高分子材料等。稳定剂可以包含一种或两种以上。稳定剂的含量可以根据其种类适当设定。例如,可以以使有效成分与稳定剂的重量比(有效成分:稳定剂)为1:0.1~1:10的方式进行混合。
[0091]
作为经皮吸收促进剂,并无特别限制,例如,可列举:高级醇、n-酰基肌氨酸或其盐、高级单羧酸、高级单羧酸酯、芳族单萜脂肪酸酯,碳原子数为2~10的二元羧酸或其盐、聚氧乙烯烷基醚磷酸酯或其盐、乳酸、乳酸酯、柠檬酸等。经皮吸收促进剂可以含有一种或两种以上。经皮吸收促进剂的含量可以根据其种类适当设定。例如,可以进行混合以使有效成分与经皮吸收促进剂的重量比(有效成分:经皮吸收促进剂)为1:0.01~1:50。
[0092]
作为皮肤刺激减轻剂,并无特别限制,例如,可列举:氢醌糖苷、泛硫乙胺、氨甲环酸、卵磷脂、氧化钛、氢氧化铝、亚硝酸钠、亚硝酸氢钠、大豆卵磷脂、蛋氨酸、甘草次酸、bht、bha、维生素e或其衍生物、维生素c或其衍生物、苯并三唑、没食子酸丙酯、巯基苯并咪唑等。皮肤刺激减轻剂可以含有一种或两种以上。皮肤刺激减轻剂的含有比例可以根据种类适当设定。例如,可以进行混合,使皮肤刺激减轻剂相对于芯壳结构体整体为0.1重量%~50重量%。
[0093]
作为防腐剂,并无特别限制,例如,可列举:对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯氧乙醇及百里酚等。防腐剂在芯部的含有比例可以根据种类适当设定。例如,可以以混合防腐剂,使其相对于芯壳结构体整体为0.01重量%~10重量%。防腐剂可以含有一种或两种以上。
[0094]
作为镇痛剂,并无特别限制,例如,可列举:普鲁卡因、丁卡因、利多卡因、二丁卡因及丙胺卡因等的局部麻醉剂或其盐等。镇痛剂可以包含一种或两种以上。芯壳结构中镇痛剂的含有比例可以根据类型适当设定。例如,可以混合镇痛剂,并使其相对于芯壳结构体整体为0.1重量%~30重量%。
[0095]
制造方法;
[0096]
芯壳结构体的制造方法,无特别限制,例如可以通过包括对水相中含有有效成分的w/o乳液进行干燥的工序的方法而制造。
[0097]
w/o乳液是所谓的油中水滴乳液,具体而言,只要是水性溶剂的液滴在油性溶剂中分散的状态的乳液即可,无特别限制。
[0098]
水相中含有有效成分的w/o乳液,例如,可以通过将含有有效成分的水或缓冲水溶液等水性溶剂和含有表面活性剂的环己烷、己烷或甲苯等油性溶剂混合而得到。含有有效成分的水性溶剂,除了有效成分之外,可以根据需要而含有稳定剂、吸收促进剂或刺激降低剂等添加成分。此外,含有表面活性剂的油性溶剂,除了表面活性剂之外,可以根据需要而含有刺激降低剂、镇痛剂、吸收促进剂或稳定剂等添加成分。作为混合的方法,只要是可以形成w/o乳液的方法即可,无特别限制,例如可以举出使用均质机等进行搅拌。
[0099]
均质机搅拌时的条件例如为5000rpm~50000rpm左右,优选为10000rpm~30000rpm左右。
[0100]
w/o乳液中的有效成分与表面活性剂的质量比(有效成分:表面活性剂)的下限值优选为1:0.1以上,更优选为1:0.3以上,进一步优选为1:0.5以上。w/o乳液中的有效成分和表面活性剂的质量比(有效成分:表面活性剂)的上限值优选为1:10以下,更优选为1:5以下,进一步优选为1:2以下。w/o乳液中的有效成分和表面活性剂的质量比(有效成分:表面活性剂)优选为1:0.1~1:10,更优选为1:0.5~1:10,进一步优选为1:0.5~1:5,特别优选为1:0.5~1:2。
[0101]
作为对水相中含有有效成分的w/o乳液进行干燥的方法,只要是可以将该乳液中的溶剂(水性溶剂以及油性溶剂)除去的方法即可,无特别限制。作为w/o乳液的干燥方法,例如可以举出冷冻干燥或减压干燥等,优选举出冷冻干燥。
[0102]
此外,从进一步降低得到的芯壳结构体的数均粒径的观点出发,优选进一步包含对w/o乳液或该w/o乳液的干燥物进行加热处理的工序。加热处理温度例如可以为30℃~60℃,优选为35℃~50℃,更优选为35℃~45℃。
[0103]
加热处理时间是根据加热处理温度而适宜调整的,例如可以为1天~30天,优选为2天~15天,更优选为3~7天。
[0104]
此外,作为进一步降低得到的芯壳结构体的数均粒径的其他方法,可以举出在根据需要将w/o乳液或该w/o乳液的干燥物分散在溶剂等中,然后用过滤器等过滤的方法、或进行离心处理分离的方法。以过滤器过滤时,过滤器孔径例如可以为1μm以下,优选为0.2μm以下,更优选为0.1μm以下。
[0105]
(制剂)
[0106]
本发明的制剂根据有效成分的种类,例如,可以用于皮肤外用药、滴眼剂、滴鼻剂、栓剂或口腔药等外用药、化妆品或注射剂等,意图经皮吸收或经粘膜吸收等的广泛用途。
[0107]
本发明的制剂并无特别限制,通常具有1天~1周的持续性,优选以每天至每周一次的频率使用。
[0108]
本发明的制剂是外用药时,对象疾病根据有效成分的种类而不同。
[0109]
本发明的制剂,并无特别限制,可以使用膏剂等贴剂或硬膏剂等贴剂(储库型、基剂型等)、巴布膏剂、贴片剂或微针等贴附剂、软膏剂、搽剂或乳剂等外用液剂、外用气雾剂或泵喷雾剂等喷雾剂、乳膏剂、凝胶剂、滴眼剂、眼软膏剂、滴鼻剂、栓剂、直肠用半固体剂、灌肠剂、口服剂或注射剂等。
[0110]
本发明的制剂优选含水率为20质量%以下,更优选实质上不含水。由此,可以更进一步提高使用芯壳结构体时的形状保持性。另外,结合芯壳结构体固有的形状保持性,可以更进一步抑制有效成分从芯壳结构体中漏出,进而可以更进一步抑制有效成分的结晶化,
结果可以发挥更高的经皮吸收性。从该观点出发,本发明的制剂优选作为含水率调整至20质量%以下的制剂而使用。更优选作为实质上不含水的制剂而使用。本发明的制剂,例如,优选作为膏剂、贴片剂、软膏剂、凝胶剂等使用。
[0111]
(基剂相)
[0112]
本发明的制剂可以包含基剂相,而在该基剂相中包含芯壳结构体。此时,芯壳结构体优选分散或溶解于基剂相中。
[0113]
基剂没有特别限制,可广泛地在可以用作外用药等医药品或化妆品的物质中选择。
[0114]
如上所述,芯壳结构体的芯部为固体。因此,基剂相为油相时,可以通过将芯壳结构体分散于油相的基剂相,从而形成s/o(solid in oil)型制剂。s/o型制剂例如可通过将上述的制备方法得到的粒子分散于油相中而得到。
[0115]
基剂可以从适合分散或溶解芯壳结构体的物质中根据使用目的等适当选择,并无特别限制。
[0116]
此外,可以组合使用多种类型的基剂。
[0117]
作为基剂,并无特别限制,可列举:油性基剂、水性基剂等。其中,优选油性基剂。基剂是油性基剂时,可以通过将芯壳结构体分散于油性基剂而形成具有s/o(solid in oil)型结构的制剂。具有s/o(solid in oil)型结构的制剂可以例如通过后述的具备如下步骤的方法制备:对在水相中含有有效成分的w/o乳液进行干燥的步骤。
[0118]
作为油性基剂,可列举:植物油、动物油、中性脂质、合成脂肪、、甾醇衍生物、蜡类、烃类、一元醇羧酸酯类、含氧酸酯类、多元醇脂肪酸酯类、有机硅类、高级醇类、高级脂肪酸类、氟类油剂类等。作为水性基剂,可列举:水、(多元)醇等。
[0119]
作为植物油,并无特别限制,例如,可列举:大豆油、芝麻油、橄榄油、棕榈油、椰子油、米油、棉籽油、向日葵油、米糠油、可可脂、玉米油、红花油、蓖麻油、菜籽油等。
[0120]
作为动物油,并无特别限制,例如,可列举:貂油、龟油、鱼油、牛油、马油、猪油和鲨鱼角鲨烷等。
[0121]
作为中性脂质,并无特别限制,可列举:三油酸甘油酯、三亚麻油酸甘油酯、三肉豆莞酸甘油酯、三硬脂酸酯和三花生酸酯等。
[0122]
作为合成油脂,并无特别限制,例如,可列举:磷脂或氮酮等。
[0123]
作为甾醇衍生物,并无特别限制,例如,可列举:二氢胆固醇、羊毛甾醇、二氢羊毛固醇、植物甾醇、胆酸和胆甾醇亚油酸酯等。
[0124]
作为蜡,可列举:小烛树蜡、巴西棕榈蜡、米糠蜡、木蜡、蜂蜡、褐煤蜡、重晶石蜡、地蜡、石蜡、微晶蜡、凡士林、费托蜡、聚乙烯蜡或乙烯-丙烯共聚物等。
[0125]
作为烃类,可列举:液体石蜡(矿物油)、重质液体异链烷烃、轻质液体异链烷烃、α-烯烃低聚物、聚异丁烯、氢化聚异丁烯、聚丁烯、角鲨烷、源自橄榄的角鲨烷、角鲨烷、凡士林或固体石蜡等。
[0126]
作为一元醇羧酸酯类,可列举:肉豆蔻酸十八烷基酯、肉豆蔻酸十六烷基酯、异硬脂酸辛基十二烷基酯、棕榈酸十六烷基酯、棕榈酸辛基十二烷基酯、辛酸鲸蜡酯、辛酸十六烷基酯、异壬酸异十三烷基酯、异壬酸异壬酯、异壬酸辛酯、异壬酸异十三烷基酯、新戊酸异癸酯、新戊酸异十三烷基酯、新戊酸异硬脂基酯、新癸酸辛基十二烷基酯、油酸油醇酯、油酸
辛基十二烷基酯、蓖麻油酸辛基十二烷基酯、羊毛脂脂肪酸辛基十二烷基酯、二甲基辛酸十六烷基酯、芥酸十八烷基酯、异硬脂酸酯氢化蓖麻油、油酸乙酯、鳄梨油脂肪酸乙酯、肉豆蔻酸异丙酯、棕榈酸异丙酯、棕榈酸辛酯、异硬脂酸异丙酯、羊毛脂脂肪酸异丙酯、癸二酸二乙酯、癸二酸二异丙基、癸二酸二辛酯、己二酸二异丙酯、癸二酸二丁辛酯、己二酸二异丁酯、琥珀酸二辛酯和柠檬酸三乙酯等。
[0127]
作为含氧酸酯类,可列举:乳酸十六烷基酯、苹果酸二异硬脂酯、单异硬脂酸氢化蓖麻油等。
[0128]
作为多元醇脂肪酸酯类,可列举:三辛酸甘油酯、三油酸甘油酯、三异硬脂酸甘油酯、二异硬脂酸甘油酯、三(辛酸/癸酸)甘油酯、三(辛酸/癸酸/肉豆蔻酸/硬脂酸)甘油酯、氢化松香甘油三酸酯(氢化酯胶)、松香甘油酯(酯胶)、山嵛酸二十烷二酸甘油酯、三羟甲基丙烷三辛酸酯、三羟甲基丙烷三异硬脂酸酯、新戊二醇二辛酸酯、新戊二醇二癸酸酯、2-丁基-2-乙基-1,3-丙二醇二辛酸酯、丙二醇二油酸酯、季戊四醇四辛酸酯、氢化松香季戊四醇、二-三羟甲基丙烷三乙基己酸酯(异硬脂酸/癸二酸)二-三羟甲基丙烷、三乙基己酸季戊四醇酯、(羟基硬脂酸/硬脂酸/松香酸)二季戊四醇、二异硬脂酸二甘油酯、四异硬脂酸聚甘油酯、壬酸硬脂酸酯聚甘油酯-10、癸(芥酸/异硬脂酸/蓖麻油酸)聚甘油-8、(己基癸酸/癸二酸)二甘油基低聚酯、乙二醇二硬脂酸酯(二硬脂酸乙二醇酯)、二新戊酸3-甲基-1,5-戊二醇酯、或二新戊酸2,4-二乙基-1,5-戊二醇酯等。
[0129]
作为有机硅类,可列举:聚二甲基硅氧烷(二甲基聚硅氧烷)、高度聚二甲基聚硅氧烷(高度聚合二甲基聚硅氧烷)、环聚二甲基硅氧烷(环状二甲基硅氧烷、十甲基环戊基硅氧烷)、苯基三甲基聚硅氧烷、二苯基二甲基聚硅氧烷、苯基二甲基聚硅氧烷、硬脂氧丙基二甲胺、(氨基乙基氨基丙基甲基聚硅氧烷/二甲基聚硅氧烷)共聚物、聚二甲基硅氧烷醇、聚二甲基硅氧烷醇交联聚合物、聚硅氧烷树脂、聚硅氧烷橡胶、氨基丙基二甲基硅氧烷或氨基二甲基硅氧烷等氨基改性的聚硅氧烷、阳离子改性的聚硅氧烷、聚二甲基硅氧烷共聚醇等聚醚改性的硅氧烷,聚甘油改性的聚硅氧烷、糖改性的聚硅氧烷、羧酸改性的聚硅氧烷、磷酸改性的聚硅氧烷、硫酸改性的聚硅氧烷、烷基改性的聚硅氧烷、脂肪酸改性的聚硅氧烷、烷基醚改性的聚硅氧烷、氨基酸改性的聚硅氧烷、肽改性的聚硅氧烷、氟改性的聚硅氧烷、阳离子改性或聚醚改性的聚硅氧烷、氨基改性或聚醚改性的聚硅氧烷、烷基改性或聚醚改性的聚硅氧烷、聚硅氧烷/氧化烯共聚物等。
[0130]
作为高级醇类,可列举:鲸蜡醇、肉豆蔻醇、油醇、月桂醇、十六十八烷醇、硬脂醇、芳烃醇、山嵛醇、霍霍巴醇、鲛肝醇、鲨油醇、鲨肝醇、己基癸醇、异硬脂醇、2-辛基十二烷醇、二聚体二醇等。
[0131]
作为高级脂肪酸类,可列举:月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、异硬脂酸、山嵛酸、十一碳烯酸、12-羟基硬脂酸、棕榈酸、油酸、亚油酸、芥酸、二十二碳六烯酸、二十碳五烯酸、异十六烷酸、前异二十烷酸、长链支链脂肪酸、二聚酸、氢化二聚酸等。
[0132]
作为氟类油剂类,可列举:全氟癸烷、全氟辛烷、全氟聚醚等。
[0133]
作为(多元)醇,可列举:乙醇、异丙醇、甘油、丙二醇、1,3-丁二醇、聚乙二醇等。
[0134]
另外,作为所述其他基剂,并无特别限制,可列举可用于如下物质的基剂等:膏剂或硬膏剂等贴剂(储库型、基剂型等)、巴布膏剂、贴片剂或微针等贴附剂、软膏剂、外用液剂(搽剂或乳剂等)、喷雾剂(外用气雾剂或泵喷雾剂等)、乳膏剂、凝胶剂、滴眼剂、眼软膏剂、
滴鼻剂、栓剂、直肠用半固体剂、灌肠剂、口服或注射剂等。
实施例
[0135]
接下来,将通过举出本发明的具体的实施例以及比较例,对本发明进行详细说明。需要说明的是,本发明不限于以下的实施例。
[0136]
(实施例1)
[0137]
芯壳结构体的制备;
[0138]
将盐酸多奈哌齐(东京化成工业株式会社制造,辛醇水分配系数:4.3,分子量:416g/mol)1g溶解在40g的纯水中,向其中加入溶液,该溶液是将作为表面活性剂的辛酸甘油酯(太阳化学株式会社制造,制品名“sunsoft no.700p-2-c”,hlb值:10.8,饱和烃基的碳原子数:7)2g溶解在环己烷80g中的溶液,以均质机搅拌(25000rpm,2分钟)。之后冷冻干燥2天,得到了芯壳结构体。
[0139]
制剂的制备;
[0140]
向得到的芯壳结构体30重量份中混合软膏基剂plastibase(大正制药株式会社制造)70重量份,进行混合、分散而制作了制剂(软膏剂)。
[0141]
(实施例2)
[0142]
作为表面活性剂,代替辛酸甘油酯(太阳化学株式会社制造,制品名“sun soft no.700p-2-c”,hlb值:10.8,饱和烃基的碳原子数:7)2g,使用了辛酸甘油酯(abitec株式会社制造,制品名“mcm-c8”,hlb值:10.1,饱和烃基的碳原子数:7)2g,除此以外,以与实施例1同样的方式制作了制剂(软膏剂)。
[0143]
(实施例3)
[0144]
作为表面活性剂,代替辛酸甘油酯(太阳化学株式会社制造,制品名“sun soft no.700p-2-c”,hlb值:10.8,饱和烃基的碳原子数:7)2g,使用了辛酸甘油酯(abitec株式会社制造,制品名“capmul mcm-c8”,hlb值:10.1,饱和烃基的碳原子数:7)1g以及辛酸甘油二酯(太阳化学株式会社制造,制品名“sunfat gdc-s”,hlb值:8.9,饱和烃基的碳原子数:7)1g,除此以外,以与实施例1同样的方式制作了制剂(软膏剂)。
[0145]
(实施例4)
[0146]
作为表面活性剂,代替辛酸甘油酯(太阳化学株式会社制造,制品名“sun soft no.700p-2-c”,hlb值:10.8,饱和烃基的碳原子数:7)2g,使用了辛酸甘油酯(abitec株式会社制造,制品名“capmul mcm-c8”,hlb值:10.1,饱和烃基的碳原子数:7)0.5g以及辛酸甘油二酯(太阳化学株式会社制造,制品名“sunfat gdc-s”,hlb值:8.9,饱和烃基的碳原子数:7)1.5g,除此以外,以与实施例1同样的方式制作了制剂(软膏剂)。
[0147]
(实施例5)
[0148]
芯壳结构体的制备;
[0149]
将醋酸奥曲肽(shanghai haoyuan chemexpress株式会社制造,辛醇水分配系数:0.12,分子量:1139.4g/mol)1g溶解在40g的纯水中,在其中加入下述溶液,该溶液是将作为表面活性剂的癸酸甘油酯(abitec株式会社制造,制品名“capmul mcm-c10”,hlb值:8.9,饱和烃基的碳原子数:9)2g溶解在环己烷80g中的溶液,以均质机搅拌(25000rpm,2分钟)。之后冷冻干燥2天,得到了芯壳结构体。
[0150]
制剂的制备;
[0151]
向得到的芯壳结构体30重量份中混合流动石蜡(和光纯药株式会社制造)70重量份,进行混合、分散制作了制剂(乳剂)。
[0152]
(实施例6)
[0153]
向实施例2中得到的芯壳结构体40重量份中,混合丙烯酸粘接剂1(cos medy制药株式会社制造,制品名“mas683”)20重量份、丙烯酸粘接剂2(cos medy制药株式会社制造,制品名“mas811b”)30重量份、以及粘接赋予剂(荒川化学工业株式会社制造,制品名“ke-311”)10重量份,加入甲苯以使得固体成分的浓度为35重量%,然后,混合至均匀,制备了粘接剂层溶液。
[0154]
然后,通过对包含厚度为38μm聚对苯二甲酸乙二酯膜的剥离基材的一个表面涂布有机硅,制备进行了脱模处理的剥离片材。在该剥离片材进行了脱模处理的表面上涂布粘合剂层溶液,在90℃下干燥20分钟,从而制备了在剥离片材的进行了脱模处理的面上形成有厚度为100μm的粘合剂层的叠层体。然后,准备厚度为38μm的聚对苯二甲酸乙二醇酯膜构成的支持体。通过将该支持体的一个表面与所述叠层体的粘合剂层彼此对置叠置,将叠层体的粘合剂层转印至支持体以进行叠层一体化,从而制备制剂(贴剂)。
[0155]
(比较例1)
[0156]
作为表面活性剂,代替辛酸甘油酯(太阳化学株式会社制造,制品名“sun soft no.700p-2-c”,hlb值:10.8,饱和烃基的碳原子数:7)2g,使用了辛酸甘油二酯(太阳化学株式会社制造,制品名“sunfat gdc-s”,hlb值:8.9,饱和烃基的碳原子数:7)2g,除此以外,以与实施例1同样的方式制作了制剂(软膏剂)。
[0157]
(比较例2)
[0158]
作为表面活性剂,代替癸酸甘油酯(abitec株式会社制造,制品名“cap mul mcm-c10”,hlb值:8.9,饱和烃基的碳原子数:9)2g,使用了癸酸甘油二酯(accu standard,inc株式会社制造,制品名“dicaprin”,hlb值:7.3,饱和烃基的碳原子数:9)2g,除此以外,以与实施例5同样的方式制作了制剂(乳剂)。
[0159]
(比较例3)
[0160]
作为表面活性剂,代替辛酸甘油酯(abitec株式会社制造,制品名“cap mulmcm-c8”,hlb值:10.1,饱和烃基的碳原子数:7)2g,使用了辛酸甘油二酯(太阳化学株式会社制造,制品名“sunfat gdc-s”,hlb值:8.9,饱和烃基的碳原子数:7)2g,除此以外,以与实施例6同样的方式制作了制剂(贴剂)。
[0161]
(参考例1)
[0162]
直接使用了软膏基剂plastibase(大正制药株式会社制造)。
[0163]
(参考例2)
[0164]
向盐酸多奈哌齐(东京化成工业株式会社制造,辛醇水分配系数:4.3,分子量:416g/mol)10重量份中混合软膏基剂plastibase(大正制药株式会社制造)90重量份,进行混合、分散,制作了制剂。
[0165]
(脂肪酸结合数为2以上的化合物的比例)
[0166]
对于实施例1~6以及比较例1~3中使用的表面活性剂,使用凝胶渗透色谱(gpc),求出了脂肪酸结合数为2以上的化合物的比例(重量%)。需要说明的是,包含多种的表面活
性剂时,以实施例中使用的表面活性剂的混合比率混合,以进行gpc测定。将得到的gpc的溶出曲线分离为甘油单酯和甘油二酯,从甘油单酯和甘油二酯的比率求出甘油二酯(作为脂肪酸结合数为2以上的化合物的丙三醇脂肪酸酯)的比例以及甘油单酯(作为脂肪酸结合数为1的化合物的丙三醇脂肪酸酯)的比例。需要说明的是,gpc测定是使用apc系统(waters株式会社制造),以四氢呋喃(thf)作为展开溶剂,在柱温40℃、流速1.0ml/分种的条件下测定的。作为检测器,使用了“ri、pda”,柱则是将waters公司制造、“acquity apc xt125 4.6
×
150mm”1根和“acquity apc xt45 4.6
×
150mm”2根竖直相接而使用。作为标准聚苯乙烯,使用了to soh株式会社制造的“pstquick”。
[0167]
(评价)
[0168]
对于实施例1~6、比较例1~3、以及参考例1~2中得到的制剂,通过以下的试验,进行了无毛大鼠皮肤透过性以及兔子皮肤原发刺激性的评价。
[0169]
无毛大鼠皮肤透过性试验;
[0170]
在药物皮肤透过试验单元(图2)上设置了无毛大鼠的皮肤(日本slc株式会社制造,从8周龄的hwy/slc处取得)。在该装置的上部,对于实施例1~6、比较例1~3、以及参考例1~2中得到的制剂、对于软膏剂和乳剂使用0.2g(1.33cm2),对于贴剂以1.33cm2大小使用。此外,如下制备缓冲液:向蒸馏水中加入nah2po
4 5
×
10-4
m、na2hpo
4 2
×
10-4
m、nacl 1.5
×
10-4
m,并使硫酸庆大霉素(和光纯药株式会社制造,g1658)为10ppm得到溶液,将该溶液以naoh调整至ph7.2,由此制备缓冲液,并将其添加至下部的接受层。此外,试验开始后,将装置设置在保持32℃的恒温槽中。试验开始后,经过指定的时间之后,从下部的接受层中采取1ml槽中的液体后立刻补充1ml组成相同的液体。向回收的各接受液样品中添加甲醇以提取溶出脂质等,并进行了离心分离。离心分离后,以高效液相色谱(hplc)定量了上清中的有效成分浓度。基于定量的有效成分量,算出了滞后时间和24小时后皮肤透过量。
[0171]
需要说明的是,滞后时间是如图3所示,纵轴为累积皮肤透过量,横轴为时间的曲线中,延长稳定状态的直线部分,其与横轴相交处的时间。
[0172]
兔子皮肤原发刺激性试验;
[0173]
用电推剪剪去兔子的背部皮肤上的毛(根据需要使用电动剃须刀剃毛)。以背部皮肤的正中线为中心,将背部的单侧2处、共计4处的健康皮肤作为给药部位。将实施例1~6、比较例1~3及参考例1~2中得到的软膏以抹刀取出,将其均匀地铺在尺寸为2cm
×
2cm的纱布上,贴附于给药部位。在其上使用无纺布绷带(nichiban株式会社,网孔,no.50)进行固定。然后,将给药部位整体用纱布包裹,用粘性布伸缩绷带(nichiban株式会社,elastopore,no.100)包覆以闭塞。开始给药后二十四小时后,解除闭塞,除去给药样品。
[0174]
目视观察给药后24小时(解除闭塞,除去给药样品后30分钟)的皮肤反应。然后,进一步以相同的方式目视观察给药后48小时和72小时(解除闭塞,除去给药样品后30分钟)的皮肤反应。需要说明的是,皮肤反应的评价根据下表1中所示的draize标准进行。
[0175]
[表1]
[0176]
皮肤反应的程度评分形成红斑/痂皮 无红斑0极为轻度的红斑(刚刚达到可被判定为红斑的程度)1
明显的红斑2中等强度至严重红斑3深红色的严重红斑上形成轻度痂皮(伤害至深部)4形成浮肿 无浮肿0极轻度浮肿(刚刚达到可被判定为浮肿的程度)1明显浮肿(可与周围明显区分)2中等强度的浮肿(肿起1mm左右)3严重浮肿(肿起1mm以上,并扩散到周围)4
[0177]
具体而言,每次观察时,对于各给药样品,计算各兔子的给药部位的皮肤反应的个别评分(红斑/痂皮形成和浮肿形成的总分)。然后,从给药后24小时和72小时的个别评分(不加上给药后48小时的评分)计算出原发性刺激指数(原发性刺激指数;primary irritation index;p.i.i.)。具体而言,使用以下式(1)和(2)计算。
[0178]
各给药部位的平均评分=(给药后24小时和72小时的个别评分的总和)/2...式(1)
[0179]
原发性刺激指数(p.i.i.)=(各给药部位的平均评分的总和)/(3(只))...式(2)
[0180]
依照得到的原发性刺激指数(p.i.i.),根据下表2中的分类表,区分了各给药样品的刺激度。
[0181]
[表2]
[0182]
原发性刺激指数(p.i.i.)安全性区分0无刺激性0<p.i.i.≤2低刺激性2<p.i.i.≤5中等刺激性5<p.i.i.强刺激性
[0183]
对于通过所述的方法得到的24小时后皮肤透过量、滞后时间、以及皮肤刺激性,以下的评价基准进行了评价。
[0184]
[评价基准]
[0185]
24小时后皮肤透过量;
[0186]
aa
…
500μg/cm2以上
[0187]a…
300μg/cm2以上、小于500μg/cm2[0188]c…
小于300μg/cm2[0189]
滞后时间;
[0190]
aa
…
小于4小时
[0191]a…
4小时以上、小于6小时
[0192]b…
6小时以上、小于8小时
[0193]c…
8小时以上
[0194]
皮肤刺激性(刺激性);
[0195]
aa
…
小于1.8
[0196]a…
1.8以上、小于2.8
[0197]c…
2.8以上
[0198]
结果如下述的表3所示。
[0199]
[表3]
[0200][0201]
符号说明
[0202]1…
芯壳结构体
[0203]2…
芯部
[0204]3…
壳部
[0205]
11
…
封口膜
[0206]
12
…
皮肤
[0207]
13
…
制剂
[0208]
14
…
接受液(ph=7.2磷酸缓冲液)
[0209]
15
…
搅拌子
