1.本发明属于医药化工领域,具体涉及一种复合脂质体,其制备方法及其在肿瘤免疫治疗中的应用。
背景技术:
2.脂质体是由磷脂及胆固醇所形成的具有双分子层结构的封闭囊泡,其与细胞膜上磷脂双分子层近似的结构组成有利于其与细胞膜结构的融合,常作为小分子药物及基因的载体。
3.光热治疗是利用光敏分子在肿瘤位置局部激光照射下被激活产生热量,造成局部温度的升高,以实现其对肿瘤组织的破坏及肿瘤细胞的杀伤。但光热治疗常伴随着肿瘤的快速复发,难以有效的控制肿瘤的生长与转移过程。肿瘤免疫治疗通过激活机体自身免疫系统,可实现自体免疫细胞对肿瘤细胞的特异性识别,选择性杀伤肿瘤细胞,并通过记忆效应抑制肿瘤的转移与复发过程,有利于改善肿瘤治疗效果。现有药物中,部分化疗药物及自噬抑制类药物可通过引起肿瘤细胞的免疫原性死亡及抑制肿瘤自噬的发生,有利于肿瘤免疫的进行。通过增强肿瘤细胞免疫原性,改善肿瘤免疫微坏境,促进肿瘤组织中细胞毒性t淋巴细胞的浸润,或抑制肿瘤免疫逃逸过程的发生以改善肿瘤免疫治疗效果,从而抑制肿瘤细胞增殖及抗肿瘤转移复发。
技术实现要素:
4.技术目的
5.本发明的一个技术目的是提供一种复合脂质体,其可以实现光热治疗与免疫治疗的联合应用,进一步改善肿瘤免疫治疗效果,同时由于实现了肿瘤的靶向治疗而可以降低肿瘤治疗药物的副作用。
6.本发明的另一技术目的是提供所述复合脂质体的制备方法。
7.本发明的又一技术目的是提供所述复合脂质体在制备用于治疗的肿瘤的药物中的用途。
8.技术方案
9.为实现上述目的,一方面,本发明提供一种复合脂质体,其包括以下成分:
10.1)由下式1表示的免疫调节剂-磷脂偶联物;
11.2)由下式2表示的聚乙二醇化光敏分子;
12.3)肿瘤治疗药物;以及
13.4)磷脂,
14.其中,在所述复合脂质体中,所述免疫调节剂-磷脂偶联物1)与所述聚乙二醇化光敏分子2)以及所述磷脂4)形成脂质体,并通过物理包载的形式负载所述肿瘤治疗药物3),
[0015][0016]
其中,在式1中,表示衍生自免疫调节剂的部分,lipid表示衍生自官能化的磷脂分子的部分,l1表示与lipid之间的连接子;
[0017][0018]
其中,在式2中,
[0019]
probe为衍生自近红外二区荧光分子或其衍生物的部分;
[0020]
l2为probe与甲氧基聚乙二醇之间的连接子,
[0021]
x选自n、o、c=o,
[0022]
n为10-145的整数,优选为100-140的整数。
[0023]
在具体实施方式中,所述官能化的磷脂分子选自棕榈酰溶血卵磷脂(p-lysopc)、肉豆蔻酰溶血卵磷脂(m-lysopc)和硬脂酰溶血卵磷脂(s-lysopc)及其衍生物中的任一种,优选地,所述官能化的磷脂分子选自以下各项中的任意一种:
[0024][0025]
在具体实施方式中,所述免疫调节剂选自ido抑制剂、brd4抑制剂、toll样受体激动剂和sting激动剂中的任意一种,例如,所述免疫调节剂为jq1。
[0026]
在具体实施方式中,所述衍生自免疫调节剂的部分选自以下各项中的任意一种:
[0027][0028]
其中表示连接位置。
[0029]
在具体实施方式中,在式1中,所述l1可选自以下结构中的任意一种:
[0030][0031]
其中表示连接位置。
[0032]
在具体实施方式中,在式2中,所述l2可选自以下结构中的任意一种:
[0033][0034]
其中,表示连接位置。
[0035]
在具体实施方式中,在式2中,所述probe可以为衍生自二区近红外分子ir-1061及其类似物的部分,具体地,其可选自以下结构中的任意一种:
[0036][0037]
其中,表示连接位置。
[0038]
在具体实施方式中,所述肿瘤治疗药物为可引起肿瘤细胞免疫原性死亡或抑制肿瘤细胞自噬作用的药物,包括但不限于蒽环霉素类药物,例如多柔比星、表柔比星、伊达比星,铂类药物,例如奥沙利铂,肿瘤细胞自噬抑制剂,例如氯喹、羟基氯喹、雷帕霉素。
[0039]
在具体实施方式中,相对于所述复合脂质体的总重,所述肿瘤治疗药物的负载质量比为1-30%。
[0040]
在具体实施方式中,所述磷脂4)选自大豆卵磷脂(pc)、氢化大豆卵磷脂(hspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰乙醇胺(dppe)、二硬酯酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二硬脂酰磷脂酰甘油(dspg)和二月桂酰磷脂酰胆碱(dlpc)的任一种或两种以上。
[0041]
另一方面,本发明提供一种上述复合脂质体的制备方法,所述方法包括以下步骤:
[0042]
1)使免疫调节剂与官能化的磷脂分子偶联以制备由上文所述的免疫调节剂-磷脂偶联物;
[0043]
2)使近红外二区荧光分子或其衍生物与聚乙二醇偶联以制备由上文所述的聚乙二醇化光敏分子;
[0044]
3)将磷脂、步骤2)制备的聚乙二醇化化光敏分子与步骤1)制备的免疫调节剂-磷脂偶联物溶解于有机溶剂中,旋蒸除去有机溶剂形成均匀薄膜层,以缓冲溶液水化得到脂质体初乳后,通过均质机得到相应大小的空白脂质体;以及
[0045]
4)将步骤3)制备的空白脂质体置于缓冲溶液中透析建立硫酸铵梯度,并加入待负
载的肿瘤治疗药物,通过水浴加热方式将肿瘤治疗药物充分包载进入脂质体中,并通过缓冲溶液透析的方式获得负载有肿瘤治疗药物的复合脂质体。
[0046]
在具体实施方式中,在步骤3)中,所述磷脂选自大豆卵磷脂(pc)、氢化大豆卵磷脂(hspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二棕榈酰磷脂酰胆碱(dppc)、二棕榈酰磷脂酰乙醇胺(dppe)、二硬酯酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二硬脂酰磷脂酰甘油(dspg)和二月桂酰磷脂酰胆碱(dlpc)的任一种或两种以上。
[0047]
在具体实施方式中,在步骤3)中,所述有机溶剂选自二氯甲烷、三氯甲烷、甲醇、乙醇、四氢呋喃、乙腈、丙酮中的任一种或它们中任意两种以上的混合物,例如,所述溶剂为三氯甲烷和甲醇的混合溶剂。
[0048]
在具体实施方式中,在步骤3)中,所述缓冲溶液可选自氯化铵溶液、ph 3.0-8.0的磷酸缓冲液、ph 3.0-8.0的磷酸氢二钠-柠檬酸缓冲液、ph 3.0-7.0的柠檬酸-柠檬酸钠缓冲液、ph 3.0-6.0的乙酸-乙酸钠缓冲液中的任意一种。
[0049]
另一方面,本发明还提供了一种上述复合脂质体在制备用于治疗恶性肿瘤的药物中的用途。
[0050]
在具体实施方式中,所述恶性肿瘤可选自乳腺癌、宫颈癌、肝癌、胃癌、胰腺癌、卵巢癌、结肠癌或前列腺癌中的任意一种。
[0051]
有益效果
[0052]
本发明的复合脂质体可选择性地靶向肿瘤区域,通过对肿瘤区域的局部光照可激活脂质体中光敏分子产生热量,在杀死肿瘤细胞的同时改变脂质体的通透性,促进其中负载药物的释放,通过其中所负载的肿瘤治疗药物所产生的免疫原性细胞死亡效应或自噬抑制类的药物对肿瘤细胞自噬的抑制改善肿瘤免疫微环境,促进免疫调节剂的药物作用,提高肿瘤免疫治疗效果,有利于抑制肿瘤的生长增殖、及转移复发过程。
附图说明
[0053]
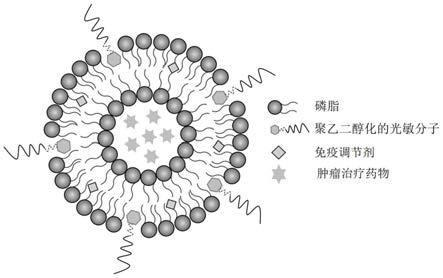
图1为本发明的复合脂质体的示意图。
[0054]
图2示出了在本发明的制备实施例3中制备的ir-1061-gplglag-peg5k的飞行时间质谱图。
[0055]
图3示出了在本发明的制备实施例4中制备的脂质体irg@jq1/dox的a)动态光散射粒径分布图及b)扫描电镜照片(图中标尺为100nm)。
[0056]
图4示出了在本发明的制备实施例4中制备的脂质体irg@jq1/dox在不同条件下jq1的释放能力图。
[0057]
图5示出了在本发明的制备实施例4中制备的脂质体irg@jq1/dox在不同强度光照下及基质金属蛋白酶2(mmp-2)存在条件下抗肿瘤细胞增殖的能力。
[0058]
图6示出了相对于对照组(生理盐水组)及其他治疗组(dox组;irg脂质体+光照组;irg@dox+光照组;irg@jq1脂质体组),在本发明的制备实施例4中制备的脂质体irg@jq1/dox在光照条件下对4t1小鼠移植瘤的生长抑制曲线。
[0059]
图7示出了相对于对照组(生理盐水组)及其他治疗组(dox组;irg脂质体+光照组;irg@dox+光照组;irg@jq1脂质体组),在本发明的制备实施例4中制备的脂质体irg@jq1/dox在光照条件下对4t1小鼠移植瘤中细胞毒性t细胞数目的影响。
具体实施方式
[0060]
以下结合附图通过具体实施例对本发明进行说明,但本发明不受这些具体实施例限定。
[0061]
以下实施例中所用试剂及仪器如下:
[0062]
实施例中所用的二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、胆固醇、棕榈酰溶血卵磷脂(p-lysopc)购自上海艾韦特拓医药科技有限公司;氨基化聚乙二醇单甲醚(mpeg-nh2,mw=5000da)购自西宝生物科技有限公司;(s)-(+)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)乙酸叔丁酯((+)-jq1),ir-1061购自西格玛奥德里奇(上海)贸易有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐、1-羟基苯并三唑、4-二甲氨基吡啶、二异丙基乙胺、三乙胺、二氯甲烷、四氢呋喃、n,n-二甲基甲酰胺、二甲亚砜购自上海百灵威科技有限公司;短肽序列甘氨酸-脯氨酸-亮氨酸-甘氨酸-亮氨酸-丙氨酸-甘氨酸(gplglag)购自上海吉尔生化有限公司。如无特殊说明,其余所用试剂和溶剂均购自国药集团(上海)化学试剂有限公司。
[0063]
4t1乳腺癌细胞购自中科院上海细胞库,细胞培养用rpim1640培养基和胎牛血清均购自gibco公司。
[0064]
4-5周龄的balb/c白鼠购自上海斯莱克实验动物有限责任公司,并通过于小鼠右背部接种体外培养的4t1乳腺癌细胞构建荷4t1肿瘤的小鼠模型。整个动物实验的操作过程均严格遵循上海药物研究所动物护理与使用委员会的相关规定。
[0065]
透射电镜照片由tecnai g2 f20 s-twin型透射电子显微镜获得。脂质体的流体力学粒径由malvern nano sizer型激光粒径测定仪测得。分离纯化由waters制备液相色谱仪(waters e2695色谱泵,xbridge c18 5μm 19*250mm色谱柱,waters 2998紫外检测器)完成。升温曲线由ai150-15-m型红外热成像仪和fc1064lnl-f-2w型激光器测得。流式实验数据由bd facs calibur流式细胞仪测得。
[0066]
如无特殊说明,所用设备及测试方法均为本领域常规的设备和方法。
[0067]
在本发明中,如无特殊说明,所用设备及测试方法均为本领域常规的设备和方法。
[0068]
制备实施例1:羧基化棕榈酰溶血卵磷脂1的合成
[0069][0070]
将p-lysopc(300mg,0.6mmol)与丁二酸酐(120mg,1.2mmol)溶于5.0ml二氯甲烷中,并向其中加入n,n-二甲氨基吡啶(150mg,1.2mmol),加热至40℃下反应36h后,旋去溶剂,并以反相柱分离羧基化棕榈酰溶血卵磷脂1(325.7mg),收率90.5%。
[0071]
制备实施例2:jq1-磷脂偶联物jpc的合成
[0072][0073]
将(s)-(+)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)乙酸叔丁酯(jq1)(200mg,0.44mmol)溶于10.0ml 40%(v/v%)三氟醋酸的二氯甲烷溶液中,室温下反应3h。反应完毕后,旋去溶剂,柱分离得化合物2(168mg),收率95.8%。
[0074]
将化合物2(160mg,0.4mmol)溶于5.0ml二氯甲烷中,并向其中加入n,n-二甲氨基吡啶(146.8mg,1.2mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(230mg,1.2mmol)与n,n-二异丙基乙胺(198.4μl,1.2mmol),冰浴下活化2h后,加入2-羟乙基二硫化物(144μl,1.2mmol),室温下反应24h。反应完毕后,旋去溶剂,柱分离得化合物3(165mg),收率77%。
[0075]
将羧基化棕榈酰溶血卵磷脂1(185mg,0.311mmol)溶于5.0ml二氯甲烷中,并向其中加入n,n-二甲氨基吡啶(114mg,0.933mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(178.9mg,0.933mmol)与n,n-二异丙基乙胺(153.8μl,0.933mmol),冰浴下活化2h后,加入化合物3(200mg,0.373mmol),室温下反应48h。反应完毕后,旋去溶剂,冰乙醚沉淀纯化得jpc(272mg),收率78.6%。
[0076]
制备实施例3:ir-1061-gplglag-peg
5k
的合成
[0077][0078]
将fmoc-gplglag(250mg,0.3mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(72.4mg,0.37mmol),1-羟基苯并三唑(51.0mg,0.37mmol)溶于2.0ml无水dmf中,室温下活化1h后,加入mpeg
5k-nh2(500mg,0.1mmol),室温下反应24h。反应完毕后,乙醇透析除去溶剂,旋干乙醇得化合物4(430mg),收率74.1%。
[0079]
将化合物4(425mg,0.073mmol)溶于5.0ml 20%(v/v%)4-甲基哌啶的无水dmf中,室温下反应24h。反应完毕后,乙醇透析除去溶剂,旋干乙醇得化合物5(370mg),收率90.2%。
[0080]
将羧酸化ir-1061(50mg,0.062mmol),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(18mg,0.093mmol),1-羟基苯并三唑(12.8mg,0.093mmol)溶于3.0ml无水dcm中,室温下活化1h后,加入化合物5(172.5mg,0.031mmol),室温下反应48h。反应完毕后,旋去溶剂,冰乙醚沉淀纯化得ir-1061-gplglag-peg
5k
(158mg),收率78.9%。图3示出了制备的ir-1061-gplglag-peg5k的飞行时间质谱图。
[0081]
制备实施例4:脂质体的制备
[0082]
将磷脂dppc 30mg及dspc 10mg,制备实施例3制得的ir-1061衍生peg化合物(下文简称irg)10mg,制备实施例2中制得的jq1-磷脂偶联物8.4mg溶解于有机溶剂(如氯仿、甲醇9:1体积比的混合溶剂)中,通过旋转蒸发除去有机溶剂并在瓶壁形成均匀薄膜层,加入硫酸铵溶液水化,水浴加热充分使其水化完全,得到脂质体初乳后,通过挤出器及滤膜得到相应大小的未包载药物的脂质体。
[0083]
将挤出后的脂质体置于缓冲溶液(ph 7.4)中透析24小时以建立硫酸铵梯度,加入相应负载药物(如多柔比星0.6~25mg),水浴加热20-40min使其充分包载进入脂质体,通过缓冲溶液透析以除去游离的药物,获得脂质体(下文称为irg@jq1/药物脂质体)。
[0084]
图1示出了本发明的复合脂质体的结构示意图。从图1中可以看出,本技术制备的复合脂质体具备这样的结构,在磷脂形成的双分子层中包载肿瘤治疗药物,同时peg改性的光敏分子和免疫调节剂-磷脂偶联物嵌在双分子层当中,这样的结构保证了免疫调节剂的有效负载,从而最大限度地发挥免疫调节剂在肿瘤治疗中的功能。
[0085]
利用动态光散射仪测定脂质体流体力学半径(图3a),透射电子显微镜照片确定其形貌(图3b)。
[0086]
如图3所示,所形成的脂质体的平均水化粒径为130nm,其透射电子显微镜照片所示平均粒径接近130nm,表明该脂质体体系具有良好物理形态。
[0087]
测试实施例1:脂质体中jq1衍生物的释放
[0088]
将制备实施例4制得的脂质体置于透析袋(3500da)中,在4种不同条件的溶出缓冲液(分别为:含0.5%吐温80的pbs(作为对照)、5.0mm谷胱甘肽(gsh)、50μg/ml基质金属蛋白酶(mmp-2)、5.0mm gsh和50μg/ml mmp-2混合液)中孵育,在37℃下摇晃。在0、0.5、1、2、4、6、8、12、24h分别收集缓冲液后,使用高效分析液相色谱计算jq1巯基衍生物的累积释放量。
[0089]
结果如图4所示,从图4中可以看出,在不存在gsh而只存在mmp-2的情况下,脂质体中的jq1磷脂衍生物不会被释放或触发还原响应,无法形成jq1巯基衍生物;而在gsh及mmp-2同时作用下,脂质体中的jq1磷脂衍生物被逐渐释放及触发还原响应,形成jq1巯基衍生物,释放率达94.0
±
0.3%。
[0090]
测试实施例2:脂质体抗肿瘤细胞增殖能力测定
[0091]
于96孔板中孵育4t1细胞24h后,将细胞与不同浓度的脂质体孵育24h。孵育完毕后,对部分细胞进行激光照射,并继续孵育4h。孵育完毕后,将细胞与mtt溶液共孵育4h。孵育完毕后,加入dmso并摇晃15分钟后,测量样品在570nm处的吸收强度,并将材料处理的细胞与未处理的细胞对照组的吸收强度归一化以计算细胞活力。
[0092]
结果如图5所示。从图5中可以看出,脂质体在不使用激光照射或mmp-2预处理的情况下,细胞毒性可忽略不计;而在照射1064nm波长的激光(2.0w/cm2,4min),mmp-2预处理的脂质体组细胞死亡超过80%,其毒性比同等照射激光但无mmp-2预处理组增加2.8倍,分析其原因为mmp-2预处理使peg脱落,进而增加细胞对脂质体的摄取。
[0093]
测试实施例3:脂质体对4t1移植瘤荷瘤鼠的肿瘤生长抑制
[0094]
于balb/c鼠右背部接种4t1细胞后,当肿瘤体积达到50mm3左右时将小鼠随机分为6组,每组6只,组别分别为生理盐水组;dox(多柔比星)组;irg脂质体+光照组;irg@dox+光照组;irg@jq1脂质体组,irg@jq1/dox脂质体+光照组,给药剂量为ir-1061 5mg/kg,jq1 15mg/kg,dox 5mg/kg。每3天给药1次,共给药3次,并在每次给药24h后对肿瘤部位进行激光照射(2.0w/cm2,4min)。每两天记录一次肿瘤的体积。其中,对于上述irg脂质体组中的irg脂质体,除了不加入免疫调节剂-磷脂偶联物和省去负载药物的步骤以外,按照制备实施例4中相同的方法制备;对于上述irg@dox+光照组中的irg@dox,除了不加入免疫调节剂-磷脂偶联物以外,按照制备实施例4中相同的方法制备;对于上述irg@jq1脂质体组中的irg@jq1脂质体,除了省去负载药物的步骤以外,按照制备实施例4中相同的方法制备。
[0095]
测试结果如图6所示。从图6可以看出,本技术制备的包含jq1-磷脂偶联物以及peg化的光敏分子并负载dox药物的脂质体在激光照射条件下相对于其他组别显示出明显改善抑制肿瘤生长的作用。
[0096]
测试实施例4:脂质体对4t1移植瘤荷瘤鼠的肿瘤中细胞毒性t细胞数量的影响
[0097]
于balb/c鼠右背部接种4t1细胞后,当肿瘤体积达到50mm3左右时将小鼠随机分为6组,每组6只,组别分别为生理盐水组;dox组;irg脂质体+光照组;irg@dox+光照组;irg@jq1脂质体组,irg@jq1/dox脂质体+光照组,给药剂量为ir-1061 5mg/kg,jq1 15mg/kg,dox 5mg/kg。每3天给药1次,共给药2次,并在每次给药24h后对肿瘤部位进行激光照射(2.0w/cm2,4min)。测试结果如图7所示。
[0098]
从图7可以看出,本技术制备的包含jq1-磷脂偶联物以及peg化的光敏分子并负载dox药物的脂质体在激光照射条件下相对于其他组别显示出明显提高细胞毒性t细胞数量的作用,从而证明了本技术的脂质体与游离药物(dox组)、仅包含改性光敏分子的脂质体(irg脂质体组)、未负载肿瘤治疗药物的脂质体(irg@jq1脂质体组)以及未包含免疫调节剂-磷脂偶联物的脂质体(irg@dox+光照组)相比,具有显著提高抗肿瘤效果的作用。
[0099]
总结上述结果,证实了本发明制备的包含免疫调节剂并有效包载肿瘤治疗药物的光敏复合脂质体可以显著提高现有肿瘤药物的治疗效果,并且由于脂质体的载运作用以及光敏分子的作用,可以有效克服现有肿瘤治疗药物的副作用,体现出了良好的靶向治疗效果。
[0100]
另外,除了肿瘤治疗药物以外,还可将本技术的脂质体包载需要靶向治疗的其他药物,从而将其应用领域扩展到其他需要靶向治疗的应用中。
