双环化合物
交叉引用
1.本技术要求2019年4月16日提交的第62/834,671号美国临时专利申请的权益,该临时申请通过引用整体并入本文。
背景技术:
2.yap和taz是hippo途径网络的转录共激活物,并且调节细胞增殖、迁移和凋亡。对hippo途径的抑制促进yap/taz易位至细胞核,其中yap/taz与转录增强子缔合域(tead)转录因子相互作用,并共激活靶基因的表达且促进细胞增殖。yap和taz的过度活化和/或hippo途径网络的一个或多个成员的突变与许多癌症有关。本文描述了与hippo途径网络的一个或多个成员相关的抑制剂,如yap/taz的抑制剂或调节yap/taz与tead之间相互作用的抑制剂。
技术实现要素:
3.本文提供了双环化合物和包含所述化合物的药物组合物。在一些实施方案中,本发明化合物可用于治疗癌症。
4.在一方面,本公开提供了式(i)化合物,或其药学上可接受的盐其中,每个x1、x4、x5和x6独立地为n或cr
x
;每个x2和x3独立地为n或cry;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个ry独立地为氢、卤素、硝基、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
5.在一方面,本公开提供了式(ii)化合物,或其药学上可接受的盐:其中,每个x1、x2、x3、x4、x5和x6独立地为n或cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;
r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
6.在一方面,本公开提供了式(iii)化合物,或其药学上可接受的盐:其中,每个x3、x5和x6独立地为n或cr
x
;x4为cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;
r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
7.本文涉及以上针对各个变量描述的基团的任意组合。在整篇说明书中,基团及其取代基由本领域技术人员选择,以提供稳定的部分和化合物。
8.在另一方面,本公开提供了一种化合物或其药学上可接受的盐,其中所述化合物是来自表1的化合物,或其药学上可接受的盐。
9.在一些实施方案中,本文公开的化合物表现出不超过10μm的ic
50
。
10.在一些实施方案中,本文公开的化合物表现出不超过3μm的ic
50
。
11.在另一方面,本公开提供了一种药物组合物,其包含药学上可接受的赋形剂和本文公开的化合物或其药学上可接受的盐。
12.在另一方面,本公开提供了一种治疗有需要的受试者的癌症的方法,其包括施用治疗有效量的本文公开的化合物或其药学上可接受的盐。援引并入
13.本说明书提到的所有出版物、专利和专利申请均通过引用并入本文,其程度如同特别地且单独地指出其中每一个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
14.在所附权利要求书中详细阐明了本公开的各个方面。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细说明和附图,将会对本发明的特征和优点获得更好的理解,在这些附图中:
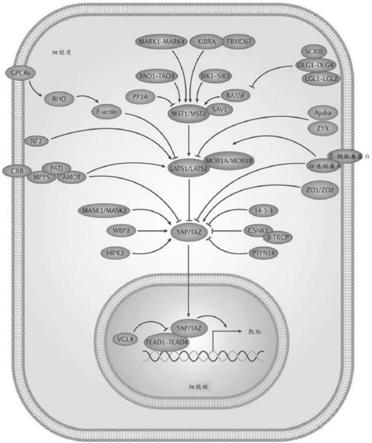
15.图1示出了hippo信号传导网络的示意图。深灰色阴影的hippo途径成分表示抑制yap/taz活性的成分。浅灰色阴影的hippo途径成分表示促进yap/taz活性的成分。尖箭头和钝箭头分别表示激活和抑制相互作用。缩写:α-cat(α-连环蛋白),ajub(ajuba),amot(血管动蛋白(angiomotin)),β-trcp(含β-转导重复序列的蛋白质),ck1(酪蛋白激酶1),crb(crumbs),e-cad(e-钙粘着蛋白),ex(扩展的),gpcr(g蛋白偶联受体),hipk(同源域相互作用蛋白激酶),kibra(肾脏大脑),lats(大肿瘤抑制物),lgl(幼虫巨大致死性基因),mask
(多锚蛋白单kh),mer(膜突样蛋白(merlin)),mob(mps one结合物),mst(哺乳动物不育20样),pals(与lin-7相关的蛋白质),patj(与pals1相关的紧密连接蛋白),pp2a(蛋白磷酸酶2a),ptpn14(蛋白酪氨酸磷酸酶非受体14型),rassf(ras相关因子),sav(salvador),scrib(scribble),sik(盐诱导型激酶),tao(一千零一个氨基酸的蛋白质),taz(具有pdz结合基序的转录共激活物),tead(tea域蛋白),vgl4(vestigial-样4),wbp2(ww域结合蛋白2),yap(yes相关蛋白),zo(闭锁小带),zyx(斑联蛋白)。
16.图2示出了由gα蛋白调节的hippo信号传导途径的示意图。
具体实施方式
某些术语
17.除非另外定义,否则本文中使用的所有技术和科学术语与所请求保护的主题所属领域的技术人员所一般了解的含义相同。应当理解,前面的一般性描述和下面的详细描述仅是示例性的和说明性的,并不是对所请求保护的任何主题的限制。在本技术中,除非另有特别说明,否则单数形式的使用包括复数形式。必须指出,除非上下文另有明确说明,否则本说明书和所附权利要求书中使用的单数形式“一个”、“一种”和“该”包括复数形式的指示物。在本技术中,除非另有说明,否则“或”的使用意为“和/或”。此外,术语“包括”以及其他形式如“包含”、“含有”和“具有”的使用不是限制性的。
18.如本文所用的,在一些实施方案中,范围和量表示为“约”特定值或范围。约还包括确切的量。因此,“约5μl”意指“约5μl”,并且还指“5μl”。通常,术语“约”包括预期在实验误差内的量。
19.本文所用的章节标题仅用于组织结构的目的,而不应理解为限制所描述的主题。
20.如本文所用的,术语“个体”、“受试者”和“患者”表示任何哺乳动物。在一些实施方案中,该哺乳动物是人。在一些实施方案中,该哺乳动物是非人哺乳动物。这些术语都不需要或受限于以卫生保健工作者(例如,医生、注册护士、从业护士、医师助理、护理员或临终关怀医院工作人员)的监护(例如,长期性或间歇性)为特征的情形。
21.如在本说明书及所附权利要求书中所使用的,除非指出意思相反,否则下列术语具有以下所述的含义。
[0022]“氨基”是指
–
nh2基团。
[0023]“氰基”是指-cn基团。
[0024]“羟基”是指-oh基团。
[0025]“硝基”是指-no2基团。
[0026]“氧杂”是指-o-基团。
[0027]“氧代”是指=o基团。
[0028]“硫代”是指=s基团。
[0029]“亚氨基”是指=n-h基团。
[0030]“肟基”是指=n-oh基团。
[0031]“烷基”是指仅由碳原子和氢原子组成、不含不饱和度、具有1至15个碳原子(例如,c
1-c
15
烷基)的直链或支链的烃链基团。在某些实施方案中,烷基包含1至13个碳原子(例如,c
1-c
13
烷基)。在某些实施方案中,烷基包含1至8个碳原子(例如,c
1-c8烷基)。在其他实施方
案中,烷基包含1至5个碳原子(例如,c
1-c5烷基)。在其他实施方案中,烷基包含1至4个碳原子(例如,c
1-c4烷基)。在其他实施方案中,烷基包含1至3个碳原子(例如,c
1-c3烷基)。在其他实施方案中,烷基包含1至2个碳原子(例如,c
1-c2烷基)。在其他实施方案中,烷基包含一个碳原子(例如,c1烷基)。在其他实施方案中,烷基包含5至15个碳原子(例如,c
5-c
15
烷基)。在其他实施方案中,烷基包含5至8个碳原子(例如,c
5-c8烷基)。在其他实施方案中,烷基包含2至5碳原子(例如,c
2-c5烷基)。在其他实施方案中,烷基包含3至5个碳原子(例如,c
3-c5烷基)。在其他实施方案中,该烷基选自甲基、乙基、1-丙基(正丙基)、1-甲基乙基(异丙基)、1-丁基(正丁基)、1-甲基丙基(仲丁基)、2-甲基丙基(异丁基)、1,1-二甲基乙基(叔丁基)、1-戊基(正戊基)。该烷基通过单键与分子的其余部分连接。除非在本说明书中另有特别说明,否则烷基任选地被以下取代基中的一个或多个所取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基(oximo)、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)orf、-oc(o)-nrarf、-n(ra)c(o)rf、-n(ra)s(o)
t
rf(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
rf(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,并且每个rf独立地为烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基。
[0032]“氨基-烷基”是指下式的基团:-烷基-nh2。
[0033]“羟基-烷基”是指下式的基团:-烷基-oh。
[0034]“烷氧基”是指式-o-烷基的通过氧原子键合的基团,其中烷基为如上定义的烷基链。
[0035]“烯基”是指仅由碳原子和氢原子组成、含有至少一个碳碳双键且具有2至12个碳原子的直链或支链的烃链基团。在某些实施方案中,烯基包含2至8个碳原子。在其他实施方案中,烯基包含2至4个碳原子。该烯基通过单键与分子的其余部分连接,例如,乙烯基、丙-1-烯基(即烯丙基)、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。除非在本说明书中另有特别说明,否则烯基任选地被以下取代基中的一个或多个所取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)orf、-oc(o)-nrarf、-n(ra)c(o)rf、-n(ra)s(o)
t
rf(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
rf(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,并且每个rf独立地为烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基。
[0036]“炔基”是指仅由碳原子和氢原子组成、含有至少一个碳碳三键、具有2至12个碳原子的直链或支链的烃链基团。在某些实施方案中,炔基包含2至8个碳原子。在其他一些实施方案中,炔基具有2至4个碳原子。该炔基通过单键与分子的其余部分连接,例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基等。除非在本说明书中另有特别说明,否则炔基任选地被以下取代基中的一个或多个所取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)orf、-oc(o)-nrarf、-n(ra)c(o)rf、-n(ra)s(o)
t
rf(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
rf(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、碳环基、
碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,并且每个rf独立地为烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基。
[0037]“亚烷基”或“亚烷基链”指连接分子的其余部分与基团的直链或支链二价烃链,其仅由碳和氢组成,不包含不饱和度并具有1至12个碳原子,例如,亚甲基、亚乙基、亚丙基、亚正丁基等。亚烷基链通过单键与分子的其余部分连接并通过单键与基团连接。在一些实施方案中,亚烷基链与分子的其余部分以及与基团的连接点是通过亚烷基链中的一个碳或通过该链内的任意两个碳。在某些实施方案中,亚烷基包含1至8个碳原子(例如,c
1-c8亚烷基)。在其他实施方案中,亚烷基包含1至5个碳原子(例如,c
1-c5亚烷基)。在其他实施方案中,亚烷基包含1至4个碳原子(例如,c
1-c4亚烷基)。在其他实施方案中,亚烷基包含1至3个碳原子(例如,c
1-c3亚烷基)。在其他实施方案中,亚烷基包含1至2个碳原子(例如,c
1-c2亚烷基)。在其他实施方案中,亚烷基包含1个碳原子(例如,c1亚烷基)。在其他实施方案中,亚烷基包含5至8个碳原子(例如,c
5-c8亚烷基)。在其他实施方案中,亚烷基包含2至5个碳原子(例如,c
2-c5亚烷基)。在其他实施方案中,亚烷基包含3至5个碳原子(例如,c
3-c5亚烷基)。除非在本说明书中另有特别说明,否则亚烷基链任选地被以下取代基中的一个或多个所取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基(oximo)、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)orf、-oc(o)-nrarf、-n(ra)c(o)rf、-n(ra)s(o)
t
rf(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
rf(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,并且每个rf独立地为烷基、氟烷基、碳环基、碳环基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基。
[0038]“芳基”是指通过从环碳原子上去除氢原子而由芳族单环或多环烃环体系衍生的基团。芳族单环或多环烃环体系仅包含氢和来自5至18个碳原子的碳,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔(h
ü
ckel)理论包含环状、离域的(4n+2)π-电子体系。衍生出芳基的环系包括但不限于诸如苯、芴、茚满、茚、四氢化萘和萘等基团。除非在本说明书中另有特别说明,否则术语“芳基”或前缀“芳
‑”
(如在“芳烷基”中)意在包括任选地被一个或多个独立地选自以下的取代基所取代的芳基基团:烷基、烯基、炔基、卤代、氟烷基、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-cn、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、环烷基、环烷基烷基、芳基(任选地被一个或多个卤代基团所取代)、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个均为未取代的。
[0039]“芳基氧基”是指式
–
o-芳基的通过氧原子键合的基团,其中芳基如上文所定义。
[0040]“芳烷基”是指式-r
c-芳基的基团,其中rc为如上文所定义的亚烷基链,例如,亚甲
基、亚乙基等。芳烷基基团的亚烷基链部分如上文针对亚烷基链所述任选地被取代。芳烷基基团的芳基部分如上文针对芳基所述任选地被取代。
[0041]“芳烯基”是指式
–rd-芳基的基团,其中rd为如上文所定义的亚烯基链。芳烯基基团的芳基部分如上文针对芳基所述任选地被取代。芳烯基基团的亚烯基链部分如上文针对亚烯基所定义的任选地被取代。
[0042]“芳炔基”是指式-r
e-芳基的基团,其中re为如上文所定义的亚炔基链。芳炔基基团的芳基部分如上文针对芳基所述任选地被取代。芳炔基基团的亚炔基链部分如上文针对亚炔基链所定义的任选地被取代。
[0043]“碳环基”是指仅由碳和氢原子组成的稳定的非芳族单环或多环烃基团,并且在一些实施方案中包括稠环或桥环体系,具有3至15个碳原子。在某些实施方案中,碳环基包含3至10个碳原子。在其他实施方案中,碳环基包含5至7个碳原子。该碳环基通过单键与分子的其余部分连接。在一些实施方案中,碳环基是饱和的(即仅包含单一c-c键)或不饱和的(即含有一个或多个双键或三键)。完全饱和的碳环基基团还被称为“环烷基”。单环环烷基的实例包括,例如,环丙基、环丁基、环戊基、环己基、环庚基和环辛基。在某些实施方案中,环烷基包含3至8个碳原子(例如,c
3-c8环烷基)。在其他实施方案中,环烷基包含3至7个碳原子(例如,c
3-c7环烷基)。在其他实施方案中,环烷基包含3至6个碳原子(例如,c
3-c6环烷基)。在其他实施方案中,环烷基包含3至5个碳原子(例如,c
3-c5环烷基)。在其他实施方案中,环烷基包含3至4个碳原子(例如,c
3-c4环烷基)。不饱和的碳环基还被称为“环烯基”。单环环烯基的实例包括,例如,环戊烯基、环己烯基、环庚烯基和环辛烯基。多环碳环基基团包括,例如,金刚烷基、降冰片基(即,双环[2.2.1]庚烷基)、降冰片烯基、十氢萘基、7,7-二甲基-双环[2.2.1]庚烷基等。除非在本说明书中另有特别说明,否则术语“碳环基”意在包括任选地被一个或多个独立地选自以下的取代基所取代的碳环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-cn、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、环烷基、环烷基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个均为未取代的。
[0044]“碳环基烷基”是指式
–rc-碳环基的基团,其中rc为如上文所定义的亚烷基链。该亚烷基链和碳环基基团如上文所定义的任选地被取代。
[0045]“卤代”或“卤素”是指溴代、氯代、氟代或碘代取代基。
[0046]“氟烷基”是指被一个或多个如上定义的氟代基团所取代的如上定义的烷基基团,例如,三氟甲基、二氟甲基、氟甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基等。在一些实施方案中,氟烷基基团的烷基部分如以上针对烷基所述任选地被取代。
[0047]“杂环基”或“杂环”是指稳定的3至18元非芳族环基团,其包含2至12个碳原子和1
至6个选自氮、氧和硫的杂原子。除非在说明书中另有明确说明,否则杂环基基团是单环、双环、三环或四环的环系,在一些实施方案中,其包括稠合或桥连的环系。杂环基中的杂原子任选地被氧化。如果存在一个或多个氮原子,其任选地被季铵化。杂环基基团是部分或完全饱和的。在一些实施方案中,杂环基通过环中的任何原子与该分子的其余部分连接。在一些实施方案中,杂环基是饱和的(即仅含有单键)或不饱和的(即含有一个或多个双键或三键)。完全饱和的杂环基也称作“杂环烷基”。这类杂环基基团的实例包括但不限于二氧戊环基、噻吩基[1,3]二噻烷基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三噻烷基、四氢吡喃基、硫代吗啉基、硫杂吗啉基、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在本说明书中另有特别说明,否则术语“杂环基”意在包括任选地被一个或多个选自以下的取代基所取代的如上定义的杂环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-cn、-r
b-cn、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、环烷基、环烷基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,每个rb独立地为直接键或者直链或支链亚烷基或亚烯基链,并且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中每个上述取代基均是未取代的。
[0048]“杂烷基”是指如上定义的烷基,其中该烷基的一个或多个骨架原子选自除碳以外的原子,例如,氧、氮(例如-nh-、-n(烷基)-)、硫或其组合。杂烷基在该杂烷基的碳原子处与该分子的其余部分连接。在一个方面,该杂烷基是c
1-c6杂烷基。在一些实施方案中,该杂烷基包含1、2或3个杂原子。在一些实施方案中,该杂烷基基团的烷基部分如针对烷基所述任选地被取代。代表性的杂烷基包括但不限于-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2oh、-ch2och3、-ch2ch2nh2、-ch2ch2nhch3、-ch2ch2n(ch3)2、-ch2ch2oh、-ch2ch2och3、-ch2ch2och2ch2nh2或-ch2ch2och2ch2oh。
[0049]“杂环基烷基”是指式-r
c-杂环基的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮杂环基,则该杂环基任选地在该氮原子处与烷基基团连接。该杂环基烷基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。该杂环基烷基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0050]“杂环基烷氧基”是指式-o-rc杂环基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮杂环基,则该杂环基任选地在该氮原子处与烷基基团连接。该杂环基烷氧基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。该杂环基烷氧基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0051]“杂芳基”是指由包含2至17个碳原子以及1至6个选自氮、氧和硫的杂原子的3至18元芳环基团衍生的基团。如本文所用的,在一些实施方案中,杂芳基基团是单环、双环、三环
或四环环系,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔(h
ü
ckel)理论包含环状、离域的(4n+2)π
–
电子体系。杂芳基包括稠合或桥连的环系。杂芳基基团中的杂原子任选地被氧化。如果存在一个或多个氮原子,其任选地被季铵化。杂芳基通过环中的任何原子与分子的其余部分连接。在一些实施方案中,杂芳基在环中含有1-4个n原子。在一些实施方案中,杂芳基在环中含有4-6个n原子。在一些实施方案中,杂芳基在环中含有0-4个n原子、0-1个o原子和0-1个s原子。在一些实施方案中,该杂芳基为单环杂芳基。在一些实施方案中,该单环杂芳基为5元或6元杂芳基。在一些实施方案中,杂芳基为c
1-c9杂芳基。在一些实施方案中,单环杂芳基为c
1-c5杂芳基。在一些实施方案中,双环杂芳基为c
5-c9杂芳基。杂芳基的实例包括但不限于氮杂基、吖啶基、苯并咪唑基、苯并吲哚基、1,3-苯并二氧戊环基、苯并呋喃基、苯并噁唑基、苯并[d]噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂基、苯并[b][1,4]噁嗪基、1,4-苯并二噁烷基、苯并萘并呋喃基(benzonaphthofuranyl)、苯并噁唑基、苯并二氧戊环基、苯并二噁英基(benzodioxinyl)、苯并吡喃基、苯并吡喃酮基(benzopyranonyl)、苯并呋喃基、苯并呋喃酮基(benzofuranonyl)、苯并噻吩基(benzothienyl)(benzothiophenyl)、苯并噻吩并[3,2-d]嘧啶基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、环戊并[d]嘧啶基、6,7-二氢-5h-环戊并[4,5]噻吩并[2,3-d]嘧啶基、5,6-二氢苯并[h]喹唑啉基、5,6-二氢苯并[h]噌啉基、6,7-二氢-5h-苯并[6,7]环庚并[1,2-c]哒嗪基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、呋喃并[3,2-c]吡啶基、5,6,7,8,9,10-六氢环辛并[d]嘧啶基、5,6,7,8,9,10-六氢环辛并[d]哒嗪基、5,6,7,8,9,10-六氢环辛并[d]吡啶基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、二氢吲哚基、异二氢吲哚基、异喹啉基、吲嗪基、异噁唑基、5,8-甲桥-5,6,7,8-四氢喹唑啉基、萘啶基、1,6-萘啶酮基(1,6-naphthyridinonyl)、噁二唑基、2-氧代氮杂基、噁唑基、环氧乙烷基、5,6,6a,7,8,9,10,10a-八氢苯并[h]喹唑啉基、1-苯基-1h-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡唑并[3,4-d]嘧啶基、吡啶基、吡啶并[3,2-d]嘧啶基、吡啶并[3,4-d]嘧啶基、吡嗪基、嘧啶基、哒嗪基、吡咯基、喹唑啉基、喹喔啉基、喹啉基、异喹啉基、四氢喹啉基、5,6,7,8-四氢喹唑啉基、5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶基、6,7,8,9-四氢-5h-环庚并[4,5]噻吩并[2,3-d]嘧啶基、5,6,7,8-四氢吡啶并[4,5-c]哒嗪基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基、噻吩并[2,3-d]嘧啶基、噻吩并[3,2-d]嘧啶基、噻吩并[2,3-c]吡啶基和噻吩基(thiophenyl)(即噻吩基(thienyl))。除非在本说明书中另有特别说明,否则术语“杂芳基”意在包括任选地被一个或多个选自以下的取代基所取代的如上定义的杂芳基基团:烷基、烯基、炔基、卤代、氟烷基、卤代烯基、卤代炔基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基、氟烷基、环烷基、环烷基烷基、芳基、芳烷基、杂环基、杂环基烷基、杂芳基或杂芳基烷基,每个rb独立地为直接键或者直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上
述取代基中的每一个均为未取代的。
[0052]“n-杂芳基”是指含有至少一个氮的如上定义的杂芳基基团,并且其中该杂芳基基团与该分子的其余部分的连接点是通过该杂芳基基团中的氮原子。n-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0053]“c-杂芳基”是指如上所定义的杂芳基,其中该杂芳基基团与该分子的其余部分的连接点是通过该杂芳基基团中的碳原子。c-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0054]“杂芳基氧基”是指式
–
o-杂芳基的通过氧原子键合的基团,其中杂芳基如上文所定义。
[0055]“杂芳基烷基”是指式
–rc-杂芳基的基团,其中rc为如上定义的亚烷基链。如果杂芳基为含氮的杂芳基,则该杂芳基任选地在该氮原子处与烷基基团连接。杂芳基烷基基团的亚烷基链如上文针对亚烷基链所定义的任选地被取代。杂芳基烷基基团的杂芳基部分如上文针对杂芳基所定义的任选地被取代。
[0056]“杂芳基烷氧基”是指式
–
o-r
c-杂芳基的通过氧原子键合的基团,其中rc为如上定义的亚烷基链。如果杂芳基为含氮的杂芳基,则该杂芳基任选地在该氮原子处与烷基基团连接。杂芳基烷氧基基团的亚烷基链如上文针对亚烷基链所定义的任选地被取代。杂芳基烷氧基基团的杂芳基部分如上文针对杂芳基所定义的任选地被取代。
[0057]
在一些实施方案中,本文公开的化合物含有一个或多个不对称中心,并因此产生对映异构体、非对映异构体以及根据绝对立体化学被定义为(r)-或(s)-的其他立体异构形式。除非另有说明,否则本发明意在涵盖本文公开的化合物的所有立体异构形式。当本文所述的化合物含有烯烃双键时,除非另有说明,否则本发明意在同时包括e和z几何异构体(例如,顺式或反式)。同样,还意在包括所有可能的异构体,以及其外消旋形式和光学纯形式,和所有互变异构形式。术语“几何异构体”是指烯烃双键的e或z几何异构体(例如,顺式或反式)。术语“位置异构体”是指围绕中心环的结构异构体,如围绕苯环的邻位、间位和对位异构体。
[0058]“互变异构体”是指这样的分子,其中质子从分子的一个原子移动到同一分子的另一原子是可能的。在某些实施方案中,本文提出的化合物作为互变异构体存在。在可能发生互变异构化的情形下,将存在互变异构体的化学平衡。互补异构体的确切比例取决于若干因素,包括物理状态、温度、溶剂和ph。互变异构平衡的一些实例包括:
[0059]“可选的”或“任选地”意指随后描述的事件或情形可能发生或可能不发生,并意指该描述包括该事件或情形发生的情况和其没有发生的情况。例如,“任选取代的芳基”意指芳基基团可能被取代或可能未被取代,并意指该描述包括取代的芳基基团和没有取代的芳基基团。
[0060]“药学上可接受的盐”包括酸加成盐和碱加成盐。任一种本文所述化合物的药学上可接受的盐意在包括任意的和所有的药学上合适的盐形式。本文所述化合物的药学上可接受的盐任选地是药学上可接受的酸加成盐和药学上可接受的碱加成盐。
[0061]“药学上可接受的酸加成盐”是指保留了游离碱的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的,并且其是用诸如盐酸、氢溴酸、硫酸、硝酸、磷酸、氢碘酸、氢氟酸、亚磷酸等无机酸形成的。还包括用如下有机酸形成的盐:诸如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基链烷酸、链烷二酸、芳族酸、脂肪族和芳香族磺酸等,并且包括例如乙酸、三氟乙酸、丙酸、羟基乙酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。因此,示例性的盐包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、三氟乙酸盐、丙酸盐、辛酸盐、异丁酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、扁桃酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、邻苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、苯乙酸盐、柠檬酸盐、乳酸盐、苹果酸盐、酒石酸盐、甲磺酸盐等。还涉及氨基酸的盐如精氨酸盐、葡糖酸盐和半乳糖醛酸盐(参见,例如,berge s.m等人,"pharmaceutical salts,"journal of pharmaceutical science,66:1-19(1997),其通过引用整体并入本文)。在一些实施方案中,碱性化合物的酸加成盐通过按照熟练技术人员熟悉的方法和技术使其游离碱形式与足量的所需酸接触以产生盐来制备。
[0062]“药学上可接受的碱加成盐”是指保留了游离酸的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的。这些盐是通过向游离酸中加入无机碱或有机碱而制备的。在一些实施方案中,药学上可接受的碱加成盐用金属或胺如碱金属和碱土金属或有机胺形成。源于有机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。源于有机碱的盐包括但不限于下列有机碱的盐:伯胺、仲胺和叔胺,取
代的胺(包括天然存在的取代的胺),环胺和碱离子交换树脂,例如,异丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、二乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、n,n-二苄基乙二胺、氯普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、乙二胺、亚乙基二苯胺、n-甲基葡糖胺、葡糖胺、甲基葡糖胺、可可碱(theobromine)、嘌呤、哌嗪、哌啶、n-乙基哌啶、聚胺树脂等。参见berge等人,同上。
[0063]
如本文所用的,“治疗”或“处理”或“减轻”或“改善”在本文中可互换使用。这些术语是指获得有益的或期望的结果(包括但不限于治疗益处和/或预防益处)的途径。所谓“治疗益处”是指所治疗的潜在病症的消除或改善。另外,治疗益处也可以如下实现:一种或多种与该潜在病症相关的生理学症状得到根除或改善,使得在患者中观察到起色,虽然在一些实施方案中该患者受该潜在病症的折磨。对于预防益处,在一些实施方案中,将所述组合物施用于处于发生特定疾病的风险中的患者,或报告疾病的一种或多种生理学症状的患者,即便尚未作出该疾病的诊断。
[0064]“前药”意在表示在生理条件下或通过溶剂分解转化为本文所述的生物活性化合物的化合物。因此,术语“前药”是指药学上可接受的生物活性化合物的前体。在一些实施方案中,前药当施用于受试者时是无活性的,而在体内例如通过水解转化为活性化合物。前药化合物在哺乳动物生物体中通常具有溶解性、组织相容性或延迟释放的优点(参见,例如,bundgard,h.,design of prodrugs(1985),pp.7-9,21-24(elsevier,amsterdam))。
[0065]
关于前药的讨论在higuchi,t.等人,“pro-drugs as novel delivery systems,”a.c.s.symposium series,vol.14和bioreversible carriers in drug design,ed.edward b.roche,american pharmaceutical association and pergamon press,1987中提供,两者均通过引用完全并入本文。
[0066]
术语“前药”也意在包括任何共价键合的载体,当这样的前药施用于哺乳动物受试者时,该载体在体内释放活性化合物。在一些实施方案中,如本文所述,活性化合物的前药通过以某种方式修饰在该活性化合物中存在的官能团来制备,该方式使得该修饰在常规操作中或在体内裂解成母体活性化合物。前药包括其中羟基、氨基或巯基键合到任何基团上的化合物,当将活性化合物的前药施用于哺乳动物受试者时,该任何基团裂解以分别形成游离羟基、游离氨基或游离巯基。前药的实例包括但不限于活性化合物中的醇或胺官能团的乙酸酯、甲酸酯和苯甲酸酯衍生物,等等。化合物
[0067]
在一些实施方案中,本文公开的化合物是双环化合物。
[0068]
在一方面,本公开提供了式(i)化合物,或其药学上可接受的盐c10
环烷基或-nh2;且n为0、1、2、3或4。
[0069]
对于式(i)化合物的任何和所有实施方案,取代基选自所列出的备选物的子集。例如,在一些实施方案中,x1为n或cr
x
。在其他实施方案中,x1为n。在一些实施方案中,x1为cr
x
。
[0070]
在一些实施方案中,x1为cr
x
;且每个x2和x3为cry。在一些实施方案中,x1为n;且每个x2和x3为cry。在一些实施方案中,x1为cr
x
;x2为cry;且x3为n。
[0071]
在一些实施方案中,每个x4、x5和x6为cr
x
。在一些实施方案中,x4为n;且每个x5和x6为cr
x
。在一些实施方案中,每个x4和x5为cr
x
;且x6为n。
[0072]
在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0073]
在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f或-och3。在一些实施方案中,每个r
x
为氢。
[0074]
在一些实施方案中,每个ry独立地为氢、卤素、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷
基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。在一些实施方案中,每个ry独立地为氢、卤素、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0075]
在一些实施方案中,每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。在一些实施方案中,每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个ry独立地为氢、f、cl或-ch3。在一些实施方案中,每个ry独立地为氢或f。在一些实施方案中,每个ry为氢。
[0076]
在一些实施方案中,r1为取代或未取代的c
1-c6烷基。
[0077]
在一些实施方案中,r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或-cn所取代的c
1-c6烷基。
[0078]
在一些实施方案中,r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0079]
在一些实施方案中,r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0080]
在一些实施方案中,r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0081]
在一些实施方案中,r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0082]
在一些实施方案中,r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0083]
在一些实施方案中,r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c3-c7杂环烷基。
[0084]
在一些实施方案中,r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。
[0085]
在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0086]
在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自该5元杂芳基环选自该5元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或
未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0087]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2或3个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。在一些实施方案中,r1为被取代或未取代的吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被2-吡啶基所取代的c
1-c6烷基。
[0088]
在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自该6元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0089]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0090]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0091]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选自取代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并
吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0092]
在一些实施方案中,r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自基环选自基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0093]
在一些实施方案中,r1为被1、2或3个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、nhch3、n(ch3)2和吡啶基。在一些实施方案中,r1为被1或2个取代基
och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。在一些实施方案中,每个r2独立地为f、cl、-cn、-och3、-ocf3、-c(=o)och3、-ch3或-cf3。在一些实施方案中,每个r2独立地为f、cl、-ocf3或-cf3。在一些实施方案中,每个r2独立地为f或cl。
[0101]
在一些实施方案中,n为0。在一些实施方案中,n为1。在一些实施方案中,n为2。在一些实施方案中,n为3。在一些实施方案中,n为4。在一些实施方案中,n为0或1。在一些实施方案中,n为1或2。在一些实施方案中,n为2或3。在一些实施方案中,n为3或4。在一些实施方案中,n为1、2或3。在一些实施方案中,n为2、3或4。在一些实施方案中,n为1、2、3或4。
[0102]
在一方面,本公开提供了式(i)化合物,或其药学上可接受的盐其中,每个x1、x4、x5和x6独立地为cr
x
;每个x2和x3独立地为cry;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c6环烷基;每个ry独立地为氢、卤素、硝基、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c6环烷基;r为卤素、硝基、-cn或c
1-c4氟烷基;r1为取代或未取代的c
1-c6烷基或者取代或未取代的c
3-c
10
环烷基;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c6环烷基;每个r3独立地为氢或取代或未取代的c
1-c6烷基;且n为0、1、2、3或4。
[0103]
在一些实施方案中,每个r
x
独立地为氢、f、cl、br、-ch3、-ch2ch3、-oh、-och3、-och2ch3、-ocf3、-ocf2ch3或-och2cf3。在一些实施方案中,每个x1、x4、x5和x6为ch。在一些实施方案中,每个ry独立地为氢、f、cl、br、-ch3、-ch2ch3。在一些实施方案中,每个x2和x3为ch。在一些实施方案中,r1为取代或未取代的c
1-c6烷基。在一些实施方案中,r1为-ch3、-ch2ch3、-ch2ch2ch3、-ch(ch3)2、-ch2ch2ch2ch3、-ch(ch3)ch2ch3、-ch2ch(ch3)2或-c(ch3)3。在一些实施
ch(och3)ch3。在一些实施方案中,r1为-ch2ch2ch2och3。在一些实施方案中,r1为-ch2ch(och3)ch3。在一些实施方案中,r1为-ch(och3)ch2ch3。在一些实施方案中,r1为-ch(ch3)ch2och3。在一些实施方案中,r1为-c(ch3)2och3。在一些实施方案中,r1为被杂芳基所取代的c
1-c6烷基。在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基的6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被吡啶基所取代的c
1-c6烷基。在一些实施方案中,该吡啶基为2-吡啶基。在一些实施方案中,r为f、cl或-cf3。在一些实施方案中,r为f。在一些实施方案中,r为cl。在一些实施方案中,r为-cf3。在一些实施方案中,每个r2独立地为f、cl、-ocf3或-cf3。在一些实施方案中,每个r2独立地为f或cl。在一些实施方案中,n为0。在一些实施方案中,n为1。在一些实施方案中,n为2。在一些实施方案中,n为1或2。
[0104]
在一方面,本公开提供了式(ii)化合物,或其药学上可接受的盐:其中,每个x1、x2、x3、x4、x5和x6独立地为n或cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代
或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
[0105]
对于式(ii)化合物的任何和所有实施方案,取代基选自所列出的备选物的子集。例如,在一些实施方案中,x1为n或cr
x
。在其他实施方案中,x1为n。在一些实施方案中,x1为cr
x
。
[0106]
在一些实施方案中,每个x1、x2和x3为cr
x
。在一些实施方案中,x1为n;且每个x2和x3为cr
x
。在一些实施方案中,每个x1和x2为cr
x
;且x3为n。
[0107]
在一些实施方案中,每个x4、x5和x6为cr
x
。在一些实施方案中,x4为n;且每个x5和x6为cr
x
。在一些实施方案中,每个x4和x5为cr
x
;且x6为n。
[0108]
在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0109]
在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为
氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f或-och3。在一些实施方案中,每个r
x
为氢。
[0110]
在一些实施方案中,r1为取代或未取代的c
1-c6烷基。
[0111]
在一些实施方案中,r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或-cn所取代的c
1-c6烷基。
[0112]
在一些实施方案中,r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0113]
在一些实施方案中,r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0114]
在一些实施方案中,r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0115]
在一些实施方案中,r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0116]
在一些实施方案中,r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0117]
在一些实施方案中,r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0118]
在一些实施方案中,r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。
[0119]
在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0120]
在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自
其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0121]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2或3个氮原子
的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基的6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被2-吡啶基所取代的c
1-c6烷基。
[0122]
在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自该6元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0123]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0124]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自
;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0125]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选自取代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0126]
在一些实施方案中,r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自基环选自基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0127]
在一些实施方案中,r1为被1、2或3个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、nhch3、n(ch3)2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、nhch3、n(ch3)2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh和吡啶
基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-nh2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh和-nh2。在一些实施方案中,r1为被-oh取代的c
1-c6烷基。在一些实施方案中,r1为被-nh2取代的c
1-c6烷基。
[0128]
在一些实施方案中,每个rz独立地为氢、f、cl、br、-ch3、-ch2ch3、-ch2f、-chf2、-cf3、-cn、-oh、-och3、-och2ch3、-ocf3、-nh2、-nhch3或-n(ch3)2。在一些实施方案中,每个rz独立地为氢、f、cl、br、-ch3、-cn、-och3、-nh2、-nhch3或-n(ch3)2。在一些实施方案中,每个rz独立地为氢、cl、br、-ch3、-och3、-nh2或-n(ch3)2。在一些实施方案中,每个rz为氢。
[0129]
在一些实施方案中,r1为被卤素、-cn、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-c(=o)or3、-c(=o)n(r3)2、-cr3=c(r3)2、-c≡cr3、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、或者取代或未取代的芳基所取代的c
1-c6烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0130]
在一些实施方案中,r1为取代或未取代的c
3-c
10
环烷基或者取代或未取代的c
2-c
10
杂环烷基。在一些实施方案中,r1为被c
1-c6烷基、苯基、吡啶基、吡嗪基、嘧啶基、哒嗪基或三嗪基所取代的c
3-c6环烷基或c
3-c5杂环烷基。在一些实施方案中,r1为被c
1-c6烷基、苯基或吡啶基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0131]
在一些实施方案中,r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0132]
在一些实施方案中,r为f、cl、br、i、硝基、-cn、-och2f、-ochf2、-ocf3、-c(=o)ch3、-c(=o)och
3-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-ch2f、-chf2或-cf3。在一些实施方案中,r为f、cl、-cn、-ocf3、-chf2或-cf3。在一些实施方案中,r为f、cl、-ocf3、-chf2或-cf3。在一些实施方案中,r为f、cl或-cf3。在一些实施方案中,r为-ocf3。在一些实施方案中,r为-cf3。
[0133]
在一些实施方案中,每个r2独立地为卤素、硝基、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0134]
在一些实施方案中,每个r2独立地为f、cl、br、硝基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。在一些实施方案中,每个r2独立地为f、cl、-cn、-och3、-ocf3、-c
(=o)och3、-ch3或-cf3。在一些实施方案中,每个r2独立地为f、cl、-ocf3或-cf3。在一些实施方案中,每个r2独立地为f或cl。
[0135]
在一些实施方案中,n为0。在一些实施方案中,n为1。在一些实施方案中,n为2。在一些实施方案中,n为3。在一些实施方案中,n为4。在一些实施方案中,n为0或1。在一些实施方案中,n为1或2。在一些实施方案中,n为2或3。在一些实施方案中,n为3或4。在一些实施方案中,n为1、2或3。在一些实施方案中,n为2、3或4。在一些实施方案中,n为1、2、3或4。
[0136]
在一方面,本公开提供了式(iii)化合物,或其药学上可接受的盐:其中,每个x3、x5和x6独立地为n或cr
x
;x4为cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;
r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
[0137]
对于式(iii)化合物的任何和所有实施方案,取代基选自所列出的备选物的子集。例如,在一些实施方案中,x5为n或cr
x
。在其他实施方案中,x5为n。在一些实施方案中,x5为cr
x
。
[0138]
在一些实施方案中,x3为cr
x
。在一些实施方案中,x3为n。
[0139]
在一些实施方案中,每个x5和x6为cr
x
。在一些实施方案中,x5为n;且x6为cr
x
。在一些实施方案中,x5为cr
x
;且x6为n。
[0140]
在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0141]
在一些实施方案中,每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0142]
在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。在一些实施方案中,每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。在一些实施方案中,每个r
x
独立地为氢、f或-och3。在一些实施方案中,每个r
x
为氢。
[0143]
在一些实施方案中,r1为取代或未取代的c
1-c6烷基。
[0144]
在一些实施方案中,r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基
或-cn所取代的c
1-c6烷基。
[0145]
在一些实施方案中,r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0146]
在一些实施方案中,r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0147]
在一些实施方案中,r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0148]
在一些实施方案中,r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0149]
在一些实施方案中,r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0150]
在一些实施方案中,r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0151]
在一些实施方案中,r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0152]
在一些实施方案中,r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自
其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0153]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2或3个氮原子
的单环6元杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。在一些实施方案中,r1为被取代或未取代的吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被吡啶基所取代的c
1-c6烷基。在一些实施方案中,r1为被2-吡啶基所取代的c
1-c6烷基。
[0154]
在一些实施方案中,r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自该6元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0155]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0156]
在一些实施方案中,r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自
;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0157]
在一些实施方案中,r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。在一些实施方案中,r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选自取代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0158]
在一些实施方案中,r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0159]
在一些实施方案中,r1为被1、2或3个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、nhch3、n(ch3)2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、nhch3、n(ch3)2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh和吡啶
基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-nh2和吡啶基。在一些实施方案中,r1为被1或2个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh和-nh2。在一些实施方案中,r1为被-oh所取代的c
1-c6烷基。在一些实施方案中,r1为被-nh2所取代的c
1-c6烷基。
[0160]
在一些实施方案中,每个rz独立地为氢、f、cl、br、-ch3、-ch2ch3、-ch2f、-chf2、-cf3、-cn、-oh、-och3、-och2ch3、-ocf3、-nh2、-nhch3或-n(ch3)2。在一些实施方案中,每个rz独立地为氢、f、cl、br、-ch3、-cn、-och3、-nh2、-nhch3或-n(ch3)2。在一些实施方案中,每个rz独立地为氢、cl、br、-ch3、-och3、-nh2或-n(ch3)2。在一些实施方案中,每个rz为氢。
[0161]
在一些实施方案中,r1为被卤素、-cn、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-c(=o)or3、-c(=o)n(r3)2、-cr3=c(r3)2、-c≡cr3、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、或者取代或未取代的芳基所取代的c
1-c6烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0162]
在一些实施方案中,r1为取代或未取代的c
3-c
10
环烷基或者取代或未取代的c
2-c
10
杂环烷基。在一些实施方案中,r1为被c
1-c6烷基、苯基、吡啶基、吡嗪基、嘧啶基、哒嗪基或三嗪基所取代的c
3-c6环烷基或c
3-c5杂环烷基。在一些实施方案中,r1为被c
1-c6烷基、苯基或吡啶基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0163]
在一些实施方案中,r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0164]
在一些实施方案中,r为f、cl、br、i、硝基、-cn、-och2f、-ochf2、-ocf3、-c(=o)ch3、-c(=o)och
3-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-ch2f、-chf2或-cf3。在一些实施方案中,r为f、cl、-cn、-ocf3、-chf2或-cf3。在一些实施方案中,r为f、cl、-ocf3、-chf2或-cf3。在一些实施方案中,r为f、cl或-cf3。在一些实施方案中,r为-ocf3。在一些实施方案中,r为-cf3。
[0165]
在一些实施方案中,每个r2独立地为卤素、硝基、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0166]
在一些实施方案中,每个r2独立地为f、cl、br、硝基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。在一些实施方案中,每个r2独立地为f、cl、-cn、-och3、-ocf3、-c
(=o)och3、-ch3或-cf3。在一些实施方案中,每个r2独立地为f、cl、-ocf3或-cf3。在一些实施方案中,每个r2独立地为f或cl。
[0167]
在一些实施方案中,n为0。在一些实施方案中,n为1。在一些实施方案中,n为2。在一些实施方案中,n为3。在一些实施方案中,n为4。在一些实施方案中,n为0或1。在一些实施方案中,n为1或2。在一些实施方案中,n为2或3。在一些实施方案中,n为3或4。在一些实施方案中,n为1、2或3。在一些实施方案中,n为2、3或4。在一些实施方案中,n为1、2、3或4。
[0168]
在一方面,本公开提供了一种化合物或其药学上可接受的盐,其中所述化合物是来自表1的化合物,或其药学上可接受的盐。表1
化合物的制备
[0169]
在本文所述的反应中使用的化合物根据本领域技术人员已知的有机合成技术,从可商购获得的化学品和/或从化学文献中描述的化合物开始进行制备。“可商购获得的化学品”获自标准商业来源,包括acros organics(pittsburgh,pa)、aldrich chemical(milwaukee,wi,包括sigma chemical和fluka)、apin chemicals ltd.(milton park,uk)、avocado research(lancashire,u.k.)、bdh inc.(toronto,canada)、bionet(cornwall,u.k.)、chemservice inc.(west chester,pa)、crescent chemical co.(hauppauge,ny)、eastman organic chemicals,eastman kodak company(rochester,ny)、fisher scientific co.(pittsburgh,pa)、fisons chemicals(leicestershire,uk)、frontier scientific(logan,ut)、icn biomedicals,inc.(costa mesa,ca)、key organics(cornwall,u.k.)、lancaster synthesis(windham,nh)、maybridge chemical co.ltd.(cornwall,u.k.)、parish chemical co.(orem,ut)、pfaltz&bauer,inc.(waterbury,cn)、
polyorganix(houston,tx)、pierce chemical co.(rockford,il)、riedel de haen ag(hanover,germany)、spectrum quality product,inc.(new brunswick,nj)、tci america(portland,or)、trans world chemicals,inc.(rockville,md)和wako chemicals usa,inc.(richmond,va)。
[0170]
本领域普通技术人员已知的方法通过各种参考书和数据库来确定。详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的合适的参考书籍和论文包括,例如,"synthetic organic chemistry",john wiley&sons,inc.,new york;s.r.sandler等人,"organic functional group preparations,"第2版,academic press,new york,1983;h.o.house,"modern synthetic reactions",第2版,w.a.benjamin,inc.menlo park,calif.1972;t.l.gilchrist,"heterocyclic chemistry",第2版,john wiley&sons,new york,1992;j.march,"advanced organic chemistry:reactions,mechanisms and structure",第4版,wiley-interscience,new york,1992。详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的其他合适的参考书籍和论文包括,例如,fuhrhop,j.和penzlin g."organic synthesis:concepts,methods,starting materials",第二次修订增补版(second,revised and enlarged edition)(1994)john wiley&sons isbn:3-527-29074-5;hoffman,r.v."organic chemistry,an intermediate text"(1996)oxford university press,isbn 0-19-509618-5;larock,r.c."comprehensive organic transformations:a guide to functional group preparations"第2版(1999)wiley-vch,isbn:0-471-19031-4;march,j."advanced organic chemistry:reactions,mechanisms,and structure"第4版(1992)john wiley&sons,isbn:0-471-60180-2;otera,j.(编者)"modern carbonyl chemistry"(2000)wiley-vch,isbn:3-527-29871-1;patai,s."patai's 1992guide to the chemistry of functional groups"(1992)interscience isbn:0-471-93022-9;solomons,t.w.g."organic chemistry"第7版(2000)john wiley&sons,isbn:0-471-19095-0;stowell,j.c.,"intermediate organic chemistry"第2版(1993)wiley-interscience,isbn:0-471-57456-2;"industrial organic chemicals:starting materials and intermediates:an ullmann's encyclopedia"(1999)john wiley&sons,isbn:3-527-29645-x,8卷;"organic reactions"(1942-2000)john wiley&sons,超过55卷;以及"chemistry of functional groups"john wiley&sons,73卷。
[0171]
在一些情况下,特定的和类似的反应物通过由美国化学学会(american chemical society)的化学文摘服务(chemical abstract service)编制的已知化学品索引来确定,该索引可从大多数公共图书馆和大学图书馆以及通过在线数据库(联系美国化学学会(washington,d.c)以获得更多细节)获得。目录中的已知但不可商购获得的化学品由定制化学合成室(houses)制备,其中许多标准化学供应室(例如,上文列出的那些)提供定制合成服务。针对本文所述化合物的药用盐的制备和选择的参考文献是p.h.stahl和c.g.wermuth"handbook of pharmaceutical salts",verlag helvetica chimica acta,zurich,2002。
[0172]
在一些实施方案中,本文公开的化合物如实施例部分所述制备。化合物的其他形式
异构体
[0173]
此外,在一些实施方案中,本文所述的化合物作为几何异构体存在。在一些实施方案中,本文所述的化合物具有一个或多个双键。本文提出的化合物包括所有的顺式、反式、顺、反、entgegen(e)和zusammen(z)异构体及其相应的混合物。在一些情况下,化合物作为互变异构体存在。本文所述的化合物包括在本文所述的通式内的所有可能的互变异构体。在一些情况下,本文所述的化合物具有一个或多个手性中心,并且每个中心以r构型或s构型存在。本文所述的化合物包括所有的非对映异构、对映异构和差向异构形式,及其相应的混合物。在本文提供的化合物和方法的其他实施方案中,由单个制备步骤、组合或相互转化产生的对映异构体和/或非对映异构体的混合物对于本文所述的应用是有用的。在一些实施方案中,通过使化合物的外消旋混合物与旋光性拆分剂反应以形成一对非对映异构化合物,分离非对映异构体并回收光学纯的对映异构体,从而将本文所述的化合物制备成其单独的立体异构体。在一些实施方案中,本文公开了可分离的复合物(例如,结晶非对映异构体盐)。在一些实施方案中,非对映异构体具有不同的物理性质(例如,熔点、沸点、溶解度、反应性等)并通过利用这些不相似性来分离。在一些实施方案中,非对映异构体通过手性色谱法,或者优选地通过基于溶解度差异的分离/拆分技术来分离。在一些实施方案中,随后通过不会导致外消旋化的任何实用手段,连同拆分剂一起回收光学纯的对映异构体。标记的化合物
[0174]
在一些实施方案中,本文所述的化合物以其同位素标记的形式存在。在一些实施方案中,本文公开的方法包括通过施用此类同位素标记的化合物治疗疾病的方法。在一些实施方案中,本文公开的方法包括通过以药物组合物形式施用此类同位素标记的化合物治疗疾病的方法。因此,在一些实施方案中,本文公开的化合物包括同位素标记的化合物,除了一个或多个原子被原子质量或质量数与自然中通常发现的原子质量或质量数不同的原子所替代外,该同位素标记的化合物与本文所列举的那些化合物相同。在一些实施方案中,掺入本公开的化合物中的同位素的实例包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,诸如分别为2h、3h、
13
c、
14
c、
l5
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f和
36
cl。含有以上提到的同位素和/或其他原子的其他同位素的本文所述化合物及其代谢物、药学上可接受的盐、酯、前药、溶剂化物、水合物或衍生物均在本公开的范围内。某些同位素标记的化合物,例如其中掺入了放射性同位素如3h和
14
c的那些化合物在药物和/或底物组织分布测定中是有用的。氚(即3h)和碳-14(即,
14
c)同位素由于其易于制备和可检测性而是特别优选的。此外,由于更好的代谢稳定性,例如,延长的体内半衰期或降低的剂量需求,使得用重同位素(如氘,即2h)取代产生了某些治疗优势。在一些实施方案中,通过任何合适的方法制备同位素标记的化合物、其药学上可接受的盐、酯、前药、溶剂化物、水合物或衍生物。
[0175]
在一些实施方案中,本文所述的化合物通过其他手段进行标记,该手段包括但不限于使用发色团或荧光部分、生物发光标记物或化学发光标记物。药学上可接受的盐
[0176]
在一些实施方案中,本文所述的化合物作为其药学上可接受的盐存在。在一些实施方案中,本文公开的方法包括通过施用此类药学上可接受的盐治疗疾病的方法。在一些实施方案中,本文公开的方法包括通过以药物组合物的形式施用此类药学上可接受的盐来治疗疾病的方法。
[0177]
在一些实施方案中,本文所述的化合物具有酸性或碱性基团,因此与一些无机或有机碱以及无机和有机酸中的任意碱或酸反应,以形成药学上可接受的盐。在一些实施方案中,这些盐在本公开的化合物的最终分离和纯化期间原位制备,或通过使处于游离形式的经纯化的化合物分别与合适的酸或碱反应并分离由此形成的盐来制备。溶剂化物
[0178]
在一些实施方案中,本文所述的化合物作为溶剂化物存在。本公开提供了通过施用此类溶剂化物治疗疾病的方法。本公开进一步提供了通过以药物组合物的形式施用此类溶剂化物治疗疾病的方法。
[0179]
溶剂化物含有化学计量或非化学计量的量的溶剂,并且在一些实施方案中,溶剂化物在与药学上可接受的溶剂如水、乙醇等结晶的过程中形成。当溶剂为水时形成水合物,或者当溶剂为醇时形成醇化物。在一些实施方案中,本文所述化合物的溶剂化物在本文所述的过程中方便地制备或形成。仅举例而言,本文所述化合物的水合物通过采用包括但不限于二氧杂环己烷、四氢呋喃或甲醇的有机溶剂,从水性/有机溶剂混合物中重结晶而方便地制备。在一些实施方案中,本文提供的化合物以非溶剂化形式以及溶剂化形式存在。通常,对于本文提供的化合物和方法而言,溶剂化形式被认为等同于非溶剂化形式。前药
[0180]
在一些实施方案中,本文描述的化合物以前药形式存在。本公开提供了通过施用这类前药来治疗疾病的方法。本公开还提供了通过以药物组合物形式施用这类前药来治疗疾病的方法。
[0181]
在一些实施方案中,前药包括其中氨基酸残基或两个或更多个(例如,两个、三个或四个)氨基酸残基的多肽链通过酰胺键或酯键共价连接至本公开的化合物的游离氨基、羟基或羧酸基团的化合物。氨基酸残基包括但不限于20种天然存在的氨基酸,还包括4-羟基脯氨酸、羟赖氨酸、锁链赖氨酸(demosine)、异锁链赖氨酸(isodemosine)、3-甲基组氨酸、正缬氨酸、β-丙氨酸、γ-氨基丁酸、瓜氨酸(cirtulline)、高半胱氨酸、高丝氨酸、鸟氨酸和甲硫氨酸砜。在其他实施方案中,前药包括其中核酸残基或两个或更多个(例如,两个、三个或四个)核酸残基的寡核苷酸与本公开的化合物共价连接的化合物。
[0182]
本文所述化合物的药学上可接受的前药包括但不限于酯、碳酸酯、硫代碳酸酯、n-酰基衍生物、n-酰氧基烷基衍生物、叔胺的季铵衍生物、n-曼尼希碱、席夫碱、氨基酸缀合物、金属盐和磺酸酯。在一些实施方案中,具有游离氨基、酰胺基、羟基或羧基的化合物被转化为前药。例如,游离羧基被衍生为酰胺或烷基酯。在某些情况下,所有这些前药部分都包含基团,包括但不限于醚、胺和羧酸官能团。
[0183]
羟基前药包括酯,例如但不限于酰氧基烷基(例如酰氧基甲基、酰氧基乙基)酯、烷氧羰基氧基烷基酯、烷基酯、芳基酯、磺酸酯、硫酸酯和含二硫化物的酯、醚、酰胺、氨基甲酸酯、半琥珀酸酯、二甲基氨基乙酸酯和磷酰氧基甲氧羰基,如advanced drug delivery reviews 1996,19,115中所概述的。
[0184]
胺衍生的前药包括但不限于以下基团和基团的组合:
以及磺酰胺类和膦酰胺类。
[0185]
在某些情况下,任何芳环部分上的位点易发生各种代谢反应,因此在芳环结构上引入适当的取代基能减少、最小化或消除该代谢途径。代谢物
[0186]
在一些实施方案中,本文所述的化合物易受多种代谢反应的影响。因此,在一些实施方案中,向结构中引入合适的取代基将减少、最小化或消除代谢途径。在特定的实施方案中,仅举例而言,用于减少或消除芳香环对代谢反应的敏感性的合适的取代基为卤素或烷基。
[0187]
在另外的或进一步的实施方案中,本文所述的化合物在施用于有需要的生物体时被代谢以产生代谢物,该代谢物随后用于产生期望的效果,包括期望的治疗效果。药物组合物
[0188]
在某些实施方案中,如本文所述的化合物作为纯化学品施用。在其他实施方案中,本文所述的化合物与药学上合适的或可接受的载体(本文中也为药学上合适的(或可接受的)赋形剂,生理学上合适的(或可接受的)赋形剂,或生理学上合适的(或可接受的)载体)组合,该载体是基于选定的给药途径和例如在remington:the science and practice of pharmacy(gennaro,第21版.mack pub.co.,easton,pa(2005))中描述的标准药学实践而选择的,该文献的公开内容通过引用整体并入本文。
[0189]
因此,本文提供了一种药物组合物,其包含至少一种本文所述的化合物,或其立体异构体、药学上可接受的盐、水合物、溶剂化物或n-氧化物,以及一种或多种药学上可接受的载体。如果该载体与该组合物的其他成分相容并且对该组合物的接受者(即,受试者)无害,则该载体(或赋形剂)是可接受的或合适的。
[0190]
一个实施方案提供了包含药学上可接受的载体和式(i)、式(ii)或式(iii)化合物或其药学上可接受的盐的药物组合物。
[0191]
另一个实施方案提供了基本上由药学上可接受的载体和式(i)、式(ii)或式(iii)化合物或其药学上可接受的盐组成的药物组合物。
[0192]
在某些实施方案中,如本文所述的化合物是基本上纯的,因为其含有少于约5%,或少于约1%,或少于约0.1%的其他有机小分子,如例如在合成方法的一个或多个步骤中产生的掺杂中间体或副产物。
[0193]
这些制剂包括适于口服、直肠、局部、颊部、肠胃外(例如,皮下、肌肉内、皮内或静脉内)、直肠、阴道或气雾剂给药的制剂,但在任何给定情况下最合适的给药形式将取决于正在治疗的病况的程度和严重性以及所使用的具体化合物的性质。例如,公开的组合物被
配制成单位剂量和/或配制用于口服或皮下给药。
[0194]
在一些情况下,示例性的药物组合物以药物制品的形式使用,例如以固体、半固体或液体形式使用,其中包含作为活性成分的、与适于外部、肠内或肠胃外应用的有机或无机载体或赋形剂混合的一种或多种公开的化合物。在一些实施方案中,该活性成分与例如通常无毒的、药学上可接受的载体复合,其用于片剂、丸剂、胶囊、栓剂、溶液、乳剂、悬浮液以及适合应用的其他任何形式。药物组合物内包含其量足以对疾病的过程或状况产生期望的效果的活性目标化合物。
[0195]
在一些情况下,为了制备固体组合物如片剂,将主要的活性成分与药物载体(例如常规的片剂成分,如玉米淀粉、乳糖、蔗糖、山梨醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶)和其他药物稀释剂(例如水)混合,以形成包含公开的化合物或其无毒的药学上可接受的盐的均匀混合物的固体预制剂组合物。当提及这些预制剂组合物为均匀时,意指将活性成分均匀地分散在整个组合物中,以使该组合物容易地细分成等效的单位剂型,如片剂、丸剂和胶囊。
[0196]
在用于口服给药的固体剂型(胶囊、片剂、丸剂、糖锭剂、粉末、颗粒等)中,本发明的组合物与一种或多种药学上可接受的载体如柠檬酸钠或磷酸二钙和/或以下任何物质相混合:(1)填充剂或增充剂,如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和/或硅酸;(2)粘合剂,例如,羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和/或阿拉伯胶;(3)保湿剂,如甘油;(4)崩解剂,如琼脂、碳酸钙、马铃薯或木薯淀粉、藻酸、某些硅酸盐和碳酸钠;(5)溶解阻滞剂,如石蜡;(6)吸收加速剂,如季铵化合物;(7)润湿剂,例如,鲸蜡醇和单硬脂酸甘油酯;(8)吸收剂,如高岭土和膨润土;(9)润滑剂,如滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、月桂基硫酸钠及其混合物;和(10)着色剂。在一些实施方案中,在胶囊、片剂和丸剂的情况下,该组合物还包含缓冲剂。还采用相似类型的固体组合物作为使用诸如乳糖或奶糖以及高分子量聚乙二醇等赋形剂的软和硬填充明胶胶囊中的填充剂。
[0197]
在一些情况下,片剂通过任选地与一种或多种辅助成分一起压制或模制而制成。压制的片剂使用粘合剂(例如,明胶或羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,羟乙酸淀粉钠或交联羧甲基纤维素钠)、表面活性剂或分散剂来制备。模制的片剂通过在合适的机器中对用惰性液体稀释剂润湿的本组合物的混合物进行模制来制备。任选地对片剂和其他固体剂型如糖锭剂、胶囊、丸剂和颗粒剂进行刻痕或采用包衣和壳如药物配制领域公知的肠溶衣和其他包衣来制备。
[0198]
用于吸入或吹入的组合物包括在药学上可接受的水性或有机溶剂或其混合物中的溶液和悬浮液以及粉剂。用于口服给药的液体剂型包括药学上可接受的乳剂、微乳剂、溶液、悬浮液、糖浆和酏剂。除了本发明的组合物之外,所述液体剂型还任选地含有本领域常用的惰性稀释剂,例如,水或其他溶剂、增溶剂和乳化剂,例如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油(特别是棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢呋喃醇、聚乙二醇和失水山梨醇的脂肪酸酯、环糊精及其混合物。
[0199]
除了本发明的组合物之外,悬浮液还任选地含有悬浮剂,例如,乙氧基化异硬脂醇、聚氧乙烯山梨醇和失水山梨醇酯、微晶纤维素、偏氢氧化铝(aluminum metahydroxide)、膨润土、琼脂和黄蓍胶及其混合物。
[0200]
在一些实施方案中,用于直肠或阴道给药的制剂以栓剂呈现,其通过混合本发明的组合物与一种或多种合适的非刺激性赋形剂或载体(包括,例如,可可脂、聚乙二醇、栓剂蜡或水杨酸盐)来制备,且其在室温下为固体,而在体温下为液体,从而将在体腔内熔融并释放活性剂。
[0201]
本发明组合物用于经皮给药的剂型包括粉剂、喷雾剂、软膏、糊剂、乳膏、洗剂、凝胶、溶液、贴剂和吸入剂。活性成分任选地在无菌条件下与药学上可接受的载体混合,并且在一些实施方案中与需要的任何防腐剂、缓冲液或推进剂混合。
[0202]
在一些实施方案中,除本发明的组合物外,软膏、糊剂、乳膏和凝胶还含有赋形剂,如动物和植物脂肪、油、蜡、石蜡、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、硅氧烷、膨润土、硅酸、滑石和氧化锌,或其混合物。
[0203]
在一些实施方案中,除本发明的组合物外,粉末和喷雾剂还含有赋形剂,如乳糖、滑石、硅酸、氢氧化铝、硅酸钙和聚酰胺粉末,或这些物质的混合物。喷雾剂另外含有常规的推进剂,如氯氟烃和挥发性的未取代烃,如丁烷和丙烷。
[0204]
或者,本文公开的组合物和化合物通过气雾剂来施用。这是通过制备含有该化合物的水性气雾剂、脂质体制品或固体颗粒来实现的。可使用非水性(例如碳氟化合物推进剂)悬浮液。在一些实施方案中,使用声波喷雾器,因为它们使得药剂暴露于剪切力(这导致包含在本发明组合物中的化合物降解)最小化。通常,通过将本发明组合物的水性溶液或悬浮液与常规的药学上可接受的载体和稳定剂一起配制来制备水性气雾剂。载体和稳定剂随特定目标组合物的要求而变化,但通常包括非离子表面活性剂(吐温、普郎尼克(pluronics)或聚乙二醇)、无毒的蛋白质如血清白蛋白、失水山梨醇酯、油酸、卵磷脂、氨基酸如甘氨酸、缓冲液、盐、糖或糖醇。气雾剂通常由等渗溶液来制备。
[0205]
适合于肠胃外给药的药物组合物包含与一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散液、悬浮液或乳剂或无菌粉末组合的本发明组合物,该无菌粉末在临使用前被重建成无菌可注射溶液或分散液,其任选地含有抗氧化剂、缓冲液、抑菌剂、使制剂与预期接受者的血液等渗的溶质或悬浮剂或增稠剂。
[0206]
在药物组合物中使用的合适的水性和非水性载体的实例包括水、乙醇、多元醇(如甘油、丙二醇、聚乙二醇等),及其合适的混合物、植物油如橄榄油,以及可注射的有机酯如油酸乙酯和环糊精。在一些实施方案中,例如,通过使用包衣材料,如卵磷脂,在分散液的情况下通过维持所需要的粒径,以及通过使用表面活性剂,保持适当的流动性。
[0207]
还涉及包含所公开的化合物和肠溶性材料及其药学上可接受的载体或赋形剂的肠溶药物制剂。肠溶性材料是指在胃的酸性环境中基本上不溶,而在特定ph的肠液中基本可溶的聚合物。小肠是胃和大肠之间的胃肠道(肠)的部分,并包括十二指肠、空肠和回肠。十二指肠的ph约为5.5,空肠的ph约为6.5,而远端回肠的ph约为7.5。相应地,肠溶性材料不是可溶性的,例如,直至ph为约5.0、约5.2、约5.4、约5.6、约5.8、约6.0、约6.2、约6.4、约6.6、约6.8、约7.0、约7.2、约7.4、约7.6、约7.8、约8.0、约8.2、约8.4、约8.6、约8.8、约9.0、约9.2、约9.4、约9.6、约9.8或约10.0。示例性的肠溶性材料包括乙酸纤维素邻苯二甲酸酯(cap)、羟丙基甲基纤维素邻苯二甲酸酯(hpmcp)、聚乙酸乙烯邻苯二甲酸酯(pvap)、乙酸羟丙基甲基纤维素琥珀酸酯(hpmcas)、乙酸纤维素偏苯三酸酯、羟丙基甲基纤维素琥珀酸酯、乙酸纤维素琥珀酸酯、乙酸纤维素六氢邻苯二甲酸酯、丙酸纤维素邻苯二甲酸酯、乙酸纤维
素马来酸酯、乙酸纤维素丁酸酯、乙酸纤维素丙酸酯、甲基甲基丙烯酸和甲基丙烯酸甲酯的共聚物、丙烯酸甲酯、甲基丙烯酸甲酯和甲基丙烯酸的共聚物、甲基乙烯基醚和马来酸酐的共聚物(gantrez es系列)、甲基丙烯酸乙酯-甲基丙烯酸甲酯-氯三甲基铵丙烯酸乙酯共聚物,天然树脂,如玉米蛋白、虫胶和柯巴脂(copal collophorium),以及几种可商购获得的肠溶分散系统(例如,eudragit l30d55、eudragit fs30d、eudragit l100、eudragit s100、kollicoat emm30d、estacryl 30d、coateric和aquateric)。上述各材料的溶解性或者是已知的或者是在体外容易确定的。前述内容是可能的材料的列表,但是受益于本公开的本领域技术人员将认识到其并不全面,并且有其他肠溶材料满足本公开的目的。
[0208]
在一些实施方案中,包含至少一种本文所述化合物的组合物的剂量根据患者(例如,人)的状况,即疾病的阶段、一般健康状态、年龄以及医学领域技术人员用来确定剂量的其他因素而不同。
[0209]
在一些情况下,药物组合物以医学领域技术人员所确定的适合于待治疗(或预防)的疾病的方式施用。适当的剂量和合适的给药持续时间和频率将取决于诸如患者的状况、患者疾病的类型和严重程度、活性成分的特定形式和给药方法等因素。通常,适当的剂量和治疗方案以足以提供治疗和/或预防益处(例如,改善的临床结果,例如更频繁的完全或部分缓解,或更长的无疾病和/或总体存活时间,或症状严重程度的减轻)的量提供组合物。通常使用实验模型和/或临床试验确定最佳剂量。在一些实施方案中,最佳剂量取决于患者的身体质量、体重或血容量。
[0210]
在一些实施方案中,口服剂量一般在约1.0mg至约1000mg的范围内,每天一至四次或更多次。hippo信号传导网络
[0211]
hippo信号传导网络(也称为salvador/warts/hippo(swh)途径)是细胞增殖、死亡和分化的主要调节物。在一些实施方案中,hippo信号传导途径的主要功能是负调节转录共激活物yes相关蛋白(yap)及其旁系同源物,具有pdz结合基序的转录共激活物(taz;也称为wwtr1)(图1)。hippo激酶级联通过促进yap/taz的细胞质保留和降解来磷酸化并抑制yap/taz,从而抑制在yap/taz控制下调节的生长促进功能。在未磷酸化/去磷酸化的状态下,yap(也称为yap1或yap65)与taz一起被转运到细胞核中,在其中它们与tead转录因子家族相互作用,从而上调促进增殖和迁移的基因,并抑制凋亡。在一些情况下,参与增殖、迁移和抗凋亡的这些基因的失调上调导致癌症的发展。在一些情况下,yap/taz的过表达与癌症有关。
[0212]
hippo信号传导途径的其他核心成员分别包括丝氨酸/苏氨酸激酶mst1/2(果蝇中hippo/hpo的同源物)、lats1/2(warts/wts的同源物)及其衔接蛋白sav1(salvador/sav的同源物)和mob(mobkl1a和mobkl1b;mats的同源物)(图1)。通常,mst1/2激酶与支架蛋白sav1复合,后者又磷酸化并激活lats1/2激酶。lats1/2也被支架蛋白mob激活。然后,活化的lats1/2使yap或其旁系同源物taz磷酸化并失活。yap/taz的磷酸化导致它们的核输出、在细胞质内的保留以及被泛素蛋白酶体系统的降解。
[0213]
在一些情况下,lats1/2使yap在[hxrxxs]共有基序处磷酸化。yap包含五个[hxrxxs]共有基序,其中x表示任何氨基酸残基。在一些情况下,lats1/2使yap在一个或多个共有基序处磷酸化。在一些情况下,lats1/2使yap在所有五个共有基序处磷酸化。在一些情况下,lats1/2在s127氨基酸位置处磷酸化。yap s127的磷酸化促进14-3-3蛋白结合,并
导致yap的细胞质隔离。yap在s127位置处的突变由此破坏其与14-3-3的相互作用,随后促进核易位。
[0214]
另外的磷酸化发生在yap的s381氨基酸位置处。yap在s381位置处和taz中相应位点上的磷酸化引发这两种蛋白质由降解基序中的ck1δ/ε引起的进一步磷酸化事件,然后发出与β-trcp e3泛素连接酶相互作用的信号,从而导致yap的多泛素化和降解。
[0215]
在一些情况下,lats1/2使taz在[hxrxxs]共有基序处磷酸化。taz包含四个[hxrxxs]共有基序,其中x表示任何氨基酸残基。在一些情况下,lats1/2使taz在一个或多个共有基序处磷酸化。在一些情况下,lats1/2使taz在所有四个共有基序处磷酸化。在一些情况下,lats1/2在s89氨基酸位置处磷酸化。taz s89的磷酸化促进14-3-3蛋白结合,并导致taz的细胞质隔离。taz在s89位置处的突变由此破坏其与14-3-3的相互作用,随后促进核易位。
[0216]
在一些实施方案中,磷酸化的yap/taz在细胞质中积累,并经历scf
β-trcp
介导的泛素化和随后的蛋白酶体降解。在一些情况下,含有skp、cullin、f-box的复合物(scf复合物)是包含f-box家族成员蛋白质(例如cdc4)、skp1(一种桥接蛋白质)和rbx1(其含有与e2-泛素缀合酶相互作用的小ring finger域)的多蛋白质e3泛素连接酶复合物。在一些情况下,f-box家族包含超过40个成员,其中示例性成员包括含有f-box/wd重复序列的蛋白1a(fbxw1a、βtrcp1、fbxw1、hsslimb、plkappabalpha-e3受体亚单位)和s期激酶相关蛋白2(skp2)。在一些实施方案中,scf复合物(例如scf
βtrcp1
)与e1泛素激活酶和e2泛素缀合酶相互作用,以催化泛素转移至yap/taz底物。示例性的e1泛素激活酶包括由以下基因编码的酶:uba1、uba2、uba3、uba5、uba5、uba7、atg7、nae1和sae1。示例性的e2泛素缀合酶包括由以下基因编码的酶:ube2a、ube2b、ube2c、ube2d1、ube2d2、ube2d3、ube2e1、ube2e2、ube2e3、ube2f、ube2g1、ube2g2、ube2h、ube2i、ube2j1、ube2j2、ube2k、ube2l3、ube2l6、ube2m、ube2n、ube2o、ube2q1、ube2q2、ube2r1、ube2r2、ube2s、ube2t、ube2u、ube2v1、ube2v2、ube2z、atg2、birc5和ufc1。在一些实施方案中,泛素化的yap/taz进一步经历通过26s蛋白酶体的降解过程。
[0217]
在一些实施方案中,hippo途径由几个不同家族的调节物在上游调节(图1)。在一些情况下,hippo途径受g蛋白及其偶联受体、crumbs复合物、mst激酶上游的调节物和粘着连接点的调节。yap/taz与tead的相互作用
[0218]
在一些实施方案中,未磷酸化和/或去磷酸化的yap/taz在细胞核中积累。在细胞核内,yap/taz与tead家族的转录因子(例如tead1、tead2、tead3或tead4)相互作用,以激活参与抗凋亡和增殖的基因,例如ctfg、cyr61和fgf1。
[0219]
在一些实施方案中,本文公开的化合物调节yap/taz与tead之间的相互作用。在一些实施方案中,本文公开的化合物与tead、yap或taz结合,并阻止yap/taz与tead之间的相互作用。g-蛋白/gpcr介导的yap/taz调节
[0220]
在一些实施方案中,hippo途径由g蛋白偶联受体(gpcr)和g蛋白(也称为鸟嘌呤核苷酸结合蛋白)家族的蛋白质调节(图2)。g蛋白是通过gpcr将细胞外刺激物传递到细胞内的分子开关。在一些情况下,存在两类g蛋白:单体小gtp酶;和异三聚体g蛋白复合物。在一
些情况下,后一类复合物由alpha(g
α
)、beta(g
β
)和gamma(g
γ
)亚单位组成。在一些情况下,存在几类g
α
亚单位:g
q/11
α、g
12/13
α、g
i/o
α(g抑制性,g其他)和gsα(g刺激性)。
[0221]
在一些情况下,giα(g抑制性)、goα(g其他)、g
q/11
α和g
12/13
α偶联的gpcr激活yap/taz并促进核易位。在其他情况下,gsα(g刺激性)偶联的gpcr抑制yap/taz活性,从而导致yap/taz降解。
[0222]
在一些情况下,giα(g抑制性)、goα(g其他)、g
q/11
α和g
12/13
α偶联的gpcr通过抑制lats1/2活性激活yap/taz。相比之下,gsα在一些实施方案中诱导lats1/2活性,从而促进yap/taz降解。gq家族
[0223]gq
α(也称为g
q/11
蛋白)参与肌醇三磷酸(ip3)信号转导途径以及通过激活磷脂酶c(plc)从细胞内储存中的钙(ca
2+
)释放。活化的plc将磷脂酰肌醇4,5-双磷酸(pip2)水解为二酰基甘油(dag)和ip3。在一些情况下,对于肌细胞,ip3然后通过细胞质扩散到er或肌质网(sr)中,然后与肌醇三磷酸受体(insp3r)结合,后者是ca
2+
通道。在一些情况下,该结合触发ca
2+
通道的开放,从而增加ca
2+
向细胞质中的释放。
[0224]
在一些实施方案中,与gqα相互作用的gpcr包括但不限于5-羟基色胺受体(5-ht受体)类型5-ht2和5-ht3;α-1肾上腺素能受体;血管升压素1型受体1a和ib;1型血管紧张素ii受体;降钙素受体;组胺h1受体;代谢型谷氨酸受体,i组;毒蕈碱受体m1、m3和m5;以及痕量胺相关受体1。
[0225]
在一些情况下,存在几种类型的gqα:gq、g
q/11
、g
q/14
和g
q/15
。gq蛋白由gnaq编码。g
q/11
由gna11编码。g
q/14
由gna14编码。g
q/15
由gna15编码。
[0226]
在一些情况下,gqα基因的突变或修饰与癌症相关。实际上,研究表明,gqα中的突变促进葡萄膜黑素瘤(um)的肿瘤发生。在一些情况下,已检测到约80%的um病例在gnaq和/或gna11中含有突变。
[0227]
在一些情况下,gqα基因的突变或修饰与先天性疾病相关。在一些情况下,在先天性疾病如葡萄酒色痣(port-wine stain)和/或sturge-weber综合征中观察到gqα的突变。在一些情况下,约92%的葡萄酒色痣病例在gnaq中具有突变。在一些情况下,约88%的sturge-weber综合征在gnaq中具有突变。g
12/13
家族
[0228]g12/13
α通过鸟嘌呤核苷酸交换因子(gef)调节细胞中的肌动蛋白细胞骨架重塑并调节细胞过程。gef参与小gtp酶的激活,小gtp酶在多种细胞内信号传导途径中充当分子开关。小gtp酶的实例包括ras相关的gtp酶超家族(例如rho家族,如cdc42),其参与细胞分化、增殖、细胞骨架组织化、囊泡运输和细胞核转运。
[0229]
在一些实施方案中,与g
12/13
α相互作用的gpcr包括但不限于嘌呤能受体(例如p2y1、p2y2、p2y4、p2y6);毒蕈碱乙酰胆碱受体m1和m3;凝血酶的受体[蛋白酶激活受体(par)-1,par-2];血栓烷(txa2);鞘氨醇1-磷酸(例如s1p2、s1p3、s1p4和s1p5);溶血磷脂酸(例如lpa1、lpa2、lpa3);血管紧张素ii(at1);5-羟色胺(5-ht
2c
和5-ht4);促生长素抑制素(sst5);内皮素(eta和etb);胆囊收缩素(cck1);血管升压素受体;d5多巴胺受体;fmlp甲酰基肽受体;gal2甘丙肽受体;ep3前列腺素类受体;a1腺苷受体;α1肾上腺素能受体;bb2铃蟾肽受体;b2缓激肽受体;钙传感受体;kshv-orf74趋化因子受体;nk1速激肽受体;和促甲状腺激素
(tsh)受体。
[0230]
在一些情况下,g
12/13
α被进一步细分为分别由gna12和gna13编码的g
12
和g
13
型。g
i/o
家族
[0231]gi/o
α(g抑制性,g其他)(也称为gi/g0或gi蛋白)通过抑制腺苷酸环化酶活性抑制由三磷酸腺苷(atp)产生3’,5
’‑
环amp(camp),该腺苷酸环化酶活性将atp转化为camp。
[0232]
在一些实施方案中,与giα相互作用的gpcr包括但不限于5-羟基色胺受体(5-ht受体)类型5-ht1和5-ht5;毒蕈碱乙酰胆碱受体,如m2和m4;腺苷受体,如a1和a3;肾上腺素能受体,如α
2a
、α
2b
和α
2c
;apelin受体;钙传感受体;大麻素受体cb1和cb2;趋化因子cxcr4受体;多巴胺d2、d3和d4;gabab受体;谷氨酸受体,如代谢型谷氨酸受体2(mglur2)、代谢型谷氨酸受体3(mglur3)、代谢型谷氨酸受体4(mglur4)、代谢型谷氨酸受体6(mglur6)、代谢型谷氨酸受体7(mglur7)和代谢型谷氨酸受体8(mglur8);组胺受体,如h3和h4受体;褪黑素受体,如1型褪黑素受体(mt1)、2型褪黑素受体(mt2)和3型褪黑素受体(mt3);烟酸受体,如niacr1和niacr2;阿片样物质受体,如δ、κ、μ和伤害感受肽受体;前列腺素受体,如前列腺素e受体1(ep1)、前列腺素e受体3(ep3)、前列腺素f受体(fp)和血栓烷受体(tp);促生长素抑制素受体sst1、sst2、sst3、sst4和sst5;和痕量胺相关受体8。
[0233]
在一些情况下,存在几种类型的giα:giα1、giα2、giα3、giα4、goα、g
t
、g
gust
和gz。giα1由gnai1编码。giα2由gnai2编码。giα3由gnai3编码。goα,即ao亚单位,由gnao1编码。g
t
由gnat1和gnat2编码。g
gust
由gnat3编码。gz由gnaz编码。gs家族
[0234]gs
α(也称为g刺激性g
s alpha亚单位或gs蛋白)通过激活腺苷酸环化酶来激活camp依赖性途径,腺苷酸环化酶将三磷酸腺苷(atp)转化为3’,5
’‑
环amp(camp)和焦磷酸。在一些实施方案中,与gsα相互作用的gpcr包括但不限于于5-羟基色胺受体(5-ht受体)类型5-ht4、5-ht6和5-ht7;促肾上腺皮质激素受体(acth受体)(也称为黑皮质素受体2或mc2r);腺苷受体类型a
2a
和a
2b
;精氨酸血管升压素受体2(avpr2);β-肾上腺素能受体β1、β2和β3;降钙素受体;降钙素基因相关肽受体;促肾上腺皮质激素释放激素受体;多巴胺受体d1样家族受体,如d1和d5;促卵泡激素受体(fsh-受体);胃抑制性多肽受体;胰高血糖素受体;组胺h2受体;黄体生成素/绒毛膜促性腺激素受体;黑皮质素受体,如mc1r、mc2r、mc3r、mc4r和mc5r;甲状旁腺激素受体1;前列腺素受体类型d2和i2;促胰液素受体;促甲状腺素受体;痕量胺相关受体1;和箱形水母视蛋白。
[0235]
在一些情况下,存在两种类型的gsα:gs和g
olf
。gs由gnas编码。g
olf
由gnal编码。hippo信号传导网络的其他调节物
[0236]
在一些实施方案中,hippo信号传导途径的其他调节物是crumbs(crb)复合物。crumbs复合物是细胞极性和细胞形状的关键调节物。在一些情况下,crmbs复合物包含跨膜crb蛋白,这些跨膜crb蛋白组装在细胞极性中起作用的多蛋白质复合物。在一些情况下,crb复合物募集血管动蛋白(amot)衔接蛋白家族的成员,这些成员与hippo途径成分相互作用。在一些情况下,研究表明amot直接与yap结合,促进yap磷酸化,并抑制其核定位。
[0237]
在一些情况下,hippo信号传导途径的其他调节物包括mst激酶家族的调节物。mst激酶监测肌动蛋白细胞骨架的完整性。在一些情况下,调节物包括tao激酶和细胞极性激酶par-1。
[0238]
在一些情况下,hippo信号传导途径的其他调节物包括粘着连接的分子。在一些情况下,e-钙粘着蛋白(e-cad)通过调节mst活性抑制yap核定位和活性。在一些实施方案中,e-cad相关蛋白α-连环蛋白通过在细胞质中隔离yap/14-3-3复合物来调节yap。在其他情况下,ajuba蛋白家族成员与lats1/2激酶活性相互作用,从而防止yap/taz的失活。
[0239]
在一些实施方案中,与yap/taz直接或间接相互作用的其他蛋白质包括但不限于膜突样蛋白(merlin)、原钙粘蛋白fat 1、mask1/2、hipk2、ptpn14、rassf、pp2a、盐诱导性激酶(sik)、scribble(scrib)、scribble相关蛋白discs large(dlg)、kibra、ptpn14、nphp3、lkb1、ajuba和zo1/2。
[0240]
在一些实施方案中,本文所述的化合物是具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的抑制剂。在一些实施方案中,本文所述的化合物增加具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的磷酸化或减少具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的去磷酸化。在一些实施方案中,所述化合物增加具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的泛素化或减少具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的脱泛素化。
[0241]
在一些实施方案中,本文公开的化合物是hippo途径所涵盖或与之相关的一种或多种蛋白质的抑制剂。在一些情况下,所述一种或多种蛋白质包括图1和/或图2中所示的蛋白质。在一些实施方案中,hippo途径的抑制剂是g-蛋白和/或其偶联的gpcr的抑制剂。在一些实施方案中,hippo途径的抑制剂是g-蛋白的抑制剂。在一些实施方案中,hippo途径的抑制剂是以下蛋白质的抑制剂:gqα家族蛋白质,如gq、g
q/11
、g
q/14
和g
q/15
;g
12/13
α家族的蛋白质,如g
12
和g
13
;或giα家族的蛋白质,如giα1、giα2、giα3、giα4、goα、g
t
、g
gust
和gz。在一些实施方案中,hippo途径的抑制剂是gq的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
q/11
的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
q/14
的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
q/15
的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
12
的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
13
的抑制剂。在一些实施方案中,hippo途径的抑制剂是giα1的抑制剂。在一些实施方案中,hippo途径的抑制剂是giα2的抑制剂。在一些实施方案中,hippo途径的抑制剂是giα3的抑制剂。在一些实施方案中,hippo途径的抑制剂是giα4的抑制剂。在一些实施方案中,hippo途径的抑制剂是goα的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
t
的抑制剂。在一些实施方案中,hippo途径的抑制剂是g
gust
的抑制剂。在一些实施方案中,hippo途径的抑制剂是gz的抑制剂。
[0242]
在一些实施方案中,hippo途径的抑制剂是hippo途径的核心蛋白质的抑制剂。在一些实施方案中,hippo途径的抑制剂是sav1的抑制剂。在一些实施方案中,hippo途径的抑制剂是mob的抑制剂。在一些实施方案中,hippo途径的抑制剂是yap的抑制剂。在一些实施方案中,hippo途径的抑制剂是taz的抑制剂。在一些实施方案中,hippo途径的抑制剂是tead的抑制剂。
[0243]
在一些实施方案中,hippo途径的抑制剂是与泛素化和蛋白酶体降解途径相关的蛋白质的抑制剂。在一些实施方案中,hippo途径的抑制剂是蛋白酶体降解途径蛋白质(例如,26s蛋白酶体)的抑制剂。
[0244]
在一些实施方案中,hippo途径的抑制剂是ras蛋白质超家族的蛋白质的抑制剂。
在一些实施方案中,hippo途径的抑制剂是rho蛋白质家族的蛋白质的抑制剂。在一些实施方案中,hippo途径的抑制剂是cdc42的抑制剂。
[0245]
cdc42是小gtp酶的ras超家族的成员。具体而言,cdc42属于gtp酶的rho家族,其中该家族的成员参与多种关键的细胞过程,如基因转录、细胞-细胞粘附和细胞周期进程。cdc42参与细胞生长和极性,并且在一些情况下,cdc42被鸟嘌呤核苷酸交换因子(gef)激活。在一些情况下,cdc42的抑制剂是本文公开的化合物。
[0246]
在一些实施方案中,hippo途径的抑制剂是脱泛素化酶的抑制剂。在一些实施方案中,hippo途径的抑制剂是半胱氨酸蛋白酶或金属蛋白酶的抑制剂。在一些实施方案中,hippo途径的抑制剂是泛素特异性蛋白酶的抑制剂。usp47是半胱氨酸蛋白酶的泛素特异性蛋白酶(usp/ubp)超家族的成员。在一些实施方案中,本文公开的化合物是usp47的抑制剂。
[0247]
本文提供的其他实施方案包括一个或多个上述特定实施方案的组合。疾病癌症
[0248]
在一些实施方案中,本文公开的式(i)、式(ii)或式(iii)化合物可用于治疗癌症。在一些实施方案中,本文提供了一种治疗有需要的受试者的癌症的方法,其包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了一种用于治疗有需要的受试者的癌症的化合物,该治疗包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了本文公开的化合物或其药学上可接受的盐或溶剂化物在制备用于治疗癌症的药物中的用途。
[0249]
在一些实施方案中,所述癌症通过激活具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)来介导。在一些实施方案中,该癌症通过调节yap/taz与tead的相互作用来介导。在一些实施方案中,该癌症的特征在于突变gα-蛋白。在一些实施方案中,该突变gα-蛋白选自g12、g13、gq、g11、gi、go和gs。在一些实施方案中,该突变gα-蛋白是g12。在一些实施方案中,该突变gα-蛋白是g13。在一些实施方案中,该突变gα-蛋白是gq。在一些实施方案中,该突变gα-蛋白是g11。在一些实施方案中,该突变gα-蛋白是gi。在一些实施方案中,该突变gα-蛋白是go。在一些实施方案中,该突变gα-蛋白是gs。
[0250]
在一些实施方案中,所述癌症是实体瘤。在一些情况下,该癌症是血液系统恶性肿瘤。在一些情况下,该实体瘤是肉瘤或癌。在一些情况下,该实体瘤是肉瘤。在一些情况下,该实体瘤是癌。
[0251]
示例性的肉瘤包括但不限于小泡型横纹肌肉瘤、软组织腺泡状肉瘤、成釉细胞瘤、血管肉瘤、软骨肉瘤、脊索瘤、软组织的透明细胞肉瘤、去分化脂肪肉瘤、硬纤维瘤、结缔组织增生性小圆细胞肿瘤、胚胎型横纹肌肉瘤、上皮样纤维肉瘤、上皮样血管内皮瘤、上皮样肉瘤、成感觉神经细胞瘤、尤因肉瘤、肾外横纹肌样瘤、骨外粘液样软骨肉瘤、骨外骨肉瘤、纤维肉瘤、巨细胞瘤、血管外皮细胞瘤、婴儿型纤维肉瘤、炎性成肌纤维细胞瘤、卡波西肉瘤、骨平滑肌肉瘤、脂肪肉瘤、骨脂肪肉瘤、恶性纤维组织细胞瘤(mfh)、骨恶性纤维组织细胞瘤(mfh)、恶性间叶瘤、恶性周围神经鞘瘤、间充质软骨肉瘤、粘液纤维肉瘤、粘液样脂肪肉瘤、粘液炎性成纤维细胞肉瘤、伴血管周围上皮样细胞分化的肿瘤、骨肉瘤、骨旁骨肉瘤、伴血管周围上皮样细胞分化的肿瘤、骨膜骨肉瘤、多形性脂肪肉瘤、多形性横纹肌肉瘤、
pnet/骨外尤因肿瘤、横纹肌肉瘤、圆细胞脂肪肉瘤、小细胞骨肉瘤、孤立性纤维瘤、滑膜肉瘤和毛细血管扩张性骨肉瘤。
[0252]
示例性的癌包括但不限于腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、肛门癌、阑尾癌、胆管癌(即,胆管上皮癌)、膀胱癌、脑瘤、乳腺癌、宫颈癌、结肠癌、原发性不明癌(cup)、食管癌、眼癌、输卵管癌、胃肠癌、肾癌、肝癌、肺癌、髓母细胞瘤、黑素瘤、口癌、卵巢癌、胰腺癌、甲状旁腺病、阴茎癌、垂体瘤、前列腺癌、直肠癌、皮肤癌、胃癌、睾丸癌、喉癌、甲状腺癌、子宫癌、阴道癌和外阴癌。在一些情况下,所述肝癌是原发性肝癌。
[0253]
在一些情况下,所述癌症选自葡萄膜黑素瘤、间皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌和脑膜瘤。在一些情况下,该癌症是葡萄膜黑素瘤、间皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌或脑膜瘤。在一些情况下,该癌症是葡萄膜黑素瘤、间皮瘤、食管癌或肝癌。在一些情况下,该癌症是葡萄膜黑素瘤。在一些情况下,该癌症是间皮瘤。在一些情况下,该癌症是食管癌。在一些情况下,该癌症是肝癌。在一些情况下,该癌症是原发性肝癌。
[0254]
在一些情况下,所述癌症是血液系统恶性肿瘤。在一些实施方案中,该血液系统恶性肿瘤是白血病、淋巴瘤、骨髓瘤、非霍奇金淋巴瘤、霍奇金淋巴瘤、t细胞恶性肿瘤或b细胞恶性肿瘤。在一些情况下,血液系统恶性肿瘤是t细胞恶性肿瘤。示例性的t细胞恶性肿瘤包括但不限于未另外指定的外周t细胞淋巴瘤(ptcl-nos)、间变性大细胞淋巴瘤、血管免疫母细胞性淋巴瘤、皮肤t细胞淋巴瘤、成年t细胞白血病/淋巴瘤(atll)、母细胞性nk细胞淋巴瘤、肠病型t细胞淋巴瘤、肝脾γ-δt细胞淋巴瘤、淋巴母细胞淋巴瘤、鼻nk/t细胞淋巴瘤和治疗相关的t细胞淋巴瘤。
[0255]
在一些情况下,血液系统恶性肿瘤是b细胞恶性肿瘤。示例性的b细胞恶性肿瘤包括但不限于慢性淋巴细胞性白血病(cll)、小淋巴细胞淋巴瘤(sll)、高危型cll和非cll/sll淋巴瘤。在一些实施方案中,该癌症为滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、瓦尔登斯特伦巨球蛋白血症、多发性骨髓瘤、结外边缘区b细胞淋巴瘤、结边缘区b细胞淋巴瘤、伯基特淋巴瘤、非伯基特高等级b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤(pmbl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、b细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵隔(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。
[0256]
在一些情况下,所述癌症是复发性或难治性癌症。在一些实施方案中,该复发性或难治性癌症是复发性或难治性实体瘤。在一些实施方案中,该复发性或难治性实体瘤是复发性或难治性肉瘤或复发性或难治性癌。在一些实施方案中,该复发性或难治性癌包括腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、肛门癌、阑尾癌、胆管癌(即,胆管上皮癌)、膀胱癌、脑瘤、乳腺癌、宫颈癌、结肠癌、原发性不明癌(cup)、食管癌、眼癌、输卵管癌、胃肠癌、肾癌、肝癌、肺癌、髓母细胞瘤、黑素瘤、口癌、卵巢癌、胰腺癌、甲状旁腺病、阴茎癌、垂体瘤、前列腺癌、直肠癌、皮肤癌、胃癌、睾丸癌、喉癌、甲状腺癌、子宫癌、阴道癌和外阴癌。
[0257]
在一些情况下,所述复发性或难治性癌症选自复发性或难治性葡萄膜黑素瘤、间
皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌和脑膜瘤。在一些情况下,该复发性或难治性癌症是复发性或难治性葡萄膜黑素瘤、间皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌或脑膜瘤。在一些情况下,该复发性或难治性癌症是复发性或难治性葡萄膜黑素瘤、间皮瘤、食管癌或肝癌。在一些情况下,该复发性或难治性癌症是复发性或难治性葡萄膜黑素瘤。在一些情况下,该复发性或难治性癌症是复发性或难治性间皮瘤。在一些情况下,该复发性或难治性癌症是复发性或难治性食管癌。在一些情况下,该复发性或难治性癌症是复发性或难治性肝癌。在一些情况下,该复发性或难治性癌症是复发性或难治性原发性肝癌。
[0258]
在一些实施方案中,所述复发性或难治性癌症是复发性或难治性血液系统恶性肿瘤。在一些实施方案中,复发性或难治性血液系统恶性肿瘤是复发性或难治性白血病、复发性或难治性淋巴瘤、复发性或难治性骨髓瘤、复发性或难治性非霍奇金淋巴瘤、复发性或难治性霍奇金淋巴瘤、复发性或难治性t细胞恶性肿瘤或复发性或难治性b细胞恶性肿瘤。在一些情况下,复发性或难治性血液系统恶性肿瘤是复发性或难治性t细胞恶性肿瘤。在一些情况下,复发性或难治性血液系统恶性肿瘤是复发性或难治性b细胞恶性肿瘤,例如慢性淋巴细胞性白血病(cll)、小淋巴细胞性白血病(sll)、高危型cll或非cll/sll淋巴瘤。在一些实施方案中,该癌症为滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、瓦尔登斯特伦巨球蛋白血症、多发性骨髓瘤、结外边缘区b细胞淋巴瘤、结边缘区b细胞淋巴瘤、伯基特淋巴瘤、非伯基特高等级b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤(pmbl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、b细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵隔(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。
[0259]
在一些情况下,所述癌症是转移的癌症。在一些情况下,该转移癌症是转移的实体瘤。在一些情况下,该转移的实体瘤是转移的肉瘤或转移的癌。在一些实施方案中,该转移癌包括腺癌、鳞状细胞癌、腺鳞癌、间变性癌、大细胞癌、小细胞癌、肛门癌、阑尾癌、胆管癌(即,胆管上皮癌)、膀胱癌、脑瘤、乳腺癌、宫颈癌、结肠癌、原发性不明癌(cup)、食管癌、眼癌、输卵管癌、胃肠癌、肾癌、肝癌、肺癌、髓母细胞瘤、黑素瘤、口癌、卵巢癌、胰腺癌、甲状旁腺病、阴茎癌、垂体瘤、前列腺癌、直肠癌、皮肤癌、胃癌、睾丸癌、喉癌、甲状腺癌、子宫癌、阴道癌和外阴癌。
[0260]
在一些情况下,所述转移的癌症选自转移的葡萄膜黑素瘤、间皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌和脑膜瘤。在一些情况下,该转移的癌症是转移的葡萄膜黑素瘤、间皮瘤、食管癌、肝癌、乳腺癌、肝细胞癌、肺腺癌、神经胶质瘤、结肠癌、结直肠癌、胃癌、髓母细胞瘤、卵巢癌、食管鳞状细胞癌、肉瘤、尤因肉瘤、头颈癌、前列腺癌或脑膜瘤。在一些实施方案中,该转移的癌症是转移的葡萄膜黑素瘤、间皮瘤、食管癌或肝癌。在一些情况下,该转移的癌症是转移的葡萄膜黑素瘤。在一些情况下,该转移的癌症是转移的间皮瘤。在一些情况下,该转移的癌症是转移的食管癌。在一些情况下,该转移的癌症是转移的肝癌。在一些情况下,该转移的癌症是转移的原发性肝癌。
[0261]
在一些情况下,所述转移的癌症是转移的血液系统恶性肿瘤。在一些实施方案中,该转移的血液系统恶性肿瘤是转移的白血病、转移的淋巴瘤、转移的骨髓瘤、转移的非霍奇金淋巴瘤、转移的霍奇金淋巴瘤、转移的t细胞恶性肿瘤或转移的b细胞恶性肿瘤。在一些情况下,转移的血液系统恶性肿瘤是转移的t细胞恶性肿瘤。在一些情况下,转移的血液系统恶性肿瘤是转移的b细胞恶性肿瘤,例如慢性淋巴细胞性白血病(cll)、小淋巴细胞性白血病(sll)、高危型cll或非cll/sll淋巴瘤。在一些实施方案中,该癌症为滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlbcl)、套细胞淋巴瘤(mcl)、瓦尔登斯特伦巨球蛋白血症、多发性骨髓瘤、结外边缘区b细胞淋巴瘤、结边缘区b细胞淋巴瘤、伯基特淋巴瘤、非伯基特高等级b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤(pmbl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、b细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、纵隔(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巴瘤、原发性渗出性淋巴瘤或淋巴瘤样肉芽肿病。
[0262]
在一些情况下,所述癌症是间皮瘤、肝细胞癌、脑膜瘤、恶性周围神经鞘瘤、许旺细胞瘤、肺癌、膀胱癌、皮肤神经纤维瘤、前列腺癌、胰腺癌、胶质母细胞瘤、子宫内膜腺鳞状癌、未分化甲状腺癌、胃腺癌、食管腺癌、卵巢癌、卵巢浆液性腺癌、黑素瘤或乳腺癌。非癌症适应症
[0263]
在一些实施方案中,式(i)、式(ii)或式(iii)化合物可用于治疗多囊肾病。在一些实施方案中,式(i)、式(ii)或式(iii)化合物可用于治疗肝纤维化。在一些实施方案中,本文提供了一种治疗有需要的受试者的多囊肾病的方法,其包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了一种用于治疗有需要的受试者的多囊肾病的化合物,所述治疗包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了本文公开的化合物或其药学上可接受的盐或溶剂化物在制备用于治疗多囊肾病的药物中的用途。在一些实施方案中,本文提供了一种治疗有需要的受试者的肝纤维化的方法,其包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了一种用于治疗有需要的受试者的肝纤维化的化合物,所述治疗包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了本文公开的化合物或其药学上可接受的盐或溶剂化物在制备用于治疗肝纤维化的药物中的用途。先天性疾病
[0264]
在一些实施方案中,式(i)、式(ii)或式(iii)化合物可用于治疗先天性疾病。在一些实施方案中,本文提供了一种治疗有需要的受试者的先天性疾病的方法,其包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了一种用于治疗有需要的受试者的先天性疾病的化合物,所述治疗包括向有需要的受试者施用治疗有效量的本文公开的化合物或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文提供了本文公开的化合物或其药学上可接受的盐或溶剂化物在制备用于治疗先天性疾病的药物中的用途。在一些实施方案中,该先天性疾病通过激活具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)来介导。在一些实施方案中,该先天性疾病的特征在于突变gα-蛋白。在一些实施方案中,该突变gα-蛋
白选自g12、g13、gq、g11、gi、go和gs。在一些实施方案中,该突变gα-蛋白是g12。在一些实施方案中,该突变gα-蛋白是g13。在一些实施方案中,该突变gα-蛋白是gq。在一些实施方案中,该突变gα-蛋白是g11。在一些实施方案中,该突变gα-蛋白是gi。在一些实施方案中,该突变gα-蛋白是go。在一些实施方案中,该突变gα-蛋白是gs。
[0265]
在一些实施方案中,所述先天性疾病是遗传异常、子宫内环境、与形态发生有关的错误、感染、亲本种系上的表观遗传修饰或染色体异常的结果。示例性的先天性疾病包括但不限于sturge-weber综合征、葡萄酒色痣、holt-oram综合征、腹壁缺损、becker肌营养不良(bmd)、生物素酶缺乏症、charcot-marie-tooth(cmt)、唇裂、腭裂、先天性肾上腺增生、先天性心脏缺损、先天性甲状腺功能减退、先天性肌营养不良、囊性纤维化、唐氏综合征、杜氏肌营养不良、脆性x染色体综合征、friedreich共济失调、半乳糖血症、血红蛋白病、krabbe病、肢带肌营养不良、中链酰基辅酶a脱氢酶缺乏症、重症肌无力、神经管缺损、苯丙酮尿症、庞皮病、重度联合免疫缺陷(scid)、stickler综合征(或遗传性进行性关节眼病)、脊髓性肌萎缩和18号染色体三体性。在一些实施方案中,该先天性疾病是sturge-weber综合征或葡萄酒色痣。在一些实施方案中,该先天性疾病是sturge-weber综合征。在一些实施方案中,该先天性疾病是葡萄酒色痣。实施例
[0266]
这些实施例仅为了说明性目的而提供,而不是限制本文提供的权利要求书的范围。缩写列表
[0267]
如上所用的,在整个公开内容中,除非另有说明,否则下列缩写应理解为具有以下含义:acn或mecn
ꢀꢀꢀꢀꢀꢀ
乙腈ac
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酰基boc或boc
ꢀꢀꢀꢀꢀꢀꢀ
氨基甲酸叔丁酯t-bu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摄氏度dast
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二乙基氨基三氟化硫dba或dba
ꢀꢀꢀꢀꢀꢀꢀ
二苄亚基丙酮dce
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯乙烷(clch2ch2cl)dcm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷(ch2cl2)dipea或diea
ꢀꢀꢀꢀ
二异丙基乙胺dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基甲酰胺dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基亚砜dppf或dppf
ꢀꢀꢀꢀꢀ
1,1'-双(二苯基膦基)二茂铁ea或etoac
ꢀꢀꢀꢀꢀꢀ
乙酸乙酯et
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙基etoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇g
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
克h、hr、hrs
ꢀꢀꢀꢀꢀ
小时
hatu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱法hz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
赫兹lah
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
氢化铝锂lcms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱质谱法m/z
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质荷比m
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摩尔浓度me
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲基meoh
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇mg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫克mhz
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
兆赫umol
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微摩尔ul
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微升ml
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫升mmol
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫摩尔ms
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
质谱法nmr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
核磁共振pe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
石油醚ph
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
苯基prep-hplc
ꢀꢀꢀꢀꢀꢀ
制备型高压液相色谱法prep-tlc
ꢀꢀꢀꢀꢀꢀꢀ
制备型薄层色谱法py
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
吡啶rt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
保留时间tea
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三乙胺tfa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃tlc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄层色谱法xphos
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-二环己基膦基-2
′
,4
′
,6
′‑
三异丙基联苯i.化学合成
[0268]
除非另外指出,否则试剂和溶剂按从商业供应商接收时原样使用。无水溶剂和烘干的玻璃器皿用于对水分和/或氧敏感的合成转化。没有对产率进行优化。反应时间是近似值,并且没有优化。除非另外指出,否则柱色谱法和薄层色谱法(tlc)在硅胶上进行。在一些实施方案中,如果在反应方案与书写的程序之间存在差异,则应当以书写的程序为准。实施例1:5-(4-氯苯氧基)-n-异丙基-2-萘甲酰胺(化合物1)
[0269]
将5-溴-n-异丙基-萘-2-甲酰胺(0.15g,0.51mmol,1eq)、4-氯苯酚(99.0mg,0.77mmol,75.6ul,1.5eq)、cui(19.5mg,0.10mmol,0.2eq)、cs2co3(418.2mg,1.28mmol,2.5eq)和2-(二甲基氨基)乙酸(15.9mg,0.15mmol,0.3eq)在dmso(2ml)中的混合物脱气并用n2吹扫3次,然后在微波和n2气氛下将混合物在140℃下搅拌1hr。将h2o(8ml)添加到溶液中。将混合物用乙酸乙酯(15ml*3)萃取。合并的有机层用盐水(25ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物5-(4-氯苯氧基)-n-异丙基-萘-2-甲酰胺(14.5mg,42.6umol,8.3%产率)。lcms(esi):rt=0.877min,针对c
20h18
clno2计算的质量339.10,m/z实测值339.9[m+h]
+
;1h nmr(400mhz,cdod3)δ8.36(d,j=1.5hz,1h),8.13(d,j=8.8hz,1h),7.85(dd,j=1.8,8.8hz,1h),7.75(d,j=8.3hz,1h),7.46(t,j=8.0hz,1h),7.34-7.30(m,2h),7.03-6.96(m,3h),4.23(s,1h),1.25(d,j=6.5hz,7h)。实施例2:5-(3-氯苯氧基)-n-异丙基-2-萘甲酰胺(化合物2)
[0270]
将5-溴-n-异丙基-萘-2-甲酰胺(0.15g,0.51mmol,1eq)、3-氯苯酚(99.0mg,0.77mmol,81.1ul,1.5eq)、cui(19.6mg,0.10mmol,0.2eq)、cs2co3(418.2mg,1.28mmol,2.5eq)和2-(二甲基氨基)乙酸(15.9mg,0.15mmol,0.3eq)在dmso(2ml)中的混合物脱气并用n2吹扫3次,然后在微波和n2气氛下将混合物在140℃下搅拌1hr。将h2o(8ml)添加到溶液中。将混合物用乙酸乙酯(15ml*3)萃取。合并的有机层用盐水(25ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物5-(3-氯苯氧基)-n-异丙基-萘-2-甲酰胺(13.5mg,39.9umol,7.7%产率)。lcms(esi):rt=0.873min,针对c
20h18
clno2计算的质量339.10,m/z实测值339.9[m+h]
+
;1h nmr(400mhz,cdod3)δ8.42(d,j=1.3hz,1h),8.13(d,j=8.8hz,1h),7.92-7.81(m,2h),7.54(t,j=8.0hz,1h),7.38-7.30(m,1h),7.16-7.10(m,2h),7.01(t,j=2.1hz,1h),6.95(dd,j=1.8,8.3hz,1h),4.35-4.21(m,1h),1.30(d,j=6.5hz,6h)。实施例3:5-(3,4-二氯苯氧基)-n-异丙基-萘-2-甲酰胺(化合物3)
[0271]
将化合物5-溴-n-异丙基-2-萘甲酰胺(140mg,0.5mmol,1eq)、化合物3,4-二氯苯酚(117.2mg,0.7mmol,27.1ul,1.5eq)、cui(18.3mg,95.8umol,0.2eq)、cs2co3(390.3mg,1.2mmol,2.5eq)和n,n-二甲基甘氨酸(14.8mg,0.1mmol,0.3eq)的混合物加入到微波管中的dmso(3ml)中。将密封管在微波下于140℃加热1hr。将残余物倒入h2o(50ml)中并搅拌5min。用ea(20ml*3)萃取水相。合并的有机相用盐水(50ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(58.6mg,0.2mmol,32.7%产率)。lcms(esi):rt=0.920min,针对c
20h17cl2
no2计算的质量373.1.1,m/z实测值373.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.64-8.36(m,2h),8.16-7.84(m,3h),7.61(d,j=12.3hz,2h),7.37(s,1h),7.22(s,1h),7.01(d,j=5.8hz,1h),4.15(s,1h),1.20(d,j=5.8hz,6h)。实施例4:n-异丙基-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物4)
[0272]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(0.1,0.30mmol,1eq)在dmf(2ml)中的溶液中加入hatu(228.8mg,0.60mmol,2eq)和tea(152.2mg,1.50mmol,0.20ml,5eq)。将混合物在25℃下搅拌0.5hr。将异丙胺(35.5mg,0.60mmol,51.7ul,2eq)添加到混合物中,并将混合物在25℃下搅拌0.5hr。将混合物用h2o(30ml)猝灭,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(20ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:60%-90%,9.5min),得到标题化合物(13.26mg,35.5umol,11.8%产率)。lcms(esi):rt=0.881min,针对c
21h18
f3no2计算的质量373.37,m/z实测值373.9;1h nmr(400mhz,甲醇-d4)位移=8.45(d,j=1.5hz,1h),8.10(d,j=8.9hz,1h),7.91(d,j=8.7hz,2h),7.71-7.64(m,j=8.5hz,2h),7.59(t,j=7.9hz,1h),7.23(dd,j=0.8,7.6hz,1h),7.18-7.12(m,j=8.6hz,2h),4.34-4.24(m,1h),1.31(d,j=6.6hz,6h)。实施例5:n-(甲基磺酰基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物5)
[0273]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(0.05g,0.15mmol,1eq)在dmf(2ml)中的溶液中加入cdi(29.2mg,0.18mmol,1.2eq)。将混合物在30℃下搅拌0.5hr。将甲烷磺酰胺(17.1mg,0.18mmol,1.2eq)和dbu(27.4mg,0.18mmol,27.2ul,1.2eq)添加到混合物中,并将混合物在25℃下搅拌0.5hr。将混合物用h2o(30ml)猝灭,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(20ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(8.3mg,20.3umol,13.5%产率)。1h nmr(400mhz,甲醇-d4)位移=8.59(d,j=1.6hz,1h),8.18(d,j=8.9hz,1h),7.97(t,j=7.6hz,2h),7.73-7.62(m,3h),7.30(d,j=7.4hz,1h),7.17(d,j=8.6hz,2h),3.43(s,3h)。实施例6:5-(3,4-二氯苯氧基)-n-(甲基磺酰基)-2-萘甲酰胺(化合物6)
[0274]
向5-(3,4-二氯苯氧基)萘-2-甲酸(50.1mg,0.15mmol,1eq)在dmf(2ml)中的溶液中加入dbu(27.4mg,0.18mmol,27.2ul,1.2eq)。将混合物在40℃下搅拌0.5hr。将甲烷磺酰胺(17.1mg,0.18mmol,1.2eq)和cdi(29.2mg,0.18mmol,1.2eq)添加到混合物中,并将混合物在25℃下搅拌0.5hr。将h2o(6ml)添加到溶液中。将混合物用乙酸乙酯(10ml*3)萃取。合并的有机层用盐水(15ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(9.1mg,21.6umol,14.3%产率)。lcms(esi):rt=0.881min,针对c
18h13
cl2no4s计算的质量410.27,m/z实测值409.8[m+h]
+
;1h nmr(400mhz,dmso-d6)δ=12.34(br s,1h),8.68(s,1h),8.09(d,j=8.8hz,1h),8.00-7.91(m,2h),7.65-7.58(m,2h),7.38(d,j=2.7hz,1h),7.27(d,j=7.6hz,1h),7.01(dd,j=2.8,8.9hz,1h),3.39(s,3h)。实施例7:n-甲基-5-(4-(三氟甲基)苯氧基)萘-2-磺酰胺(化合物7)
5-溴萘-2-磺酰氯
[0275]
将5-溴萘-2-磺酸(900mg,3.13mmol,1eq)和socl2(745.8mg,6.27mmol,0.45ml,2eq)在dmf(2ml)中的混合物在30℃下搅拌1hr。将反应混合物用h2o(5ml)稀释,并将混合物用ea(15ml*3)萃取。合并的有机相用盐水(10ml*6)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过硅胶柱色谱法纯化。获得化合物5-溴萘-2-磺酰氯(800mg,2.62mmol,83.5%产率)。5-溴-n-甲基萘-2-磺酰胺
[0276]
在0℃下,将甲胺(2m,3.93ml,3eq)逐滴加入到5-溴萘-2-磺酰氯(800mg,2.62mmol,1eq)在thf(1ml)中的混合物中。然后将混合物在25℃下搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(30ml*3)萃取。合并的有机相用盐水(20ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过硅胶柱色谱法纯化。获得化合物5-溴-n-甲基-萘-2-磺酰胺(600mg,2.00mmol,76.3%产率)。n-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)萘-2-磺酰胺
[0277]
将5-溴-n-甲基-萘-2-磺酰胺(400mg,1.33mmol,1eq)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1,3,2-二氧杂硼杂环戊烷(507.5mg,2.00mmol,1.5eq)、acok(261.5mg,2.67mmol,2eq)和pd(dppf)cl2(48.7mg,66.6umol,0.05eq)在二氧杂环己烷(3ml)中的混合物脱气并用n2吹扫3次,然后将混合物在n2气氛下于90℃搅拌3hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过硅胶柱色谱法纯化。获得化合物n-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)萘-2-磺酰胺(350mg,1.01mmol,75.6%产率)。5-羟基-n-甲基萘-2-磺酰胺
[0278]
将n-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)萘-2-磺酰胺(350mg,1.01mmol,1eq)和3-氧代二氧杂硼烷钠四水合物(465.2mg,3.02mmol,0.58ml,3eq)在thf(2ml)和h2o(1ml)中的混合物在30℃下搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。获得化合物5-羟基-n-甲基-萘-2-磺酰胺(250mg,粗品),其不经进一步纯化而用于下一步。n-甲基-5-(4-(三氟甲基)苯氧基)萘-2-磺酰胺
[0279]
将5-羟基-n-甲基-萘-2-磺酰胺(100mg,0.42mmol,1eq)、[4-(三氟甲基)苯基]硼酸(120.0mg,0.63mmol,1.5eq)、diea(217.8mg,1.69mmol,0.29ml,4eq)和cu(oac)2(153.1mg,0.84mmol,2eq)在dcm(5ml)中的混合物脱气并用o2吹扫3次,然后将混合物在o2气氛下于20℃搅拌16hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(20mg,51.9umol,12.3%产率)。lcms(esi):rt=0.828min,针对c
18h14
f3no3s计算的质量381.37,m/z实测值382.06[m+h]
+
;1h nmr(400mhz,甲醇-d4)δ=8.51(d,j=1.5hz,1h),8.26(d,j=8.8hz,1h),7.97(d,j=8.3hz,1h),7.88(dd,j=1.8,8.8hz,1h),7.72-7.65(m,3h),7.31(d,j=7.0hz,1h),7.18(d,j=8.8hz,2h),2.58(s,3h)。实施例8:5-(3,4-二氟苯氧基)-n-异丙基-2-萘甲酰胺(化合物8)
[0280]
向5-(3,4-二氟苯氧基)萘-2-甲酸(70mg,0.23mmol,1eq)在dcm(1.5ml)中的溶液中加入hatu(132.9mg,0.34mmol,1.5eq)。将混合物在15℃下搅拌1hr。将diea(60.2mg,0.46mmol,81.2ul,2eq)和异丙胺(13.7mg,0.23mmol,20.0ul,1eq)添加到溶液中。将反应在15℃下搅拌1hr。将h2o(6ml)添加到溶液中。将混合物用乙酸乙酯(10ml*3)萃取。合并的有机层用盐水(15ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(10.5mg,30.8umol,13.2%产率)。lcms(esi):rt=0.847min,针对c
20h17
f2no2计算的质量341.35,m/z实测值341.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ=8.51(s,1h),8.48-8.43(m,1h),8.11(d,j=8.8hz,1h),7.98(dd,j=1.4,8.9hz,1h),7.87(d,j=8.3hz,1h),7.56(t,j=7.9hz,1h),7.52-7.42(m,1h),7.36-7.27(m,1h),7.15-7.09(m,1h),6.94-6.86(m,1h),4.16(qd,j=6.8,13.7hz,1h),1.22(d,j=6.5hz,6h)。实施例9:5-(3,4-二氯苯氧基)-n-甲基萘-2-磺酰胺(化合物9)
[0281]
将5-羟基-n-甲基-萘-2-磺酰胺(80mg,0.33mmol,1eq)、(3,4-二氯苯基)硼酸(96.5mg,0.50mmol,1.5eq)、cu(oac)2(122.4mg,0.67mmol,2eq)、diea(174.3mg,1.35mmol,0.23ml,4eq)在dcm(3ml)中的混合物脱气并用o2吹扫3次,然后将混合物在o2气氛下于25℃搅拌16hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(5mg,12.8umol,3.8%产率)。1h nmr(400mhz,甲醇-d4)δ=8.50(d,j=1.5hz,
7.35(m,3h),6.14(br d,j=7.3hz,1h),6.20-6.06(m,1h),4.37(qd,j=6.7,13.7hz,1h),1.33(d,j=6.5hz,6h)。实施例12:n-[(1r)-2-羟基-1-甲基-乙基]-1-[4-(三氟甲基)苯氧基]异喹啉-6-甲酰胺(化合物12)
[0285]
向1-(4-(三氟甲基)苯氧基)异喹啉-6-甲酸(20mg,60.0umol,1eq)和(r)-2-氨基丙烷-1-醇(6.8mg,90.0umol,7ul,1.5eq)在dcm(1ml)中的溶液中加入diea(31.0mg,0.24mmol,42ul,4eq)和hatu(34.2mg,90umol,1.5eq)。将混合物在25℃下搅拌12h。将混合物用h2o(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(5.5mg,14.2umol,23.6%产率)。lcms(esi):rt=0.882min,针对c
20h17
f3n2o3计算的质量390.36,m/z实测值391.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.48(d,j=8.5hz,1h),8.25(d,j=1.0hz,1h),8.03(d,j=5.8hz,1h),7.99(dd,j=1.5,8.8hz,1h),7.73(d,j=8.5hz,2h),7.44(d,j=5.5hz,1h),7.40(d,j=8.5hz,2h),6.57-6.44(m,1h),4.46-4.31(m,1h),3.93-3.81(m,1h),3.79-3.68(m,1h),2.40(br s,1h),1.37(d,j=6.8hz,3h)。实施例13:n-异丙基-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物13)
[0286]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,150.0umol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(1ml)中的溶液中加入diea(77.6mg,0.6mmol,0.1ml,4eq)。将混合物在30℃下搅拌30min。将异丙胺(13.3mg,0.22mmol,19.3ul,1.5eq)添加到混合物中。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化。获得标题化合物(7.9mg,21.2umol,14.1%产率)。lcms(esi):rt=0.802min,针对c
20h17
f3n2o2计算的质量374.12,m/z实测值374.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.20(d,j=2.4hz,1h),8.64(d,j=2.0hz,1h),7.76(d,j=8.0hz,1h),7.60-7.56(m,3h),7.35(d,j=6.8hz,1h),7.10(d,j=8.8hz,2h),6.09(d,j=7.2hz,1h),4.39-4.34(m,1h),1.32(d,j=6.4hz,6h)。实施例14:n-[2-羟基-1-(2-吡啶基)乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物14)
[0287]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,150.0umol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(96.9mg,0.75mmol,0.13ml,5eq)和2-氨基-2-吡啶-2-基-乙醇(40mg,0.19mmol,1.3eq,2hcl)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(15.7mg,34.7umol,23.1%产率)。lcms(esi):rt=0.695min,针对c
24h18
f3n3o3计算的质量453.13,m/z实测值454.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.35(d,j=2.0hz,1h),8.73(d,j=2.0hz,1h),8.56(d,j=4.4hz,1h),8.22(br d,j=6.8hz,1h),7.78-7.76(m,2h),7.59-7.51(m,4h),7.36-7.34(m,2h),7.10(d,j=8.4hz,2h),5.43-5.39(m,1h),4.20-4.16(m,1h),4.10-4.06(m,1h),2.7(br s,1h)。实施例15:n-[(1r)-2-羟基-1-甲基-乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物15)
[0288]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,0.15mmol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(77.6mg,0.60mmol,0.1ml,4eq)和(2r)-2-氨基丙烷-1-醇(16.9mg,0.23mmol,17.6ul,1.5eq)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(5.3mg,13.6umol,9.1%产率)。lcms(esi):rt=0.733min,针对c
20h17
f3n2o3计算的质量390.12,m/z实测值390.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.26(d,j=2.0hz,1h),8.67(d,j=2.0hz,1h),7.74(d,j=7.2hz,1h),7.73-7.57(m,3h),7.34(d,j=7.2hz,1h),7.09(d,j=8.4hz,2h),6.71(br d,j=7.2hz,1h),4.44-4.37(m,1h),3.83-3.83(m,1h),3.72-3.68(m,1h),1.34(d,j=6.8hz,3h)。实施例16:n-[(1r)-2-甲氧基-1-甲基-乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物16)
[0289]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,0.15mmol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(96.9mg,0.75mmol,0.13ml,5eq)和(2r)-1-甲氧基丙烷-2-胺(28.3mg,0.22mmol,17.6ul,1.5eq,hcl)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(16.9mg,41.9umol,27.9%产率)。lcms(esi):rt=0.778min,针对c
21h19
f3n2o3计算的质量404.13,m/z实测值404.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.24(d,j=2.0hz,1h),8.65(d,j=2.0hz,1h),7.77(d,j=8.4hz,1h),7.60-7.56(m,3h),7.36(d,j=8.4hz,1h),7.10(d,j=8.8hz,2h),6.58(br d,j=5.6hz,1h),4.45-4.42(m,1h),3.58-3.54(m,1h),3.49-3.46(m,1h),3.41(s,3h),1.35(d,j=6.4hz,3h)。实施例17:n-[(1r)-1-(2-吡啶基)乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物17)
[0290]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,0.15mmol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(77.6mg,0.60mmol,0.1ml,4eq)和(1r)-1-(2-吡啶基)乙胺(27.5mg,0.22mmol,17.55ul,1.5eq)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用etoac(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(26.7mg,61.2umol,40.8%产率)。lcms(esi):rt=0.709min,针对c
24h18
f3n3o2计算的质量437.14,m/z实测值438.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.36(d,j=2.4hz,1h),8.78(d,j=2.0hz,1h),8.58(d,j=4.8hz,1h),8.24(br d,j=6.4hz,1h),7.81-7.79(m,2h),7.60-7.56(m,3h),7.38-7.35(m,2h),7.31-7.27(m,1h),7.11(d,j=8.4hz,2h),5.44-5.37(m,1h),1.65(d,j=6.8hz,3h)。实施例18:n-[(1s)-2-甲氧基-1-甲基-乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物18)
[0291]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,0.15mmol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(77.6mg,0.6mmol,0.1ml,4eq)和(2s)-1-甲氧基丙烷-2-胺(20.1mg,0.22mmol,17.6ul,1.5eq)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(25.0mg,61.4umol,40.9%产率)。lcms(esi):rt=0.782min,针对c
21h19
f3n2o3计算的质量404.13,m/z实测值404.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.23(d,j=2.4hz,1h),8.65(d,j=2.0hz,1h),7.77(d,j=7.6hz,1h),7.60-7.56(m,3h),7.36(d,j=6.4hz,1h),7.10(d,j=8.4hz,2h),6.59(br d,j=8.0hz,1h),4.46-4.42(m,1h),3.58-3.54(m,1h),3.49-3.46(m,1h),3.41(s,3h),1.35(d,j=6.8hz,3h)。实施例19:n-[(1s)-1-(2-吡啶基)乙基]-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酰胺(化合物19)
[0292]
向8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(50mg,0.15mmol,1eq)和hatu(62.8mg,0.16mmol,1.1eq)在dcm(2ml)中的溶液中加入diea(77.6mg,0.6mumol,0.1ml,4eq)和(1s)-1-(2-吡啶基)乙胺(27.5mg,0.22mmol,17.6ul,1.5eq)。将混合物在30℃下搅拌12h。将混合物用水(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(19.6mg,44.9umol,29.9%产率)。lcms(esi):rt=0.717min,针对c
24h18
f3n3o2计算的质量437.14,m/z实测值437.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.36(d,j=2.0hz,1h),8.74(d,j=2.0hz,1h),8.57(d,j=4.8hz,1h),8.16(br d,j=6.8hz,1h),7.79(d,j=8.4hz,1h),7.72(t,j=8.0hz,1h),7.60-7.53(m,3h),7.36-7.34(m,2h),7.26-7.21(m,1h),7.11(d,j=8.4hz,2h),5.42-5.35(m,1h),1.63(d,j=6.8hz,3h)。实施例20:n-(丙-2-炔-1-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物20)
[0293]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和丙-2-炔-1-胺(9.9mg,0.18mmol,11.5ul,1.2eq)在dmf(1ml)中的溶液中加入hatu(114.4mg,0.3mmol,2eq)和diea(77.7mg,0.6mmol,0.1ml,4eq)。将混合物在25℃下搅拌2hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(5.2mg,14.1umol,9.41%产率)。lcms(esi):rt=0.875min,针对c
21h14
f3no2计算的质量369.34m/z实测值369.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.16(t,j=5.5hz,1h),8.58(d,j=1.1hz,1h),8.05-8.01(m,1h),8.01-7.94(m,2h),7.75(d,j=8.8hz,2h),7.64(t,j=7.9hz,1h),7.34(d,j=7.1hz,1h),7.18(d,j=8.6hz,2h),4.12(dd,j=2.5,5.5hz,2h),3.17(t,j=2.5hz,1h)。实施例21:n-(丁-3-炔-1-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物21)
[0294]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和丁-3-炔-1-胺盐酸盐(10.4mg,98.5umol,0.66eq)在dmf(1ml)中的溶液中加入hatu(114.4mg,0.3mmol,2eq)和diea(77.7mg,0.6mmol,0.1ml,4eq)。将混合物在25℃下搅拌2hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(12.6mg,33.1umol,22%产率)。lcms(esi):rt=0.878min,针对c
22h16
f3no2计算的质量383.36m/z实测值383.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.88(t,j=5.5hz,1h),8.55(s,1h),8.05-7.99(m,1h),7.99-7.92(m,2h),7.75(d,j=8.5hz,2h),7.64(t,j=7.9hz,1h),7.33(d,j=7.0hz,1h),7.17(d,j=8.5hz,2h),3.48-3.41(m,2h),2.87(t,j=2.6hz,1h),2.49-2.44(m,2h)。实施例22:n-(氰基甲基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物22)
[0295]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和2-氨基乙腈(16.7mg,0.18mmol,1.2eq,hcl)在dmf(1ml)中的溶液中加入hatu(114.4mg,0.3mmol,2eq)和diea(77.7mg,0.6mmol,0.1ml,4eq)。将混合物在25℃下搅拌2hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:65%-95%,7min),得到标题化合物(20.4mg,55.2umol,36.7%产率)。lcms(esi):rt=0.852min,针对c
20h13
f3n2o2计算的质量370.32m/z实测值370.8[m+h]
+
;1h nmr(400mhz,cd3od)δ8.51(d,j=1.4hz,1h),8.14(d,j=8.8hz,1h),7.96-7.89(m,2h),7.68(d,j=8.6hz,2h),7.61(t,j=7.9hz,1h),7.25(d,j=7.1hz,1h),7.15(d,j=8.6hz,2h),4.44-4.39(m,2h)。实施例23:n-(2-氰基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物23)
[0296]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和3-氨基丙腈(12.6mg,0.18mmol,13.3ul,1.2eq)在dmf(1ml)中的溶液中加入hatu(114.4mg,0.3mmol,2eq)和diea(77.7mg,0.6mmol,0.1ml,4eq)。将混合物在25℃下搅拌2hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(5.7mg,14.6umol,9.7%产率)。lcms(esi):rt=0.843min,针对c
21h15
f3n2o2计算的质量384.35m/z实测值384.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.08(t,j=5.6hz,1h),8.57(s,1h),8.08-8.02(m,1h),8.00-7.94(m,2h),7.75(d,j=8.8hz,2h),7.65(t,j=7.9hz,1h),7.34(d,j=7.4hz,1h),7.18(d,j=8.6hz,2h),3.57(q,j=6.3hz,2h),2.83(t,j=6.5hz,2h)。实施例24:(r)-n-(1-羟基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物24)
[0297]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)、dipea(77.7mg,0.6mmol,0.1ml,4eq)和hatu(114.4mg,0.3mmol,2eq)在dcm(1ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入(r)-2-氨基丙烷-1-醇(22.6mg,0.3mmol,23.9ul,2eq),并将混合物再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化
(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:60%-88.4%,5.6min),得到标题化合物(30mg,76.2umol,50.6%产率)。lcms(esi):rt=0.930min,针对c
21h18
f3no3计算的质量389.37m/z实测值390.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.56(s,1h),8.33(d,j=7.9hz,1h),8.01-7.94(m,3h),7.75(d,j=8.6hz,2h),7.63(t,j=7.9hz,1h),7.33(d,j=7.5hz,1h),7.17(d,j=8.6hz,2h),4.77(t,j=5.8hz,1h),4.12-4.03(m,1h),3.55-3.46(m,1h),3.42-3.39(m,1h),1.19-1.15(m,3h)。实施例25:n-(2-羟基-1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物25)
[0298]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(60mg,0.18mmol,1eq)、hatu(102.9mg,0.27mmol,1.5eq)和dipea(70mg,0.54mmol,94.3ul,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入2-氨基-2-吡啶-2-基-乙醇(50mg,0.23mmol,1.31eq,2hcl),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:60%-90%,7.8min),得到标题化合物(32mg,70.7umol,39.1%产率)。lcms(esi):rt=0.868min,针对c
25h19
f3n2o3计算的质量452.34m/z实测值453.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.90(d,j=7.8hz,1h),8.67(s,1h),8.58-8.53(m,1h),8.04-7.97(m,3h),7.80-7.73(m,4h),7.69-7.62(m,1h),7.47(d,j=7.8hz,1h),7.34(d,j=7.5hz,1h),7.31-7.21(m,2h),7.18(d,j=8.5hz,2h),5.26-5.18(m,1h),4.98(br s,1h),3.85(br dd,j=5.8,12.0hz,2h)。实施例26:(r)-n-(1-甲氧基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物26)
[0299]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)、dipea(58.3mg,0.45mmol,78.6ul,3eq)和hatu(85.8mg,0.22mmol,1.5eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入(2r)-1-甲氧基丙烷-2-胺盐酸盐(22.6mg,0.18mmol,1.2eq),并将混合物在25℃下搅拌2hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残
余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:60%-90%,7min),得到标题化合物(40mg,99.1umol,65.9%产率)。lcms(esi):rt=0.863min,针对c
22h20
f3no3计算的质量403.39m/z实测值404.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.46(d,j=1.3hz,1h),8.10(d,j=8.8hz,1h),7.94-7.87(m,2h),7.68(d,j=8.5hz,2h),7.60(t,j=7.9hz,1h),7.26-7.20(m,1h),7.15(d,j=8.5hz,2h),4.40(sxt,j=6.5hz,1h),3.59-3.53(m,1h),3.50-3.45(m,1h),3.42(s,3h),1.30(d,j=6.8hz,4h)。实施例27:n-[(1r)-1-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物27)
[0300]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)、dipea(58.3mg,0.45mmol,78.6ul,3eq)和hatu(85.8mg,0.22mmol,1.5eq)在dcm(3ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入(1r)-1-(2-吡啶基)乙胺(22mg,0.18mmol,1.2eq),并将混合物在25℃下再搅拌2hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:65%-95%,7min),得到标题化合物(30mg,68umol,45.2%产率)。lcms(esi):rt=0.891min,针对c
25h19
f3n2o2计算的质量436.43m/z实测值437.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.54(d,j=1.5hz,2h),8.10(d,j=8.8hz,1h),7.98-7.88(m,2h),7.83(dt,j=1.8,7.7hz,1h),7.66(d,j=8.6hz,2h),7.59(t,j=7.9hz,1h),7.52(d,j=8.0hz,1h),7.32(ddd,j=0.9,5.0,7.5hz,1h),7.23(d,j=7.0hz,1h),7.13(d,j=8.6hz,2h),5.34(q,j=7.0hz,1h),1.64(d,j=7.1hz,3h)。实施例28:(s)-n-(1-甲氧基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物28)
[0301]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)、dipea(58.3mg,0.45mmol,78.6ul,3eq)和hatu(85.8mg,0.22mmol,1.5eq)在dcm(3ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入(2s)-1-甲氧基丙烷-2-胺(16.1mg,0.18mmol,1.2eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];
b%:60%-90%,7min),得到标题化合物(40mg,99.1umol,65.9%产率)。lcms(esi):rt=0.995min,针对c
22h20
f3no3计算的质量403.39m/z实测值404.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.46(d,j=1.5hz,1h),8.09(d,j=8.8hz,1h),7.96-7.87(m,2h),7.66(d,j=8.8hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.6hz,1h),7.13(d,j=8.6hz,2h),4.40(sxt,j=6.5hz,1h),3.59-3.53(m,1h),3.50-3.45(m,1h),3.44-3.39(m,3h),1.30(d,j=6.8hz,3h).。实施例29:(s)-n-(1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物29)
[0302]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)、dipea(58.3mg,0.45mmol,78.6ul,3eq)和hatu(85.8mg,0.22mmol,1.5eq)在dcm(3ml)中的混合物在25℃下搅拌1hr。然后向该混合物中加入(1s)-1-(2-吡啶基)乙胺(22mg,0.18mmol,1.2eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 150*25mm*5um;流动相:[水(10mm nh4hco3)-acn];b%:66%-76%,8min),得到标题化合物(32mg,72.5umol,48.2%产率)。lcms(esi):rt=0.886min,针对c
25h19
f3n2o2计算的质量436.34m/z实测值437.0[m+h]
+
;1h nmr(400mhz,cd3odδ8.58-8.51(m,2h),8.12(d,j=8.8hz,1h),7.99-7.90(m,2h),7.84(dt,j=1.6,7.8hz,1h),7.68(d,j=8.6hz,2h),7.61(t,j=7.9hz,1h),7.53(d,j=7.9hz,1h),7.33(dd,j=5.1,6.9hz,1h),7.25(d,j=7.5hz,1h),7.15(d,j=8.6hz,2h),5.34(q,j=7.1hz,1h),1.65(d,j=7.0hz,3h)。实施例30:n-(2-(甲基氨基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物30)
[0303]
将n-甲基-n-[2-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氨基甲酸叔丁酯(20mg,40.9umol,1eq)在hcl/二氧杂环己烷(4m,51.1ul,5eq)中的溶液在25℃下搅拌1hr。减压浓缩反应混合物以除去溶剂。残余物通过prep-hplc纯化,得到标题化合物(5.0mg,11.8umol,28.8%产率,hcl)。lcms(esi):rt=0.742min,针对c
21h19
f3n2o2计算的质量388.38m/z实测值389.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.56(s,1h),8.14(d,j=8.8hz,1h),7.98(d,j=8.8hz,1h),7.93(d,j=8.3hz,1h),7.68(d,j=8.5hz,2h),7.62(t,j=
7.9hz,1h),7.26(d,j=7.5hz,1h),7.15(d,j=8.5hz,2h),3.79(br t,j=5.4hz,2h),3.30(br s,2h),2.80(s,3h)。实施例31:n-(2-(n-甲基氰胺基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物31)
[0304]
向n-[2-(甲基氨基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(50mg,0.12mmol,1eq)在dcm(1ml)中的溶液中加入tea(52.1mg,0.51mmol,71.6ul,4eq)和brcn(40.9mg,0.38mmol,28.4ul,3eq)。将混合物在0℃下搅拌1hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(2.8mg,6.6umol,5.1%产率)。lcms(esi):rt=0.819min,针对c
22h18
f3n3o2计算的质量413.39m/z实测值435.9[m+na]
+
;1h nmr(400mhz,cd3od)δ8.50(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.97-7.89(m,2h),7.68(d,j=8.5hz,2h),7.61(t,j=7.9hz,1h),7.25(d,j=7.5hz,1h),7.15(d,j=8.8hz,2h),3.70(t,j=5.6hz,2h),3.38-3.34(m,2h),3.00(s,3h)。实施例32:n-异丙基-7-(4-(三氟甲基)苯氧基)苯并[b]噻吩-2-甲酰胺(化合物32)
[0305]
向7-[4-(三氟甲基)苯氧基]苯并噻吩-2-甲酸(30mg,88.6umol,1.2eq)在dmf(1ml)中的溶液中加入hatu(56.2mg,0.14mmol,2eq)和diea(38.2mg,0.29mmol,51.4ul,4eq)。将混合物在25℃下搅拌0.5hr。向溶液中添加异丙胺(4.3mg,73.9umol,6.3ul,1eq)。将混合物在25℃下搅拌0.5hr。向溶液中添加h2o(5ml)。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(9.6mg,25.4umol,34.3%产率)。lcms(esi):rt=0.889min,针对c
19h16
f3no2s计算的质量379.40m/z实测值379.9[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.60(d,j=7.6hz,1h),8.20(s,1h),7.85(d,j=7.8hz,1h),7.77(d,j=8.6hz,2h),7.52(t,j=7.9hz,1h),7.22(dd,j=2.3,8.3hz,3h),4.06(qd,j=6.7,13.8hz,1h),1.18(d,j=6.6hz,6h)。实施例33:(r)-n-(1-羟基丙烷-2-基)-7-(4-(三氟甲基)苯氧基)苯并[b]噻吩-2-甲酰胺(化合物33)
[0306]
向(2r)-2-氨基丙烷-1-醇(5.5mg,73.9umol,5.7ul,1eq)和7-[4-(三氟甲基)苯氧基]苯并噻吩-2-甲酸(30mg,88.6umol,1.2eq)在dmf(1ml)中的溶液中加入diea(38.2mg,0.29mmol,51.4ul,4eq)和hatu(56.2mg,0.14mmol,2eq)。将混合物在25℃下搅拌1hr。将h2o(5ml)添加到溶液中。将混合物用乙酸乙酯(8ml*3)萃取。合并的有机层用盐水(12ml*2)洗涤,经无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(3.0mg,7.5umol,10.2%产率)。lcms(esi):rt=0.803min,针对c
19h16
f3no3s计算的质量395.40m/z实测值395.9[m+h]
+
,1h nmr(400mhz,cd3od)δ8.07(s,1h),7.80(d,j=7.5hz,1h),7.70(d,j=8.5hz,2h),7.49(t,j=7.9hz,1h),7.19(d,j=8.5hz,2h),7.13(d,j=7.3hz,1h),4.22-4.14(m,1h),3.67-3.58(m,2h),1.28(d,j=6.8hz,3h)。实施例34:n-(3-(甲基氨基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物34)
[0307]
将n-甲基-n-[3-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]丙基]氨基甲酸叔丁酯(0.02g,39.8umol,1eq)在hcl/etoac(4m,0.49ml,50eq)中的混合物在25℃下搅拌1hr。真空浓缩该混合物,得到粗产物。残余物通过prep-hplc纯化,得到标题化合物(8.5mg,19.3umol,48.6%产率,hcl)。lcms(esi):rt=0.745min,针对c
22h21
f3n2o2计算的质量402.41m/z实测值403.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.52(s,1h),8.13(d,j=8.8hz,1h),7.92(d,j=8.4hz,2h),7.68(d,j=8.6hz,2h),7.62(t,j=7.9hz,1h),7.26(d,j=7.5hz,1h),7.15(d,j=8.5hz,2h),3.58(t,j=6.6hz,2h),3.11(br t,j=7.2hz,2h),2.05(quin,j=7.0hz,2h)。实施例35:n-(3-(n-甲基氰胺基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物35)
[0308]
将n-[3-(甲基氨基)丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(0.048g,
0.11mmol,1eq)、tea(48.2mg,0.47mmol,66.4ul,4eq)和brcn(37.9mg,0.35mmol,26.3ul,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。将混合物用盐水(3ml)洗涤,经无水na2so4干燥并真空浓缩,得到粗产物。残余物通过prep-hplc纯化,得到标题化合物(30.5mg,71.3umol,59.8%产率)。lcms(esi):rt=0.957min,针对c
23h20
f3n3o2计算的质量427.42m/z实测值428.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.48(d,j=1.3hz,1h),8.11(d,j=8.8hz,1h),7.95-7.88(m,2h),7.68(d,j=8.6hz,2h),7.60(t,j=7.9hz,1h),7.24(d,j=7.4hz,1h),7.15(d,j=8.5hz,2h),3.55(t,j=6.9hz,2h),3.17(t,j=7.1hz,2h),2.93(s,3h),2.07-1.98(m,2h)。实施例36:n-(1-苯基环丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物36)5-[4-(三氟甲基)苯氧基]萘-2-甲酸甲酯
[0309]
在o2下,向5-羟基-2-萘甲酸甲酯(3.6g,17.80mmol,1eq)和(4-(三氟甲基)苯基)硼酸(6.76g,35.61mmol,2eq)在dcm(120ml)中的溶液中加入diea(9.20g,71.21mmol,12.40ml,4eq)和cu(oac)2(6.47g,35.61mmol,2eq)。将混合物在真空下脱气,并用o2吹扫3次。将混合物在o2(15psi)下于30℃搅拌12小时。过滤混合物。将滤液用h2o(250ml)稀释,用ea(500ml*3)萃取。合并的有机层用盐水(300ml)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化,得到5-[4-(三氟甲基)苯氧基]萘-2-甲酸甲酯(2.5g,7.22mmol,20.3%产率)和1(1.5g,7.42mmol,20.8%产率)。5-[4-(三氟甲基)苯氧基]萘-2-甲酸
[0310]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸甲酯(200mg,0.58mmol,1eq)在meoh(1.5ml)、thf(0.5ml)和h2o(0.5ml)中的混合物中加入naoh(2m,2.89ml,10eq)。将混合物在30℃下搅拌1h。将混合物浓缩。将残余物用h2o(20ml)稀释,并用1n hcl调节至ph=6-7。将混合物用ea(40ml*3)萃取。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤并减压浓缩,得到5-[4-(三氟甲基)苯氧基]萘-2-甲酸(220mg,粗品)。n-(1-苯基环丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0311]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(30mg,90.3umol,1eq)在dcm(1ml)中的溶液中加入diea(46.7mg,0.36mmol,63ul,4eq)和hatu(51.5mg,0.14mmol,1.5eq)。将混合物在30℃下搅拌0.5h。向混合物中添加1-苯基环丙烷-1-胺(23.0mg,0.14mmol,1.5eq,hcl)。将混合物在30℃下搅拌1h。将混合物用h2o(10ml)稀释,用ea(20ml*3)萃取。合并的有机层
用盐水(10ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(16.6mg,36.9umol,40.8%产率)。lcms(esi):rt=1.053min,针对c
27h20
f3no2计算的质量447.14,m/z实测值448.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.37(d,j=1.0hz,1h),8.12(d,j=8.8hz,1h),7.84(dd,j=1.6,8.8hz,1h),7.78(d,j=8.3hz,1h),7.59(d,j=8.6hz,2h),7.50(t,j=7.9hz,1h),7.38-7.27(m,4h),7.24-7.17(m,1h),7.14(d,j=7.4hz,1h),7.06(d,j=8.6hz,2h),6.98(s,1h),1.47-1.35(m,4h)。实施例37:n-(3-苯基氧杂环丁烷-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物37)5-(4-(三氟甲基)苯氧基)-2-萘甲酸
[0312]
向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸甲酯(2g,5.78mmol,1eq)在meoh(16ml)和thf(4ml)中的溶液中加入在h2o(4ml)中的naoh(2.31g,57.75mmol,10eq)。将混合物在25℃下搅拌1hr。将混合物浓缩。向残余物中添加1n hcl直到ph=6-7。将混合物用ea(20ml*3)萃取。有机层经na2so4干燥,过滤并浓缩,得到化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(2.5g,粗品)。n-(3-苯基氧杂环丁烷-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0313]
向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(50.0mg,0.15mmol,1eq)、化合物3-苯基氧杂环丁烷-3-胺(22.5mg,0.15mmol,1eq)和hatu(85.8mg,0.23mmol,1.5eq)在dcm(0.5ml)中的溶液中加入diea(38.9mg,0.30mmol,52ul,2eq)。将混合物在25℃下搅拌2hr。将混合物用水(5ml)稀释。将混合物用ea(10ml*3)萃取。有机层经na2so4干燥,过滤并浓缩。残余物通过prep-hplc纯化,得到标题化合物(2.0mg,4.4umol,2.9%产率)。lcms(esi):rt=0.895min,针对c
27h20
f3no3计算的质量463.14,m/z实测值464.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.45(d,j=1.4hz,1h),8.17(d,j=8.9hz,1h),7.89(dd,j=1.8,8.8hz,1h),7.81(d,j=8.4hz,1h),7.61(br d,j=7.8hz,4h),7.54(t,j=7.9hz,1h),7.42(t,j=7.6hz,2h),7.36-7.30(m,1h),7.17(d,j=7.5hz,1h),7.09(d,j=8.5hz,2h),7.05(s,1h),5.21(d,j=6.8hz,2h),5.08(d,j=6.9hz,2h)。实施例38:(r)-n-(1-环丙基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物38)和(s)-n-(1-环丙基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物39)
n-(1-环丙基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0314]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入1-环丙基乙胺(28.1mg,0.33mmol,1.1eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-(1-环丙基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(99mg,0.24mmol,82.3%产率)。(r)-n-(1-环丙基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物38)和(s)-n-(1-环丙基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物39)
[0315]
外消旋化合物n-(1-环丙基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(99mg,0.24mmol,1eq)通过sfc拆分(柱:daicel chiralpak as-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:30%-30%,min),得到化合物38(20mg,49.6umol,20%产率)lcms(esi):rt=1.042min,针对c
23h20
f3no2计算的质量399.41m/z实测值400.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.46(s,1h),8.09(br d,j=8.8hz,1h),7.95-7.84(m,2h),7.69-7.54(m,3h),7.25-7.18(m,1h),7.14(br d,j=8.3hz,2h),3.63-3.50(m,1h),1.37(d,j=6.8hz,4h),1.07(dt,j=4.3,8.7hz,1h),0.65-0.37(m,3h),0.36-0.25(m,1h),和化合物39(20mg,49.6umol,20%产率)lcms(esi):rt=1.036min,针对c
23h20
f3no2计算的质量399.41m/z实测值400.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.45(s,1h),8.08(dd,j=4.1,8.7hz,1h),7.95-7.83(m,2h),7.68-7.52(m,3h),7.23-7.08(m,3h),3.62-3.49(m,1h),1.37(d,j=6.8hz,3h),1.13-1.01(m,1h),0.63-0.37(m,3h),0.36-0.23(m,1h)。实施例39:(r)-n-(1-(氧杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物40)和(s)-n-(1-(氧杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物41)
n-(1-(氧杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0316]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入1-(氧杂环丁烷-3-基)乙胺(33.4mg,0.33mmol,1.1eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(氧杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(66.2mg,0.15mmol,50.8%产率)。(r)-n-(1-(氧杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物40)和(s)-n-(1-(氧杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物41)
[0317]
外消旋化合物n-[1-(氧杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(66.2mg,0.15mmol,1eq)通过sfc拆分(柱:daicel chiralpak ad-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:30%-30%,min),得到化合物40(10.8mg,25.6umol,16.1%产率)lcms(esi):rt=0.954min,针对c
23h20
f3no3计算的质量415.41m/z实测值416.0[m+h]
+
,1h nmr(400mhz,cd3od)δ8.46(d,j=1.5hz,1h),8.11(d,j=8.8hz,1h),7.93-7.87(m,2h),7.70-7.57(m,3h),7.24(d,j=7.5hz,1h),7.15(br d,j=8.5hz,2h),4.67-4.51(m,5h),1.24(d,j=6.8hz,3h),和化合物41(19.1mg,45.2umol,28.4%产率)lcms(esi):rt=0.949min,针对c
23h20
f3no3计算的质量415.41m/z实测值416.0[m+h]
+
,1h nmr(400mhz,cd3od)δ8.34(s,1h),7.99(d,j=8.8hz,1h),7.81-7.76(m,2h),7.56(br d,j=8.5hz,2h),7.48(t,j=7.9hz,1h),7.12(d,j=7.5hz,1h),7.03(br d,j=8.5hz,2h),4.55(s,1h),4.51-4.45(m,4h),4.43(t,j=6.1hz,1h),1.15-1.05(m,4h)。实施例40:(r)-6-甲氧基-n-(1-(吡啶-2-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物42)
4-甲氧基-1-硝基-2-(4-(三氟甲基)苯氧基)苯
[0318]
向化合物2-氟-4-甲氧基-1-硝基苯(3.00g,17.53mmol,1.0eq)和化合物4-(三氟甲基)苯酚(3.13g,19.28mmol,1.1eq)在dmf(30ml)中的溶液中加入k2co3(4.85g,35.06mmol,2.0eq)。将反应混合物在60℃下搅拌16小时。减压浓缩反应混合物。将混合物用水(20ml)稀释,并将所得混合物用ea(30ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到4-甲氧基-1-硝基-2-(4-(三氟甲基)苯氧基)苯(5.2g,94.7%产率)。1h nmr(400mhz,cdcl3)δ8.13(d,j=9.3hz,1h),7.62(d,j=8.6hz,2h),7.08(d,j=8.5hz,2h),6.82(dd,j=2.6,9.3hz,1h),6.58(d,j=2.6hz,1h),3.86(s,3h)。4-甲氧基-2-(4-(三氟甲基)苯氧基)苯胺
[0319]
向化合物4-甲氧基-1-硝基-2-(4-(三氟甲基)苯氧基)苯(5.20g,16.60mmol,1.0eq)在etoh(50ml)和h2o(10ml)中的溶液中加入fe(9.27g,0.17mol,10eq)和nh4cl(17.76g,0.33mol,20eq)。将反应混合物在80℃下搅拌16小时。将反应混合物过滤,并用ea(80ml)和h2o(40ml)洗涤。分离悬浮液,然后有机层经na2so4干燥,过滤并减压浓缩,得到4-甲氧基-2-(4-(三氟甲基)苯氧基)苯胺(4.6g,粗品)。3-溴-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉
[0320]
将化合物4-甲氧基-2-(4-(三氟甲基)苯氧基)苯胺(1.00g,3.53mmol,1.0eq)和化合物2,2,3-三溴丙醛(2.08g,7.06mmol,2.0eq)在acoh(10ml)中的混合物在110℃下搅拌16小时。减压浓缩反应混合物。将混合物用水(20ml)稀释,然后将悬浮液用naoh(1m)碱化至ph=10。所得混合物用ea(30ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到3-溴-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉(230mg,16.3%产率)。6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸甲酯
[0321]
在n2下,向化合物3-溴-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉(180.0mg,0.45mmol,1.0eq)和tea(183.0mg,1.81mmol,4.0eq)在dmso(3ml)和meoh(2.4ml)中的溶液中加入pd(dppf)cl2(33.1mg,45.2umol,0.1eq)。将悬浮液在真空下脱气,并用co吹扫数次。将混合物在co(45psi)下于80℃搅拌16小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(30ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸甲酯(140mg,82.0%产率)。6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸
[0322]
向化合物6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸甲酯(25.0mg,66.2umol,1.0eq)在thf(0.45ml)和meoh(0.15ml)中的溶液中加入naoh(1m,0.13ml,2.0eq)。将反应混合物在25℃下搅拌2小时。将悬浮液用hcl(1m)调节至ph=5,然后将所得混合物用ea(10ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干,得到6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(20mg,粗品)。(r)-6-甲氧基-n-(1-(吡啶-2-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺
[0323]
向化合物6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(20.0mg,55.0umol,1.0eq)、化合物(r)-1-(吡啶-2-基)乙-1-胺(6.7mg,55.0umol,1.0eq)和dipea(14.2mg,0.11umol,2.0eq)在dcm(1ml)中的溶液中加入hatu(31.4mg,82.5umol,1.5eq)。将反应混合物在25℃下搅拌2小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(8.33mg,32.3%产率)。lcms(esi):rt=0.840min,针对c
25h20
f3n3o3计算的质量467.15,m/z实测值468.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.21(d,j=2.0hz,1h),8.67(s,1h),8.59(d,j=5.0hz,1h),8.28-8.16(m,1h),7.82-7.74(m,1h),7.62(d,j=8.6hz,2h),7.40(d,j=7.5hz,1h),7.34-7.28(m,1h),7.16(d,j=8.5hz,2h),7.03(d,j=2.4hz,1h),6.95(d,j=2.6hz,1h),5.46-5.36(m,1h),3.94(s,3h),1.67(d,j=6.6hz,3h)。实施例41:(s)-6-甲氧基-n-(1-(吡啶-2-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物43)
[0324]
向6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(如实施例40所述制备)(25.0mg,68.8umol,1.0eq)、化合物(s)-1-(吡啶-2-基)乙-1-胺(8.4mg,68.8umol,1.0eq)和dipea(17.8mg,0.14mol,2.0eq)在dcm(1ml)中的溶液中加入hatu(39.2mg,0.10mmol,1.5eq)。将反应混合物在25℃下搅拌1小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(11.25mg,34.9%产率)。lcms(esi):rt=0.843min,针对c
25h20
f3n3o3计算的质量467.44,m/z实测值468.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.20(d,j=1.9hz,1h),8.62(d,j=1.9hz,1h),8.57(d,j=4.6hz,1h),8.14(d,j=6.6hz,1h),7.76-7.68(m,1h),7.62(d,j=8.6hz,2h),7.34(d,j=7.8hz,1h),7.27-7.23(m,1h),7.16(d,j=8.5hz,2h),7.02(d,j=2.4hz,1h),6.95(d,j=2.5hz,1h),5.44-5.34(m,1h),3.94(s,3h),1.63(d,j=6.8hz,3h)。实施例42:(r)-6-甲氧基-n-(1-甲氧基丙烷-2-基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物44)
[0325]
向6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(如实施例40所述制备)(25.0mg,68.8umol,1.0eq)、化合物(r)-1-甲氧基丙烷-2-胺(8.6mg,68.8umol,1.0eq,hcl)和dipea(26.6mg,0.20mmol,3.0eq)在dcm(1ml)中的溶液中加入hatu(39.2mg,0.10mmol,1.5eq)。将反应混合物在25℃下搅拌1小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(11.71mg,38.7%产率)。lcms(esi):rt=0.910min,针对c
22h21
f3n2o4计算的质量434.15,m/z实测值435.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.07(d,j=2.0hz,1h),8.54(d,j=1.9hz,1h),7.61(d,j=8.5hz,2h),7.15(d,j=8.5hz,2h),7.00(d,j=2.5hz,1h),6.94(d,j=2.5hz,1h),6.60(d,j=7.8hz,1h),4.50-4.37(m,1h),3.93(s,3h),3.58-3.53(m,1h),3.51-3.45(m,1h),3.41(s,3h),1.35(d,j=6.8hz,3h)。实施例43:(s)-6-甲氧基-n-(1-甲氧基丙烷-2-基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物45)
[0326]
向6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(如实施例40所述制备)(25.0mg,68.8umol,1.0eq)、化合物(s)-1-甲氧基丙烷-2-胺(6.1mg,68.8umol,1.0eq)和dipea(17.8mg,0.14mol,2.0eq)在dcm(1ml)中的溶液中加入hatu(39.2mg,0.10mmol,1.5eq)。将反应混合物在25℃下搅拌1小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(13.85mg,46.3%产率)。lcms(esi):rt=0.906min,针对c
22h21
f3n2o4计算的质量434.15,m/z实测值435.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.07(d,j=1.9hz,1h),8.54(d,j=1.6hz,1h),7.62(d,j=8.5hz,2h),7.15(d,j=8.5hz,2h),7.00(d,j=2.4hz,1h),6.95(d,j=2.4hz,1h),6.59(d,j=8.0hz,1h),4.49-4.37(m,1h),3.93(s,3h),3.58-3.53(m,1h),3.51-3.46(m,1h),3.41(s,3h),1.35(d,j=6.8hz,3h)。实施例44:(r)-n-(1-(吡嗪-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物46)和(s)-n-(1-(吡嗪-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物47)
n-(1-(吡嗪-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0327]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中添加1-吡嗪-2-基乙胺(40.7mg,0.33mmol,1.1eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-(1-吡嗪-2-基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(22mg,49.7umol,16.5%产率)。(r)-n-(1-(吡嗪-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物46)和(s)-n-(1-(吡嗪-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物47)
[0328]
外消旋化合物n-(1-吡嗪-2-基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(22mg,50.30umol,1eq)通过sfc拆分(柱:regis(s,s)whelk-o1(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:50%-50%,min),得到化合物46(6mg,13.6umol,27.2%产率)lcms(esi):rt=0.970min,针对c
24h18
f3n3o2计算的质量437.41m/z实测值438.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.75(s,1h),8.65-8.62(m,1h),8.56-8.51(m,2h),8.13(d,j=8.8hz,1h),7.97-7.91(m,2h),7.68(d,j=8.5hz,2h),7.61(t,j=7.9hz,1h),7.25(dd,j=0.8,7.8hz,1h),7.16(d,j=8.5hz,2h),5.42(q,j=7.2hz,1h),1.70(d,j=7.3hz,3h);和化合物47(5mg,11.4umol,22.6%产率)lcms(esi):rt=0.974min,针对c
24h18
f3n3o2计算的质量437.41m/z实测值438.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.75(br s,1h),8.64(s,1h),8.54(d,j=1.5hz,2h),8.12(d,j=8.8hz,1h),7.98-7.90(m,2h),7.68(d,j=8.5hz,2h),7.61(t,j=7.9hz,1h),7.27-7.23(m,1h),7.15(d,j=8.5hz,2h),5.42(q,j=7.0hz,1h),1.70(d,j=7.0hz,3h)。实施例45:(r)-n-(1-(1h-咪唑-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物48)和(s)-n-(1-(1h-咪唑-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物49)
n-(1-(1h-咪唑-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0329]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入1-(1h-咪唑-4-基)乙胺(60.9mg,0.33mmol,1.1eq,2hcl),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(1h-咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(103mg,0.23mmol,79.6%产率)。(r)-n-(1-(1h-咪唑-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物48)和(s)-n-(1-(1h-咪唑-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物49)
[0330]
外消旋化合物n-[1-(1h-咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(70mg,0.16mmol,1eq)通过sfc纯化(柱:daicel chiralpak ic(250mm*30mm,5um);流动相:[0.1%nh3h2o ipa];b%:45%-45%,min),得到化合物48(13mg,30.2umol,18.3%产率)lcms(esi):rt=0.860min,针对c
23h18
f3n3o2计算的质量425.40m/z实测值426.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.34(s,1h),7.99(d,j=8.8hz,1h),7.81-7.76(m,2h),7.56(br d,j=8.5hz,2h),7.48(t,j=7.9hz,1h),7.12(d,j=7.5hz,1h),7.03(br d,j=8.5hz,2h),4.55(s,1h),4.51-4.45(m,4h),4.43(t,j=6.1hz,1h),1.15-1.05(m,4h);和化合物49(15mg,34.9umol,21.2%产率)lcms(esi):rt=0.860min,针对c
23h18
f3n3o2计算的质量425.40m/z实测值426.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.37(d,j=1.5hz,1h),7.96(d,j=8.9hz,1h),7.84-7.73(m,2h),7.58-7.51(m,3h),7.45(t,j=7.9hz,1h),7.09(dd,j=0.8,7.6hz,1h),7.00(d,j=8.5hz,2h),6.94(s,1h),5.26(q,j=6.9hz,1h),1.52(d,j=6.9hz,3h)。实施例46:(s)-n-(1-氨基-1-氧代丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物50)
[0331]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和hatu(68.6mg,0.18mmol,1.2eq)在dcm(2ml)中的溶液中添加dipea(77.7mg,0.60mmol,0.10ml,4eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加(2s)-2-氨基丙酰胺(19.8mg,0.15mmol,1.06eq,hcl)。将所得混合物在25℃下搅拌2hr。将反应混合物加入h2o(50ml),并用ea(30ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过prep-hplc纯化,得到标题化合物(31mg,77.0umol,51.2%产率)。lcms(esi):rt=0.785min,针对c
21h17
f3n2o3计算的质量402.37m/z实测值425.1[m+na]
+
;1h nmr(400mhz,dmso-d6)δ8.68-8.58(m,2h),8.03-7.94(m,3h),7.74(d,j=8.8hz,2h),7.64(t,j=8.0hz,1h),7.43(br s,1h),7.33(d,j=7.0hz,1h),7.17(d,j=8.5hz,2h),7.03(s,1h),4.47(quin,j=7.2hz,1h),1.37(d,j=7.3hz,3h)。实施例47:(r)-n-(1-氨基-1-氧代丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物51)
[0332]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和hatu(68.6mg,0.18mmol,1.2eq)在dcm(2ml)中的溶液中添加dipea(77.7mg,0.60mmol,0.10ml,4eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加(2r)-2-氨基丙酰胺(19.8mg,0.15mmol,1.06eq,hcl)。将所得混合物在25℃下搅拌2hr。将反应混合物加入h2o(20ml),并用ea(15ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过prep-hplc纯化,得到标题化合物(30.5mg,75.8umol,50.3%产率)。lcms(esi):rt=0.790min,针对c
21h17
f3n2o3计算的质量402.37m/z实测值425.1.0[m+na]
+
;1h nmr(400mhz,dmso-d6)δ8.69-8.57(m,2h),8.04-7.93(m,3h),7.74(d,j=8.8hz,2h),7.63(t,j=7.9hz,1h),7.43(br s,1h),7.33(d,j=7.5hz,1h),7.16(d,j=8.5hz,2h),7.03(br s,1h),4.47(quin,j=7.1hz,1h),1.37(d,j=7.3hz,3h)。实施例48:(s)-n-(1-(2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物52)和(r)-n-(1-(2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物53)
n-(1-(2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0333]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(0.05g,0.15mmol,1eq)在dmf(3ml)中的溶液中加入hatu(114.4mg,0.30mmol,2eq)和et3n(45.6mg,0.45mmol,62.8ul,3eq)。将混合物在25℃下搅拌0.5hr。向混合物中添加1-(2h-四唑-5-基)乙胺(34.0mg,0.30mmol,2eq)。将混合物在25℃下搅拌2.5h。将混合物用h2o(30ml)猝灭,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(20ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(2h-四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(30mg,70.2umol,46.6%产率)。(s)-n-(1-(2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物52)和(r)-n-(1-(2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物53)
[0334]
外消旋化合物n-[1-(2h-四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(0.02g,46.8umol,1eq)通过sfc拆分(柱:regis(s,s)whelk-o1(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:40%-40%,min)两次,得到化合物52(1.1mg,2.6umol,11.1%产率)lcms(esi):rt=0.929min,针对c
21h16
f3n5o2计算的质量427.38m/z实测值428.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.44(s,1h),8.00(d,j=8.8hz,1h),7.86(br d,j=8.6hz,1h),7.80(d,j=8.3hz,1h),7.56(d,j=8.6hz,2h),7.49(t,j=7.9hz,1h),7.13(d,j=7.4hz,1h),7.03(d,j=8.6hz,2h),5.54(br d,j=6.8hz,1h),1.66(br d,j=6.5hz,3h);和化合物53(3.2mg,7.6umol,32.5%产率)lcms(esi):rt=0.923min,针对c
21h16
f3n5o2计算的质量427.38m/z实测值428.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.41(s,1h),7.96(d,j=8.6hz,1h),7.87-7.72(m,2h),7.53(d,j=8.6hz,2h),7.45(t,j=7.9hz,1h),7.09(d,j=7.5hz,1h),7.00(d,j=8.5hz,2h),5.52(br s,1h),1.61(br d,j=5.6hz,3h)。实施例49:n-(1-(吡啶-2-基)环丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物54)
[0335]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)和hatu(68.6mg,0.18mmol,1.2eq)在dcm(2ml)中的溶液中添加diea(77.7mg,0.60mmol,0.10ml,4eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加1-(2-吡啶基)环丙胺(121.1mg,0.22mmol,1.5eq)。将所得混合物在25℃下搅拌2hr。将反应混合物加入h2o(20ml),并用ea(15ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过prep-hplc纯化。获得标题化合物(17mg,37.9umol,25.1%产率)。lcms(esi):rt=0.783min,针对c
26h19
f3n2o2计算的质量448.44m/z实测值449.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.47(s,1h),8.66(s,1h),8.48-8.44(m,1h),8.03-7.97(m,3h),7.75(d,j=8.5hz,2h),7.70-7.63(m,2h),7.40-7.34(m,2h),7.19-7.13(m,3h),1.61-1.55(m,2h),1.34-1.28(m,2h)。
实施例50:(s)-n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物55)和(r)-n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物56)n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺和n-(1-(2-甲基-2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0336]
向n-[1-(2h-四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(0.2g,0.46mmol,1eq)在dmf(3ml)中的溶液中加入ch3i(132.8mg,0.93mmol,58.2ul,2eq)和k2co3(194.0mg,1.40mmol,3eq)。将混合物在25℃下搅拌3hr。将反应溶液加入到h2o(10ml)中。将混合物用乙酸乙酯(20ml*3)萃取。合并的有机相用盐水(20ml*3)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到n-[1-(2-甲基四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(20.9mg,47.3umol,10.1%产率)和n-[1-(1-甲基四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(20.8mg,47.3umol,10.1%产率)。(s)-n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物55)和(r)-n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物56)
[0337]
外消旋n-(1-(1-甲基-1h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(0.02g,45.3umol,1eq)通过sfc拆分(柱:daicel chiralpak ad-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:40%-40%,min),得到化合物55(2.2mg,4.9umol,21.9%产率)lcms(esi):rt=0.954min,针对c
22h18
f3n5o2计算的质量441.41m/z实测值442.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.40(s,1h),8.00(d,j=8.8hz,1h),7.85-7.74(m,2h),7.58-7.42(m,3h),7.14(d,j=7.5hz,1h),7.03(d,j=8.6hz,2h),5.54(q,j=7.2hz,1h),4.15-4.04(m,3h),1.69(d,j=7.0hz,3h);和化合物56(2.6mg,6.0umol,26.9%产率)lcms(esi):rt=0.957min,针对c
22h18
f3n5o2计算的质量441.41m/z实测值442.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.39(s,1h),8.00(d,j=8.8hz,1h),7.84-7.77(m,2h),7.56(d,j=8.6hz,2h),7.49(t,j=7.9hz,1h),7.13(d,j=7.5hz,1h),7.03(d,j=8.6hz,2h),5.54(q,j=7.0hz,1h),4.09(s,3h),1.69(d,j=7.0hz,3h)。实施例51:(r)-n-(1-(2-甲基-2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物57)和(s)-n-(1-(2-甲基-2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物58)
(r)-n-(1-(2-甲基-2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物57)和(s)-n-(1-(2-甲基-2h-四唑-5-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物58)
[0338]
外消旋化合物n-[1-(2-甲基四唑-5-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(如实施例50所述制备)(0.02g,45.3umol,1eq)通过sfc拆分(柱:phenomenex-cellulose-2(250mm*30mm,10um);流动相:[0.1%nh3h2o ipa];b%:35%-35%,min),得到化合物57(4.8mg,10.8umol,48.0%产率)lcms(esi):rt=0.960min,针对c
22h18
f3n5o2计算的质量441.41m/z实测值442.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.41(d,j=1.0hz,1h),8.00(d,j=8.8hz,1h),7.86-7.76(m,2h),7.56(d,j=8.6hz,2h),7.49(t,j=7.9hz,1h),7.13(d,j=7.6hz,1h),7.04(d,j=8.5hz,2h),5.50(q,j=7.1hz,1h),4.25(s,3h),1.63(d,j=7.1hz,3h);和化合物58(4.5mg,10.1umol,45.0%产率)lcms(esi):rt=0.959min,针对c
22h18
f3n5o2计算的质量441.41m/z实测值442.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.41(s,1h),8.00(d,j=8.8hz,1h),7.86-7.75(m,2h),7.56(d,j=8.6hz,2h),7.48(t,j=7.9hz,1h),7.13(d,j=7.5hz,1h),7.03(d,j=8.6hz,2h),5.50(q,j=7.1hz,1h),4.30-4.20(m,3h),1.63(d,j=7.1hz,3h)。实施例52:(r)-n-(1-环丁基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物59)和(s)-n-(1-环丁基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物60)n-(1-环丁基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0339]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入1-环丁基乙胺(44.9mg,0.33mmol,1.1eq,hcl),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过硅胶柱色谱法纯化。获得化合物n-(1-环丁基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(91mg,0.21mmol,71.6%产率)。
(r)-n-(1-环丁基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物59)和(s)-n-(1-环丁基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物60)
[0340]
外消旋化合物n-(1-环丁基乙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(91mg,0.22mmol,1eq)通过sfc纯化(柱:daicel chiralpak as-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:30%-30%,min),得到化合物59(26.7mg,64.5umol,29.3%产率)lcms(esi):rt=1.068min,针对c
24h22
f3no2计算的质量413.43m/z实测值414.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.44(d,j=1.5hz,1h),8.10(d,j=8.8hz,1h),7.93-7.87(m,2h),7.72-7.55(m,3h),7.24(d,j=7.8hz,1h),7.15(br d,j=8.5hz,2h),4.23-4.13(m,1h),2.56-2.46(m,1h),2.15-2.04(m,2h),1.97-1.78(m,4h),1.18(d,j=6.5hz,3h);和化合物60(18.9mg,45.6umol,20.7%产率)lcms(esi):rt=1.069min,针对c
24h22
f3no2计算的质量413.43m/z实测值414.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.44(d,j=1.5hz,1h),8.10(d,j=8.8hz,1h),7.90(td,j=1.9,8.7hz,2h),7.70-7.56(m,3h),7.24(d,j=7.5hz,1h),7.15(d,j=8.8hz,2h),4.22-4.13(m,1h),2.57-2.45(m,1h),2.16-2.03(m,2h),1.97-1.80(m,4h),1.18(d,j=6.8hz,3h).。实施例53:(r)-n-(丁-3-炔-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物61)和(s)-n-(丁-3-炔-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物62)n-(丁-3-炔-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0341]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入丁-3-炔-2-胺盐酸盐(34.9mg,0.33mmol,1.1eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过硅胶柱色谱法纯化。获得化合物n-(1-甲基丙-2-炔基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(112mg,0.29mmol,96.6%产率)。(r)-n-(丁-3-炔-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物61)和(s)-n-(丁-3-炔-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物62)
[0342]
外消旋化合物n-(1-甲基丙-2-炔基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(98mg,0.25mmol,1eq)通过sfc纯化,得到化合物61(24.6mg,64.1umol,25.1%产率)lcms(esi):rt=0.999min,针对c
22h16
f3no2计算的质量383.36m/z实测值384.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.48(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.95-7.89(m,2h),7.68
(d,j=8.8hz,2h),7.60(t,j=7.9hz,1h),7.25(d,j=7.0hz,1h),7.15(d,j=8.5hz,2h),5.02(dd,j=2.4,6.9hz,1h),2.72(d,j=2.3hz,1h),1.56(d,j=7.0hz,4h);和化合物62(24.8mg,64.8umol,25.3%产率)lcms(esi):rt=0.999min,针对c
22h16
f3no2计算的质量383.36m/z实测值383.9[m+h]
+
;1h nmr(400mhz,cd3od)δ8.48(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.95-7.89(m,2h),7.68(d,j=8.8hz,2h),7.60(t,j=8.0hz,1h),7.25(d,j=7.5hz,1h),7.15(d,j=8.8hz,2h),5.02(dq,j=2.3,7.0hz,1h),2.72(d,j=2.5hz,1h),1.56(d,j=7.0hz,4h)。实施例54:(s)-n-(1-(1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物63)和(r)-n-(1-(1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物64)n-(1-(1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0343]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、hatu(171.6mg,0.45mmol,1.5eq)和dipea(116.6mg,0.90mmol,0.15ml,3eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后向混合物中加入1-(1h-咪唑-2-基)乙胺(48.8mg,0.33mmol,1.1eq,hcl),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(1h-咪唑-2-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(52mg,0.12mmol,40.2%产率)。(s)-n-(1-(1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物63)和(r)-n-(1-(1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物64)
[0344]
外消旋化合物n-[1-(1h-咪唑-2-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(52mg,0.12mmol,1eq)通过sfc纯化,得到化合物63(5.2mg,12.3umol,10.1%产率)lcms(esi):rt=0.855min,针对c
23h18
f3n3o2计算的质量425.40m/z实测值426.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.43(d,j=1.3hz,1h),8.00(d,j=8.8hz,1h),7.85(dd,j=1.8,8.8hz,1h),7.80(d,j=8.3hz,1h),7.56(d,j=8.8hz,2h),7.48(t,j=8.0hz,1h),7.16-7.10(m,1h),7.03(d,j=8.5hz,2h),6.89(s,2h),5.31(q,j=7.0hz,1h),1.58(d,j=7.0hz,3h);和化合物64(21.5mg,50.6umol,41.4%产率)lcms(esi):rt=0.855min,针对c
23h18
f3n3o2计算的质量425.40m/z实测值426.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.55(d,j=1.5hz,1h),8.11(d,j=8.8hz,1h),8.00-7.89(m,2h),7.68(d,j=8.5hz,2h),7.60(t,j=8.0hz,1h),7.24
(dd,j=0.8,7.5hz,1h),7.15(d,j=8.5hz,2h),7.01(s,2h),5.43(q,j=7.0hz,1h),1.70(d,j=7.0hz,3h)。实施例55:(s)-n-(1-(6-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物65)和(r)-n-(1-(6-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物66)1-(4-溴吡啶-2-基)-n-(2,4-二甲氧基苄基)乙胺
[0345]
向1-(6-溴-2-吡啶基)乙酮(3.2g,16.00mmol,1eq)和(2,4-二甲氧基苯基)甲胺(2.67g,16.00mmol,2.41ml,1eq)在dce(30ml)中的溶液中加入hoac(4.80g,79.99mmol,4.57ml,5eq),并在25℃下搅拌1hr,然后添加nabh(oac)3(5.09g,24.00mmol,1.5eq)。将所得混合物在25℃下搅拌15hr。然后添加冰水(30ml),并将混合物用naoh水溶液(2m)中和至ph=9~10。用ea(30ml*3)萃取水相。合并的有机相用盐水(60ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物1-(6-溴-2-吡啶基)-n-[(2,4-二甲氧基苯基)甲基]乙胺(1.6g,4.42mmol,27.6%产率)。n-(1-(6-溴吡啶-2-基)乙基)-n-(2,4-二甲氧基苄基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0346]
在25℃下,向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(473.0mg,1.42mmol,1eq)、hatu(1.08g,2.85mmol,2eq)在dcm(10ml)中的混合物添加dipea(551.9mg,4.27mmol,0.74ml,3eq)。添加后,将混合物在25℃下搅拌1hr,然后添加1-(6-溴-2-吡啶基)-n-[(2,4-二甲氧基苯基)甲基]乙胺(500mg,1.42mmol,1eq)(在dcm(3ml)中)。将所得混合物在25℃下搅拌15hr。将残余物倒入h2o(50ml)中并搅拌5min。用ea(30ml*3)萃取水相。合并的有机相用盐水(50ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物n-[1-(6-溴-2-吡啶基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(650mg,0.97mmol,68.6%产率)。n-(1-(6-溴吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0347]
向n-[1-(6-溴-2-吡啶基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(590mg,0.88mmol,1eq)在dcm(0.5ml)中的溶液中加入tfa(9.09g,
79.69mmol,5.90ml,89.88eq)。将混合物在25℃下搅拌3hr。然后添加冰水(30ml),并将混合物用naoh水溶液(2m)中和至ph=9~10。用ea(30ml*3)萃取水相。合并的有机相用盐水(60ml)洗涤,用无水na2so4干燥,过滤并真空浓缩,得到粗产物。残余物通过急骤硅胶色谱法纯化。获得化合物n-[1-(6-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(425mg,0.82mmol,93.0%产率)。n-(1-(6-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0348]
将n-[1-(6-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(150mg,0.29mmol,1eq)、cu2o(41.6mg,0.29mmol,29.7ul,1eq)、nh3.h2o(134.2mg,1.46mmol,0.14ml,38%,5eq)在二氧杂环己烷(1ml)中的混合物装入密封的反应管中。将反应温度升高至80℃,并将反应混合物在80℃下搅拌16hr。将混合物倒入h2o(30ml)中并搅拌5min。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物n-[1-(6-氨基-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(98mg,0.21mmol,74.5%产率)。(s)-n-(1-(6-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物65)和(r)-n-(1-(6-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物66)
[0349]
外消旋化合物n-[1-(6-氨基-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(85mg,0.18mmol,1eq)通过sfc纯化,得到化合物65(20.2mg,42.0umol,22.3%产率)lcms(esi):rt=0.776min,针对c
25h20
f3n3o2计算的质量451.44m/z实测值452.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.51(s,1h),8.10(d,j=8.9hz,1h),7.98-7.87(m,2h),7.66(d,j=8.5hz,2h),7.58(t,j=8.0hz,1h),7.43(t,j=7.7hz,1h),7.23(d,j=7.6hz,1h),7.13(d,j=8.6hz,2h),6.66(d,j=7.3hz,1h),6.46(d,j=8.1hz,1h),5.18-5.07(m,1h),1.56(d,j=7.0hz,3h);和化合物66(17.6mg,37.4umol,19.8%产率)lcms(esi):rt=0.773min,针对c
25h20
f3n3o2计算的质量451.44m/z实测值452.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.51(s,1h),8.10(d,j=8.8hz,1h),7.98-7.88(m,2h),7.66(d,j=8.5hz,2h),7.59(t,j=7.9hz,1h),7.42(t,j=7.8hz,1h),7.23(d,j=7.5hz,1h),7.13(d,j=8.4hz,2h),6.66(d,j=7.5hz,1h),6.46(d,j=8.3hz,1h),5.12(q,j=6.9hz,1h),1.56(d,j=6.9hz,3h)。实施例56:n-异丙基-4-(4-(三氟甲基)苯氧基)喹啉-7-甲酰胺(化合物67)7-溴-4-氯喹啉
[0350]
将pocl3(1.03g,6.72mmol,7.53eq)加入到化合物7-溴喹啉-4-醇(200.0mg,0.89mmol,1.0eq)在二氧杂环己烷(2ml)中的混合物中,并将混合物在90℃下搅拌5小时。使
反应混合物冷却至25℃。将混合物倒入水(10ml)中,并用固体na2co3调节至ph=8。所得混合物用ea(50ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到7-溴-4-氯喹啉(170mg,78.5%产率)。1h nmr(400mhz,cdcl3)δ8.81(d,j=4.5hz,1h),8.34(d,j=1.8hz,1h),8.13(d,j=9.0hz,1h),7.80-7.74(m,1h),7.76(dd,j=2.0,9.0hz,1h),7.53(d,j=4.8hz,1h)。7-溴-4-(4-(三氟甲基)苯氧基)喹啉
[0351]
向化合物7-溴-4-氯喹啉(120.0mg,0.49mmol,1.0eq)和化合物4-(三氟甲基)苯酚(96.2mg,0.59mmol,1.2eq)在dmf(1.5ml)中的溶液中加入k2co3(136.7mg,0.98mmol,2.0eq)。将反应混合物在90℃下搅拌16小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到7-溴-4-(4-(三氟甲基)苯氧基)喹啉(52mg,27.6%产率)。lcms(esi):rt=0.894min,针对c
16
h9brf3no计算的质量366.98,m/z实测值369.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.73(d,j=5.1hz,1h),8.36(d,j=1.3hz,1h),8.21(d,j=8.8hz,1h),7.77(d,j=8.6hz,2h),7.72(dd,j=1.8,8.8hz,1h),7.31(d,j=8.4hz,2h),6.65(d,j=5.1hz,1h)。4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯
[0352]
在n2下,向化合物7-溴-4-(4-(三氟甲基)苯氧基)喹啉(50.0mg,0.13mmol,1.0eq)和tea(54.9mg,0.54mmol,4.0eq)在meoh(0.8ml)和dmso(1ml)中的溶液中加入pd(dppf)cl2(9.9mg,13.5umol,0.1eq)。将悬浮液在真空下脱气,并用co吹扫数次。将混合物在co(45psi)下于80℃搅拌16小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(30ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯(40mg,80.5%产率)。lcms(esi):rt=0.867min,针对c
18h12
f3no3计算的质量347.08,m/z实测值348.0[m+h]
+
。4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯
[0353]
向化合物4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯(25.0mg,72.0umol,1.0eq)在thf(0.6ml)和meoh(0.2ml)中的溶液中加入naoh(1m,0.14ml,2.0eq)。将反应混合物在25℃下搅拌1小时。添加h2o(5ml),然后将混合物用hcl(1m)调节至ph=5。所得混合物用ea(10ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干,得到4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯(20mg,83.3%产率)。n-异丙基-4-(4-(三氟甲基)苯氧基)喹啉-7-甲酰胺
[0354]
向化合物4-(4-(三氟甲基)苯氧基)喹啉-7-甲酸甲酯(20.0mg,60.0umol,1.0eq)、异丙胺(3.6mg,60.0umol,1.0eq)和dipea(15.5mg,0.12mmol,2.0eq)在dcm(1ml)中的溶液中加入hatu(34.2mg,90.0umol,1.5eq)。将反应混合物在25℃下搅拌1小时。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(10.42mg,45.4%产率)。lcms(esi):rt=0.820min,针对c
20h17
f3n2o2计算的质量374.12,m/z实测值375.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.79(d,j=5.3hz,1h),8.42-8.35(m,2h),8.09-8.03(m,1h),7.76(d,j=8.5hz,2h),7.32(d,j=8.5hz,2h),6.69(d,j=5.0hz,1h),6.19(d,j=7.5hz,1h),4.43-4.30(m,1h),1.33(d,j=6.5hz,6h)。
实施例57:(r)-n-(1-(1-甲基-1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物68)和(s)-n-(1-(1-甲基-1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物69)n-(1-(1-甲基-1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0355]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(200mg,0.60mmol,1eq)、dipea(233.3mg,1.81mmol,0.31ml,3eq)和hatu(343.3mg,0.90mmol,1.5eq)在dcm(2ml)中的混合物在25℃下搅拌1hr。然后在混合物中加入1-(1-甲基咪唑-2-基)乙胺(90.4mg,0.72mmol,1.2eq),并将混合物在25℃下再搅拌1hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(1-甲基咪唑-2-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg,0.20mmol,34.0%产率)。(r)-n-(1-(1-甲基-1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物68)和(s)-n-(1-(1-甲基-1h-咪唑-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物69)
[0356]
n-[1-(1-甲基咪唑-2-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg,0.20mmol,1eq)通过sfc拆分,得到化合物68(22.6mg,51.6umol,25.2%产率)lcms(esi):rt=0.872min,针对c
24h20
f3n3o2计算的质量439.43m/z实测值440.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.48(s,1h),8.08(d,j=8.8hz,1h),7.94-7.86(m,2h),7.65(d,j=8.8hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.5hz,1h),7.12(d,j=8.5hz,2h),7.03(s,1h),6.91(d,j=1.3hz,1h),5.50(q,j=7.0hz,1h),3.76(s,3h),1.69-1.64(m,1h),1.66(d,j=7.0hz,2h);和化合物69(10.5mg,23.8umol,11.6%产率)lcms(esi):rt=0.872min,针对c
24h20
f3n3o2计算的质量439.43m/z实测值440.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.46(d,j=1.5hz,1h),8.06(d,j=8.8hz,1h),7.92-7.83(m,2h),7.63(d,j=8.5hz,2h),7.55(t,j=8.0hz,1h),7.19(dd,j=0.8,7.5hz,1h),7.10(d,j=8.5hz,2h),7.01(d,j=1.3hz,1h),6.90(d,j=1.3hz,1h),5.49(q,j=6.9hz,1h),3.74(s,3h),1.65(d,j=7.0hz,3h)。实施例58:n-异丙基-5-(4-(三氟甲基)苯氧基)喹啉-2-甲酰胺(化合物70)
5-(4-(三氟甲基)苯氧基)喹啉
[0357]
向化合物喹啉-5-醇(400.0mg,2.76mmol,1.0eq)、化合物1-碘-4-(三氟甲基)苯(899.4mg,3.31mmol,1.2eq)、cui(524.8mg,2.76mmol,1.0eq)和化合物二甲基甘氨酸(85.2mg,0.82mmol,0.3eq)在二氧杂环己烷(10ml)中的溶液中加入cs2co3(1.80g,5.51mmol,2.0eq)。将反应混合物在n2下于110℃搅拌16小时。减压浓缩反应混合物。将混合物用水(30ml)稀释,并将所得混合物用ea(50ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到5-(4-(三氟甲基)苯氧基)喹啉(270mg,33.2%产率)。lcms(esi):rt=0.848min,针对c
16h10
f3no计算的质量289.07,m/z实测值290.0[m+h]
+
。5-(4-(三氟甲基)苯氧基)喹啉1-氧化物
[0358]
向化合物5-(4-(三氟甲基)苯氧基)喹啉(250.0mg,0.86mmol,1.0eq)在dcm(5ml)中的溶液中加入m-cpba(350.9mg,1.73mmol,85%,2.0eq)。将反应混合物在25℃下搅拌16小时。将混合物用naoh(30ml,1m)稀释,并将所得混合物用dcm(50ml*2)萃取。合并的有机层用naoh(25ml,1m)、盐水(25ml)洗涤,经na2so4干燥,过滤并减压浓缩至干,得到5-(4-(三氟甲基)苯氧基)喹啉1-氧化物(220mg,83.3%产率)。5-(4-(三氟甲基)苯氧基)喹啉-2-甲腈
[0359]
向化合物5-(4-(三氟甲基)苯氧基)喹啉1-氧化物(100.0mg,0.32mmol,1.0eq)在1,2-二氯乙烷(2ml)中的溶液中加入tmscn(35.7mg,0.36mmol,1.1eq)和二甲基氨基甲酰氯(35.2mg,0.32mmol,1.0eq)。将反应混合物在60℃下搅拌16小时。减压浓缩反应混合物。将混合物用水(20ml)稀释,并将所得混合物用ea(30ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化,得到5-(4-(三氟甲基)苯氧基)喹啉-2-甲腈(75mg,72.8%产率)。5-(4-(三氟甲基)苯氧基)喹啉-2-甲酸
[0360]
将化合物5-(4-(三氟甲基)苯氧基)喹啉-2-甲腈(40.0mg,0.12mmol,1.0eq)在浓hcl(1ml)中的混合物在100℃下搅拌16小时。将反应混合物冷却至25℃,然后过滤悬浮液,得到5-(4-(三氟甲基)苯氧基)喹啉-2-甲酸(35mg,粗品)。n-异丙基-5-(4-(三氟甲基)苯氧基)喹啉-2-甲酰胺
[0361]
向化合物5-(4-(三氟甲基)苯氧基)喹啉-2-甲酸(35.0mg,94.6umol,1eq,hcl)、异丙胺(6.7mg,0.11mmol,1.2eq)和dipea(36.7mg,0.28mmol,3.0eq)在dcm(1ml)中的溶液中加入hatu(54.0mg,0.14mmol,1.5eq)。将反应混合物在25℃下搅拌1小时。减压浓缩反应混
合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化,得到标题化合物(5.81mg,16.2%产率)。lcms(esi):rt=1.048min,针对c
21h18
f4n2o3计算的质量374.12,m/z实测值375.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.61(d,j=8.6hz,1h),8.34(d,j=8.6hz,1h),8.09(d,j=7.8hz,1h),7.98(d,j=8.6hz,1h),7.71(t,j=8.1hz,1h),7.64(d,j=8.1hz,2h),7.13(d,j=8.0hz,3h),4.42-4.28(m,1h),1.37(d,j=6.5hz,6h)。实施例59:(s)-n-(1-(4-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物71)和(r)-n-(1-(4-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物72)n-(1-(4-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0362]
向n-[1-(4-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(200mg,0.38mmol,1eq)在二氧杂环己烷(1ml)中的溶液中加入nh3.h2o(2.73g,23.37mmol,3ml,30%,60.21eq)和cu2o(55.53mg,0.38mmol,39.6ul,1eq)。将混合物在密封管中在100℃下搅拌16hr。将混合物加入h2o(20ml),并用ea(15ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化,得到n-[1-(4-氨基-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(88mg,0.19mmol,49.7%产率)。(s)-n-(1-(4-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物71)和(r)-n-(1-(4-氨基吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物72)
[0363]
外消旋化合物n-[1-(4-氨基-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(88mg,0.19mmol,1eq)通过sfc纯化,得到化合物71(22.6mg,50.0umol,25.6%产率)lcms(esi):rt=0.879min,针对c
25h20
f3n3o2计算的质量451.44m/z实测值452.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.88(br d,j=7.8hz,1h),8.64(s,1h),8.04-7.91(m,4h),7.74(d,j=8.5hz,2h),7.64(t,j=7.9hz,1h),7.33(d,j=7.5hz,1h),7.16(d,j=8.4hz,2h),6.52(s,1h),6.34(br d,j=5.5hz,1h),5.96(s,2h),5.08-4.98(m,1h),1.48(d,j=7.0hz,3h);和化合物72(24.5mg,53.1umol,27.28%产率)lcms(esi):rt=0.823min,针对c
25h20
f3n3o2计算的质量451.44m/z实测值452.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.92(br d,j=7.8hz,1h),8.65(s,1h),8.06-7.90(m,4h),7.75(d,j=8.5hz,2h),7.64(t,j=7.9hz,1h),7.34(d,j=7.5hz,1h),7.16(d,j=8.4hz,2h),6.54(s,1h),6.37(br d,j=5.6hz,1h),
6.15(br s,2h),5.04(quin,j=7.0hz,1h),1.49(d,j=7.0hz,3h)。实施例60:(s)-n-(1-(4-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物73)和(r)-n-(1-(4-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物74)n-(1-(4-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0364]
向n-[1-(4-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(200mg,0.38mmol,1eq)在二氧杂环己烷(1ml)中的溶液中加入n-甲基甲胺(2.67g,23.69mmol,3ml,40%,60eq)和cu2o(55.5mg,0.38mmol,39.6ul,1eq)。将混合物在密封管中在100℃下搅拌16hr。将反应混合物加入h2o(20ml),并用ea(20ml*3)萃取。合并的有机层用盐水(30ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化,得到n-[1-[4-(二甲基氨基)-2-吡啶基]乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(134mg,0.27mmol,69.8%产率)。(s)-n-(1-(4-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物73)和(r)-n-(1-(4-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物74)
[0365]
外消旋化合物n-[1-[4-(二甲基氨基)-2-吡啶基]乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(95mg,0.19mmol,1eq)通过sfc纯化,得到化合物73(24.3mg,50.0umol,25.2%产率)lcms(esi):rt=0.885min,针对c
27h24
f3n3o2计算的质量479.49m/z实测值480.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.88(d,j=8.0hz,1h),8.61(s,1h),8.08(d,j=5.9hz,1h),8.03-7.95(m,3h),7.74(d,j=8.5hz,2h),7.63(t,j=7.9hz,1h),7.33(d,j=7.6hz,1h),7.17(d,j=8.6hz,2h),6.68(s,1h),6.54-6.47(m,1h),5.13(quin,j=7.2hz,1h),2.98-2.90(m,6h),1.49(d,j=7.0hz,3h),化合物74(39.6mg,81.1umol,40.9%产率)lcms(esi):rt=0.882min,针对c
27h24
f3n3o2计算的质量479.49m/z实测值480.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.88(br d,j=7.9hz,1h),8.61(s,1h),8.08(d,j=5.9hz,1h),8.02-7.95(m,3h),7.74(d,j=8.5hz,2h),7.63(t,j=7.9hz,1h),7.33(d,j=7.6hz,1h),7.17(d,j=8.4hz,2h),6.68(s,1h),6.50(br d,j=5.8hz,1h),5.13(quin,j=7.0hz,1h),2.94(s,6h),1.50(d,j=6.9hz,3h)。实施例61:n-(1-(4-溴吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物75)
1-(4-溴吡啶-2-基)-n-(2,4-二甲氧基苄基)乙胺
[0366]
向1-(4-溴-2-吡啶基)乙酮(10g,49.99mmol,1eq)和(2,4-二甲氧基苯基)甲胺(8.36g,49.99mmol,7.53ml,1eq)在dce(120ml)中的溶液中加入hoac(15.01g,249.96mmol,14.30ml,5eq),并在25℃下搅拌1hr。然后添加nabh(oac)3(15.89g,74.99mmol,1.5eq)。将所得混合物在25℃下搅拌15hr。然后添加冰水(50ml),并将混合物用naoh水溶液(4m)中和至ph=9~10。用ea(100ml*3)萃取水相。合并的有机相用盐水(150ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物1-(4-溴-2-吡啶基)-n-[(2,4-二甲氧基苯基)甲基]乙胺(7.16g,15.29mmol,30.5%产率)。n-(1-(4-溴吡啶-2-基)乙基)-n-(2,4-二甲氧基苄基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0367]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(2g,6.02mmol,1eq)和hatu(2.75g,7.22mmol,1.2eq)在dcm(35ml)中的溶液中添加dipea(3.11g,24.08mmol,4.19ml,4eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加1-(4-溴-2-吡啶基)-n-[(2,4-二甲氧基苯基)甲基]乙胺(2.82g,6.02mmol,1eq)。将所得混合物在25℃下搅拌1.5hr。将反应混合物加入h2o(50ml),并用ea(50ml*3)萃取。合并的有机层用盐水(60ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化,得到n-[1-(4-溴-2-吡啶基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(3.5g,5.15mmol,85.6%产率)。n-(1-(4-溴吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0368]
向n-[1-(4-溴-2-吡啶基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(3.5g,5.26mmol,1eq)在dcm(10ml)中的溶液中加入tfa(61.60g,540.24mmol,40ml,102.7eq)。将混合物在25℃下搅拌16hr。添加冰水(30ml),并将混合物用naoh水溶液(4m)中和至ph=9~10。用ea(40ml*3)萃取水相。合并的有机相用盐水(60ml)洗涤,用无水na2so4干燥,过滤并真空浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化,得到n-[1-(4-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(2.68g,4.99mmol,94.9%产率)。粗产物通过prep-hplc纯化。获得标题化合物(72mg,0.13mmol,75.0%产率)。lcms(esi):rt=0.951min,针对c
25h18
brf3n2o2计算的质量515.32m/z实测值517.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.08(d,j=7.5hz,1h),8.64(s,1h),8.44(d,j=5.3hz,1h),8.06-7.96(m,3h),7.78-7.62(m,4h),7.57(dd,j=1.8,5.3hz,1h),7.34(d,j=7.3hz,1h),7.17(d,j=8.5hz,2h),5.24(quin,j=7.2hz,1h),1.55(d,j=7.0hz,3h)。
实施例62:(s)-n-(1-(6-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物76)和(r)-n-(1-(6-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物77)n-(1-(6-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0369]
将n-[1-(6-溴-2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(如实施例55所述制备)(120mg,0.23mmol,1eq)、cu2o(33.3mg,0.23mmol,23.8ul,1eq)、n-甲基甲胺(1.78g,15.79mmol,2ml,68eq)在二氧杂环己烷(0.5ml)中的混合物装入密封的反应管中。将反应温度升高至80℃,并将反应混合物在80℃下搅拌16hr。将滤液倒入h2o(30ml)中并搅拌5min。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物n-[1-[6-(二甲基氨基)-2-吡啶基]乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(88mg,0.18mmol,78.8%产率)。(s)-n-(1-(6-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物76)和(r)-n-(1-(6-(二甲基氨基)吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物77)
[0370]
外消旋化合物n-[1-[6-(二甲基氨基)-2-吡啶基]乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(88mg,0.18mmol,1eq)通过sfc纯化,得到化合物76(20.7mg,41.0umol,22.3%产率)lcms(esi):rt=0.808min,针对c
27h24
f3n3o2计算的质量479.49m/z实测值480.2[m+h]
+
;1h nmr(400mhz,cd3od)δ8.49(s,1h),8.10(d,j=8.8hz,1h),7.96-7.84(m,2h),7.65(d,j=8.5hz,2h),7.57(t,j=7.9hz,1h),7.46(t,j=7.9hz,1h),7.21(d,j=7.5hz,1h),7.12(d,j=8.5hz,2h),6.61(d,j=7.3hz,1h),6.50(d,j=8.5hz,1h),5.18(q,j=6.8hz,1h),3.09(s,6h),1.59(d,j=6.9hz,3h);和化合物77(22.3mg,46.5umol,25.3%产率)lcms(esi):rt=0.790min,针对c
27h24
f3n3o2计算的质量479.49m/z实测值480.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.49(s,1h),8.10(d,j=8.9hz,1h),7.96-7.84(m,2h),7.65(d,j=8.5hz,2h),7.57(t,j=7.9hz,1h),7.47(t,j=7.9hz,1h),7.21(d,j=7.5hz,1h),7.12(d,j=8.5hz,2h),6.62(d,j=7.4hz,1h),6.50(d,j=8.5hz,1h),5.18(q,j=6.8hz,1h),3.09(s,6h),1.59(d,j=6.9hz,3h)。实施例63:(s)-n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物78)和(r)-n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物79)
(e)-1-(2-氨基吡啶-3-基)乙酮肟
[0371]
向1-(2-氨基吡啶-3-基)乙-1-酮(300mg,2.2mmol,1eq)在吡啶(py)(6ml)中的30℃溶液中加入羟胺(229.7mg,3.31mmol,1.5eq)。将混合物在80℃下搅拌2h。减压浓缩反应混合物以得到残余物,其通过急骤硅胶色谱法纯化,得到(e)-1-(2-氨基吡啶-3-基)乙酮肟(375mg,2.2mmol,99.1%产率)。lcms(esi):rt=0.333min,针对c7h9n3o计算的质量151.07,m/z实测值152.1[m+h]
+
。3-(1-氨基乙基)吡啶-2-胺
[0372]
在剧烈搅拌下,向(e)-1-(2-氨基吡啶-3-基)乙酮肟(200mg,1.3mmol,1eq)和zn(345.3mg,5.3mmol,4eq)的20℃混合物中缓慢加入浓hcl(3ml)。将混合物在90℃下加热16小时。减压浓缩反应混合物以除去溶剂。将残余物用水(20ml)稀释,然后用20℃的2n naoh碱化至ph=9-10,然后用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到3-(1-氨基乙基)吡啶-2-胺(70mg,0.46mmol,34.8%产率)。1h nmr(400mhz,cdcl3)δ7.93(brd,j=4.8hz,1h),7.32(brd,j=7.3hz,1h),6.60(brt,j=6.1hz,1h),6.01(brs,2h),4.16(brs,1h),1.46(br d,j=6.3hz,3h)。n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0373]
向3-(1-氨基乙基)吡啶-2-胺(50mg,0.36mmol,1.6eq)和hatu(129.9mg,0.34mmol,1.5eq)在dmf(1ml)中的20℃溶液中加入5-(4-(三氟甲基)苯氧基)-2-萘甲酸(75.7mg,0.23mmol,1eq)和tea(69.2mg,0.68mmol,95ul,3eq)。将混合物在20℃下搅拌16h。减压浓缩反应混合物以得到残余物,其通过prep-hplc纯化,得到n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(50mg,0.11mmol,48.1%产率)。lcms(esi):rt=0.796min,针对c
25h20
f3n3o2计算的质量451.15,m/z实测值452.0[m+h
+
]。(s)-n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物78)和(r)-n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物79)
[0374]
n-(1-(2-氨基吡啶-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(42mg,93umol,1eq)通过sfc纯化(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:25%-25%,min),得到化合物78(7mg,15umol,16.3%产率)lcms(esi):rt=0.876min,针对c
25h20
f3n3o2计算的质量451.15,m/z实测值452.1[m+h
+
];11h nmr
(400mhz,cdcl3)δ8.37(d,j=1.3hz,1h),8.14(d,j=8.8hz,1h),7.88(brd,j=5.0hz,1h),7.84-7.76(m,2h),7.64-7.57(m,3h),7.54-7.48(m,1h),7.15(d,j=7.0hz,1h),7.07(d,j=8.5hz,2h),6.64(dd,j=5.4,7.2hz,1h),6.54(brd,j=9.3hz,1h),6.03(brs,1h),5.52-5.43(m,1h),1.73(d,j=7.0hz,3h);和化合物79(6mg,13umol,14%产率)lcms(esi):rt=0.876min,针对c
25h20
f3n3o2计算的质量451.15,m/z实测值452.0[m+h
+
];1h nmr(400mhz,cdcl3)δ8.37(d,j=1.5hz,1h),8.14(d,j=8.8hz,1h),7.91(brd,j=4.3hz,1h),7.82-7.77(m,2h),7.62-7.58(m,3h),7.52(t,j=7.9hz,1h),7.15(d,j=7.0hz,1h),7.07(d,j=8.5hz,2h),6.64(dd,j=5.3,7.5hz,1h),6.48(brd,j=9.5hz,1h),5.91(br s,1h),5.55-5.42(m,1h),1.73(d,j=6.8hz,3h)。实施例64:n-[1-(羟基甲基)-2-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物80)2-(叔丁氧羰基氨基)-3-(2-吡啶基)丙酸
[0375]
在0℃下向化合物2-氨基-3-(吡啶-2-基)丙酸(0.2g,0.83mmol,1eq,2hcl)在二氧杂环己烷(10ml)和h2o(5ml)中的溶液中加入na2co3(354.6mg,3.35mmol,4eq)。然后向溶液中逐滴加入boc2o(237.3mg,1.0mmol,0.24ml,1.3eq)。将反应在25℃下搅拌16hr。将反应用h2o(10ml)稀释并用ea(20ml)萃取。水层用0.5m柠檬酸水溶液调节至ph 3-4,并用ea(5*10ml)萃取。有机层经na2so4干燥并浓缩。化合物2-(叔丁氧羰基氨基)-3-(2-吡啶基)丙酸(75mg,0.25mmol,29.9%产率)直接用于下一步。n-[1-(羟基甲基)-2-(2-吡啶基)乙基]氨基甲酸叔丁酯
[0376]
向化合物2-(叔丁氧羰基氨基)-3-(2-吡啶基)丙酸(75mg,0.28mmol,1eq)在thf(1ml)中的溶液中加入lialh4(26.7mg,0.7mmol,2.5eq)。将反应在25℃下搅拌16hr。将反应在45℃下加热16hr。用h2o(1ml)、2m naoh水溶液(1ml)、h2o(10ml)猝灭反应,并用ea(2*10ml)萃取。有机层经na2so4干燥并浓缩。化合物n-[1-(羟基甲基)-2-(2-吡啶基)乙基]氨基甲酸叔丁酯(60mg,0.12mmol,44.7%产率)直接用于下一步。2-氨基-3-(2-吡啶基)丙烷-1-醇
[0377]
向化合物n-[1-(羟基甲基)-2-(2-吡啶基)乙基]氨基甲酸叔丁酯(60mg,0.12mmol,1eq)在dcm(1ml)中的溶液中加入tfa(57.4mg,0.5mmol,37ul,4eq)。将反应在25℃下搅拌1hr。将反应混合物浓缩,得到2-氨基-3-(2-吡啶基)丙烷-1-醇(50mg,粗品,2tfa),其直接用于下一步。n-[1-(羟基甲基)-2-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0378]
向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(21.8mg,65.7umol,1eq)和hatu(30mg,78.9umol,1.2eq)在dcm(1ml)中的溶液中加入化合物2-氨基-3-(2-吡啶基)丙烷-1-醇(25mg,65.7umol,1eq,2tfa),随后加入diea(25.4mg,0.19mmol,34ul,3eq)。将反应在25℃下搅拌1hr。将反应用dcm(15ml)稀释,并用h2o(2*10ml)洗涤。有机层经na2so4干燥并浓缩。残余物通过prep-hplc纯化,得到标题化合物(2.1mg,4.5umol,6.8%产率)。lcms(esi):rt=0.825min,针对c
26h21
f3n2o3计算的质量466.15,m/z实测值467.1[m+h]
+
,1h nmr(400mhz,cdcl3)δ8.60-8.55(m,1h),8.36(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.83(dd,j=1.8,8.8hz,2h),7.79(d,j=8.3hz,1h),7.68(dt,j=1.8,7.7hz,1h),7.60(d,j=8.5hz,2h),7.54-7.49(m,1h),7.30(d,j=7.6hz,1h),7.25-7.19(m,1h),7.15(dd,j=0.8,7.5hz,1h),7.08(d,j=8.4hz,2h),4.59-4.48(m,1h),3.89-3.73(m,2h),3.41-3.32(m,1h),3.28-3.18(m,1h)。实施例65:5,6-二氟-n-异丙基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物81)3-溴-5,6-二氟-8-甲氧基喹啉
[0379]
在115℃下向4,5-二氟-2-甲氧基-苯胺(0.5g,3.14mmol,1eq)在acoh(8ml)中的溶液中加入2,2,3-三溴丙醛(1.20g,4.08mmol,1.3eq)。将混合物在115℃下搅拌3hr。通过添加饱和na2co3(50ml)猝灭反应混合物,并用etoac(30ml*3)萃取。合并的有机层用盐水(50ml*2)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到3-溴-5,6-二氟-8-甲氧基-喹啉(400mg,1.39mmol,44.1%产率)。5,6-二氟-8-甲氧基喹啉-3-甲酸甲酯
[0380]
在n2下向3-溴-5,6-二氟-8-甲氧基-喹啉(0.4g,1.46mmol,1eq)在meoh(4ml)和dmso(6ml)中的溶液中加入pd(dppf)cl2(106.8mg,0.14mmol,0.1eq)和tea(590.7mg,5.84mmol,0.81ml,4.0eq)。将悬浮液在真空下脱气,并用co吹扫数次。将混合物在co(45psi)下于80℃搅拌16hr。将反应混合物过滤,用h2o(60ml)稀释,并用etoac(40ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到5,6-二氟-8-甲氧基-喹啉-3-甲酸甲酯(250mg,0.98mmol,67.6%产率)。获得化合物5,6-二氟-8-甲氧基-喹啉-3-甲酸甲酯(250mg,0.98mmol,67.6%产率)。5,6-二氟-8-羟基喹啉-3-甲酸
[0381]
向5,6-二氟-8-甲氧基-喹啉-3-甲酸甲酯(0.2g,0.78mmol,1eq)在dce(3ml)中的溶液中加入在dce(1ml)中的bbr3(1.58g,6.32mmol,0.60ml,8.0eq)。将混合物在75℃下搅
拌2hr。通过添加饱和na2co3(20ml)猝灭反应混合物,然后用etoac(20ml*2)萃取。然后用hcl(2m)将水相的ph调节至5-6,并将混合物用etoac(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩,得到5,6-二氟-8-羟基-喹啉-3-甲酸(120mg,粗品)。粗产物不经进一步纯化而用于下一步。获得化合物5,6-二氟-8-羟基-喹啉-3-甲酸(120mg,粗品)。5,6-二氟-8-羟基喹啉-3-甲酸甲酯
[0382]
将5,6-二氟-8-羟基-喹啉-3-甲酸(120mg,0.53mmol,1eq)在hcl/meoh(4m,12.00ml,90.06eq)中的溶液在80℃下搅拌1hr。减压浓缩反应混合物,得到5,6-二氟-8-羟基-喹啉-3-甲酸甲酯(130mg,粗品)。粗产物不经进一步纯化而用于下一步。5,6-二氟-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸甲酯
[0383]
向5,6-二氟-8-羟基-喹啉-3-甲酸甲酯(100mg,0.41mmol,1eq)在mecn(0.5ml)中的溶液中加入1-碘-4-(三氟甲基)苯(170.5mg,0.62mmol,92.2ul,1.5eq)、cs2co3(272.4mg,0.83mmol,2.0eq)和cu2o(17.9mg,0.12mmol,12.8ul,0.3eq)、1h-咪唑-5-甲酸(28.1mg,0.25mmol,0.6eq)。将混合物在微波中于80℃搅拌16hr。将反应混合物过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到5,6-二氟-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸甲酯(20mg,52.1umol,12.4%产率)。5,6-二氟-n-异丙基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺
[0384]
向5,6-二氟-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸甲酯(20mg,52.1umol,1eq)在meoh(1ml)中的溶液中加入异丙胺(61.6mg,1.04mmol,89.6ul,20eq)。将混合物在90℃下搅拌16hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化,得到标题化合物(1.9mg,4.6umol,8.9%产率)。lcms(esi):rt=0.793min,针对c
20h15
f5n2o2计算的质量410.34m/z实测值411.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ9.24(br s,1h),8.82(s,1h),7.64(d,j=8.3hz,2h),7.22(dd,j=7.2,10.9hz,1h),7.13(br d,j=8.5hz,2h),6.08(br s,1h),4.39(br s,1h),1.35(d,j=6.3hz,6h)。实施例66:(r)-n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物82)和(s)-n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物83)5-(4-(三氟甲基)苯氧基)-2-萘甲酸
[0385]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸甲酯(500mg,1.44mmol,1eq)在meoh(8ml)中的20℃溶液中加入naoh(2m,3.6ml,5eq)和thf(3ml)。将混合物在20℃下搅拌16h。减压浓缩反应混合物以除去溶剂。残余物用水(20ml)稀释,然后用0℃的2n hcl酸化至ph=2-3,然
后用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到5-(4-(三氟甲基)苯氧基)-2-萘甲酸(440mg,1.28mmol,89%产率)。n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0386]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(50mg,0.15mmol,1eq)和hatu(85.8mg,0.23mmol,1.5eq)在dmf(1ml)中的20℃溶液中加入1-(2-氯苯基)乙-1-胺(28.1mg,0.18mmol,1.2eq)和tea(45.7mg,0.45mmol,62ul,3eq)。将混合物在20℃下搅拌16h。减压浓缩反应混合物以得到残余物,其通过prep-hplc纯化,得到n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(52mg,0.11mmol,73.5%产率)。lcms(esi):rt=0.993min,针对c
26h19
clf3no2计算的质量469.11,m/z实测值470.0[m+h]
+
。(r)-n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物82)和(s)-n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物83)
[0387]
n-(1-(2-氯苯基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(50mg,0.11mmol,1eq)通过sfc纯化,得到化合物82(12mg,25umol,23.8%产率)lcms(esi):rt=1.049min,针对c
26h19
clf3no2计算的质量469.11,m/z实测值470.0[m+h
+
];1h nmr(400mhz,cdcl3)δ8.37(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.86-7.78(m,2h),7.59(d,j=8.5hz,2h),7.51(t,j=8.0hz,1h),7.43(ddd,j=1.6,7.7,14.3hz,2h),7.31-7.27(m,1h),7.26-7.22(m,1h),7.15(d,j=7.5hz,1h),7.07(d,j=8.5hz,2h),6.75(br d,j=7.3hz,1h),5.65(quin,j=7.1hz,1h),1.68(d,j=7.0hz,3h);和化合物83(13mg,28umol,26%产率)lcms(esi):rt=1.056min,针对c
26h19
clf3no2计算的质量469.11,m/z实测值470.0[m+h
+
];1h nmr(400mhz,cdcl3)δ8.37(d,j=1.5hz,1h),8.12(d,j=8.8hz,1h),7.86-7.78(m,2h),7.59(d,j=8.5hz,2h),7.51(t,j=7.9hz,1h),7.43(ddd,j=1.6,7.7,14.3hz,2h),7.32-7.28(m,1h),7.32-7.27(m,1h),7.26-7.22(m,1h),7.17-7.14(m,1h),7.07(d,j=8.3hz,2h),6.75(brd,j=7.3hz,1h),5.65(quin,j=7.0hz,1h),1.68(d,j=7.0hz,3h)。实施例67:5-(2-氟-4-(三氟甲基)苯氧基)-n-异丙基-2-萘甲酰胺(化合物84)5-羟基-2-萘甲酸
[0388]
向5-羟基萘-2-甲酸甲酯(1.5g,7.42mmol,1eq)在thf(25ml)中的溶液中加入在h2o(5ml)中的naoh(741.8mg,18.55mmol,2.5eq)。将混合物在25℃下搅拌3hr。添加h2o(20ml),并将混合物用hcl水溶液(2m)中和至ph=3~4,用ea(35ml*3)萃取水相。合并的有机相用盐水(40ml)洗涤,用无水na2so4干燥,过滤并真空浓缩,得到粗产物。粗产物用pe(30ml*3)研磨。获得化合物5-羟基萘-2-甲酸(1.35g,粗品)。5-羟基-n-异丙基-2-萘甲酰胺
[0389]
在25℃下向5-羟基萘-2-甲酸(500mg,2.66mmol,1eq)、hatu(1.21g,3.19mmol,1.2eq)在dcm(15ml)中的混合物中添加dipea(1.03g,7.97mmol,1.39ml,3eq)。添加后,将混合物在25℃下搅拌1hr,然后添加异丙胺(235.5mg,3.99mmol,0.34ml,1.5eq)。将所得混合物在25℃下搅拌2hr。将残余物倒入0℃的h2o(50ml)中并搅拌5min。用ea(30ml*3)萃取水相。合并的有机相用盐水(40ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤
硅胶色谱法纯化。获得化合物5-羟基-n-异丙基-萘-2-甲酰胺(410mg,1.79mmol,67.3%产率)。5-(2-氟-4-(三氟甲基)苯氧基)-n-异丙基-2-萘甲酰胺
[0390]
5-羟基-n-异丙基-萘-2-甲酰胺(120mg,0.52mmol,1eq)、1,2-二氟-4-(三氟甲基)苯(104.8mg,0.57mmol,1.1eq)、t-buok(117.4mg,1.05mmol,2eq)在dmf(3ml)中的混合物,将该混合物在100℃下搅拌3hr。将混合物倒入0℃的h2o(30ml)中并搅拌5min。用ea(20ml*3)萃取水相。合并的有机相用盐水(30ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化,得到标题化合物(49.8mg,0.12mmol,23.8%产率)。lcms(esi):rt=0.879min,针对c
21h17
f4no2计算的质量391.36,m/z实测值392.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.53(d,j=1.3hz,1h),8.46(br d,j=7.8hz,1h),8.10(d,j=8.8hz,1h),8.02-7.90(m,3h),7.61-7.53(m,2h),7.23-7.12(m,2h),4.16(qd,j=6.8,13.8hz,1h),1.21(d,j=6.8hz,6h)。实施例68:5-(2-氯-4-(三氟甲基)苯氧基)-n-异丙基-2-萘甲酰胺(化合物85)
[0391]
5-羟基-n-异丙基-萘-2-甲酰胺(120mg,0.52mmol,1eq)、2-氯-1-氟-4-(三氟甲基)苯(114.3mg,0.57mmol,1.1eq)、t-buok(117.4mg,1.05mmol,2eq)在dmf(3ml)中的混合物,将该混合物在100℃下搅拌3hr。将混合物倒入0℃的h2o(30ml)中并搅拌5min。用ea(20ml*3)萃取水相。合并的有机相用盐水(30ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。粗产物通过prep-hplc纯化。获得标题化合物(45.6mg,0.11mmol,21.1%产率)。lcms(esi):rt=0.951min,针对c
21h17
clf3no2计算的质量407.81,m/z实测值408.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.54(s,1h),8.46(br d,j=7.5hz,1h),8.12(s,1h),8.05-7.92(m,3h),7.70-7.57(m,2h),7.23(d,j=7.5hz,1h),7.04(d,j=8.6hz,1h),4.16(qd,j=6.6,13.2hz,1h),1.22(d,j=6.4hz,6h)。实施例69:n-氰基-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物86)
[0392]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(50mg,0.15mmol,1eq)在dmf(2ml)中的溶液中加入氰胺(25.3mg,0.60mmol,25ul,4eq)、dipea(116.6mg,0.90mmol,0.15ml,6eq)和bop(79.8mg,0.18mmol,1.2eq)。将混合物在25℃下搅拌2hr。将反应混合物用h2o(10ml)稀释并用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化,得到标题化合物(11.9mg,33.2umol,22.1%产率)。
lcms(esi):rt=3.083min,针对c
19h11
f3n2o2计算的质量356.30m/z实测值354.9[m-h]-;1h nmr(400mhz,cd3od)δ8.58(d,j=1.5hz,1h),8.20(d,j=8.8hz,1h),7.96(d,j=7.5hz,2h),7.71(s,1h),7.69-7.63(m,2h),7.31(d,j=7.8hz,1h),7.17(d,j=8.5hz,2h)。实施例70:n-[(1r)-1-(1h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物87)和n-[(1s)-1-(1h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物88)n-[1-(2h-吲唑-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺
[0393]
在0℃下,向(z)-n-((2h-吲唑-7-基)亚甲基)-2-甲基丙烷-2-亚磺酰胺(110mg,0.44mmol,1eq)在thf(1ml)中的溶液中加入甲基溴化镁(在thf中3m,0.44ml,3eq)。将混合物在20℃下搅拌1h。将混合物用h2o(5ml)稀释,用ea(10ml*3)萃取。合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过急骤硅胶色谱法纯化,得到n-[1-(2h-吲唑-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺(90mg,0.30mmol,66.9%产率)。1-(2h-吲唑-7-基)乙胺
[0394]
将n-[1-(2h-吲唑-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺(90mg,0.34mmol,1eq)在hcl/meoh(2ml)中的混合物在10℃下搅拌1h。将混合物浓缩,得到1-(2h-吲唑-7-基)乙胺(80mg,粗品,hcl)。n-[1-(2h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0395]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(70mg,0.21mmol,1eq)在dcm(2ml)中的溶液中加入hatu(120.2mg,0.32mmol,1.5eq)和diea(108.9mg,0.84mmol,0.15ml,4eq)。将混合物在30℃下搅拌0.5h。向混合物中加入1-(2h-吲唑-7-基)乙胺(45.8mg,0.23mmol,1.1eq,hcl)。将混合物在30℃下搅拌2h。将混合物用h2o(10ml)稀释,用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过prep-hplc纯化,得到n-[1-(2h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(40mg,80.8umol,38.3%产率)。n-[(1r)-1-(1h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物87)和n-[(1s)-1-(1h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物88)
[0396]
n-[1-(2h-吲唑-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(40mg,84.1umol,1eq)通过sfc纯化,得到化合物87(13.6mg,28.5umol,33.9%产率)。lcms(esi):rt=1.037min,针对c
27h20
f3n3o2计算的质量475.46,m/z实测值476.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ11.99-11.46(m,1h),8.36(d,j=1.0hz,1h),8.13-8.03(m,2h),7.83-7.67(m,3h),7.57(d,j=8.5hz,2h),7.52-7.45(m,1h),7.40(d,j=7.0hz,1h),7.20-7.08
(m,2h),7.04(d,j=8.5hz,2h),6.57(br d,j=9.8hz,1h),6.08-5.93(m,1h),1.91(d,j=7.0hz,3h);和化合物88(13.0mg,27.1umol,32.2%产率)。lcms(esi):rt=1.039min,针对c
27h20
f3n3o2计算的质量475.46,m/z实测值476.0[m+h]
+
;1h nmr(400mhz,cdcl3)δ12.05-11.50(m,1h),8.36(s,1h),8.13-8.03(m,2h),7.82-7.69(m,3h),7.57(d,j=8.8hz,2h),7.52-7.45(m,1h),7.40(d,j=7.0hz,1h),7.20-7.10(m,2h),7.04(d,j=8.5hz,2h),6.55(br d,j=9.3hz,1h),6.08-5.90(m,1h),1.91(d,j=7.0hz,3h)。实施例71:n-[(1s)-1-甲基丁-2-炔基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物89)和n-[(1r)-1-甲基丁-2-炔基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物90)n-(1-甲基丁-2-炔基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0397]
在25℃下向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(160mg,0.48mmol,1eq)、hatu(274.6mg,0.72mmol,1.5eq)在dcm(5ml)中的混合物中添加dipea(186.7mg,1.4mmol,0.25ml,3eq)。添加后,将混合物在25℃下搅拌1hr,然后添加化合物戊-3-炔-2-胺(80.1mg,0.96mmol,2eq)。将所得混合物在25℃下搅拌2hr。将混合物倒入h2o(30ml)中并搅拌5min。用ea(20ml*3)萃取水相。合并的有机相用盐水(30ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物n-(1-甲基丁-2-炔基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(98mg,0.24mmol,51.21%产率)。n-[(1s)-1-甲基丁-2-炔基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物89)和n-[(1r)-1-甲基丁-2-炔基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物90)
[0398]
外消旋化合物n-(1-甲基丁-2-炔基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(98mg,0.25mmol,1eq)通过sfc纯化,得到化合物89(36.4mg,90.7umol,36.7%产率)lcms(esi):rt=1.052min,针对c
23h18
f3no2计算的质量397.13m/z实测值398.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.01(d,j=8.0hz,1h),8.58(s,1h),8.04-7.94(m,3h),7.75(d,j=8.8hz,2h),7.64(t,j=7.9hz,1h),7.33(d,j=7.5hz,1h),7.17(d,j=8.5hz,2h),4.97-4.83(m,1h),1.81(d,j=2.3hz,3h),1.41(d,j=7.0hz,3h);和化合物90(38.3mg,95.4umol,38.7%产率)lcms(esi):rt=1.047min,针对c
23h18
f3no2计算的质量397.13m/z实测值398.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.01(d,j=8.0hz,1h),8.58(s,1h),8.05-7.92(m,3h),7.75(d,j=8.8hz,2h),7.64(t,j=7.9hz,1h),7.33(d,j=7.5hz,1h),7.17(d,j=8.8hz,2h),4.89(m,1h),1.81(d,j=2.3hz,3h),1.41(d,j=7.0hz,3h)。实施例72:n-[(1r)-1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物91)和n-[(1s)-1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物92)
n-[1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0399]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、1-(1-甲基咪唑-4-基)乙胺(41.4mg,0.33mmol,1.1eq)、dipea(116.6mg,0.90mmol,0.15ml,3eq)和hatu(171.6mg,0.45mmol,1.5eq)在dcm(1ml)中的混合物在25℃下搅拌2hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化。获得化合物n-[1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(40mg,90.1umol,29.9%产率)。n-[(1r)-1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物91)和n-[(1s)-1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物92)
[0400]
外消旋化合物n-[1-(1-甲基咪唑-4-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺通过sfc拆分(柱:ymc chiral amylose-c(250mm*30mm,10um;流动相:[0.1%nh3h2o etoh];b%:45%-45%,min),得到化合物91(13.7mg,31.3umol,34.4%产率)lcms(esi):rt=0.867min,针对c
24h20
f3n3o2计算的质量439.43m/z实测值440.1[m+h]
+
;1h nmr(400mhz,cd3od)δppm 1.65(d,j=6.75hz,4h)3.69(s,3h)5.36(br t,j=7.13hz,1h)6.88(s,1h)7.06(d,j=8.50hz,2h)7.11-7.23(m,2h)7.47-7.53(m,1h)7.59(d,j=8.76hz,2h)7.79(d,j=8.13hz,1h)7.89(d,j=8.76hz,1h)8.09(d,j=8.88hz,1h)8.41(s,1h);和化合物92(6.32mg,14.2umol,15.6%产率)lcms(esi):rt=0.865min,针对c
24h20
f3n3o2计算的质量439.43m/z实测值440.1[m+h]
+
;1h nmr(400mhz,cd3od)δppm 1.16-1.38(m,2h)1.63(br d,j=6.63hz,3h)3.66(s,3h)5.31-5.39(m,1h)6.85(br s,1h)7.06(d,j=8.63hz,2h)7.10-7.19(m,1h)7.13(d,j=7.63hz,1h)7.41-7.52(m,2h)7.59(d,j=8.63hz,2h)7.78(d,j=8.25hz,1h)7.87(br d,j=8.76hz,1h)8.09(d,j=8.75hz,1h)8.39(s,1h)。实施例73:n-异丙基-4-(4-(三氟甲基)苯氧基)异喹啉-7-甲酰胺(化合物93)
异喹啉-7-甲酸甲酯
[0401]
在n2下向7-溴异喹啉(1g,4.42mmol,1eq)在meoh(6ml)和dmso(8ml)中的溶液中加入tea(1.79g,17.69mmol,2.46ml,4.0eq)和pd(dppf)cl2(323.5mg,0.44mmol,0.1eq)。将悬浮液在真空下脱气并用co吹扫数次。将混合物在co(45psi)下于80℃搅拌16hr。将反应混合物用h2o(10ml)稀释并用etoac(10ml*3)萃取。合并的有机层用盐水(20ml*3)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到异喹啉-7-甲酸甲酯(800mg,4.27mmol,96.6%产率)。4-溴异喹啉-7-甲酸甲酯
[0402]
向异喹啉-7-甲酸甲酯(400mg,2.14mmol,1eq)在acoh(7ml)中的溶液中加入nbs(494.4mg,2.78mmol,1.3eq)。将混合物在100℃下搅拌1hr。将反应混合物用饱和na2co3(10ml)稀释并用etoac(15ml*3)萃取。合并的有机层用盐水(20ml*2)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到4-溴异喹啉-7-甲酸甲酯(420mg,1.56mmol,73.1%产率)。4-甲氧基异喹啉-7-甲酸甲酯
[0403]
向4-溴异喹啉-7-甲酸甲酯(420mg,1.56mmol,1eq)和meoh(400.5mg,12.50mmol,0.50ml,8.0eq)在甲苯(8ml)中的溶液中加入cs2co3(763.7mg,2.34mmol,1.5eq)、t-bu xphos(165.8mg,0.39mmol,0.25eq)和pd2(dba)3(143.0mg,0.15mmol,0.1eq)。将混合物在80℃下搅拌2hr。将反应混合物过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到4-甲氧基异喹啉-7-甲酸甲酯(270mg,0.85mmol,54.8%产率)。4-羟基异喹啉-7-甲酸
[0404]
在0℃下向4-甲氧基异喹啉-7-甲酸甲酯(270mg,0.85mmol,1eq)在dce(4ml)中的溶液中加入bbr3(1.07g,4.29mmol,0.41ml,5.0eq)在dce(2ml)中的溶液。将混合物在75℃下搅拌2hr。通过添加0℃的饱和nahco3(15mg)猝灭反应混合物,然后用etoac(15ml*2)萃取。减压浓缩水相,得到4-羟基异喹啉-7-甲酸(300mg,粗品)。粗产物不经进一步纯化而用于下一步。获得化合物4-羟基异喹啉-7-甲酸(300mg,粗品)。4-羟基异喹啉-7-甲酸甲酯
[0405]
将4-羟基异喹啉-7-甲酸(300mg,1.59mmol,1eq)在hcl/meoh(4m,35.71ml,
90.06eq)中的溶液在80℃下搅拌0.5hr。减压浓缩反应混合物,得到4-羟基异喹啉-7-甲酸甲酯(250mg,粗品)。粗产物不经进一步纯化而用于下一步。获得化合物4-羟基异喹啉-7-甲酸甲酯(250mg,粗品)。4-(4-(三氟甲基)苯氧基)异喹啉-7-甲酸甲酯
[0406]
向4-羟基异喹啉-7-甲酸甲酯(150mg,0.73mmol,1eq)在mecn(4ml)中的溶液中加入1-碘-4-(三氟甲基)苯(301.2mg,1.11mmol,0.16ml,1.5eq)、1h-咪唑-5-甲酸(49.6mg,0.44mmol,0.6eq)、cs2co3(481.0mg,1.48mmol,2.0eq)和cu2o(31.6mg,0.22mmol,22.6ul,0.3eq)。将混合物在80℃下搅拌16hr。将反应混合物过滤并减压浓缩,得到残余物。残余物通过硅胶柱色谱法纯化,得到4-[4-(三氟甲基)苯氧基]异喹啉-7-甲酸甲酯(30mg,82.0umol,11.1%产率)。4-(4-(三氟甲基)苯氧基)异喹啉-7-甲酸
[0407]
向4-[4-(三氟甲基)苯氧基]异喹啉-7-甲酸甲酯(30mg,86.3umol,1eq)在meoh(1ml)中的溶液中加入在h2o(0.5ml)中的naoh(13.8mg,0.34mmol,4.0eq)。将混合物在25℃下搅拌1hr。用hcl(2m)将反应混合物的ph调节至4-5,然后将混合物用etoac(15ml*2)萃取。减压浓缩合并的有机物,得到4-[4-(三氟甲基)苯氧基]异喹啉-7-甲酸(30mg,粗品)。粗产物不经进一步纯化而用于下一步。n-异丙基-4-(4-(三氟甲基)苯氧基)异喹啉-7-甲酰胺
[0408]
向4-[4-(三氟甲基)苯氧基]异喹啉-7-甲酸(30mg,90.0umol,1eq)在dcm(1.5ml)中的溶液中加入hatu(51.3mg,0.13mmol,1.5eq)、dipea(23.2mg,0.18mmol,31.3ul,2.0eq)和异丙胺(7.9mg,0.13mmol,11.6ul,1.5eq)。将混合物在25℃下搅拌2hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化,得到标题化合物(3.97mg,10.6umol,11.7%产率)。lcms(esi):rt=0.876min,针对c
20h17
f3n2o2计算的质量374.36m/z实测值375.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.42(s,1h),8.78(s,1h),8.61(br d,j=7.8hz,1h),8.44(s,1h),8.24(d,j=8.8hz,1h),8.02(d,j=8.8hz,1h),7.76(d,j=8.6hz,2h),7.24(d,j=8.5hz,2h),4.16(qd,j=6.8,13.6hz,1h),1.21(d,j=6.5hz,6h)。实施例74:n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物94)
(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺
[0409]
向吡啶甲醛(3g,28.01mmol,1eq)和2-甲基丙烷-2-亚磺酰胺(4.07g,33.61mmol,1.2eq)在dcm(56ml)中的20℃溶液中加入cuso4(8.94g,56.02mmol,8.60ml,2eq)。将反应在20℃下搅拌16h。将反应混合物过滤以除去固体,并减压浓缩滤液,得到残余物。将残余物用水(100ml)稀释,然后用ea(100ml*3)萃取。合并的有机层用水(50ml)和盐水(50ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺(4.32g,20.54mmol,73.3%产率),其直接用于下一步。lcms(esi):rt=0.640min,针对c
10h14
n2os计算的质量210.08,m/z实测值210.9[m+h]
+
。3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯
[0410]
向乙酸乙酯(837.9mg,9.51mmol,0.93ml,2eq)在thf(5ml)中的溶液中加入lda(2m,4.76ml,2eq),并将混合物在-78℃下搅拌10min,然后在-78℃下将(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺(1.0g,4.76mmol,1eq)在thf(5ml)中的溶液缓慢加入到上述混合物中。将反应混合物在-78℃下搅拌20min。将反应混合物用nh4cl(3ml)和水(40ml)稀释,并用ea(40ml*3)萃取。合并的有机层用水(20ml*2)和盐水(20ml*2)洗涤,经na2so4干燥,过滤并减压浓缩,得到3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯(1.1g,3.32mmol,69.8%产率),其直接用于下一步。lcms(esi):rt=0.803min,针对c
14h22
n2o3s计算的质量298.14,m/z实测值298.9[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.55(brd,j=4.5hz,1h),7.67(dt,j=1.5,7.8hz,1h),7.42(dd,j=5.3,7.8hz,1h),7.21-7.17(m,1h),4.85(s,1h),4.16-4.07(m,2h),3.28-3.06(m,1h),2.95-2.81(m,1h),1.24(d,j=4.8hz,9h),1.23-1.17(m,3h)。3-氨基-3-(吡啶-2-基)丙酸乙酯
[0411]
向3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯(100mg,0.34mmol,1eq)在meoh(3ml)中的20℃溶液中逐滴加入hcl/meoh(4m,0.42ml,5eq),并将混合物在20℃下搅拌1h。将反应混合物浓缩,得到3-氨基-3-(吡啶-2-基)丙酸乙酯(65mg,0.33mmol,99.9%产率),其直接用于下一步。3-氨基-3-(吡啶-2-基)丙烷-1-醇
[0412]
向3-氨基-3-(吡啶-2-基)丙酸乙酯(65mg,0.33mmol,1eq)在thf(2ml)中的0℃溶液中加入lah(19.1mg,0.50mmol,1.5eq),并将混合物在20℃下搅拌1h。将反应混合物在0℃下用水(两滴),然后用2n naoh(两滴)猝灭,用ea(20ml)稀释,经na2so4干燥,然后过滤以除去固体。将滤液浓缩,得到3-氨基-3-(吡啶-2-基)丙烷-1-醇(45mg,0.30mmol,88.4%产率),其直接用于下一步。n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0413]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(40mg,0.12mmol,1eq)、3-氨基-3-(吡啶-2-基)丙烷-1-醇(36.6mg,0.24mmol,2eq)和hatu(59.5mg,0.16mmol,1.3eq)在dmf(1ml)中的20℃溶液中加入tea(36.5mg,0.36mmol,50ul,3eq),并将混合物在20℃下搅拌1h。将混合物浓缩,得到残余物。残余物通过prep-hplc纯化,得到标题化合物(15.0mg,29.8umol,24.8%产率,hcl)。lcms(esi):rt=0.843min,针对c
26h21
f3n2o3计算的质量466.15,m/z实测值467.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.79(d,j=5.3hz,1h),8.63(t,j=7.3hz,1h),8.58(d,j=1.3hz,1h),8.19(d,j=8.3hz,1h),8.13(d,j=8.8hz,1h),8.01(t,j=6.8hz,
1h),7.98-7.87(m,2h),7.66(d,j=8.8hz,2h),7.61(t,j=8.0hz,1h),7.25(d,j=7.0hz,1h),7.14(d,j=8.5hz,2h),5.52(dd,j=6.3,8.3hz,1h),3.83(ddd,j=4.0,7.7,11.4hz,1h),3.72(td,j=5.4,11.1hz,1h),2.46-2.36(m,1h),2.34-2.24(m,1h)。实施例75:n-[(1s)-1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物95)和n-[(1r)-1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物96)3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯
[0414]
在25℃下向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(1.38g,4.16mmol,1eq)、hatu(2.37g,6.24mmol,1.5eq)在dcm(20ml)中的混合物中添加dipea(1.61g,12.48mmol,2.17ml,3eq)。添加后,将混合物在25℃下搅拌1hr,然后添加3-[1-[(2,4-二甲氧基苯基)甲基氨基]乙基]氮杂环丁烷-1-甲酸苄酯(1.6g,4.16mmol,1eq)。将所得混合物在25℃下搅拌15hr。将残余物倒入h2o(50ml)中并搅拌5min。用ea(30ml*3)萃取水相。合并的有机相用盐水(40ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(2.21g,3.07mmol,73.7%产率)。n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0415]
在n2下向3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(250mg,0.35mmol,1eq)在meoh(5ml)中的溶液中加入pd/c(50mg,0.36mmol,10%,1.00eq)和hcl(12m,0.31ml,10.5eq)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌16hr。过滤反应混合物,并用meoh(10ml*2)洗涤滤饼。真空浓缩滤液,得到粗产物。粗产物不经进一步纯化而用于下一步。获得化合物n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(195mg,粗品)。n-[1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0416]
向n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(190mg,0.34mmol,1eq)在dcm(1ml)中的溶液中加入tfa(2.31g,20.26mmol,1.5ml,60.2eq)。将混合物在60℃下搅拌1hr。减压浓缩反应混合物以除去dcm和tfa,得到粗产物。粗产物通过prep-hplc纯化。获得化合物n-[1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(91.4mg,0.22mmol,64.9%产率)。
n-[(1s)-1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物95)和n-[(1r)-1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物96)
[0417]
外消旋化合物n-[1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg,0.22mmol,1eq)通过sfc纯化,得到化合物95(23.4mg,54.7umol,25.2%产率)lcms(esi):rt=0.822min,针对c
23h21
f3n2o2计算的质量414.16m/z实测值415.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.45(s,1h),8.09(d,j=8.8hz,1h),7.89(d,j=8.8hz,2h),7.68-7.54(m,3h),7.23(d,j=7.8hz,1h),7.13(d,j=8.8hz,2h),4.49-4.30(m,1h),3.81-3.58(m,3h),3.52-3.36(m,1h),2.99(m,1h),1.23-1.15(m,3h);和化合物96(18.3mg,42.8umol,19.7%产率)lcms(esi):rt=0.830min,针对c
23h21
f3n2o2计算的质量414.16m/z实测值415.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.47-8.40(m,1h),8.11-8.03(m,1h),7.89(d,j=8.5hz,2h),7.68-7.53(m,3h),7.25-7.06(m,3h),4.50-4.26(m,1h),3.81-3.55(m,2h),3.51-3.35(m,1h),3.07-2.61(m,1h),1.25-1.14(m,3h)。实施例76:(s)-n-(1-(吡啶-2-基)乙基)-7-(4-(三氟甲基)苯氧基)苯并噻吩-2-甲酰胺(化合物97)7-(4-(三氟甲基)苯氧基)苯并噻吩-2-甲酸
[0418]
向7-[4-(三氟甲基)苯氧基]苯并噻吩-2-甲酸甲酯(50mg,0.14mmol,1eq)在meoh(1ml)中的溶液中加入naoh(17.0mg,0.42mmol,3eq)和h2o(2.00g,111.02mmol,2ml,782eq)。将混合物在60℃下搅拌3hr。添加冰水(5ml),并用hcl水溶液(4m)将混合物中和至ph=6~7。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。获得化合物7-[4-(三氟甲基)苯氧基]苯并噻吩-2-甲酸(41.3mg,粗品)。(s)-n-(1-(吡啶-2-基)乙基)-7-(4-(三氟甲基)苯氧基)苯并噻吩-2-甲酰胺
[0419]
向7-[4-(三氟甲基)苯氧基]苯并噻吩-2-甲酸(40mg,0.11mmol,1eq)和hatu(53.9mg,0.14mmol,1.2eq)在dcm(2ml)中的溶液中添加diea(61.1mg,0.47mmol,82.3ul,4eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加(1s)-1-(2-吡啶基)乙胺(15.8mg,0.13mmol,1.1eq)。将所得混合物在25℃下搅拌2hr。将混合物加入h2o(10ml),并用ea(15ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过prep-hplc纯化,得到标题化合物(9.5mg,21.3umol,18.0%产率)。lcms(esi):rt=0.801min,针对c
23h17
f3n2o2s计算的质量442.45m/z实测值443.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.22(br d,j=7.8hz,1h),8.53(br d,j=4.8hz,1h),8.37(s,1h),7.88(d,j=8.0hz,1h),7.80-7.73(m,3h),7.52(t,j=7.8hz,1h),7.41(d,j=7.9hz,1h),7.29-7.18(m,4h),5.16(quin,j=7.1hz,1h),1.52(d,j=7.0hz,3h)。实施例77:n-[(1r)-1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物98)和n-[(1s)-1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯
氧基]萘-2-甲酰胺(化合物99)8-溴-2-氯-喹啉
[0420]
将8-溴喹啉-2(1h)-酮(1.1g,4.91mmol,1eq)在pocl3(4ml)和dmf(0.1ml)中的溶液在90℃下加热2hr。将反应冷却至20℃,倒入h2o(10ml)中,并用dcm(2*15ml)萃取。有机层经na2so4干燥并浓缩,得到8-溴-2-氯-喹啉(1.05g,4.20mmol,85.6%产率),其直接用于下一步。8-溴-2-甲氧基-喹啉
[0421]
向8-溴-2-氯-喹啉(0.95g,3.92mmol,1eq)在meoh(15ml)中的溶液中加入ch3ona(846.6mg,15.67mmol,4eq)。将反应在70℃下加热48hr。将反应混合物浓缩。残余物用ea(30ml)稀释并用h2o(2*10ml)洗涤。有机层经na2so4干燥并浓缩,得到8-溴-2-甲氧基-喹啉(1g,3.44mmol,87.9%产率),其直接用于下一步。1-(2-甲氧基-8-喹啉基)乙酮
[0422]
向8-溴-2-甲氧基-喹啉(0.8g,3.36mmol,1eq)和三丁基(1-乙氧基乙烯基)锡烷(1.51g,4.18mmol,1.4ml,1.24eq)在甲苯(10ml)中的混合物中加入pd(dppf)cl2(122.9mg,0.16mmol,0.05eq)并脱气。将反应在n2下于105℃加热16hr。将反应混合物浓缩。向残余物添加2n hcl水溶液(10ml),并将溶液在25℃下搅拌1hr。将反应用ea(2*50ml)萃取。有机层经na2so4干燥并浓缩。残余物通过硅胶柱色谱法纯化,得到1-(2-甲氧基-8-喹啉基)乙酮(0.6g,2.83mmol,84.3%产率)。1-(2-甲氧基-8-喹啉基)乙酮肟
[0423]
向nh2oh.hcl(62.1mg,0.89mmol,1.5eq)在etoh(1ml)中的混合物中加入naoh(47.7mg,1.19mmol,2eq)。将混合物过滤,并将滤液加入1-(2-甲氧基-8-喹啉基)乙酮(120mg,0.59mmol,1eq)在etoh(2ml)中的溶液中。将反应在25℃下搅拌16hr。将反应过滤,得到1-(2-甲氧基-8-喹啉基)乙酮肟(50mg,0.22mmol,38.00%产率)。将滤液浓缩,得到1-(2-甲氧基-8-喹啉基)乙酮肟(60mg,0.19mmol,32.1%产率),其直接用于下一步。1-(2-甲氧基-8-喹啉基)乙胺
[0424]
将1-(2-甲氧基-8-喹啉基)乙酮肟(60mg,0.19mmol,1eq)、zn(125.1mg,1.91mmol,
10eq)和nh4cl(102.4mg,1.91mmol,10eq)在meoh(5ml)和hoac(1ml)中的混合物在80℃下加热16hr。将反应混合物浓缩。将残余物用ea(10ml)稀释并用水(5ml)洗涤。将水层用饱和na2co3调节至ph 10-11,过滤并用ea(2*10ml)萃取。有机层经na2so4干燥并浓缩,得到1-(2-甲氧基-8-喹啉基)乙胺(60mg,0.28mmol,74.3%产率),其直接用于下一步。8-(1-氨基乙基)-1h-喹啉-2-酮
[0425]
将1-(2-甲氧基-8-喹啉基)乙胺(55mg,0.27mmol,1eq)在二氧杂环己烷(1ml)和hcl(0.5ml)中的溶液在100℃下加热1hr。将反应混合物浓缩,得到8-(1-氨基乙基)-1h-喹啉-2-酮(60mg,0.24mmol,81.2%产率,hcl),其直接用于下一步。n-[1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0426]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(53.8mg,0.16mmol,1eq)、hatu(92.4mg,0.24mmol,1.5eq)和8-(1-氨基乙基)-1h-喹啉-2-酮(40mg,0.16mmol,1eq,hcl)在dcm(2ml)中的溶液中加入diea(62.8mg,0.48mmol,84ul,3eq)。将反应在25℃下搅拌1hr。将反应用dcm(30ml)稀释并用h2o(2*5ml)洗涤。有机层经na2so4干燥并浓缩。粗产物通过prep-hplc纯化,得到n-[1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(30mg,59.7umol,36.8%产率)。n-[(1r)-1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物98)和n-[(1s)-1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(化合物99)
[0427]
外消旋化合物n-[1-(2-氧代-1h-喹啉-8-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(30mg,59.7umol,1eq)通过手性sfc拆分,得到化合物98(14.3mg,28.0umol,46.9%产率)。lcms(esi):rt=0.970min,针对c
29h21
f3n2o3计算的质量502.15m/z实测值503.1[m+h]
+
。1h nmr(400mhz,cdcl3)δ11.33(br s,1h),8.48(d,j=1.1hz,1h),8.04(d,j=8.8hz,1h),7.86(dd,j=1.6,8.8hz,1h),7.75(d,j=9.5hz,1h),7.68(dd,j=7.9,11.6hz,2h),7.56(d,j=8.6hz,2h),7.52(d,j=7.1hz,1h),7.41(t,j=7.9hz,2h),7.26-7.20(m,1h),7.09(d,j=7.4hz,1h),7.02(d,j=8.5hz,2h),6.70(d,j=9.4hz,1h),5.83-5.70(m,1h),1.88(d,j=7.0hz,3h);和化合物99lcms(esi):rt=0.971min,针对c
29h21
f3n2o3计算的质量502.15m/z实测值503.1[m+h]
+
。1h nmr(400mhz,cdcl3)δ11.33(br s,1h),8.48(d,j=1.1hz,1h),8.04(d,j=8.8hz,1h),7.86(dd,j=1.6,8.8hz,1h),7.75(d,j=9.5hz,1h),7.68(dd,j=7.9,11.6hz,2h),7.56(d,j=8.6hz,2h),7.52(d,j=7.1hz,1h),7.41(t,j=7.9hz,2h),7.26-7.20(m,1h),7.09(d,j=7.4hz,1h),7.02(d,j=8.5hz,2h),6.70(d,j=9.4hz,1h),5.83-5.70(m,1h),1.88(d,j=7.0hz,3h)。实施例78:(s)-n-(1-(1-乙酰基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物100)和(r)-n-(1-(1-乙酰基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物101)
n-(1-(1-乙酰基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0428]
在n2和0℃下,向n-[1-(氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(150mg,0.36mmol,1eq)和dipea(233.8mg,1.81mmol,0.31ml,5eq)在dcm(5ml)中的溶液中逐滴添加乙酰氯(31.2mg,0.39mmol,28.4ul,1.1eq)(在dcm(1ml)中)。添加后,将混合物在20℃下搅拌2hr。将残余物混合到h2o(30ml)中并搅拌5min。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化。获得化合物n-[1-(1-乙酰基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(96mg,0.20mmol,55.7%产率)。(s)-n-(1-(1-乙酰基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物100)和(r)-n-(1-(1-乙酰基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物101)
[0429]
外消旋化合物n-[1-(1-乙酰基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(95mg,0.20mmol,1eq)进一步通过sfc拆分,得到化合物100(32.4mg,68.1umol,32.7%产率)lcms(esi):rt=0.927min,针对c
25h23
f3n2o3计算的质量456.46m/z实测值479.1[m+na]
+
;1h nmr(400mhz,cd3od)δ8.44(s,1h),8.10(d,j=8.9hz,1h),7.89(d,j=8.6hz,2h),7.66(d,j=8.8hz,2h),7.59(t,j=7.9hz,1h),7.23(d,j=7.5hz,1h),7.13(d,j=8.6hz,2h),4.51-4.40(m,1h),4.35-4.22(m,1h),4.12-3.98(m,2h),3.92-3.74(m,1h),2.90-2.78(m,1h),1.85(s,3h),1.26(d,j=6.6hz,3h);和化合物101(31.8mg,69.6umol,33.4%产率)lcms(esi):rt=0.927min,针对c
25h23
f3n2o3计算的质量456.46m/z实测值479.1[m+na]
+
;1h nmr(400mhz,cd3od)δ8.44(s,1h),8.10(d,j=8.8hz,1h),7.89(d,j=8.5hz,2h),7.66(d,j=8.6hz,2h),7.59(t,j=7.9hz,1h),7.23(d,j=7.6hz,1h),7.13(d,j=8.6hz,2h),4.51-4.41(m,1h),4.35-4.23(m,1h),4.13-3.98(m,2h),3.92-3.74(m,1h),2.90-2.78(m,1h),1.85(d,j=1.6hz,3h),1.26(d,j=6.6hz,3h)。实施例79:(r)-5,6-二氟-n-(1-羟基丙烷-2-基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物102)
[0430]
向5,6-二氟-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酸(25mg,67.7umol,1eq)在dcm(1ml)中的溶液中加入hatu(38.6mg,0.1mmol,1.5eq)、(r)-2-氨基丙烷-1-醇(7.6mg,0.1mmol,8.0ul,1.5eq)和dipea(17.5mg,0.13mmol,23.5ul,2.0eq)。将混合物在25℃下搅拌3hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化,得到标题化合物(3.8mg,8.9umol,13.2%产率)lcms(esi):rt=0.881min,针对c
20h15
f5n2o3计算的质量426.10m/z实测值427.0[m+h]
+
;1h nmr(400mhz,meod)δ9.21(s,1h),9.06(d,j=2.0hz,1h),7.67(d,j=8.8hz,2h),7.58(dd,j=7.3,11.3hz,1h),7.16(d,j=8.8hz,2h),4.33-4.17(m,1h),3.65(d,j=5.8hz,2h),1.30-1.28(m,3h)。实施例80:(r)-n-(1-(1h-苯并[d]咪唑-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物103)和(s)-n-(1-(1h-苯并[d]咪唑-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物104)n-(1-(1h-苯并[d]咪唑-7-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0431]
向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(100.0mg,0.30mmol,1eq)、1-(1h-苯并[d]咪唑-7-基)乙-1-胺(58.2mg,0.36mmol,1.2eq)和hatu(171.7mg,0.45mmol,1.5eq)在dcm(2ml)中的溶液中加入diea(77.8mg,0.60mmol,0.10ml,2eq)。将混合物在10℃下搅拌16hr。将混合物用h2o(10ml)稀释。将混合物用ea(15ml*3)萃取。有机层经na2so4干燥,过滤并浓缩,得到残余物。残余物通过prep-hplc纯化,得到n-(1-(1h-苯并[d]咪唑-7-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(30.0mg,63.1umol,20.9%产率)。(r)-n-(1-(1h-苯并[d]咪唑-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物103)和(s)-n-(1-(1h-苯并[d]咪唑-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物104)
[0432]
n-(1-(1h-苯并[d]咪唑-7-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(30.0mg,63.1umol,1eq)通过手性sfc纯化,得到化合物103(8.9mg,18.6umol,29.5%产率)lcms(esi):针对c
27h20
f3n3o2计算的质量475.15,m/z实测值476.1[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.42(br s,1h),8.14-8.08(m,2h),7.87(br d,j=7.5hz,1h),7.77(br d,j=8.3hz,1h),7.69-7.56(m,3h),7.50(t,j=7.9hz,1h),7.30-7.24(m,3h),7.14(d,j=7.3hz,1h),7.06(br d,j=8.5hz,2h),5.87(br s,1h),1.85(br d,j=6.3hz,3h);和化合物104(4.9mg,10.4umol,16.5%产率)lcms(esi):针对c
27h20
f3n3o2计算的质量475.15,m/z实测值476.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.32(br d,j=7.5hz,1h),8.70-8.55(m,
2h),8.05-7.97(m,3h),7.74(d,j=8.8hz,2h),7.67-7.60(m,2h),7.53(br d,j=8.5hz,1h),7.34(d,j=7.5hz,2h),7.29-7.24(m,1h),7.16(d,j=8.5hz,2h),5.74(br t,j=7.1hz,1h),1.62(br d,j=6.9hz,3h)。实施例81:(r)-n-(1-(苯并[b]噻吩-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物105)和(s)-n-(1-(苯并[b]噻吩-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物106)苯并噻吩-7-甲醛
[0433]
在-78℃下向7-溴苯并[b]噻吩(500mg,2.35mmol,1eq)在thf(5ml)中的溶液中加入n-buli(2.5m,1ml,1.07eq)。将混合物在-78℃下搅拌20min。向混合物中加入dmf(205.8mg,2.82mmol,0.22ml,1.2eq)。将混合物在-78℃下搅拌40min。用饱和nh4cl(10ml)猝灭反应。将混合物用水(10ml)稀释并用etoac(30ml*3)萃取。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并浓缩,得到残余物。残余物通过柱色谱法纯化,得到苯并噻吩-7-甲醛(120mg,0.74mmol,31.5%产率)。(e)-n-(苯并[b]噻吩-7-基亚甲基)-2-甲基丙烷-2-亚磺酰胺
[0434]
向苯并噻吩-7-甲醛(50mg,0.31mmol,1eq)和2-甲基丙烷-2-亚磺酰胺(41.1mg,0.34mmol,1.1eq)在thf(2ml)中的溶液中加入ti(oet)4(140.6mg,0.62mmol,0.13ml,2eq)。将混合物在20℃下搅拌12h。为了进一步完成反应,将混合物在80℃下搅拌12h。将混合物冷却至室温,用水(15ml)稀释,并用etoac(30ml*3)萃取。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并浓缩,得到残余物。残余物通过柱色谱法纯化,得到(e)-n-(苯并[b]噻吩-7-基亚甲基)-2-甲基丙烷-2-亚磺酰胺(50mg,0.19mmol,61.1%产率)。1h nmr(400mhz,cd3cl)δ8.88(s,1h),8.03(d,j=7.2hz,1h),7.74(d,j=7.2hz,1h),7.62(d,j=5.2hz,1h),7.54(t,j=7.7hz,1h),7.47(d,j=5.5hz,1h),1.35(s,9h)。n-[1-(苯并噻吩-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺
[0435]
在0℃下向(e)-n-(苯并[b]噻吩-7-基亚甲基)-2-甲基丙烷-2-亚磺酰胺(50mg,0.19mmol,1eq)在thf(1ml)中的溶液中加入memgbr(3m,0.19ml,3eq)。将混合物在0℃下搅拌1h。用饱和nh4cl(5ml)猝灭反应,并用水(10ml)稀释。将混合物用ea(30ml*3)萃取。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并浓缩,得到残余物。残余物通过柱色谱法纯化,得到n-[1-(苯并噻吩-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺(30mg,0.11mmol,56.6%产率)。1-(苯并噻吩-7-基)乙胺
[0436]
向n-[1-(苯并噻吩-7-基)乙基]-2-甲基-丙烷-2-亚磺酰胺(30mg,0.11mmol,1eq)
在meoh(2ml)中的溶液中加入hcl/meoh(4m,1ml)。将混合物在20℃下搅拌0.5h。将混合物浓缩,得到1-(苯并噻吩-7-基)乙胺(30mg,粗品,hcl盐)。粗化合物直接用于下一步。n-[1-(苯并噻吩-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0437]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(45mg,0.14mmol,1eq)和diea(70.0mg,0.54mmol,94.4ul,4eq)在dcm(2ml)中的溶液中加入hatu(103.0mg,0.27mmol,2eq)。将混合物在20℃下搅拌0.5h,并向混合物中加入1-(苯并噻吩-7-基)乙胺(29.0mg,0.14mmol,1eq,hcl)。将所得混合物在20℃下搅拌12h。将混合物用水(10ml)稀释并用etoac(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤,并浓缩,得到残余物。残余物通过柱色谱法纯化,得到n-[1-(苯并噻吩-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(40mg,78.9umol,58.3%产率)。(r)-n-(1-(苯并[b]噻吩-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物105)和(s)-n-(1-(苯并[b]噻吩-7-基)乙基)-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物106)
[0438]
n-[1-(苯并噻吩-7-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(40mg,81.4umol,1eq)通过sfc拆分,得到化合物105(17.6mg,35.5umol,43.7%产率)lcms(esi):针对c
28h20
f3no2s计算的质量491.12,m/z实测值492.0[m+h]
+
;1h nmr(400mhz,cd3cl)δ8.31(d,j=1.1hz,1h),8.03(d,j=8.8hz,1h),7.78(dd,j=1.6,8.8hz,1h),7.75-7.68(m,2h),7.51(d,j=8.6hz,2h),7.46-7.31(m,5h),7.06(d,j=7.6hz,1h),6.98(d,j=8.5hz,2h),6.55(br d,j=7.1hz,1h),5.61(t,j=7.1hz,1h),1.75(d,j=6.9hz,3h);和化合物106(16.2mg,32.9umol,40.5%产率)lcms(esi):针对c
28h20
f3no2s计算的质量491.12,m/z实测值492.0[m+h]
+
;1h nmr(400mhz,cd3cl)δ8.38(s,1h),8.10(d,j=8.8hz,1h),7.87-7.82(m,1h),7.82-7.75(m,2h),7.58(d,j=8.6hz,2h),7.53-7.34(m,5h),7.13(d,j=7.5hz,1h),7.05(d,j=8.5hz,2h),6.62(br d,j=7.0hz,1h),5.68(t,j=7.0hz,1h),2.07-2.02(m,1h),1.82(d,j=6.9hz,3h)。实施例82:(r)-n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物107)和(s)-n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物108)(2-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)丙基)氨基甲酸叔丁酯
[0439]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(100mg,0.3mmol,1eq)和hatu(171.7mg,0.45mmol,1.5eq)在dmf(1ml)中的20℃溶液中加入(2-氨基丙基)氨基甲酸叔丁酯(62.9mg,0.36mmol,1.2eq)和tea(91.4mg,0.9mmol,0.13ml,3eq)。将混合物在20℃下搅拌16h。残余物用水(20ml)稀释,然后用ea(20ml*3)萃取。合并的有机层用水(10ml)和盐水(10ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到呈黄色固体的(2-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)丙基)氨基甲酸叔丁酯(130mg,0.27mmol,88.4%产率)。1h nmr(400mhz,cdcl3)δ8.43(s,1h),8.10(d,j=8.9hz,1h),7.91(brd,j=8.6hz,1h),7.79(d,j=8.4hz,1h),7.59(d,j=8.6hz,2h),7.50(t,j=7.9hz,1h),7.41(brd,j=7.0hz,1h),7.14(d,j=7.5hz,1h),7.07(d,j=8.6hz,2h),5.00(brs,1h),4.26(brd,j=5.9hz,1h),3.45-3.37(m,1h),3.31-3.24(m,1h),1.41(s,9h),1.31(d,j=6.6hz,3h)。n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0440]
向(2-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)丙基)氨基甲酸叔丁酯(130mg,0.27mmol,1eq)在dcm(2ml)中的20℃溶液中加入tfa(364.1mg,3.2mmol,0.24ml,12eq)。将混合物在20℃下搅拌4h。减压浓缩反应混合物以得到残余物。残余物用水(20ml)、na2co3(20ml)稀释,并用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物,得到化合物n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(100mg,0.24umol,91.9%产率)。lcms(esi):rt=0.825min,针对c
21h19
f3n2o2计算的质量388.14,m/z实测值389.0[m+h]
+
。(r)-n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物107)和(s)-n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物108)
[0441]
n-(1-氨基丙烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(100mg,0.26mmol,1eq)通过sfc纯化。不进行监测而直接用于下一步。外消旋化合物通过sfc拆分(柱:phenomenex-cellulose-2(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:35%-35%,min),得到呈白色固体的化合物107(10mg,25umol,9.90%产率)和化合物108(13.5mg,35umol,13.5%产率)。化合物107lcms(esi):rt=0.827min,针对c
21h19
f3n2o2计算的质量388.14,m/z实测值389.0[m+h
+
];1h nmr(400mhz,cdcl3)δ8.38(s,1h),8.05(d,j=8.9hz,1h),7.83(brd,j=8.8hz,1h),7.73(brd,j=8.4hz,1h),7.57(brd,j=8.6hz,2h),7.45(t,j=7.9hz,1h),7.10(d,j=7.5hz,1h),7.07-7.02(m,3h),4.33(brs,1h),3.02-2.91(m,2h),1.27-1.24(m,1h),1.25(brd,j=6.5hz,2h)。化合物108lcms(esi):rt=0.833min,针对c
21h19
f3n2o2计算的质量388.14,m/z实测值389.0[m+h
+
];1h nmr(400mhz,cdcl3)δ8.40(s,1h),8.08(d,j=8.8hz,1h),7.85(brd,j=8.8hz,1h),7.77(brd,j=8.3hz,1h),7.58(brd,j=8.5hz,2h),7.47(t,j=7.9hz,1h),7.12(d,j=7.5hz,1h),7.05(brd,j=8.5hz,2h),6.92(brd,j=7.0hz,1h),4.31(brs,1h),2.94(brs,2h),1.28(brd,j=6.6hz,3h)。实施例83:(r)-n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物109)和(s)-n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物110)
(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺
[0442]
向吡啶甲醛(3g,28.01mmol,1eq)和2-甲基丙烷-2-亚磺酰胺(4.07g,33.61mmol,1.2eq)在dcm(56ml)中的20℃溶液中加入cuso4(8.94g,56.02mmol,8.60ml,2eq)。将反应在20℃下搅拌16h。将反应混合物过滤以除去固体,并减压浓缩滤液,得到残余物。残余物用水(100ml)稀释,然后用ea(100ml*3)萃取。合并的有机层用水(50ml)和盐水(50ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到呈黄色油状物的(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺(4.32g,20.54mmol,73.3%产率),其直接用于下一步。lcms(esi):rt=0.640min,针对c
10h14
n2os计算的质量210.08,m/z实测值210.9[m+h]
+
。3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯
[0443]
向乙酸乙酯(838.8mg,9.52mmol,0.93ml,2eq)在thf(5ml)中的-78℃溶液中逐滴加入lda(2m,4.76ml,2eq),并将所得混合物在-78℃下搅拌0.5h。然后在-78℃下向上述混合物中加入(e)-2-甲基-n-(吡啶-2-基亚甲基)丙烷-2-亚磺酰胺(1g,4.76mmol,1eq)在thf(5ml)中的溶液。将反应混合物在-78℃下再搅拌0.5h。将反应混合物用饱和nh4cl溶液(20ml)猝灭,然后用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~20%乙酸乙酯/石油醚梯度,30ml/min),得到呈黄色固体的3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯(1.2g,3.98mmol,83.6%产率)。lcms(esi):rt=0.708min,针对c
14h22
n2o3s计算的质量298.14,m/z实测值298.9[m+h]
+
。3-氨基-3-(吡啶-2-基)丙酸乙酯
[0444]
向3-(1,1-二甲基乙基亚磺酰胺基)-3-(吡啶-2-基)丙酸乙酯(250mg,0.84mmol,1eq)在meoh(2ml)中的20℃溶液中加入hcl/meoh(4m,1.05ml,5eq)。将反应混合物在20℃下搅拌1h。减压浓缩反应混合物,得到呈黄色固体的3-氨基-3-(吡啶-2-基)丙酸乙酯(162mg,0.83mmol,99.6%产率),其直接用于下一步。3-氨基-3-(吡啶-2-基)丙烷-1-醇
[0445]
向3-氨基-3-(吡啶-2-基)丙酸乙酯(162mg,0.83mmol,1eq)在thf(3ml)中的0℃溶液中加入lah(63.3mg,1.67mmol,2eq)。将反应混合物在20℃下搅拌2h。在0℃下用水
(0.06ml),然后用4n naoh(0.06ml),再然后用水(0.18ml)猝灭反应混合物,然后在20℃下搅拌0.5h。混合物经无水na2so4干燥,然后过滤以除去沉淀物。减压浓缩滤液,得到呈黄色油状物的3-氨基-3-(吡啶-2-基)丙烷-1-醇(110mg,0.72mmol,86.7%产率),其直接用于下一步。1h nmr(400mhz,cdcl3)δ8.57(brs,1h),7.71-7.61(m,1h),7.24(s,1h),7.21-7.14(m,1h),4.47-4.19(m,1h),3.96-3.81(m,1h),2.91-2.68(m,1h),2.15-1.83(m,2h)。n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0446]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(120mg,0.36mmol,1eq)、3-氨基-3-(吡啶-2-基)丙烷-1-醇(109.9mg,0.72mmol,2eq)在dmf(2ml)中的20℃溶液中加入hatu(178.5mg,0.47mmol,1.3eq)和tea(109.6mg,1.08mmol,0.15ml,3eq)。将反应混合物在20℃下搅拌16h。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:30%-60%,8.5min),得到呈黄色油状物的n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(60mg,0.13mmol,35.3%产率)。lcms(esi):rt=0.843min,针对c
26h21
f3n2o3计算的质量466.15,m/z实测值467.0[m+h]
+
。(r)-n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物109)和(s)-n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物110)
[0447]
样品n-(3-羟基-1-(吡啶-2-基)丙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(60mg,0.13mmol,1eq)通过sfc纯化(柱:daicel chiralpak ad(250mm*30mm,10um);流动相:[0.1%nh3h2o etoh];b%:45%-45%,min),得到呈白色固体的化合物109(13.1mg,27.6umol,21.5%产率)。lcms(esi):rt=0.848min,针对c
26h21
f3n2o3计算的质量466.15,m/z实测值467.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.55(d,j=4.5hz,1h),8.52(s,1h),8.11(d,j=8.8hz,1h),7.96-7.89(m,2h),7.83(dt,j=1.6,7.8hz,1h),7.66(d,j=8.8hz,2h),7.59(t,j=7.9hz,1h),7.53(d,j=7.9hz,1h),7.32(dd,j=5.4,7.1hz,1h),7.24(d,j=7.6hz,1h),7.14(d,j=8.6hz,2h),5.42(dd,j=5.9,8.3hz,1h),3.76-3.62(m,2h),2.27-2.12(m,2h),和呈白色固体的化合物110(14.0mg,30.2umol,23.5%产率)。lcms(esi):rt=0.857min,针对c
26h21
f3n2o3计算的质量466.15,m/z实测值467[m+h]
+
;1h nmr(400mhz,cd3od)δ8.56(d,j=4.3hz,1h),8.52(d,j=1.5hz,1h),8.11(d,j=8.9hz,1h),7.96-7.89(m,2h),7.87(dt,j=1.7,7.7hz,1h),7.66(d,j=8.6hz,2h),7.62-7.54(m,2h),7.38-7.33(m,1h),7.24(d,j=7.5hz,1h),7.14(d,j=8.6hz,2h),5.42(dd,j=6.1,8.3hz,1h),3.77-3.64(m,2h),2.29-2.15(m,2h)。实施例84:(s)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物111)和(r)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物112)
n-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0448]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(100mg,0.30mmol,1eq)、2-(3-氨基丁基)异吲哚啉-1,3-二酮(76.6mg,0.30mmol,1eq,hcl)和dipea(116mg,0.90mmol,3eq)在dcm(3ml)中的溶液中加入hatu(137mg,0.36mmol,1.2eq)。将反应混合物在25℃下搅拌2hr。lc-ms显示起始材料完全耗尽,并且检测到一个具有所需ms的主峰。减压浓缩反应混合物。将混合物用水(30ml)稀释,并将所得混合物用ea(50ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过硅胶柱色谱法纯化(石油醚:乙酸乙酯=1:0至2:1),得到呈白色固体的n-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(150mg,92%产率)。lcms(esi):rt=1.025min,针对c
30h23
f3n2o4计算的质量532.16m/z实测值533.1[m+h]
+
。n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0449]
将nh2nh2.h2o(143mg,2.44mmol,0.14ml,85%,10eq)加入n-[3-(1,3-二氧代异吲哚啉-2-基)-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(130mg,0.24mmol,1eq)在etoh(8ml)中的溶液中。将反应混合物在25℃下搅拌5hr。lc-ms显示起始材料完全耗尽,并且检测到一个具有所需ms的主峰。减压浓缩反应混合物。将混合物用水(10ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,8.5min),得到呈白色固体的n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(85mg,78%产率,hcl)。lcms(esi):rt=0.837min,针对c
22h21
f3n2o2计算的质量402.16m/z实测值403.1[m+h]
+
。(s)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物111)和(r)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物112)
[0450]
n-(3-氨基-1-甲基-丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(85mg,0.19mmol,1eq,hcl)通过sfc拆分(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o meoh];b%:25%-25%,min)。收集纯级分,并在真空下除去挥发物。将残余物重悬于水(10ml)和acn(1ml)中,然后将所得混合物冻干至干以完全除去残留溶剂。获得呈白色固体的化合物112(32.08mg,79umol,41.1%产率),并获得呈白色固体的化合物111
(35mg)。粗产物通过sfc纯化(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o meoh];b%:25%-25%,min),然后收集纯级分,并在真空下除去挥发物。将残余物重悬于水(10ml)和acn(1ml)中,然后将所得混合物冻干至干以完全除去残留溶剂,得到呈白色固体的化合物111(29.44mg,72umol,37.40%产率)。化合物112lcms(esi):rt=0.847min,针对c
22h21
f3n2o2计算的质量402.16m/z实测值403.0[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.63-8.51(m,2h),8.03-7.91(m,3h),7.75(d,j=8.6hz,2h),7.64(t,j=7.9hz,1h),7.33(d,j=7.0hz,1h),7.16(d,j=8.5hz,2h),4.25-4.09(m,1h),2.70(t,j=7.2hz,2h),1.81-1.61(m,2h),1.22(d,j=6.6hz,3h)。化合物111lcms(esi):rt=0.847min,针对c
22h21
f3n2o2计算的质量402.16m/z实测值403.1[m+h]
+
.1h nmr(400mhz,dmso-d6)δ8.59-8.48(m,2h),8.03-7.90(m,3h),7.75(d,j=8.6hz,2h),7.63(t,j=7.9hz,1h),7.32(d,j=7.3hz,1h),7.16(d,j=8.5hz,2h),4.25-4.13(m,1h),2.61(t,j=6.8hz,2h),1.70-1.52(m,2h),1.20(d,j=6.6hz,3h)。实施例85:n-异丙基-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物113)
[0451]
向6-甲氧基-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(20mg,55umol,1eq)、丙-2-胺(3.9mg,66umol,5.68ul,1.2eq)和dipea(7.1mg,55umol,1eq)在dcm(1ml)中的溶液中加入hatu(25.1mg,66umol,1.2eq)。将反应混合物在25℃下搅拌1hr。lc-ms显示起始材料完全耗尽,并且检测到一个具有所需ms的主峰。减压浓缩反应混合物。将混合物用水(5ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化(柱:waters xbridge beh c18 100*25mm*5um;流动相:[水(0.04%nh3h2o 10mm nh4hco3)-acn];b%:50%-80%,7.8min),得到呈白色固体的标题化合物。lcms(esi):rt=0.911min,针对c
21h19
f3n2o3计算的质量404.13m/z实测值405.2[m+h]
+
。1h nmr(400mhz,cdcl3)δ9.03(d,j=2.3hz,1h),8.54(d,j=2.0hz,1h),7.62(d,j=8.5hz,2h),7.16(d,j=8.5hz,2h),6.98(d,j=2.5hz,1h),6.93(d,j=2.5hz,1h),6.08(br d,j=6.8hz,1h),4.37(qd,j=6.7,13.8hz,1h),3.93(s,3h),1.33(d,j=6.5hz,6h)。实施例86:(r)-n-(4-羟基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物114)和(s)-n-(4-羟基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物115)n-(3-羟基-1-甲基-丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0452]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(90mg,0.27mmol,1eq)、3-氨基丁烷-1-醇(28.9mg,0.32mmol,1.2eq)、dipea(105mg,0.81mmol,0.14ml,3eq)和hatu(154.4mg,0.40mmol,1.5eq)在dcm(10ml)中的混合物在25℃下搅拌2hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过柱色谱法纯化(sio2,石油醚/乙酸乙酯=1/0至0/1)。获得呈白色固体的化合物n-(3-羟基-1-甲基-丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(100mg,0.24mmol,91.5%产率)。(r)-n-(4-羟基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物114)和(s)-n-(4-羟基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物115)
[0453]
外消旋化合物n-(3-羟基-1-甲基-丙基)-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg,0.22mmol,1eq)通过sfc拆分(柱:phenomenex-cellulose-2(250mm*30mm,5um);流动相:[0.1%nh3h2o meoh];b%:30%-30%,min)。获得呈白色固体的化合物114(14.6mg,35.5umol,15.9%产率)。lcms(esi):rt=0.927min,针对c
22h20
f3no3计算的质量403.39m/z实测值404.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 1.19(d,j=6.63hz,3h)1.61-1.80(m,2h)3.48(q,j=5.75hz,2h)4.14-4.21(m,1h)4.47(t,j=5.07hz,1h)7.15(d,j=8.63hz,2h)7.31(d,j=7.38hz,1h)7.62(t,j=7.88hz,1h)7.73(d,j=8.75hz,2h)7.91-8.01(m,3h)8.42(d,j=8.13hz,1h)8.52(s,1h)。获得呈白色固体的化合物115(19.23mg,47.19umol,21.15%产率)。lcms(esi):rt=0.926min,针对c
22h20
f3no3计算的质量403.39m/z实测值404.1[m+h]
+
。1h nmr(400mhz,dmso-d6)δppm 1.19(d,j=6.63hz,3h)1.61-1.80(m,2h)3.41-3.52(m,2h)4.12-4.23(m,1h)4.47(t,j=5.13hz,1h)7.15(d,j=8.63hz,2h)7.31(d,j=7.50hz,1h)7.62(t,j=7.94hz,1h)7.73(d,j=8.63hz,2h)7.91-8.01(m,3h)8.42(br d,j=8.13hz,1h)8.52(s,1h)。实施例87:(r)-n-(1-羟基丙烷-2-基)-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物116)
[0454]
向6-甲氧基-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(20mg,55umol,1eq),(2r)-2-氨基丙烷-1-醇(4.9mg,66umol,1.2eq)和dipea(7.1mg,55umol,1eq)在dcm(1ml)中的溶液中加入hatu(25.1mg,66umol,1.2eq)。将反应混合物在25℃下搅拌1hr。lc-ms显示起始材料完全耗尽,并且检测到一个具有所需ms的主峰。减压浓缩反应混合物。将混合物用水(5ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化(柱:waters xbridge beh c18 100*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:40%-70%,9min),得到呈白色固体的标题化合物(9.27mg,39%产率)。lcms(esi):rt=0.840min,针对c
21h19
f3n2o4计算的质量420.13m/z实测值421.0[m+h]
+
。1h nmr(400mhz,cdcl3)δ9.07(d,j=2.0hz,1h),8.55(d,j=2.0hz,1h),
7.62(d,j=8.5hz,2h),7.16(d,j=8.5hz,2h),6.97(d,j=2.5hz,1h),6.93(d,j=2.5hz,1h),6.60(br d,j=7.5hz,1h),4.44-4.32(m,1h),3.93(s,3h),3.86(dd,j=3.5,11.0hz,1h),3.71(dd,j=5.5,11.0hz,1h),1.35(d,j=6.8hz,3h)。实施例88:5-(4-(三氟甲基)苯氧基)萘-2-磺酰胺(化合物117)5-[4-(三氟甲基)苯氧基]萘-2-磺酰氯
[0455]
在0℃下向化合物5-(4-(三氟甲基)苯氧基)萘-2-胺(100.0mg,0.33mmol,1eq)在hcl(0.5ml)和acoh(1ml)中的溶液中加入在h2o(0.5ml)中的nano2(27.3mg,0.40mmol,1.2eq)。然后将混合物在0℃下搅拌30min。然后在0℃下将so2(1.00eq)鼓泡入溶液中30min。然后向混合物中加入cucl(16.3mg,0.16mmol,3.9ul,0.5eq)并搅拌30min。将反应混合物倒入冰水(20ml)中,用ea(20ml*3)萃取。合并的有机相用h2o(10ml)、盐水(10ml)洗涤,经na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~10%乙酸乙酯/石油醚梯度,30ml/min)。获得呈棕色固体的标题化合物(60.0mg,0.16mmol,47.1%产率)。1h nmr(400mhz,cdcl3)δ8.66(d,j=1.8hz,1h),8.40(d,j=9.0hz,1h),8.03(dd,j=1.9,9.0hz,1h),7.89(d,j=8.3hz,1h),7.71-7.62(m,3h),7.27-7.24(m,1h),7.13(d,j=8.6hz,2h)。5-[4-(三氟甲基)苯氧基]萘-2-磺酰胺
[0456]
在0℃下向化合物5-[4-(三氟甲基)苯氧基]萘-2-磺酰氯(50.0mg,0.13mmol,1eq)在dcm(1ml)中的溶液中加入nh3.h2o(362.4mg,2.59mmol,0.4ml,20eq)。然后将混合物在20℃下搅拌1hr。真空浓缩反应混合物。残余物通过prep-hplc纯化(柱:waters xbridge c18150*50mm*10um;流动相:[水(0.04%nh3h2o+10mm nh4hco3)-acn];b%:54%-84%,9.3min)。获得呈白色固体的标题化合物(8.1mg,22umol,17.1%产率)。lcms(esi):rt=0.878min,针对c
17h12
f3no3s计算的质量367.05,m/z实测值366.0[m-h]-;1h nmr(400mhz,cdcl3)δ8.55(d,j=1.8hz,1h),8.26(d,j=8.8hz,1h),7.92(dd,j=1.8,8.8hz,1h),7.82(d,j=8.5hz,1h),7.65-7.54(m,3h),7.24-7.17(m,1h),7.09(d,j=8.3hz,2h),4.91(br s,2h)。实施例89:n-(2-羟基-1-(吡啶-2-基)乙基)-6-甲氧基-8-(4-(三氟甲基)苯氧基)喹啉-3-甲酰胺(化合物118)
[0457]
向6-甲氧基-8-[4-(三氟甲基)苯氧基]喹啉-3-甲酸(30mg,82.5umol,1eq)、2-氨基-2-(2-吡啶基)乙醇(13.6mg,99.1umol,1.2eq)和dipea(21.3mg,0.16mmol,2eq)在dcm(1ml)中的溶液中加入hatu(37.6mg,99.1umol,1.2eq)。将反应混合物在25℃下搅拌1hr。lc-ms显示起始材料完全耗尽,并且检测到一个具有所需ms的峰。将混合物用水(5ml)稀释,并将所得混合物用ea(20ml*3)萃取。合并的有机层经na2so4干燥,过滤并减压浓缩至干。残余物通过prep-hplc纯化(柱:waters xbridge c18 150*50mm*10um;流动相:[水(0.04%nh3h2o+10mm nh4hco3)-acn];b%:36%-66%,11min),得到呈白色固体的标题化合物(11.9mg,29%产率)。lcms(esi):rt=0.826min,针对c
25h20
f3n3o4计算的质量483.14m/z实测值484.0[m+h]
+
。1h nmr(400mhz,cdcl3)δ9.19(d,j=2.0hz,1h),8.61(d,j=2.0hz,1h),8.57(d,j=4.3hz,1h),8.14(br d,j=6.8hz,1h),7.77(dt,j=1.8,7.7hz,1h),7.62(d,j=8.5hz,2h),7.52(d,j=7.8hz,1h),7.34-7.28(m,1h),7.16(d,j=8.5hz,2h),7.01(d,j=2.5hz,1h),6.95(d,j=2.5hz,1h),5.47-5.37(m,1h),4.21-4.15(m,1h),4.07(dd,j=3.9,11.4hz,1h),3.94(s,3h)。实施例90:(s)-n-(2-羟基-1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物119)和(r)-n-(2-羟基-1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物120)(2e)-2-羟基亚氨基-2-(2-吡啶基)乙酸甲酯
[0458]
在搅拌下向2-(2-吡啶基)乙酸甲酯(1g,6.62mmol,0.89ml,1eq)在acoh(1.6ml)中的0℃溶液中逐批加入nano2(456.4mg,6.62mmol,1eq)在h2o(1.40g,77.71mmol,1.4ml,11.75eq)中的水溶液。添加完成后,在25℃下继续搅拌1hr。添加h2o(3.00g,166.53mmol,3ml,25.17eq),并将混合物再搅拌1hr。将反应混合物用h2o(5ml)稀释,并将混合物用ea(10ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残
余物通过柱色谱法纯化(sio2,石油醚/乙酸乙酯=1/0至1/1)。获得呈白色固体的化合物(2e)-2-羟基亚氨基-2-(2-吡啶基)乙酸甲酯(670mg,3.61mmol,54.5%产率)。2-氨基-2-(2-吡啶基)乙醇
[0459]
在0℃下向(2e)-2-羟基亚氨基-2-(2-吡啶基)乙酸甲酯(200mg,1.11mmol,1eq)在thf(6ml)中的溶液中加入lah(210.6mg,5.55mmol,5eq)。然后将混合物在25℃下搅拌16hr。lc-ms显示检测到所需化合物。将反应混合物用h2o(2ml)、naoh(2m,2.5ml)稀释。然后将混合物在真空中浓缩。未进行纯化。获得呈黄色固体的化合物2-氨基-2-(2-吡啶基)乙醇(180mg,粗品),其不经进一步纯化而用于下一步。n-[2-羟基-1-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0460]
将5-[4-(三氟甲基)苯氧基]萘-2-甲酸(150mg,0.45mmol,1eq)、2-氨基-2-(2-吡啶基)乙醇(68.6mg,0.49mmol,1.1eq)、dipea(175.0mg,1.35mmol,0.23ml,3eq)和hatu(257.4mg,0.67mmol,1.5eq)在dcm(1ml)中的混合物在25℃下搅拌2hr。将反应混合物用h2o(10ml)稀释,并将混合物用ea(20ml*3)萃取。合并的有机相用盐水(10ml*2)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:xtimate c18 100*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:28%-58%,8.5min)。获得呈黄色固体的化合物n-[2-羟基-1-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(15mg,30.5umol,6.7%产率)。(s)-n-(2-羟基-1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物119)和(r)-n-(2-羟基-1-(吡啶-2-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物120)
[0461]
外消旋化合物n-[2-羟基-1-(2-吡啶基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(20mg,44.2umol,1eq)通过制备型sfc纯化(柱:daicel chiralpak ad(250mm*30mm,10um);流动相:[0.1%nh3h2o etoh];b%:40%-40%,min)。获得呈白色固体的化合物119(2.4mg,5.4umol,12.3%产率)。lcms(esi):rt=0.801min,针对c
25h19
f3n2o3计算的质量452.43m/z实测值453.0[m+h]
+
。1h nmr(400mhz,cdcl3)δ4.07(br dd,j=11.07,3.56hz,1h)4.20(dd,j=11.26,4.13hz,1h)4.36(br s,1h)5.39-5.45(m,1h)7.08(d,j=8.63hz,2h)7.16(d,j=7.50hz,1h)7.30(dd,j=6.94,5.44hz,1h)7.48-7.56(m,2h)7.60(d,j=8.75hz,2h)7.76(td,j=7.66,1.69hz,1h)7.82(d,j=8.25hz,1h)7.92(dd,j=8.76,1.50hz,1h)8.04(br d,j=7.13hz,1h)8.14(d,j=8.75hz,1h)8.46(s,1h)8.58(br d,j=4.63hz,1h)。获得呈白色固体的化合物120(2.5mg,5.6umol,12.7%产率)。lcms(esi):rt=0.794min,针对c
25h19
f3n2o3计算的质量452.43m/z实测值453.0[m+h]
+
。1h nmr(400mhz,cdcl3)δ4.07(dd,j=11.32,3.69hz,1h)4.20(dd,j=11.26,4.25hz,1h)4.36(br s,1h)5.39-5.43(m,1h)7.08(d,j=8.50hz,2h)7.16(d,j=6.88hz,1h)7.28-7.33(m,1h)7.49-7.56(m,2h)7.60(d,j=8.50hz,2h)7.76(td,j=7.69,1.75hz,1h)7.82(d,j=8.25hz,1h)7.92(dd,j=8.82,1.69hz,1h)8.04(br d,j=6.75hz,1h)8.14(d,j=8.75hz,1h)8.45(d,j=1.38hz,1h)8.58(d,j=4.25hz,1h)。实施例91:n-(1,5-二羟基戊烷-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物121)
3-氨基戊烷-1,5-二醇
[0462]
向3-氨基戊二酸二甲酯(120.0mg,0.57mmol,1eq,hcl)在thf(1.5ml)中的0℃溶液中逐批加入lialh4(32.3mg,0.85mmol,1.5eq)。将所得混合物在0℃下搅拌1h,并在20℃下搅拌16h。在0℃下用水(50μl),然后用2m naoh溶液(50μl)猝灭反应混合物,然后用水(150μl)稀释。然后向反应中加入na2so4,并在20℃下搅拌0.5h,将反应过滤并减压浓缩,得到呈无色油状物的化合物3-氨基戊烷-1,5-二醇(20.0mg,0.17mmol,29.6%产率)。1h nmr(400mhz,cdcl3)δ3.87-3.76(m,4h),3.23-3.11(m,1h),1.76-1.68(m,2h),1.62-1.56(m,2h)。n-(1,5-二羟基戊烷-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0463]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(38.6mg,0.12mmol,1.0eq)和hatu(66.3mg,0.17mmol,1.5eq)在dmf(1ml)中的20℃溶液中加入3-氨基戊烷-1,5-二醇(18.0mg,0.15mmol,1.3eq)和tea(35.3mg,0.35mmol,49ul,3eq)。将混合物在20℃下搅拌16h。将反应混合物浓缩,得到残余物,其通过prep-hplc纯化(柱:xtimate c18100*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:35%-65%,8.5min),得到呈无色油状物的标题化合物(3.2mg,7umol,6.2%产率)。lcms(esi):rt=0.891min,针对c
23h22
f3no4计算的质量433.15,m/z实测值434.0[m+h]
+
;1h nmr(400mhz,cd3od)δ8.45(s,1h),8.10(d,j=8.8hz,1h),7.90(brd,j=8.5hz,2h),7.66(brd,j=8.6hz,2h),7.59(t,j=7.9hz,1h),7.23(d,j=7.5hz,1h),7.13(brd,j=8.5hz,2h),4.44-4.35(m,1h),3.69(brt,j=6.4hz,4h),1.97-1.77(m,4h)。实施例92:(r)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物122)和(r)-n-(1-(1-(4-羟基丁基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物123)3-[(1r)-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯
[0464]
在25℃下向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(350mg,1.05mmol,1eq)、hatu(600.8mg,1.58mmol,1.5eq)在dmf(5ml)中的混合物中添加dipea(408.4mg,3.16mmol,0.55ml,3eq)。添加后,将混合物在25℃下搅拌0.5hr,然后添加在dmf(3ml)中的(r)-3-(1-氨基乙基)氮杂环丁烷-1-甲酸苄酯(246.8mg,1.05mmol,1eq)。将所得混合物在25℃下搅拌15.5hr。将残余物倒入h2o(30ml)中并搅拌5min。用ea(20ml*3)萃取水相。合并的有机相用盐水(30ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过急骤硅胶色谱法纯化(20gsilica flash column,ea/pe:0~40%),得到呈黄色固体的3-[(1r)-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(465mg,0.80mmol,75.6%产率)。(r)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物122)和(r)-n-(1-(1-(4-羟基丁基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物123)
[0465]
在n2下向3-[(1r)-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(350mg,0.64mmol,1eq)在thf(2ml)中的溶液中加入pd/c(30mg,10%)。将悬浮液在真空下脱气,并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌16hr。过滤反应混合物,并用meoh(10ml*2)洗涤滤饼。真空浓缩滤液,得到粗产物。粗产物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,8.5min),得到95mg化合物,然后通过sfc(柱:daicel chiralpak ic(250mm*30mm,5um);流动相:[0.1%nhho etoh];b%:45%-45%,min)纯化该化合物,得到呈白色固体的化合物122(61.4mg,0.14mmol,22.5%产率)。lcms(esi):rt=0.782min,针对c
23h21
f3n2o2计算的质量414.16,m/z实测值415.2[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.55-8.49(m,1h),8.40(d,j=8.3hz,1h),8.01-7.91(m,3h),7.77-7.70(m,2h),7.68-7.58(m,1h),7.35-7.27(m,1h),7.19-7.08(m,2h),4.34-4.12(m,1h),3.51-3.43(m,1h),3.30-3.26(m,1h),3.26-3.10(m,1h),3.01-2.81(m,1h),2.81-2.69(m,1h),1.12-1.03(m,3h)。呈黄色固体的化合物123(7.4mg,13.4umol,2.1%产率)。lcms(esi):rt=0.781min,针对c
27h29
f3n2o3计算的质量486.21,m/z实测值487.3[m+h]
+
;1h nmr(400mhz,cd3od)δ8.43(d,j=1.5hz,1h),8.09(d,j=8.8hz,1h),7.96-7.84(m,2h),7.66(d,j=8.8hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.0hz,1h),7.13(d,j=8.5hz,2h),4.38-4.28(m,1h),3.57-3.41(m,4h),3.08(t,j=7.5hz,1h),2.96(t,j=7.8hz,1h),2.77-2.65(m,1h),2.50(t,j=7.4hz,2h),1.57-1.49(m,2h),1.48-1.39(m,2h),1.35-1.23(m,4h),1.20(d,j=6.8hz,3h),0.89(d,j=7.3hz,2h)。实施例93:(r)-n-(1-(1-(2-氟乙基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物124)
xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:21%-51%,8.5min),得到呈黄色固体的n-[1-(1-甲基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(54.8mg,0.13mmol,35.3%产率)。(r)-n-(1-(1-甲基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物126)和(s)-n-(1-(1-甲基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物127)
[0471]
n-[1-(1-甲基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(45mg,0.11mmol,1eq)进一步通过sfc拆分(柱:phenomenex-cellulose-2(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:35%-35%,min),得到呈黄色固体的化合物126(7.6mg,17.74umol,16.89%产率)。lcms(esi):rt=0.795min,针对c
24h23
f3n2o2计算的质量428.17,m/z实测值429.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.50(d,j=1.5hz,1h),8.11(d,j=8.8hz,1h),7.94-7.88(m,2h),7.66(d,j=8.6hz,2h),7.60(t,j=7.9hz,1h),7.27-7.21(m,1h),7.13(d,j=8.5hz,2h),4.56-4.43(m,1h),4.30-4.12(m,3h),4.10-3.98(m,1h),3.15-3.06(m,1h),2.93(s,3h),1.26(d,j=6.8hz,3h),和呈白色固体的化合物127(8.8mg,20.3umol,19.4%产率)。lcms(esi):rt=0.794min,针对c
24h23
f3n2o计算的质量412.18,m/z实测值413.1[m+h]
+
;1h nmr(400mhz,cd3od)δ8.46(s,1h),8.07(d,j=7.8hz,1h),7.88-7.82(m,4h),7.71-7.64(m,3h),7.57(dd,j=1.1,7.0hz,1h),4.45-4.34(m,1h),3.68(m,2h),3.39-3.33(m,1h),3.25(t,j=8.1hz,1h),2.84-2.73(m,1h),2.47(s,3h),1.90(s,1h),1.21(d,j=6.8hz,3h)。实施例96:(s)-n-(1-(1-(2-羟基乙基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物128)
[0472]
向(s)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(50mg,0.12mmol,1eq)在dmf(2ml)中的溶液中加入k2co3(41.7mg,0.30mmol,2.5eq)和2-溴乙醇(22.6mg,0.18mmol,12.8ul,1.5eq)。将混合物在25℃下搅拌16hr。将反应混合物用h2o(20ml)稀释并搅拌5min。用ea(10ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。粗产物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,8.5min),得到呈黄色油状物的标题化合物(9.5mg,19.2umol,15.9%产率,hcl)。lcms(esi):rt=0.779min,针对c
25h25
f3n2o3计算的质量458.18,m/z实测值459.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.58(s,1h),8.49(d,j=6.3hz,1h),8.04-7.91(m,3h),7.72(d,j=8.5hz,2h),7.62(t,j=7.9hz,1h),7.28(d,j=7.3hz,1h),7.17(d,j=8.5hz,2h),4.38(s,1h),4.22-3.90(m,4h),3.64(t,j=5.0hz,2h),3.11-3.03(m,3h),1.17(d,j=6.5hz,3h)。实施例97:(s)-n-(1-(1-(2-氟乙基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物129)
[0473]
向(s)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(60mg,0.15mmol,1eq)在mecn(1ml)中的溶液中加入k2co3(50.0mg,0.36mmol,2.5eq)和1-溴-2-氟-乙烷(27.6mg,0.22mmol,2.6ul,1.5eq)。将混合物在60℃下搅拌16hr。将反应混合物用h2o(30ml)稀释并搅拌5min。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。粗产物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,8.5min),得到呈白色固体的标题化合物(13.2mg,26.6umol,18.4%产率,hcl)。lcms(esi):rt=0.801min,针对c
25h24
f4n2o2计算的质量460.18,m/z实测值461.2[m+h]
+
;1h nmr(400mhz,dmso-d6)δ11.67-10.81(m,1h),8.60(s,1h),8.52(d,j=7.0hz,1h),8.05-7.91(m,3h),7.72(d,j=8.8hz,2h),7.62(t,j=7.9hz,1h),7.29(d,j=7.5hz,1h),7.17(d,j=8.8hz,2h),4.83-4.62(m,2h),4.38(m,1h),4.30-3.85(m,4h),3.63-3.42(m,2h),3.10(m,j=7.5hz,1h),1.17(s,3h)。实施例98:(s)-n-(1-(1-乙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物130)和(r)-n-(1-(1-乙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物131)3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯
[0474]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(1g,3.0mmol,1.0eq)在dcm(6ml)中的溶液中加入hatu(1.72g,4.51mmol,1.5eq)、dipea(972.3mg,7.52mmol,1.31ml,2.5eq)和3-(1-((2,4-二甲氧基苄基)氨基)乙基)氮杂环丁烷-1-甲酸苄酯(1.16g,3.01mmol,1.0eq)。将混合物在25℃下搅拌1hr。减压浓缩反应混合物以得到残余物。残余物通过柱色谱法纯化(sio2,石油醚/乙酸乙酯=100/1至1/1),得到呈无色油状物的3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(1.3g,1.62mmol,53.7%产率)。lcms(esi):rt=1.133min,针对c
40h37
f3n2o6计算的质量698.26m/z
实测值699.1[m+h]
+
。n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0475]
在n2下向3-[1-[(2,4-二甲氧基苯基)甲基-[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸苄酯(0.6g,0.85mmol,1eq)在meoh(30ml)中的溶液中加入pd/c(0.25g,10%)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌1小时。将反应混合物过滤并减压浓缩,得到残余物。粗产物不经进一步纯化而用于下一步。获得呈白色固体的n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(400mg,0.70mmol,82.5%产率)。lcms(esi):rt=0.933min,针对c
32h31
f3n2o4计算的质量564.22m/z实测值565.1[m+h]
+
。n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0476]
向n-[1-(氮杂环丁烷-3-基)乙基]-n-[(2,4-二甲氧基苯基)甲基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(200mg,0.35mmol,1eq)在meoh(3ml)中的溶液中加入乙醛(194.7mg,4.42mmol,0.24ml,12.48eq)和pd/c(50mg,10%)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌1小时。lc-ms显示3完全耗尽,并且检测到91%的所需化合物。将反应混合物过滤并减压浓缩,得到残余物。粗产物不经进一步纯化而用于下一步。获得呈白色固体的n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(150mg,粗品)。lcms(esi):rt=0.958min,针对c
34h35
f3n2o4计算的质量592.25m/z实测值593.1[m+h]
+
。n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0477]
向n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(200mg,0.33mmol,1eq)在dcm(2ml)中的溶液中加入tfa(5.99g,52.5mmol,3.89ml,155.7eq)。将混合物在25℃下搅拌16hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:22%-52%,9.5min),得到呈白色固体的n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg,0.20mol,60.2%产率)。lcms(esi):rt=0.863min,针对c
25h25
f3n2o2计算的质量442.19m/z实测值433.1[m+h]
+
。(s)-n-(1-(1-乙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物130)和(r)-n-(1-(1-乙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物131)
[0478]
n-[1-(1-乙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(90mg)通过制备型sfc纯化(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:20%-20%,min),得到作为两种白色固体的化合物130(9.6mg,21.5umol,10.5%产率)和化合物131(13.6mg,30.5umol,15.0%产率)。化合物130lcms(esi):rt=0.875min,针对c
25h25
f3n2o2计算的质量442.19m/z实测值433.2[m+h]
+
。1h nmr(400mhz,cd3od)δ8.50(d,j=1.3hz,1h),8.10(d,j=8.9hz,1h),7.95-7.87(m,2h),7.66(d,j=8.6hz,2h),7.59(t,j=7.9hz,1h),7.23(d,j=7.3hz,1h),7.12(d,j=8.6hz,2h),4.50(s,1h),4.32-3.90(m,4h),3.29-3.20(m,1h),3.25(q,j=7.0hz,1h),3.11(sxt,j=
8.5hz,1h),1.27(d,j=6.8hz,3h),1.21(t,j=7.3hz,3h)。化合物131lcms(esi):rt=0.863min,针对c
25h25
f3n2o2计算的质量442.19m/z实测值433.2[m+h]
+
。1h nmr(400mhz,cd3od)δ8.45(d,j=1.3hz,1h),8.09(d,j=8.8hz,1h),7.92-7.87(m,2h),7.65(d,j=8.6hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.4hz,1h),7.12(d,j=8.6hz,2h),4.38(dd,j=6.8,9.3hz,1h),3.74-3.64(m,2h),3.37-3.32(m,1h),3.22(t,j=8.1hz,1h),2.81(d,j=9.0hz,1h),2.71(q,j=7.1hz,2h),1.22(d,j=6.6hz,3h),1.03(t,j=7.2hz,3h)。实施例99:(s)-n-(1-(1-异丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物132)和(r)-n-(1-(1-异丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物133)n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0479]
向n-(1-(氮杂环丁烷-3-基)乙基)-n-(2,4-二甲氧基苄基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(200mg,0.35mmol,1eq)在meoh(3ml)中的溶液中加入丙酮(256.7mg,4.42mmol,0.32ml,12.48eq)和pd/c(100mg,10%)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌1hr。将反应混合物过滤并减压浓缩,得到残余物。残余物通过柱色谱法纯化(sio2,乙酸乙酯:甲醇=100/1至10/1),得到呈白色固体的n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(150mg,0.24mmol,69.80%产率)。lcms(esi):rt=0.965min,针对c
35h37
f3n2o4计算的质量606.27m/z实测值607.1[m+h]
+
。n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺
[0480]
向n-[(2,4-二甲氧基苯基)甲基]-n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(100mg,0.16mmol,1eq)在dcm(2ml)中的溶液中加入tfa(2.93g,25.6mmol,1.90ml,155.7eq)。将混合物在25℃下搅拌5hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,8.5min),得到呈白色固体的n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(50mg,0.10mmol,66.45%产率)。lcms(esi):rt=0.885min,针对c
26h27
f3n2o2计算的质量456.20m/z实测值457.0[m+h]
+
。(s)-n-(1-(1-异丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物132)和(r)-n-(1-(1-异丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧
基)-2-萘甲酰胺(化合物133)
[0481]
n-[1-(1-异丙基氮杂环丁烷-3-基)乙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(60mg)通过制备型sfc纯化(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:35%-35%,min),得到作为两种白色固体的化合物132(5.4mg,11.8umol,9.0%产率)和化合物133(4.4mg,9.6umol,7.3%产率)。化合物132lcms(esi):rt=0.907min,针对c
26h27
f3n2o2计算的质量456.20m/z实测值457.0[m+h]
+
。1h nmr(400mhz,cd3od)δ8.43(d,j=1.3hz,1h),8.09(d,j=8.8hz,1h),7.88(d,j=8.5hz,2h),7.65(d,j=8.8hz,2h),7.58(t,j=8.0hz,1h),7.22(d,j=7.3hz,1h),7.12(d,j=8.5hz,2h),4.34-4.20(m,1h),3.54-3.42(m,2h),3.03(t,j=7.7hz,1h),2.90(t,j=7.8hz,1h),2.69-2.57(m,1h),2.39(spt,j=6.2hz,1h),1.19(d,j=6.5hz,3h),0.94(dd,j=4.1,6.1hz,6h)。化合物133lcms(esi):rt=0.903min,针对c
26h27
f3n2o2计算的质量456.20m/z实测值457.0[m+h]
+
。1h nmr(400mhz,cd3od)δ8.43(d,j=1.3hz,1h),8.09(d,j=9.0hz,1h),7.88(d,j=8.5hz,2h),7.65(d,j=8.5hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.5hz,1h),7.12(d,j=.8hz,2h),4.42-4.20(m,1h),3.55-3.41(m,2h),3.03(t,j=7.7hz,1h),2.91(t,j=7.8hz,1h),2.69-2.57(m,1h),2.44-2.35(m,1h),1.19(d,j=6.8hz,3h),0.94(dd,j=4.1,6.1hz,6h)。实施例100:(s)-n-(1-(1-(2,2-二氟乙基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物134)
[0482]
向(s)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(75mg,0.18mmol,1eq)在mecn(3ml)中的溶液中加入k2co3(62.5mg,0.45mmol,2.5eq)和2-溴-1,1-二氟乙烷(39.4mg,0.27mmol,2.6ul,1.5eq)。将混合物在70℃下搅拌16hr。将反应混合物用h2o(30ml)稀释并搅拌5min。用ea(15ml*3)萃取水相。合并的有机相用盐水(20ml)洗涤,用无水na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:waters xbridge c18 150*50mm*10um;流动相:[水(0.04%nh3h2o)-acn];b%:51%-81%,11min),得到呈白色固体的标题化合物(26.8mg,54.9umol,30.33%产率)。lcms(esi):rt=0.796min,针对c
25h23
f5n2o2计算的质量478.17,m/z实测值479.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.51(s,1h),8.44(d,j=8.3hz,1h),8.02-7.90(m,3h),7.74(d,j=8.8hz,2h),7.63(t,j=7.9hz,1h),7.32(d,j=7.0hz,1h),7.15(d,j=8.5hz,2h),6.09-5.75(m,1h),4.32-4.19(m,1h),3.34(t,j=6.8hz,2h),3.11-2.95(m,2h),2.76(m,2h),2.63-2.52(m,2h),1.09(d,j=6.5hz,3h)。实施例101:(r)-n-(1-(1-(2-羟基乙基)氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物135)
[0483]
在30℃下向(r)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(20.0mg,48umol,1eq)在acn(0.5ml)中的溶液中加入ki(0.8mg,4.8umol,0.1eq)、k2co3(20.0mg,0.14mmol,3eq)和2-溴乙-1-醇(9.1mg,72umol,5ul,1.5eq)。将反应在60℃下搅拌16hr。将反应减压浓缩,得到残余物,其通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:24%-54%,8.5min),得到呈白色固体的标题化合物(2.0mg,4.1umol,8.5%产率,hcl)。lcms(esi):rt=0.861min,针对c
25h25
f3n2o3计算的质量458.18,m/z实测值459.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ10.74(brs,1h),8.61(s,1h),8.53(brd,j=8.0hz,1h),8.04-7.97(m,2h),7.94(d,j=8.3hz,1h),7.72(d,j=8.6hz,2h),7.62(t,j=7.9hz,1h),7.29(d,j=7.4hz,1h),7.18(d,j=8.6hz,2h),5.03(brs,1h),4.39(brd,j=6.5hz,1h),4.19-4.02(m,3h),3.95(brs,1h),3.65(t,j=5.1hz,2h),3.22(brs,1h),3.06-3.02(m,1h),1.17(d,j=6.8hz,3h)。实施例102:(s)-n-(1-(1-环丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物136)
[0484]
在25℃下向(s)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(60mg,0.14mmol,1eq)和环丙基硼酸(18.7mg,0.22mmol,1.5eq)在dcm(3ml)中的混合物中一次性加入cu(oac)2(52.6mg,0.29mmol,2eq)和dipea(37.4mg,0.29mmol,50.4ul,2eq)。将悬浮液在真空下脱气并用o2吹扫数次。将混合物在o2(15psi)下于25℃搅拌18hr。过滤反应混合物,并用ea(10ml*2)洗涤滤饼。真空浓缩滤液,得到粗产物。粗产物通过prep-hplc纯化(柱:waters xbridge c18 150*50mm*10um;流动相:[水(0.04%nh3h2o)-acn];b%:55%-85%,11min),得到呈白色固体的标题化合物(12.6mg,26.9umol,18.6%产率)。lcms(esi):rt=0.799min,针对c
26h25
f3n2o2计算的质量454.19,m/z实测值455.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.51(s,1h),8.42(d,j=8.3hz,1h),8.02-7.91(m,3h),7.74(d,j=8.8hz,2h),7.63(t,j=7.9hz,1h),7.32(d,j=7.3hz,1h),7.15(d,j=8.5hz,2h),4.29-4.17(m,1h),3.26(t,j=7.2hz,1h),3.02(t,j=6.5hz,1h),2.93(t,j=6.7hz,1h),2.48-2.41(m,1h),1.80(m,1h),1.09(d,j=6.5hz,3h),0.28(m,2h),0.17(m,2h)。实施例103:(r)-n-(1-(1-环丙基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物137)
[0485]
在30℃下向(r)-n-(1-(氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(100.0mg,0.24mmol,1eq)和环丙基硼酸(31.1mg,0.36mmol,1.5eq)在dcm(6ml)中的混合物中一次性加入cu(oac)2(87.7mg,0.48mmol,2.0eq)和dipea(62.4mg,0.48mmol,84ul,2.0eq)。将悬浮液在真空下脱气并用o2吹扫数次。将混合物在o2(15psi)下于30℃搅拌40小时。将反应减压浓缩,得到残余物,其通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%nh3h2o+10mm nh4hco3)-acn];b%:65%-95%,7.8min),得到呈黄色固体的标题化合物(9.73mg,21umol,8.7%产率)。lcms(esi):rt=0.890min,针对c
26h25
f3n2o2计算的质量454.19,m/z实测值455.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.51(s,1h),8.43(d,j=8.0hz,1h),8.01-7.90(m,3h),7.74(d,j=8.5hz,2h),7.63(t,j=7.9hz,1h),7.33(d,j=7.5hz,1h),7.16(d,j=8.8hz,2h),4.29-4.14(m,1h),3.28(brs,3h),3.11-2.90(m,2h),1.83(brs,1h),1.09(d,j=6.5hz,3h),0.35-0.24(m,2h),0.19(brs,2h)。实施例104:(s)-n-(1-(3-羟基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物138)3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯
[0486]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(150.0mg,0.45mmol,1.0eq)和hatu(257.5mg,0.68mmol,1.5eq)在dmf(2ml)中的30℃溶液中加入3-(1-氨基乙基)-3-羟基氮杂环丁烷-1-甲酸叔丁酯(107.4mg,0.50mmol,1.1eq)和tea(137.0mg,1.35mmol,0.2ml,3.0eq)。将混合物在30℃下搅拌16h。将反应混合物用水(20ml)稀释,并用ea(20ml*3)萃取。合并的有机层用水(20ml*2)和盐水(20ml*2)洗涤,经na2so4干燥,过滤并减压浓缩,得到残余物。将反应减压浓缩,得到残余物,其通过急骤硅胶色谱法纯化(4gsilica flash column,洗脱液为0~75%乙酸乙酯/石油醚梯度,20ml/min),得到呈无色油状物的3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(175.0mg,0.32mmol,70.0%产率)。lcms(esi):rt=1.012min,针对c28h29
f3n2o5计算的质量530.20,m/z实测值531.3[m+h]
+
;化合物3:(s)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯,化合物4:(r)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯
[0487]
3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯通过sfc纯化(柱:daicel chiralpak ad-h(250mm*30mm,5um);流动相:[0.1%nh3h2o ipa];b%:25%-25%,min),得到呈白色固体的(s)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(50.0mg,90umol,48.0%产率)。lcms(esi):rt=1.014min,针对c
28h29
f3n2o5计算的质量530.20,m/z实测值531.4[m+h]
+
,和呈白色固体的(r)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(43mg,79umol,42.1%产率)。lcms(esi):rt=1.016min,针对c
28h29
f3n2o5计算的质量530.20,m/z实测值531.4[m+h]
+
。(s)-n-(1-(3-羟基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0488]
向(s)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(50.0mg,94.0umol,1.0eq)在dcm(1ml)中的30℃溶液中加入tfa(154.0mg,1.35mmol,0.1ml,14.33eq)。将混合物在30℃下搅拌2h。将反应减压浓缩,得到残余物,其通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.225%fa)-acn];b%:16%-46%,8.5min),得到呈白色固体的标题化合物(2.06mg,4umol,4.5%产率,fa)。lcms(esi):rt=0.856min,针对c
23h21
f3n2o3计算的质量430.15,m/z实测值431.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.64(s,1h),8.58(brd,j=8.3hz,1h),8.37(brs,1h),8.02-7.96(m,3h),7.74(brd,j=8.5hz,2h),7.64(t,j=7.9hz,1h),7.34(d,j=7.5hz,1h),7.15(brd,j=8.8hz,2h),4.46-4.39(m,1h),4.07(brd,j=10.5hz,1h),3.91(brd,j=10.0hz,1h),3.68-3.68(m,1h),3.68-3.65(m,2h),1.15(brd,j=6.8hz,3h)。实施例105:(r)-n-(1-(3-羟基氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物139)
[0489]
向(r)-3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(43.0mg,81umol,1eq)在dcm(1ml)中的30℃溶液中加入tfa(132.4mg,1.16mmol,86ul,14.33eq)。将混合物在30℃下搅拌1h。将反应减压浓缩,得到残余物,其通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.225%fa)-acn];b%:16%-46%,8.5min),得到呈白色固体的标题化合物(2.7mg,6umol,7.2%产率,fa)。lcms(esi):rt=0.859min,针对c
23h21
f3n2o3计算的质量430.15,m/z实测值431.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.66-8.57(m,2h),8.39(brs,1h),8.01-7.96(m,3h),7.74(brd,j=8.3hz,2h),7.64(brt,j=7.8hz,1h),7.33(brd,j=7.5hz,1h),7.15(brd,j=8.5hz,2h),
4.41(brs,1h),4.05(brd,j=9.8hz,1h),3.89(brd,j=9.3hz,2h),3.64(brs,1h),1.15(brd,j=6.3hz,3h)。实施例106:(r)-n-(1-(氮杂环丁烷-3-基)-2-羟基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物140)和n-((3r)-4-(氨基甲基)四氢呋喃-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物141)3-[2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯
[0490]
向化合物5-(4-(三氟甲基)苯氧基)-2-萘甲酸(250mg,0.75mmol,1eq)和hatu(429.1mg,1.13mmol,1.5eq)在dcm(4ml)中的溶液中加入化合物3-(1-氨基-2-(苄基氧基)乙基)氮杂环丁烷-1-甲酸叔丁酯(461.0mg,1.50mmol,2eq)和diea(194.4mg,1.50mmol,0.26ml,2eq)。将混合物在30℃下搅拌3hr。将反应混合物在真空中浓缩。然后将残余物用ea(15ml*3)稀释,用h2o(10ml)和盐水(10ml*2)洗涤,经na2so4干燥,过滤并真空浓缩。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:60%-90%,8.5min)。获得呈黄色固体的3-[2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(115mg,0.18mmol,24.3%产率)。lcms(esi):rt=1.055min,针对c
35h35
f3n2o5计算的质量620.25m/z实测值621.2[m+h]
+
。1h nmr(400mhz,cdcl3)δ8.33(d,j=1.0hz,1h),8.13(d,j=8.8hz,1h),7.85-7.76(m,2h),7.60(d,j=8.5hz,2h),7.53(t,j=7.9hz,1h),7.38-7.29(m,5h),7.16(d,j=7.5hz,1h),7.08(d,j=8.8hz,2h),6.64(br d,j=9.0hz,1h),4.65-4.59(m,1h),4.59-4.49(m,2h),4.05-3.91(m,3h),3.79-3.71(m,1h),3.66-3.59(m,2h),3.11-2.89(m,1h),1.42(s,9h)。3-[(1r)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯和3-[(1s)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯
[0491]
3-[2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(115mg,0.18mmol,1eq)的分离方法由sfc开发。通过手性sfc(柱:daicel chiralcel od-h(250mm*30mm,5um);流动相:[0.1%nh3h2o etoh];b%:30%-30%,min)拆分外消旋物。获得呈无色油状物的3-[(1r)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(52mg,82.9umol,44.7%产率)。lcms(esi):rt=1.048min,针对c
35h35
f3n2o5计算的质量620.25m/z实测值621.2[m+h]
+
。获得呈无色油状物的3-[(1s)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(50mg,78.9umol,42.6%产率)。lcms(esi):rt=1.050min,针对c35h35
f3n2o5计算的质量620.25m/z实测值621.1[m+h]
+
。3-[(1r)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯
[0492]
向3-[(1r)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(52mg,83.7umol,1eq)在meoh(2ml)中的溶液中加入pd(oh)2(5.8mg,8.3umol,20%,0.1eq)和tfa(9.5mg,83.7umol,6ul,1eq)。将混合物脱气并用h2吹扫3次,并在h2气氛(15psi)下于25℃搅拌0.5hr。过滤反应混合物并真空浓缩滤液。粗产物直接用于下一步。呈白色固体的3-[(1r)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(37mg,62.7umol,74.9%产率)。lcms(esi):rt=0.912min,针对c
28h29
f3n2o5计算的质量530.20m/z实测值531.1[m+h]
+
。1h nmr(400mhz,cdcl3)δ8.37(d,j=1.3hz,1h),8.14(d,j=8.8hz,1h),7.85-7.77(m,2h),7.62-7.58(m,2h),7.55-7.50(m,1h),7.16(d,j=6.8hz,1h),7.07(d,j=8.5hz,2h),6.73(br d,j=8.5hz,1h),4.58-4.44(m,1h),4.07(td,j=8.7,11.8hz,2h),3.94(dd,j=5.8,8.8hz,1h),3.88-3.76(m,3h),3.03-2.93(m,1h),1.42(s,9h)。(r)-n-(1-(氮杂环丁烷-3-基)-2-羟基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物140)和n-((3r)-4-(氨基甲基)四氢呋喃-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物141)
[0493]
向3-[(1r)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(35mg,65.9umol,1eq)在dcm(2ml)中的溶液中加入tfa(112.8mg,0.98mmol,73ul,15eq)。将混合物在25℃下搅拌1hr。将反应混合物在真空中浓缩。将残余物用饱和nahco3水溶液调节至ph=8,用ea(15ml*3)萃取。合并的有机相用h2o(10ml)、盐水(10ml)洗涤,经na2so4干燥,过滤并真空浓缩。粗产物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:15%-45%,8.5min)。获得呈黄色油状物的化合物141(7.5mg,16.0umol,24.3%产率,hcl)。lcms(esi):rt=0.733min,针对c
23h21
f3n2o3计算的质量430.15m/z实测值431.1[m+h]
+
。1h nmr(400mhz,cd3od)δ8.46(s,1h),8.27(d,j=8.8hz,1h),7.96(d,j=8.3hz,1h),7.78(dd,j=1.8,8.8hz,1h),7.72-7.65(m,3h),7.31(d,j=7.5hz,1h),7.17(d,j=8.8hz,2h),3.98-3.92(m,1h),3.91-3.86(m,2h),3.85-3.74(m,2h),3.73-3.61(m,2h),2.57-2.43(m,1h)。获得呈黄色油状物的化合物140(3.8mg,8.1umol,12.3%产率,hcl)。lcms(esi):rt=0.751min,针对c
23h21
f3n2o3计算的质量430.15m/z实测值431.1[m+h]
+
。1h nmr(400mhz,cd3od)δ8.53(s,1h),8.12(d,j=8.8hz,1h),7.97-7.88(m,2h),7.66(d,j=8.8hz,2h),7.63-7.58(m,1h),7.24(d,j=7.5hz,1h),7.13(d,j=8.5hz,2h),4.50(td,j=5.5,8.9hz,1h),4.21-4.08(m,4h),3.75-3.70(m,1h),3.70-3.64(m,1h),3.41-3.33(m,1h)。实施例107:(s)-n-(1-(氮杂环丁烷-3-基)-2-羟基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物142)和n-((3s)-4-(氨基甲基)四氢呋喃-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物143)
3-[(1s)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯
[0494]
向化合物3-[(1s)-2-苄基氧基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(50mg,80.5umol,1eq)在meoh(2ml)中的溶液中加入pd(oh)2(5.6mg,8.0umol,20%,0.1eq)和tfa(91.8mg,0.80mmol,59ul,10eq)。将混合物脱气并用h2吹扫3次,并在h2气氛(15psi)下于25℃搅拌0.5hr。过滤反应混合物并真空浓缩滤液。粗产物直接用于下一步。获得呈白色固体的3-[(1s)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(38mg,65.9umol,81.8%产率)。lcms(esi):rt=0.915min,针对c
28h29
f3n2o5计算的质量530.20m/z实测值531.1[m+h]
+
。1h nmr(400mhz,cdcl3)δ8.37(d,j=1.3hz,1h),8.14(d,j=8.8hz,1h),7.85-7.77(m,2h),7.60(d,j=8.8hz,2h),7.53(t,j=7.9hz,1h),7.16(d,j=7.0hz,1h),7.07(d,j=8.5hz,2h),6.73(br d,j=8.5hz,1h),4.57-4.44(m,1h),4.07(td,j=8.6,11.9hz,2h),3.94(dd,j=5.6,8.9hz,1h),3.88-3.76(m,3h),3.05-2.92(m,1h),1.42(s,9h)。(s)-n-(1-(氮杂环丁烷-3-基)-2-羟基乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物142)和n-((3s)-4-(氨基甲基)四氢呋喃-3-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物143)
[0495]
向3-[(1s)-2-羟基-1-[[5-[4-(三氟甲基)苯氧基]萘-2-羰基]氨基]乙基]氮杂环丁烷-1-甲酸叔丁酯(35mg,65.9umol,1eq)在dcm(2ml)中的溶液中加入tfa(112.8mg,0.98mmol,73ul,15eq)。将混合物在25℃下搅拌1hr。将反应混合物在真空中浓缩。将残余物用饱和nahco3水溶液调节至ph=9,用ea(15ml*3)萃取。合并的有机相用h2o(10ml)、盐水(10ml)洗涤,经na2so4干燥,过滤并真空浓缩。粗产物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%hcl)-acn];b%:15%-45%,8.5min)。获得呈黄色油状物的化合物143(9.1mg,19.5umol,29.6%产率,hcl)。lcms(esi):rt=0.735min,针对c
23h21
f3n2o3计算的质量430.15m/z实测值431.1[m+h]
+
。1h nmr(400mhz,cd3od)δ8.46(s,1h),8.28(d,j=8.8hz,1h),7.96(d,j=8.3hz,1h),7.83-7.75(m,1h),7.72-7.65(m,3h),7.31(dd,j=0.8,7.5hz,1h),7.17(d,j=8.5hz,2h),3.98-3.92(m,1h),3.91-3.86(m,2h),3.85-3.74(m,2h),3.73-3.60(m,2h),2.58-2.44(m,1h)。获得呈黄色油状物的化合物142(2.4mg,5.1umol,7.7%产率,hcl)。lcms(esi):rt=0.753min,针对c
23h21
f3n2o3计算的质量430.15m/z实测值431.1[m+h]
+1
h nmr(400mhz,cd3od)δ8.52(d,j=1.3hz,1h),8.12(d,j=8.8hz,1h),7.97-7.88(m,2h),7.66(d,j=8.5hz,2h),7.60(t,j=7.9hz,1h),7.26-7.23(m,1h),7.14(d,j=8.5hz,2h),4.50(td,j=5.5,8.8hz,1h),4.20-4.07(m,4h),3.78-3.62(m,2h),3.40-3.33(m,1h)。实施例108:(r)-n-(4-(二甲基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物144)
(r)-n-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0496]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(500mg,1.50mmol,1eq)和hatu(855.5mg,2.25mmol,1.5eq)在dcm(10ml)中的溶液中添加dipea(581.5mg,4.50mmol,0.78ml,3eq)。添加后,将混合物在相同温度(25℃)下搅拌0.5hr,然后添加2-[(3r)-3-氨基丁基]异吲哚啉-1,3-二酮(327.3mg,1.50mmol,1eq,hcl)。将混合物在25℃下搅拌1.5hr。将反应混合物加入h2o(20ml)并用ea(20ml*3)萃取。合并的有机层用盐水(30ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~30%乙酸乙酯/石油醚梯度,30ml/min)。获得呈白色固体的化合物n-[(1r)-3-(1,3-二氧代异吲哚啉-2-基)-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(620mg,1.09mmol,72.9%产率)。(r)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0497]
向n-[(1r)-3-(1,3-二氧代异吲哚啉-2-基)-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(620mg,1.16mmol,1eq)在etoh(8ml)中的溶液中加入nh2nh2.h2o(685.7mg,11.64mmol,0.66ml,85%,10eq)。将混合物在25℃下搅拌6hr。过滤反应混合物。用etoh(10ml)洗涤滤饼,减压浓缩有机层,得到残余物。将残余物加入h2o(10ml)并用dcm(10ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。其不经进一步纯化而用于下一步。获得呈黄色油状物的化合物n-[(1r)-3-氨基-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(489mg,1.08mmol,92.8%产率)。(r)-n-(4-(二甲基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0498]
在h2下向n-[(1r)-3-氨基-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(50mg,0.12mmol,1eq)和甲醛(100.8mg,1.24mmol,92.5ul,10eq)在meoh(1ml)中的溶液中加入pd/c(30mg,0.12mmol,10%,1.00eq)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌16小时。过滤反应混合物并减压浓缩有机层,得到残余物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,6.5min)。获得呈白色固体的标题化合物(22.9mg,49.0umol,39.4%产率,hcl)。lcms(esi):rt=0.867min,针对c
24h25
f3n2o2计算的质量430.46m/z实测值431.3[m+h]
+
,1h nmr(400mhz,cdcl3)δ12.08(br s,1h),8.70(br s,1h),8.17-8.03(m,2h),7.88(br d,j=8.3hz,1h),7.70(br s,1h),7.58(d,j=8.5hz,2h),7.49(t,j=7.8hz,
1h),7.15(d,j=7.5hz,1h),7.05(d,j=8.5hz,2h),4.32(br s,1h),3.29-3.05(m,2h),2.81(br d,j=18.1hz,6h),2.53-2.08(m,2h),1.44(br d,j=5.3hz,3h)。实施例109:(r)-n-(4-(甲基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物145)(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0499]
向n-[(1r)-3-氨基-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(100mg,0.24mmol,1eq)和2,4-二甲氧基苯甲醛(41.2mg,0.24mmol,1eq)在dcm(5ml)中的溶液中加入acoh(14.9mg,0.24mmol,14ul,1eq)和nabh(oac)3(105.3mg,0.49mmol,2eq)。将混合物在25℃下搅拌16hr。将反应混合物用h2o(5ml)稀释,并用2m naoh中和至ph=7~8,然后用dcm(15ml*3)萃取。合并的有机层用盐水(10ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。其不经进一步纯化而用于下一步。获得呈黄色油状物的化合物n-[(1r)-3-[(2,4-二甲氧基苯基)甲基氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(122mg,0.16mmol,67.5%产率)。(r)-n-(4-((2,4-二甲氧基苄基)(甲基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0500]
在h2下向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(122mg,0.16mmol,1eq)和甲醛(136.1mg,1.68mmol,0.12ml,10eq)在meoh(3ml)中的溶液中加入pd/c(100mg,0.16mmol,16ul,10%,1eq)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌3小时。将反应混合物过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(4gsilica flash column,洗脱液为0~10%dcm/meoh,20ml/min)。获得呈无色油状物的化合物n-[(1r)-3-[(2,4-二甲氧基苯基)甲基-甲基-氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(41mg,58.6umol,34.9%产率)。(r)-n-(4-(甲基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0501]
在0℃下向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基-甲基-氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(41mg,72.3umol,1eq)在dce(1ml)中的溶液中加入dipea(18.7mg,0.14mmol,25ul,2eq)和氯甲酸1-氯乙酯(ace-cl)(10.3mg,72.3umol,1eq)。然后将混合物在0℃下搅拌1hr。将反应混合物减压浓缩以除去dce,得到残余物。用meoh
(5ml)猝灭残余物,并真空浓缩混合物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,6.5min)。获得呈白色固体的标题化合物(6.9mg,14.9umol,20.6%产率,hcl)。lcms(esi):rt=0.873min,针对c
23h23
f3n2o2计算的质量416.44m/z实测值417.3[m+h]
+
。1h nmr(400mhz,cdcl3)δ9.84(br s,1h),9.14(br s,1h),8.47(br s,1h),8.03(br s,1h),7.95-7.64(m,2h),7.50(br d,j=8.3hz,2h),7.40(br s,1h),7.05(br d,j=7.3hz,1h),6.97(br d,j=8.3hz,2h),4.25(br s,1h),3.28-2.78(m,2h),2.61(br s,3h),2.44-1.83(m,2h),1.33(br s,3h)。实施例110:(r)-n-(4-(乙基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物146)(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0502]
向n-[(1r)-3-氨基-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(100mg,0.24mmol,1eq)和2,4-二甲氧基苯甲醛(41.2mg,0.24mmol,1eq)在dcm(5ml)中的溶液中加入acoh(14.9mg,0.24mmol,14ul,1eq)和nabh(oac)3(105.3mg,0.49mmol,2eq)。将混合物在25℃下搅拌16hr。将反应混合物用h2o(5ml)稀释,并用2m naoh中和至ph=7~8,然后用dcm(15ml*3)萃取。合并的有机层用盐水(10ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(4gsilica flash column,洗脱液为0~20%乙酸乙酯/石油醚梯度,25ml/min)。获得呈无色油状物的化合物(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(112mg,0.16mmol,66.8%产率)。(r)-n-(4-((2,4-二甲氧基苄基)(乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0503]
在h2下向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(112mg,0.16mmol,1eq)和乙醛(73.2mg,1.66mmol,93ul,10eq)在etoh(3ml)中的溶液中加入pd/c(100mg,0.16mmol,10%,1.0eq)。将悬浮液在真空下脱气并用h2吹扫数次。将混合物在h2(15psi)下于25℃搅拌3小时。将反应混合物过滤并减压浓缩,得到残余物。其不经进一步纯化而用于下一步。获得呈黄色油状物的化合物(r)-n-(4-((2,4-二甲氧基苄基)(乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(102mg,0.14mmol,84.5%产率)。
(r)-n-(4-(乙基氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0504]
在0℃下向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基-乙基-氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(102mg,0.17mmol,1eq)在dce(2ml)中的溶液中加入dipea(45.4mg,0.35mmol,61ul,2eq)和氯甲酸1-氯乙酯(ace-cl)(25.1mg,0.17mmol,1eq)。然后将混合物在0℃下搅拌1hr。将反应混合物减压浓缩以除去dce,得到残余物。用meoh(10ml)猝灭残余物,并真空浓缩混合物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,6.5min)。然后通过prep-hplc(柱:waters xbridge 150*25mm*5um;流动相:[水(0.05%nh3h2o+10mm nh4hco3)-acn];b%:53%-83%,7.8min)纯化残余物。获得呈黄色固体的标题化合物(11.9mg,27.7umol,15.7%产率)。lcms(esi):rt=0.896min,针对c
24h25
f3n2o2计算的质量430.46m/z实测值431.4[m+h]
+
;1h nmr(400mhz,cd3od)δ8.45(d,j=1.0hz,1h),8.09(d,j=8.8hz,1h),7.89(td,j=2.3,8.7hz,2h),7.66(d,j=8.8hz,2h),7.58(t,j=7.9hz,1h),7.22(d,j=7.5hz,1h),7.13(d,j=8.5hz,2h),4.40-4.13(m,1h),2.79-2.61(m,4h),1.92-1.73(m,2h),1.32(d,j=6.8hz,3h),1.15(t,j=7.2hz,3h)。实施例111:(r)-n-(4-((2-羟基乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物147)(r)-(4-羟基丁烷-2-基)氨基甲酸叔丁酯
[0505]
向(3r)-3-氨基丁烷-1-醇(5g,56.09mmol,1eq)在dcm(50ml)中的溶液中加入tea(6.81g,67.31mmol,9.37ml,1.2eq)和叔丁氧羰基叔丁基碳酸酯(14.69g,67.31mmol,15.46ml,1.2eq)。将混合物在25℃下搅拌16hr。将反应混合物加入h2o(50ml)并用ea(50ml*3)萃取。合并的有机层用盐水(80ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(80gsilica flash column,洗脱液为0~30%乙酸乙酯/石油醚梯度,60ml/min)。获得呈无色油状物的化合物n-[(1r)-3-羟基-1-甲基-丙基]氨基甲酸叔丁酯(19.4g,102.51mmol,91.3%产率)。(r)-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)氨基甲酸叔丁酯
[0506]
向n-[(1r)-3-羟基-1-甲基-丙基]氨基甲酸叔丁酯(5g,26.42mmol,1eq)在thf
(15ml)中的溶液中加入pph3(8.32g,31.70mmol,1.2eq)和异吲哚啉-1,3-二酮(4.28g,29.06mmol,1.1eq)。然后在n2惰性气氛下于0℃向混合物中加入dead(5.52g,31.70mmol,5.76ml,1.2eq)。将所得混合物在25℃下搅拌16hr。将反应混合物加入h2o(20ml)并用ea(30ml*3)萃取。合并的有机层用盐水(80ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(40gsilica flash column,洗脱液为0~30%乙酸乙酯/石油醚梯度,40ml/min)。获得呈黄色固体的化合物(r)-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)氨基甲酸叔丁酯(11.7g,27.56mmol,86.9%产率)。(r)-2-(3-氨基丁基)异吲哚啉-1,3-二酮
[0507]
向n-[(1r)-3-(1,3-二氧代异吲哚啉-2-基)-1-甲基-丙基]氨基甲酸叔丁酯(8.3g,26.07mmol,1eq)在hcl/二氧杂环己烷(4m,95.59ml,14.67eq)中的溶液。将混合物在25℃下搅拌2hr。减压浓缩反应混合物以得到残余物。其不经进一步纯化而用于下一步。获得呈白色固体的化合物2-[(3r)-3-氨基丁基]异吲哚啉-1,3-二酮(6.6g,25.91mmol,99.3%产率,hcl)。(r)-n-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0508]
向5-[4-(三氟甲基)苯氧基]萘-2-甲酸(900mg,2.71mmol,1eq)、edci(778.8mg,4.06mmol,1.5eq)、hobt(548.9mg,4.06mmol,1.5eq)和tea(822.2mg,8.13mmol,1.13ml,3eq)在dcm(3ml)中的25℃溶液中添加。将混合物在25℃下搅拌0.5hr。然后添加2-[(3r)-3-氨基丁基]异吲哚啉-1,3-二酮(827.9mg,3.25mmol,1.2eq,hcl)。将所得混合物在25℃下搅拌15.5hr。将反应混合物加入h2o(10ml)并用ea(30ml*3)萃取。合并的有机层用盐水(50ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~30%乙酸乙酯/石油醚梯度,30ml/min)。获得呈白色固体的化合物(r)-n-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(1.3g,2.37mmol,87.4%产率)。(r)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0509]
向n-[(1r)-3-(1,3-二氧代异吲哚啉-2-基)-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(1.3g,2.44mmol,1eq)在etoh(15ml)中的溶液中加入nh2nh2.h2o(1.44g,24.41mmol,1.40ml,85%,10eq)。将混合物在25℃下搅拌6hr。将反应混合物过滤。用etoh(10ml)洗涤滤饼,减压浓缩有机层,得到残余物。将残余物加入h2o(10ml)并用dcm(20ml*3)萃取。合并的有机层用盐水(30ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。其不经进一步纯化而用于下一步。获得呈黄色油状物的化合物(r)-n-(4-氨基丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(905mg,2.19mmol,89.5%产率)。(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0510]
向n-[(1r)-3-氨基-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(855mg,2.12mmol,1eq)和2,4-二甲氧基苯甲醛(353.0mg,2.12mmol,1eq)在dcm(15ml)中的溶液中加入acoh(127.5mg,2.12mmol,0.12ml,1eq)和nabh(oac)3(900.6mg,4.25mmol,
2eq)。将混合物在25℃下搅拌16hr。将反应混合物加入h2o(10ml)并用dcm(20ml*3)萃取。合并的有机层用盐水(30ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~15%dcm/meoh,35ml/min)。获得呈黄色油状物的化合物(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(1.16g,1.91mmol,89.8%产率)。(r)-n-(4-((2,4-二甲氧基苄基)(2-羟基乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0511]
向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(100mg,0.18mmol,1eq)在dmf(2ml)中的溶液中加入k2co3(50.0mg,0.36mmol,2eq)和2-溴乙醇(67.8mg,0.54mmol,38.5ul,3eq)。将混合物在80℃下搅拌5hr。将反应混合物加入h2o(10ml)并用dcm(15ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。其不经进一步纯化而用于下一步。获得呈黄色油状物的化合物(r)-n-(4-((2,4-二甲氧基苄基)(2-羟基乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(142mg,0.20mmol,76.8%产率)。(r)-n-(4-((2-羟基乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0512]
向(r)-n-(4-((2,4-二甲氧基苄基)(2-羟基乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(70mg,0.11mmol,1eq)在tfa(1.08g,9.45mmol,0.70ml,80.5eq)中的溶液。将混合物在80℃下搅拌8hr。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,6.5min)。获得呈白色固体的标题化合物(4.2mg,8.4umol,7.2%产率,hcl)。lcms(esi):rt=0.861min,针对c
24h25
f3n2o3计算的质量446.46m/z实测值447.3[m+h]
+
,1h nmr(400mhz,cd3od)δ1.40(d,j=6.78hz,3h)1.87-2.17(m,2h)3.04-3.25(m,4h)3.83(t,j=5.14hz,2h)4.23-4.36(m,1h)7.13(d,j=8.53hz,2h)7.24(d,j=7.53hz,1h)7.60(t,j=8.03hz,1h)7.66(d,j=8.78hz,2h)7.88-7.96(m,2h)8.11(d,j=8.78hz,1h)8.52(s,1h)。实施例112:(r)-n-(4-((2-氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物148)(r)-n-(4-((2,4-二甲氧基苄基)(2-氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0513]
向(r)-n-(4-((2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(150mg,0.27mmol,1eq)在dmf(1ml)中的溶液中加入k2co3(75.0mg,0.54mmol,2eq)和1-溴-2-氟乙烷(103.3mg,0.81mmol,3eq)。将混合物在80℃下搅拌5hr。将反应混合物加入h2o(10ml)并用dcm(10ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(4g
silica flash column,洗脱液为0~60%乙酸乙酯/石油醚梯度,20ml/min)。获得呈无色油状物的化合物(r)-n-(4-((2,4-二甲氧基苄基)(2-氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(71mg,0.11mmol,41.7%产率)。(r)-n-(4-((2-氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0514]
在0℃下向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基-(2-氟乙基)氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(60mg,0.10mmol,1eq)在dce(1ml)中的溶液中加入dipea(25.9mg,0.20mmol,34.9ul,2eq)和氯甲酸1-氯乙酯(ace-cl)(17.2mg,0.12mmol,1.2eq)。然后将混合物在0℃至25℃下搅拌2hr。减压浓缩反应混合物以除去dce,得到残余物。将残余物加入meoh(5ml)并将混合物在60℃下搅拌0.5hr。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:30%-60%,6.5min)。获得呈白色固体的标题化合物(23.6mg,48.8umol,48.7%产率,hcl)。lcms(esi):rt=0.869min,针对c
24h24
f4n2o2计算的质量448.45m/z实测值449.3[m+h]
+
;1h nmr(400mhz,cd3od)δ1.41(d,j=6.78hz,3h)1.86-2.17(m,2h)3.09-3.26(m,2h)3.36-3.50(m,2h)4.23-4.41(m,1h)4.70-4.85(m,2h)7.14(d,j=8.53hz,2h)7.25(d,j=7.53hz,1h)7.60(t,j=8.03hz,1h)7.67(d,j=8.78hz,2h)7.88-7.99(m,2h)8.11(d,j=8.78hz,1h)8.51(d,j=1.26hz,1h)。实施例113:(r)-n-(4-((2,2-二氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物149)(r)-n-(4-((2,2-二氟乙基)(2,4-二甲氧基苄基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0515]
向n-[(1r)-3-[(2,4-二甲氧基苯基)甲基氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(150mg,0.2mmol,1eq)在dmf(1ml)中的溶液中加入k2co3(75.0mg,0.54mmol,2eq)和2-溴-1,1-二氟-乙烷(118.0mg,0.81mmol,3eq)。将混合物在80℃下搅拌5hr。将反应混合物加入h2o(10ml)并用ea(10ml*3)萃取。合并的有机层用盐水(20ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(4gsilica flash column,洗脱液为0~40%乙酸乙酯/石油醚梯度,20ml/min)。获得呈无色油状物的化合物n-[(1r)-3-[2,2-二氟乙基-[(2,4-二甲氧基苯基)甲基]氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(92mg,96.9umol,35.7%产率)。(r)-n-(4-((2,2-二氟乙基)氨基)丁烷-2-基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0516]
在0℃下向n-[(1r)-3-[2,2-二氟乙基-[(2,4-二甲氧基苯基)甲基]氨基]-1-甲基-丙基]-5-[4-(三氟甲基)苯氧基]萘-2-甲酰胺(80mg,0.12mmol,1eq)在dce(0.5ml)中的溶液中加入diea(33.5mg,0.25mmol,45.2ul,2eq)和氯甲酸1-氯乙酯(ace-cl)(22.2mg,0.15mmol,1.2eq)。然后将混合物在0℃至25℃下搅拌2hr。减压浓缩反应混合物以除去dce,
得到残余物。将残余物加入meoh(5ml)并将混合物在60℃下搅拌0.5hr。残余物通过prep-hplc纯化(柱:3_phenomenex luna c1875*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:30%-60%,6.5min)。获得呈白色固体的标题化合物(15.4mg,30.7umol,23.6%产率,hcl)。lcms(esi):rt=0.888min,针对c
24h23
f5n2o2计算的质量466.44m/z实测值467.3[m+h]
+
。1h nmr(400mhz,cd3od)δ1.42(d,j=6.63hz,3h)1.92-2.18(m,2h)3.15-3.29(m,2h)3.61(tt,j=15.43,3.77hz,2h)4.23-4.40(m,1h)6.20-6.51(m,1h)7.14(d,j=8.63hz,2h)7.25(d,j=7.25hz,1h)7.61(t,j=7.94hz,1h)7.67(d,j=8.63hz,2h)7.87-7.99(m,2h)8.12(d,j=8.75hz,1h)8.53(d,j=1.50hz,1h)。实施例114:(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物150)(r)-4-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)哌啶-1-甲酸苄酯
[0517]
向5-(4-(三氟甲基)苯氧基)-2-萘甲酸(100mg,0.30mmol,1eq)、(r)-4-(1-氨基乙基)哌啶-1-甲酸苄酯(86.9mg,0.33mmol,1.1eq)和hatu(148.8mg,0.39mmol,1.3eq)在dmf(2ml)中的20℃溶液中逐滴加入tea(91.4mg,0.90mmol,0.13ml,3eq),并将混合物在20℃下搅拌16h。将反应混合物用水(20ml)稀释并用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(4gsilica flash column,洗脱液为0~60%乙酸乙酯/石油醚梯度,20ml/min),得到呈无色油状物的(r)-4-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)哌啶-1-甲酸苄酯(160mg,0.27mmol,89.4%产率)。lcms(esi):rt=1.005min,针对c
33h31
f3n2o4计算的质量576.22,m/z实测值577.1[m+1]
+
。(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0518]
向(r)-4-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)哌啶-1-甲酸苄酯(140mg,0.24mmol,1eq)和nh3.h2o(1.70g,12.14mmol,1.87ml,25%,50eq)在etoh(2ml)中的20℃溶液中加入pd/c(25.8mg,24.3umol,10%,0.1eq),将混合物用h2吹扫并脱气3次,然后在h2(15psi)下于20℃搅拌1h。过滤反应混合物以除去pd/c,并减压浓缩滤液,得到呈白色固体的标题化合物(101.4mg,0.23mmol,94.4%产率)。lcms(esi):rt=0.779min,针对c
25h25
f3n2o2计算的质量442.19,m/z实测值443.1[m+1]
+
;1h nmr(400mhz,cdcl3)δ8.34(s,1h),8.12(d,j=8.5hz,1h),7.85-7.77(m,2h),7.60(d,j=8.3hz,2h),7.52(t,j=7.9hz,1h),7.15(d,j=7.0hz,1h),7.07(d,j=8.3hz,2h),6.06(d,j=8.8hz,1h),4.21(dd,j=6.4,15.4hz,1h),3.15(d,j=9.3hz,2h),2.67-2.58(m,2h),1.83-1.70(m,2h),1.68-1.63(m,1h),1.40-1.30(m,2h),1.27(d,j=6.8hz,3h)。实施例115:(s)-n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物151)
3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯
[0519]
向3-羟基-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(450mg,0.85mmol,1eq)在dcm(4ml)中的-78℃溶液中加入dast(410.2mg,2.54mmol,0.34ml,3eq),并将混合物在-78℃下搅拌1h,然后在20℃下再搅拌0.5h。将反应混合物用水(5ml)猝灭,然后用饱和nahco3(30ml)稀释,并用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤并减压浓缩,得到残余物。残余物通过急骤硅胶色谱法纯化(12gsilica flash column,洗脱液为0~50%乙酸乙酯/石油醚梯度,30ml/min),得到400mg呈黄色固体的样品。400mg样品通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.04%nh3h2o+10mm nh4hco3)-acn];b%:60%-90%,9.5min),得到呈黄色固体的3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(190mg,0.36mmol,42.1%产率)。lcms(esi):rt=0.999min,针对c
28h28
f4n2o4计算的质量532.20,m/z实测值533.1[m+1]
+
。(s)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯
[0520]
3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯的样品(90mg,0.17mmol,1eq)通过sfc纯化(柱:daicel chiralpak ad(250mm*30mm,10um);流动相:[0.1%nh3h2o etoh];b%:25%-25%,min),得到(s)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(30mg,56.3umol,33.3%产率)和(r)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(40mg,74.4umol,44.0%产率),均为白色固体。(s)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯:lcms(esi):rt=1.002min,针对c
28h28
f4n2o4计算的质量532.20,m/z实测值533.1[m+1]
+
。(r)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯:lcms(esi):rt=1.004min,针对c
28h28
f4n2o4计算的质量532.20,m/z实测值533.1[m+1]
+
。(s)-n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0521]
向(s)-3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(25mg,47.0umol,1eq)在dcm(0.5ml)中的20℃溶液中加入tfa(107.1mg,0.94mmol,70ul,20eq),并将混合物在20℃下搅拌1h。减压浓缩反应混合物以得到残余物。样品通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%nh3h2o)-acn];b%:59%-89%,9.5min),得到呈灰色固体的标题化合物(5.0mg,11.5umol,
24.6%产率)。lcms(esi):rt=0.784min,针对c
23h20
f4n2o2计算的质量432.15,m/z实测值433.0[m+1]
+
;1h nmr(400mhz,cdcl3)δ8.38(s,1h),8.14(d,j=8.8hz,1h),7.86-7.78(m,2h),7.60(d,j=8.5hz,2h),7.52(t,j=7.9hz,1h),7.16(d,j=7.5hz,1h),7.08(br d,j=8.5hz,2h),6.77(br s,1h),5.40-5.25(m,1h),4.16(br d,j=7.5hz,1h),4.00(br d,j=9.0hz,1h),3.89(br d,j=9.5hz,2h),1.54-1.44(m,3h)。实施例116:(r)-n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物152)n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0522]
向3-氟-3-(1-(5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺基)乙基)氮杂环丁烷-1-甲酸叔丁酯(80mg,0.15mmol,1eq)在dcm(0.5ml)中的20℃溶液中加入tfa(85.7mg,0.75mmol,56ul,5eq),并将混合物在20℃下搅拌1h。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:welch ultimate c18 150*25mm*5um;流动相:[水(0.225%fa)-acn];b%:20%-50%,9.5min),得到呈无色油状物的n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(40mg,83.6umol,55.7%产率,fa)。lcms(esi):rt=0.785min,针对c
23h20
f4n2o2计算的质量432.15,m/z实测值433.0[m+h]
+
。(r)-n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺
[0523]
n-(1-(3-氟氮杂环丁烷-3-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺的样品(40mg,92.5umol,1eq)通过sfc纯化(柱:daicel chiralpak ic(250mm*30mm,5um);流动相:[0.1%nh3h2o meoh];b%:25%-25%,min),得到15mg p1和13mg p2,均为黄色固体。15mg p1进一步通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%nh3h2o)-acn];b%:59%-89%,9.5min),得到呈黄色固体的标题化合物(5.5mg,12.4umol,13.4%产率)。lcms(esi):rt=0.785min,针对c
23h20
f4n2o2计算的质量432.15,m/z实测值433.1[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.38(s,1h),8.15(br d,j=8.5hz,1h),7.87-7.76(m,2h),7.60(br d,j=8.8hz,2h),7.52(t,j=8.0hz,1h),7.16(d,j=7.5hz,1h),7.08(br d,j=8.5hz,2h),6.75(br s,1h),5.39-5.25(m,1h),4.17(br d,j=8.3hz,1h),4.01(br d,j=8.5hz,1h),3.90(br d,j=9.5hz,2h),1.54-1.44(m,3h)。实施例117:(r)-n-(1-(1-(2-羟基乙基)哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物153)
[0524]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(40mg,
90.4umol,1eq)和2-溴乙-1-醇(22.6mg,0.18mmol,13ul,2eq)在acn(1ml)中的溶液中加入k2co3(37.5mg,0.27mmol,3eq),并将反应在70℃下搅拌16h。将混合物减压浓缩,得到残余物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:25%-55%,6.5min),得到呈白色固体的标题化合物(11.7mg,22.5umol,24.9%产率,hcl)。lcms(esi):rt=0.850min,针对c
27h29
f3n2o3计算的质量486.21,m/z实测值487.2[m+h]
+
;1h nmr(400mhz,dmso-d6)δ9.52(br s,1h),8.57(s,1h),8.48(br d,j=8.5hz,1h),8.00-7.94(m,3h),7.75(d,j=8.8hz,2h),7.64(t,j=7.9hz,1h),7.34(d,j=7.5hz,1h),7.15(d,j=8.5hz,2h),4.02-3.94(m,1h),3.74(br t,j=5.1hz,2h),3.53(br d,j=11.8hz,2h),3.11(br d,j=5.0hz,2h),2.97-2.84(m,2h),1.89(br d,j=11.8hz,2h),1.63(br s,3h),1.20-1.16(m,3h)。实施例118:(r)-n-(1-(1-(2-氟乙基)哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物154)
[0525]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(50.0mg,0.11mmol,1.0eq)和1-溴-2-氟乙烷(28.7mg,0.23mmol,13ul,2.0eq)在acn(1ml)中的溶液中加入k2co3(46.9mg,0.34mmol,3.0eq),并将反应在70℃下搅拌16h。将混合物减压浓缩,得到残余物,其通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%nh3h2o)-acn];b%:55%-85%,7.8min),得到呈白色固体的标题化合物(37.4mg,76umol,67.6%产率)。lcms(esi):rt=0.878min,针对c
27h28
f4n2o2计算的质量488.21,m/z实测值489.2[m+h]
+
;1h nmr(400mhz,dmso-d6)δ8.54(s,1h),8.38(brd,j=8.6hz,1h),8.00-7.93(m,3h),7.74(d,j=8.6hz,2h),7.63(t,j=7.9hz,1h),7.32(d,j=7.5hz,1h),7.15(d,j=8.5hz,2h),4.62-4.43(m,2h),3.97-3.86(m,1h),3.47-3.35(m,2h),2.96(brs,2h),2.70-2.53(m,2h),2.26-1.88(m,2h),1.72(brd,j=10.8hz,2h),1.45(brs,1h),1.34-1.22(m,2h),1.16(d,j=6.8hz,3h)。实施例119:(r)-n-(1-(1-乙基哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物155)
[0526]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(40.0mg,90umol,1.0eq)和乙醛(19.9mg,0.18mmol,25ul,40%,2.0eq)在etoh(1ml)中的溶液中加入pd/c(25.0mg,23umol,10%,0.26eq),将反应用h2吹扫并脱气,然后在h2(15psi)下于20℃搅
拌2h。将混合物减压浓缩,得到残余物,其通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,6.5min),得到呈白色固体的标题化合物(6.19mg,12umol,13.5%产率,hcl)。lcms(esi):rt=0.876min,针对c
27h29
f3n2o2计算的质量470.22,m/z实测值471.2[m+h]
+
;1h nmr(400mhz,dmso-d6)δ10.46(brs,1h),8.60(brs,1h),8.56(brs,1h),7.96(brs,3h),7.74(brs,2h),7.63(brs,1h),7.33(brs,1h),7.15(brs,2h),3.98(brs,1h),3.02(brs,2h),2.80(brs,4h),1.87(brs,2h),1.71(brs,3h),1.21(brd,j=18.8hz,8h)。实施例120:(r)-n-(1-(1-异丙基哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物156)
[0527]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(40.0mg,90umol,1.0eq)在丙酮(1ml)中的溶液中加入pd/c(25.0mg,23umol,10%,0.26eq),将反应用h2吹扫并脱气,然后在h2(15psi)下于20℃搅拌2h。将混合物减压浓缩,得到残余物,其通过prep-hplc纯化(柱:3_phenomenex luna c18 75*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,8.5min),得到呈白色固体的标题化合物(2.0mg,4umol,4.25%产率,hcl)。lcms(esi):rt=0.888min,针对c
28h31
f3n2o2计算的质量484.23,m/z实测值485.3[m+h]
+
;1h nmr(400mhz,dmso-d6)δ10.33(brs,1h),8.62(brs,1h),8.54(brd,j=7.8hz,1h),7.97(brs,3h),7.74(brd,j=7.8hz,2h),7.63(brs,1h),7.32(brd,j=7.0hz,1h),7.15(brd,j=7.8hz,2h),3.99(brs,1h),3.44-3.44(m,1h),3.34-3.33(m,1h),2.89(brs,3h),1.89-1.75(m,5h),1.25(brd,j=4.8hz,6h),1.18(brd,j=5.3hz,3h)。实施例121:(r)-n-(1-(1-甲基哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物157)
[0528]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(40mg,90.4umol,1eq)和甲醛(146.7mg,1.81mmol,0.13ml,37%,20eq)在meoh(1ml)中的20℃溶液中加入pd/c(9.6mg,9.0umol,10%,0.1eq),将混合物用h2吹扫并脱气3次,然后在h2(15psi)下于20℃搅拌16h。将反应混合物过滤以除去pd/c,并减压浓缩滤液,得到残余物。残余物通过prep-hplc纯化(柱:3_phenomenex luna c1875*30mm*3um;流动相:[水(0.05%hcl)-acn];b%:20%-50%,6.5min),得到呈黄色固体的标题化合物(12.9mg,25.8umol,28.6%产率,hcl)。lcms(esi):rt=0.786min,针对c
26h27
f3n2o2计算的质量456.20,m/z实测值
457.1[m+h]
+
;1h nmr(400mhz,dmso-d6)δ10.25(br dd,j=2.9,5.4hz,1h),8.58(s,1h),8.51(br d,j=8.5hz,1h),8.03-7.91(m,3h),7.74(br d,j=8.8hz,2h),7.63(t,j=7.9hz,1h),7.33(d,j=7.3hz,1h),7.15(br d,j=8.5hz,2h),4.04-3.90(m,1h),3.39(br d,j=11.5hz,2h),2.97-2.78(m,2h),2.69(br d,j=4.5hz,3h),1.89(br d,j=13.1hz,2h),1.76-1.47(m,3h),1.18(br d,j=6.8hz,3h)。实施例122:(r)-n-(1-(1-(2,2-二氟乙基)哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(化合物162)
[0529]
向(r)-n-(1-(哌啶-4-基)乙基)-5-(4-(三氟甲基)苯氧基)-2-萘甲酰胺(50mg,0.11mmol,1eq)、2-溴-1,1-二氟乙烷(24.6mg,0.17mmol,1.5eq)和k2co3(46.9mg,0.34mmol,3eq)在acn(2ml)中的20℃溶液中加入ki(1.9mg,11.3umol,0.1eq),并将所得混合物在90℃下搅拌16h。减压浓缩反应混合物以得到残余物。残余物通过prep-hplc纯化(柱:welch xtimate c18 150*25mm*5um;流动相:[水(0.05%氢氧化铵v/v)-acn];b%:55%-85%,7.8min),得到呈白色固体的标题化合物(17.4mg,33.8umol,29.9%产率)。lcms(esi):rt=0.807min,针对c
27h27
f5n2o2计算的质量506.20,m/z实测值507.1[m+h]
+
;1h nmr(400mhz,cdcl3)δ8.33(d,j=1.3hz,1h),8.12(d,j=8.8hz,1h),7.81(d,j=8.8hz,2h),7.60(d,j=8.8hz,2h),7.52(t,j=8.0hz,1h),7.15(d,j=7.5hz,1h),7.07(d,j=8.5hz,2h),6.08-6.02(m,1h),6.01-5.73(m,1h),4.27-4.20(m,1h),3.01(d,j=11.0hz,2h),2.81-2.68(m,3h),2.24-2.16(m,2h),1.84-1.69(m,2h),1.54-1.43(m,3h),1.27(d,j=6.8hz,3h)。ii.生物学评价实施例a1:yap报告试验
[0530]
从3μm(测定板中的最终浓度)开始,以1:3的稀释度和10个点,一式四份,用测试化合物处理在384孔板中用8xtbd萤光素酶报告基因和prltk稳定转染的hek293t细胞。与化合物在37℃和5%co2下孵育24小时后,裂解细胞,并使用promega dual-luciferase reporter assay system测量8xtbd驱动的萤火虫萤光素酶和对照tk驱动的海肾萤光素酶活性。
[0531]
试剂:用于该研究的试剂为:dmem:invitrogen#11960077,dual-glo luciferase assay system:promega-e2980,嘌呤霉素二盐酸盐:invitrogen-a1113803,384孔板:perkinelmer-6007480,l-谷氨酰胺:invitrogen-25030164,潮霉素b:invitrogen-10687010,青霉素-链霉素:merk-tms-ab2-c
[0532]
介质:用于该试验的介质为:培养基:dmem+1ug/ml嘌呤霉素+200ug/ml潮霉素(含10%fbs+1mm l-谷氨酰胺);测定介质:dmem(含10%fbs+1mm l-谷氨酰胺+1x p/s)。
[0533]
细胞接种:合适的介质通过水浴于37℃加温:培养基,测定介质,1*d-pbs,0.05%胰蛋白酶-edta。除去所有介质后,用胰蛋白酶消化细胞,然后用1*无菌d-pbs洗涤,然后用2ml 0.05%胰蛋白酶-edta洗涤。然后将细胞在室温下孵育一分钟。然后将10ml/75cm2烧瓶
测定介质添加到每个烧瓶中。然后使用10ml移液器将细胞轻轻重悬于介质中,直到团块完全消失。然后将细胞转移至50ml离心管中,并以800rpm离心5min。除去介质,并用测定介质重悬细胞。使用细胞的等分试样计算细胞密度(细胞/ml)。然后用测定介质将细胞悬浮液稀释至6
×
104个细胞/ml的浓度。然后将50μl细胞悬浮液以3
×
103个细胞/孔接种到384孔板(perkinelmer-6007480)中,并将细胞在37℃、5%co2的培养箱中孵育。
[0534]
化合物处理:下午(将板孵育3-4hr),从3um(测定板中的最终浓度)开始,以1:3的稀释度,10个点,一式四份,通过echo加入测试化合物。将板置于37℃、5%co2的培养箱中24小时
[0535]
检测:dual-glo萤光素酶试剂如下制备:将一瓶dual-glo萤光素酶缓冲液的内容物转移到一瓶dual-glo萤光素酶底物中,以制备dual-glo萤光素酶试剂。通过倒置进行混合,直至底物完全溶解。混合后,将试剂等分到15ml管中。下午(化合物处理后24hr),用microplate washer抽吸384孔板中的dmem+培养基。
[0536]
测量萤火虫萤光素酶活性:将20ul dual-glo萤光素酶试剂添加到384孔板中。将板避光以防干扰测定。将板摇动1min,然后以1000rpm将板离心30秒。等待至少10分钟后,通过envision测量萤火虫发光。
[0537]
测量海肾萤光素酶活性:将20ul stop-glo试剂添加到384孔板中。将板摇动1min,然后以1000rpm离心30秒。等待至少10分钟后,通过envision测量海肾发光。
[0538]
分开报告了化合物对萤火虫萤光素酶和海肾萤光素酶活性的ic
50
和最大抑制。对于萤火虫萤光素酶活性的ic
50
在表2中示出。表2
注:生化试验ic
50
数据在以下范围内给出:a:≤0.1μmb:》0.1μm至≤1.0μmc:》1.0μm至≤3μmd:》3μm≤10μm实施例a2:肿瘤抑制试验
[0539]
本文描述的用于肿瘤抑制试验的程序如pct/us2013/043752(wo 2013/188138)中所述。小鼠程序根据批准的动物方案的指导原则并基于这些方法进行。在细胞生长至》90%汇合后,通过胰蛋白酶消化收获这些细胞,在磷酸盐缓冲液(pbs)中洗涤,然后重悬于补充有50%基质胶的pbs(bd biosciences)中。准备适量的细胞用于施用,例如每个注射部位200μl。免疫受损的小鼠在背外侧部位皮下注射。相应地配制本文所述的任一种化合物,然后以合适的剂量施用。对照小鼠仅接受媒介物。记录平均肿瘤直径(测量肿瘤的两个垂直轴)。数据表示为通过([宽度]2x长度/2)估计的肿瘤体积。进行配对双尾student's t-检验以获取统计显著性。实施例a3:细胞增殖试验
[0540]
在药物处理前24h将癌细胞系接种在384孔板中。从3μm(测定板中的最终浓度)开
始,以1:3的稀释度和10个点,一式两份,与测试化合物孵育不同时间后,使用luminescent cell viability assay kit(promega)和click-it edu hcs assay kit(invitrogen)根据制造商的方案确定活细胞和增殖细胞的数目。使用剂量响应曲线计算测试化合物的ic
50
值和最大抑制百分比。
[0541]
本文所述的实施例和实施方案仅用于说明性目的,并且向本领域技术人员建议的各种修改或变化都将包含在本技术的精神和范围以及所附权利要求书的范围内。编号实施方案
[0542]
实施方案1为式(i)化合物,或其药学上可接受的盐或溶剂化物:其中,每个x1、x4、x5和x6独立地为n或cr
x
;每个x2和x3独立地为n或cry;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个ry独立地为氢、卤素、硝基、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取
代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
[0543]
实施方案2为实施方案1的化合物或其药学上可接受的盐或溶剂化物,其中:x1为cr
x
;且每个x2和x3为cry。
[0544]
实施方案3为实施方案1的化合物或其药学上可接受的盐或溶剂化物,其中:x1为n;且每个x2和x3为cry。
[0545]
实施方案4为实施方案1的化合物或其药学上可接受的盐或溶剂化物,其中:x1为cr
x
;x2为cry;且x3为n。
[0546]
实施方案5为实施方案1-4中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个x4、x5和x6为cr
x
。
[0547]
实施方案6为实施方案1-4中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:x4为n;且每个x5和x6为cr
x
。
[0548]
实施方案7为实施方案1-4中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个x4和x5为cr
x
;且x6为n。
[0549]
实施方案8为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0550]
实施方案9为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0551]
实施方案10为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=
o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。
[0552]
实施方案11为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0553]
实施方案12为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0554]
实施方案13为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。
[0555]
实施方案14为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。
[0556]
实施方案15为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f或-och3。
[0557]
实施方案16为实施方案1-7中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
为氢。
[0558]
实施方案17为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、卤素、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0559]
实施方案18为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、卤素、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0560]
实施方案19为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=
o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。
[0561]
实施方案20为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0562]
实施方案21为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0563]
实施方案22为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、f、cl或-ch3。
[0564]
实施方案23为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢或f。
[0565]
实施方案24为实施方案1-16中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry为氢。
[0566]
实施方案25为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
1-c6烷基。
[0567]
实施方案26为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或-cn所取代的c
1-c6烷基。
[0568]
实施方案27为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0569]
实施方案28为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0570]
实施方案29为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0571]
实施方案30为实施方案29的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0572]
实施方案31为实施方案29的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0573]
实施方案32为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化
物,其中:r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0574]
实施方案33为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。
[0575]
实施方案34为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0576]
实施方案35为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自
其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0577]
实施方案36为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有至少一个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。
[0578]
实施方案37为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2或3个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。
[0579]
实施方案38为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。
[0580]
实施方案39为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自
其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0581]
实施方案40为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。
[0582]
实施方案41为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0583]
实施方案42为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自
;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0584]
实施方案43为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0585]
实施方案44为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0586]
实施方案45为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选自取
代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0587]
实施方案46为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0588]
实施方案47为实施方案35、39、42或46中任一项的化合物或其药学上可接受的盐
或溶剂化物,其中:每个rz独立地为氢、f、cl、br、-ch3、-ch2ch3、-ch2f、-chf2、-cf3、-cn、-oh、-och3、-och2ch3、-ocf3、-nh2、-nhch3或-n(ch3)2。
[0589]
实施方案48为实施方案35、39、42或46中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz独立地为氢、cl、br、-ch3、-och3、-nh2或-n(ch3)2。
[0590]
实施方案49为实施方案35、39、42或46中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz为氢。
[0591]
实施方案50为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被卤素、-cn、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-c(=o)or3、-c(=o)n(r3)2、-cr3=c(r3)2、-c≡cr3、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、或者取代或未取代的芳基所取代的c
1-c6烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0592]
实施方案51为实施方案1-24中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
3-c
10
环烷基或者取代或未取代的c
2-c
10
杂环烷基。
[0593]
实施方案52为实施方案51的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基、吡啶基、吡嗪基、嘧啶基、哒嗪基或三嗪基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0594]
实施方案53为实施方案51的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基或吡啶基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0595]
实施方案54为实施方案1-53中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0596]
实施方案55为实施方案1-53中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、br、i、硝基、-cn、-och2f、-ochf2、-ocf3、-c(=o)ch3、-c(=o)och
3-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-ch2f、-chf2或-cf3。
[0597]
实施方案56为实施方案1-53中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-cn、-ocf3、-chf2或-cf3。
[0598]
实施方案57为实施方案1-53中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-ocf3、-chf2或-cf3。
[0599]
实施方案58为实施方案1-53中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl或-cf3。
[0600]
实施方案59为实施方案1-58中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为卤素、硝基、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0601]
实施方案60为实施方案1-58中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、br、硝基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。
[0602]
实施方案61为实施方案1-58中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-cn、-och3、-ocf3、-c(=o)och3、-ch3或-cf3。
[0603]
实施方案62为实施方案1-58中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-ocf3或-cf3。
[0604]
实施方案63为实施方案1-58中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f或cl。
[0605]
实施方案64为式(ii)化合物,或其药学上可接受的盐或溶剂化物:其中,每个x1、x2、x3、x4、x5和x6独立地为n或cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂
环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
[0606]
实施方案65为实施方案64的化合物或其药学上可接受的盐或溶剂化物,其中:每个x1、x2和x3为cr
x
。
[0607]
实施方案66为实施方案64的化合物或其药学上可接受的盐或溶剂化物,其中:x1为n;且每个x2和x3为cr
x
。
[0608]
实施方案67为实施方案64的化合物或其药学上可接受的盐或溶剂化物,其中:每个x1和x2为cr
x
;且x3为n。
[0609]
实施方案68为实施方案64-67中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个x4、x5和x6为cr
x
。
[0610]
实施方案69为实施方案64-67中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:x4为n;且每个x5和x6为cr
x
。
[0611]
实施方案70为实施方案64-67中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个x4和x5为cr
x
;且x6为n。
[0612]
实施方案71为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0613]
实施方案72为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的
氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0614]
实施方案73为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。
[0615]
实施方案74为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0616]
实施方案75为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0617]
实施方案76为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。
[0618]
实施方案77为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。
[0619]
实施方案78为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f或-och3。
[0620]
实施方案79为实施方案64-70中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
为氢。
[0621]
实施方案80为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
1-c6烷基。
[0622]
实施方案81为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或-cn所取代的c
1-c6烷基。
[0623]
实施方案82为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0624]
实施方案83为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0625]
实施方案84为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化
物,其中:r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0626]
实施方案85为实施方案84的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0627]
实施方案86为实施方案84的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0628]
实施方案87为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0629]
实施方案88为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。
[0630]
实施方案89为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0631]
实施方案90为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自
其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0632]
实施方案91为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化
物,其中:r1为被取代或未取代的含有至少一个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。
[0633]
实施方案92为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2或3个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。
[0634]
实施方案93为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。
[0635]
实施方案94为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自该6元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0636]
实施方案95为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。
[0637]
实施方案96为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0638]
实施方案97为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化
物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0639]
实施方案98为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0640]
实施方案99为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0641]
实施方案100为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂
化物,其中:r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选自取代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0642]
实施方案101为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取
代的c
3-c7杂环烷基。
[0643]
实施方案102为实施方案90、94、97或101中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz独立地为氢、f、cl、br、-ch3、-ch2ch3、-ch2f、-chf2、-cf3、-cn、-oh、-och3、-och2ch3、-ocf3、-nh2、-nhch3或-n(ch3)2。
[0644]
实施方案103为实施方案90、94、97或101中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz独立地为氢、cl、br、-ch3、-och3、-nh2或-n(ch3)2。
[0645]
实施方案104为实施方案90、94、97或101中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz为氢。
[0646]
实施方案105为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被卤素、-cn、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-c(=o)or3、-c(=o)n(r3)2、-cr3=c(r3)2、-c≡cr3、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、或者取代或未取代的芳基所取代的c
1-c6烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0647]
实施方案106为实施方案64-79中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
3-c
10
环烷基或者取代或未取代的c
2-c
10
杂环烷基。
[0648]
实施方案107为实施方案106的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基、吡啶基、吡嗪基、嘧啶基、哒嗪基或三嗪基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0649]
实施方案108为实施方案106的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基或吡啶基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0650]
实施方案109为实施方案64-108中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0651]
实施方案110为实施方案64-108中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、br、i、硝基、-cn、-och2f、-ochf2、-ocf3、-c(=o)ch3、-c(=o)och
3-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-ch2f、-chf2或-cf3。
[0652]
实施方案111为实施方案64-108中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-cn、-ocf3、-chf2或-cf3。
[0653]
实施方案112为实施方案64-108中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-ocf3、-chf2或-cf3。
[0654]
实施方案113为实施方案64-108中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl或-cf3。
[0655]
实施方案114为实施方案64-113中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为卤素、硝基、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0656]
实施方案115为实施方案64-113中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、br、硝基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。
[0657]
实施方案116为实施方案64-113中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-cn、-och3、-ocf3、-c(=o)och3、-ch3或-cf3。
[0658]
实施方案117为实施方案64-113中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-ocf3或-cf3。
[0659]
实施方案118为实施方案64-113中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f或cl。
[0660]
实施方案119为式(iii)化合物,或其药学上可接受的盐或溶剂化物:其中,每个x3、x5和x6独立地为n或cr
x
;x4为cr
x
;每个r
x
独立地为氢、卤素、硝基、-or3、-sr3、-cn、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;r为卤素、硝基、-cn、-or3、-sr3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c1-c6氟烷基;r1为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的c
1-c6杂烷基、-cn或-s(=o)2r4;每个r2独立地为卤素、硝基、-n3、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基;r4为取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基或-nh2;且n为0、1、2、3或4。
[0661]
实施方案120为实施方案119的化合物或其药学上可接受的盐或溶剂化物,其中:x3为cr
x
。
[0662]
实施方案121为实施方案119的化合物或其药学上可接受的盐或溶剂化物,其中:x3为n。
[0663]
实施方案122为实施方案119-121中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个x5和x6为cr
x
。
[0664]
实施方案123为实施方案119-121中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:x5为n;且x6为cr
x
。
[0665]
实施方案124为实施方案119-121中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:x5为cr
x
;且x6为n。
[0666]
实施方案125为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-cn、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
2-c4烯基、取代或未取代的c
2-c4炔基、或者取代或未取代的c
1-c6杂烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0667]
实施方案126为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者
取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0668]
实施方案127为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、-ch2oh、-ch2ch2oh、-ch2cn、-ch2c(=o)oh、-ch2c(=o)och3、-ch2c(=o)och2ch3、-ch2c(=o)nh2、-ch2c(=o)nhch3、-ch2c(=o)n(ch3)2、-ch2nh2、-ch2nhch3、-ch2n(ch3)2、-ch2f、-chf2、-cf3、-ch=ch2、-c≡ch、环丙基氧基、环丁基氧基、环戊基氧基、氧杂环丁烷基氧基、四氢呋喃基氧基、四氢吡喃基氧基、氮杂环丁烷基、吡咯烷基、四唑基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-c(=o)oh、-c(=o)och3、-c(=o)och2ch3、-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-nh2、-nhch3、-n(ch3)2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3或-n(ch3)s(=o)2ch3。
[0669]
实施方案128为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-c≡ch、-oh、-och3、-och2ch3、-ocf3、-sch3、环丙基氧基、-nh2、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0670]
实施方案129为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、i、-ch3、-ch2ch3、环丙基、-oh、-och3、-och2ch3、-ocf3、环丙基氧基、-nh2、-nhc(=o)ch3、-nhs(=o)2ch3、-s(=o)ch3或-s(=o)2ch3。
[0671]
实施方案130为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。
[0672]
实施方案131为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、-ch3、-och3或-ocf3。
[0673]
实施方案132为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f或-och3。
[0674]
实施方案133为实施方案119-124中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
为氢。
[0675]
实施方案134为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中r1为取代或未取代的c
1-c6烷基。
[0676]
实施方案135为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或-cn所取代的c
1-c6烷基。
[0677]
实施方案136为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0678]
实施方案137为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
c(=o)n(r5)2或
–
n(r5)2所取代的c
1-c6烷基;其中每个r5独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c6烯基、取代或未取代的c
2-c6炔基或
–
cn;或者两个r5与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0679]
实施方案138为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的c
3-c8环烷基或者取代或未取代的c
2-c7杂环烷基所取代的c
1-c6烷基。
[0680]
实施方案139为实施方案138的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被环丙基、环丁基、环戊基或环己基所取代的c
1-c6烷基。
[0681]
实施方案140为实施方案138的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被氧杂环丁烷基、四氢呋喃基、四氢吡喃基、氮杂环丁烷基、吡咯烷基或哌啶基所取代的c
1-c6烷基。
[0682]
实施方案141为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的苯基所取代的c
1-c6烷基,其中如果苯基被取代,则其被1、2、3或4个选自卤素、硝基、-cn、-or3、-n(r3)2、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基和取代或未取代的c
1-c6氟烷基的取代基所取代;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0683]
实施方案142为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被含有至少一个氮原子的5元杂芳基环所取代的c
1-c6烷基。
[0684]
实施方案143为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自取代或未取代的吡咯基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基、取代或未取代的三唑基、取代或未取代的四唑基、取代或未取代的噁二唑基和取代或未取代的噻二唑基。
[0685]
实施方案144为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被5元杂芳基环所取代的c
1-c6烷基,该5元杂芳基环选自
c6烷基。
[0687]
实施方案146为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2或3个氮原子的单环6元杂芳基环所取代的c
1-c6烷基。
[0688]
实施方案147为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。
[0689]
实施方案148为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自该6元杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0690]
实施方案149为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基。
[0691]
实施方案150为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自取代或未取代的吲哚基、取代或未取代的异吲哚基、取代或未取代的苯并呋喃基、取代或未取代的异苯并呋喃基、取代或未取代的苯并噻吩基、取代或未取代的吲唑基、取代或未取代的苯并咪唑基、取代或未取代的苯并噁唑基、取代或未取代的苯并异噁唑基、取代或未取代的苯并噻唑基、取代或未取代的苯并异噻唑基、取代或未取代的苯并三唑基、取代或未取代的苯并噁二唑基、取代或未取代的苯并噻二唑基、取代或未取代的吲嗪基和取代或未取代的咪唑并吡啶基。
[0692]
实施方案151为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/5稠合杂芳基环所取代的c
1-c6烷基,该双环6/5稠合杂芳基环选自
;其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0693]
实施方案152为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有至少一个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0694]
实施方案153为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被取代或未取代的含有1、2、3或4个氮原子的双环6/6稠合杂芳基环所取代的c
1-c6烷基。
[0695]
实施方案154为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被双环6/6稠合杂芳基环所取代的c
1-c6烷基,该双环6/6稠合杂芳基环选
自取代或未取代的喹啉基、取代或未取代的异喹啉基、取代或未取代的噌啉基、取代或未取代的喹唑啉基、取代或未取代的喹喔啉基、取代或未取代的萘啶基、取代或未取代的吡啶并嘧啶基、取代或未取代的吡啶并吡嗪基、取代或未取代的吡啶并哒嗪基、取代或未取代的嘧啶并嘧啶基和取代或未取代的蝶啶基。
[0696]
实施方案155为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6/6稠合杂芳基环所取代的c
1-c6烷基,该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自该6/6稠合杂芳基环选自其中每个rz独立地为氢、卤素、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、取代或未取代的芳烷基、取代或未取代的芳基、或者取代或未取代的杂芳基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0697]
实施方案156为实施方案144、148、151或155中任一项的化合物或其药学上可接受
的盐或溶剂化物,其中:每个rz独立地为氢、f、cl、br、-ch3、-ch2ch3、-ch2f、-chf2、-cf3、-cn、-oh、-och3、-och2ch3、-ocf3、-nh2、-nhch3或-n(ch3)2。
[0698]
实施方案157为实施方案144、148、151或155中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz独立地为氢、cl、br、-ch3、-och3、-nh2或-n(ch3)2。
[0699]
实施方案158为实施方案144、148、151或155中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个rz为氢。
[0700]
实施方案159为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被卤素、-cn、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-c(=o)or3、-c(=o)n(r3)2、-cr3=c(r3)2、-c≡cr3、取代或未取代的c
3-c
10
环烷基、取代或未取代的c
2-c
10
杂环烷基、或者取代或未取代的芳基所取代的c
1-c6烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0701]
实施方案160为实施方案119-133中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
3-c
10
环烷基或者取代或未取代的c
2-c
10
杂环烷基。
[0702]
实施方案161为实施方案160的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基、吡啶基、吡嗪基、嘧啶基、哒嗪基或三嗪基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0703]
实施方案162为实施方案160的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被c
1-c6烷基、苯基或吡啶基所取代的c
3-c6环烷基或c
3-c5杂环烷基。
[0704]
实施方案163为实施方案119-162中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0705]
实施方案164为实施方案119-162中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、br、i、硝基、-cn、-och2f、-ochf2、-ocf3、-c(=o)ch3、-c(=o)och
3-c(=o)nh2、-c(=o)nhch3、-c(=o)n(ch3)2、-s(=o)ch3、-s(=o)2ch3、-nhs(=o)2ch3、-n(ch3)s(=o)2ch3、-nhc(=o)ch3、-n(ch3)c(=o)ch3、-nhc(=o)och3、-n(ch3)c(=o)och3、-ch2f、-chf2或-cf3。
[0706]
实施方案165为实施方案119-162中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-cn、-ocf3、-chf2或-cf3。
[0707]
实施方案166为实施方案119-162中任一项的化合物或其药学上可接受的盐或溶
剂化物,其中:r为f、cl、-ocf3、-chf2或-cf3。
[0708]
实施方案167为实施方案119-162中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl或-cf3。
[0709]
实施方案168为实施方案119-167中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为卤素、硝基、-cn、-or3、-sr3、-s(=o)2r3、-n(r3)2、-c(=o)or3、取代或未取代的c
1-c6烷基、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0710]
实施方案169为实施方案119-167中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、br、硝基、-cn、-oh、-och3、-och2ch3、-och2ch2oh、-och2cn、-ocf3、-s(=o)2ch3、-nh2、-nhch3、-n(ch3)2、-c(=o)och3、-ch3、-ch2ch3、-ch2f、-chf2或-cf3。
[0711]
实施方案170为实施方案119-167中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-cn、-och3、-ocf3、-c(=o)och3、-ch3或-cf3。
[0712]
实施方案171为实施方案119-167中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-ocf3或-cf3。
[0713]
实施方案172为实施方案119-167中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f或cl。
[0714]
实施方案173为实施方案1-172中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:n为0。
[0715]
实施方案174为实施方案1-172中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:n为1或2。
[0716]
实施方案175为实施方案1-174中任一项的化合物或其药学上可接受的盐或溶剂化物,其中所述化合物表现出不超过3μm的ic
50
。
[0717]
实施方案176为一种化合物或其药学上可接受的盐或溶剂化物,其中所述化合物是来自表1的化合物,或其药学上可接受的盐或溶剂化物。
[0718]
实施方案177为一种药物组合物,其包含药学上可接受的赋形剂和实施方案1-176中任一项的化合物,或其药学上可接受的盐或溶剂化物。
[0719]
实施方案178为一种治疗有需要的受试者的癌症的方法,其包括施用治疗有效量的实施方案1-176中任一项的化合物,或其药学上可接受的盐或溶剂化物。
[0720]
实施方案i为式(i)化合物,或其药学上可接受的盐或溶剂化物:c10
环烷基或-nh2;且n为0、1、2、3或4。
[0721]
实施方案ii为实施方案i的化合物或其药学上可接受的盐或溶剂化物,其中:x1为cr
x
;且每个x2和x3为cry。
[0722]
实施方案iii为实施方案i或ii的化合物或其药学上可接受的盐或溶剂化物,其中:每个x4、x5和x6为cr
x
。
[0723]
实施方案iv为实施方案i-iii中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、卤素、-or3、-sr3、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0724]
实施方案v为实施方案i-iii中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
独立地为氢、f、cl、br、-ch3、-oh、-och3或-ocf3。
[0725]
实施方案vi为实施方案i-iii中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r
x
为氢。
[0726]
实施方案vii为实施方案i-vi中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、卤素、-s(=o)r3、-s(=o)2r3、-n(r3)2、-nr3s(=o)2r3、-nr3c(=o)r3、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
2-c4炔基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0727]
实施方案viii为实施方案i-vi中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry独立地为氢、f、cl或-ch3。
[0728]
实施方案ix为实施方案i-vi中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个ry为氢。
[0729]
实施方案x为实施方案i-ix中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为取代或未取代的c
1-c6烷基。
[0730]
实施方案xi为实施方案i-x中任一项的化合物或其药学上可接受的盐或溶剂化
物,其中:r1为被
–
or3所取代的c
1-c6烷基;且r3为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、或者取代或未取代的c
3-c
10
环烷基。
[0731]
实施方案xii为实施方案xi的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被
–
oh所取代的c
1-c6烷基。
[0732]
实施方案xiii为实施方案i-x中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被6元杂芳基环所取代的c
1-c6烷基,该6元杂芳基环选自取代或未取代的吡啶基、取代或未取代的吡嗪基、取代或未取代的嘧啶基、取代或未取代的哒嗪基和取代或未取代的三嗪基。
[0733]
实施方案xiv为实施方案xiii的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被吡啶基所取代的c
1-c6烷基。
[0734]
实施方案xv为实施方案i-x中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r1为被1、2或3个取代基所取代的c
1-c6烷基,每个取代基独立地选自-oh、-och3、-nh2、-nhch3、-n(ch3)2和吡啶基。
[0735]
实施方案xvi为实施方案i-xv中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为卤素、硝基、-cn、-or3、-c(=o)r3、-c(=o)n(r3)2、-c(=o)or3、-s(=o)r3、-s(=o)2r3、-nr3s(=o)2r3、-nr3c(=o)r3、-nr3c(=o)or3、或者取代或未取代的c
1-c6氟烷基;且每个r3独立地为氢、取代或未取代的c
1-c6烷基、取代或未取代的c
1-c6氟烷基、取代或未取代的c
1-c6杂烷基、取代或未取代的c
3-c
10
环烷基、或者取代或未取代的c
2-c
10
杂环烷基;或者如果两个r3在同一氮原子上,则两个r3与它们所连接的氮原子一起形成取代或未取代的c
3-c7杂环烷基。
[0736]
实施方案xvii为实施方案i-xv中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl、-cn、-ocf3、-chf2或-cf3。
[0737]
实施方案xviii为实施方案i-xv中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为f、cl或-cf3。
[0738]
实施方案xix为实施方案i-xv中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:r为-cf3。
[0739]
实施方案xx为实施方案i-xix中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:每个r2独立地为f、cl、-ocf3或-cf3。
[0740]
实施方案xxi为实施方案i-xix中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:
每个r2独立地为f或cl。
[0741]
实施方案xxii为实施方案i-xxi中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:n为0。
[0742]
实施方案xxiii为实施方案i-xxi中任一项的化合物或其药学上可接受的盐或溶剂化物,其中:n为1或2。
[0743]
实施方案xxiv为一种化合物或其药学上可接受的盐或溶剂化物,其中所述化合物是来自表1的化合物,或其药学上可接受的盐或溶剂化物。
[0744]
实施方案xxv为一种药物组合物,其包含药学上可接受的赋形剂和实施方案i-xxiv中任一项的化合物,或其药学上可接受的盐或溶剂化物。
[0745]
实施方案xxvi为一种抑制hippo途径所包含的一种或多种蛋白质或与hippo途径有关的一种或多种蛋白质的方法,其包括向有需要的受试者施用治疗有效量的实施方案i-xxiv中任一项的化合物,或其药学上可接受的盐。
[0746]
实施方案xxvii为一种抑制具有pdz结合基序的转录共激活物/yes相关蛋白转录共激活物(taz/yap)的方法,其包括向有需要的受试者施用治疗有效量的实施方案i-xxiv中任一项的化合物,或其药学上可接受的盐。
[0747]
实施方案xxviii为一种治疗有需要的受试者的癌症的方法,其包括向有需要的受试者施用治疗有效量的实施方案i-xxiv中任一项的化合物,或其药学上可接受的盐。
[0748]
实施方案xxix为实施方案xxviii的方法,其中所述癌症选自间皮瘤、肝细胞癌、脑膜瘤、恶性周围神经鞘瘤、许旺细胞瘤、肺癌、膀胱癌、皮肤神经纤维瘤、前列腺癌、胰腺癌、胶质母细胞瘤、子宫内膜腺鳞状癌、未分化甲状腺癌、胃腺癌、食管腺癌、卵巢癌、卵巢浆液性腺癌、黑素瘤和乳腺癌。
[0749]
实施方案xxx为一种治疗有需要的受试者的多囊肾病或肝纤维化的方法,其包括向有需要的受试者施用治疗有效量的实施方案i-xxiv中任一项的化合物,或其药学上可接受的盐。
