1.本发明涉及纳米医学技术领域,具体涉及一种用于治疗乏氧肿瘤的半导体聚合物、制备方法和应用。
背景技术:
2.在临床治疗中,一些浸润深、体积大、位置复杂、手术/放疗可能性低的恶性肿瘤(mts)难以治愈。因此,光动力/光热疗法(pdt/ptt)因其非侵入性、显著的肿瘤穿透深度和可忽略的副作用等优点而被用于治疗此类肿瘤。为了实现mts的优异功效,对pdt/ptt光敏剂有几个要求。首先,光敏剂应对近红外二区(nirⅱ)激光(1000-1700nm)照射有响应,其表现出更深的穿透力(对于1064nm激光》1cm)和更高的最大允许曝光(mpe,mpe对于皮肤,1064nm激光为1.0w cm-2
,808nm激光为0.33w cm-2
)。其次,因为ii型pdt光敏剂的功效在很大程度上取决于o2水平,光敏剂应该是可以在缺氧(2%o2)肿瘤微环境下有效工作的i型pdt材料。此外,与无机对应物相比,聚合物光敏剂具有组成简单、化学结构和光学性质可调、优异的生物相容性和易于功能化的优点。因此,缺氧肿瘤对于nir ii i型光敏剂需求很高。
3.由于多种原因,实现nir-ii i型pdt/ptt聚合物光敏剂具有挑战性。首先,需要促进系间窜越(isc)的速率常数(k
isc
)以产生三重态激子。一般来说,有两种方法可以增强isc过程。一种是通过分子内电荷转移(ict)过程,减少单重态和三重态之间的能级差异(δe
st
),其已经广泛地被用于开发热激活延迟荧光和光动力治疗材料。另一种方法是通过引入碘、硒、碲等重原子来扩大单线态和三线态之间的自旋轨道耦合常数。其次,ii型pdt是光敏剂三线态激子通过能量转移过程将基态氧(3o2)转化为单线态氧(1o2),这需要最低三线态激发态(t1)的能量高于氧敏化阈值0.98ev。i型pdt定义为光敏剂的三重态激子将在不存在还原介质时候,电子传递给3o2形成o2·
―
,也包括通过超氧化物歧化和franck
–
condon跃迁反应形成ho
·
和h2o2,然而这都需要允许的电子转移过程(吉布斯自由能变化δg《0)。一般来说,ii型过程的速度比i型过程的速度快得多。当能级满足要求时,pdt更倾向于ii型而不是i型过程。因此,尽管报道了少数的nir-ii ii型pdt/ptt光敏剂,仍然没有报道nir-ii i型pdt/ptt有机/聚合物光敏剂。
4.使用噻吩异靛蓝作为强吸电子单元,碲吩基衍生物作为电子供体单元,采用供体-受体(d-a)策略构建一种窄带隙半导体聚合物,它使nir-ii i型pdt/ptt光敏剂在常氧和缺氧环境中成为可能。将得到的半导体聚合物与乳化剂pf127通过纳米沉淀法聚集沉淀,制备聚合物纳米颗粒。d-a策略实现的强ict特征将光吸收范围扩展到nir ii区域,而k
isc
通过结合重原子(碲)显著增强以产生三线态激子。最低单线激发态能级相关的最低三线激发态能量不足,不足以将3o2敏化为1o2用于ii型pdt,可进行i型pdt。基于碲吩的半导体聚合物纳米颗粒在体外常氧和缺氧条件下表现出优异的生物相容性和前所未有的nir-ii(1064nm)i型光动力/光热性能,可有效抑制小鼠乳腺癌细胞增殖。
技术实现要素:
5.针对现有技术存在的问题,本发明提供了一种用于治疗肿瘤的半导体聚合物及其制备方法和应用,具体包括以下内容:
6.一种用于治疗乏氧肿瘤的半导体聚合物,所述半导体聚合物的化学结构式如i所示:
[0007][0008]
其中,x为1-30的自然数,x是半导体聚合物的聚合度;r1和r1’为含1-30个碳原子的烷基;ar是碲吩基给电子单元。
[0009]
具体地,所述r1和r1’选自含1-30个碳原子的直连烷基、支链烷基或环烷基,所述含1-30个碳原子的直连烷基、支链烷基和环烷基中的一个或多个碳原子被氧原子、苯环、氨基、羧基取代,和/或一个或多个氢原子被氧原子、苯环、氨基、羧基取代。
[0010]
具体地,所述ar选自碲吩衍生物、碲吩并环己烷衍生物或联碲吩衍生物。
[0011]
具体地,所述的ar选自ar1、ar2或ar3:
[0012][0013]
所述ar1中,r2和r2’选自含1到12个碳原子的烷基或甲氧基;所述ar2中,r3和r3’为氢原子;所述ar3中,r4和r4’为氢原子。
[0014]
具体地,所述半导体聚合物的化学结构包括:
[0015][0016]
所述x为1-30的自然数;r2和r2’选自含1到12个碳原子的烷基或甲氧基;r3和r3’为氢原子;r4和r4’为氢原子。
[0017]
一种用于治疗乏氧肿瘤的半导体聚合物的制备方法,包括以下步骤:
[0018]
步骤一:噻吩异靛蓝通过取代反应得到噻吩异靛蓝的双边碘化物,噻吩异靛蓝在催化剂存在下通过脱氢和加成得到噻吩异靛蓝双边锡化物;
[0019]
步骤二:碲吩衍生物通过取代反应得到碲吩衍生物的双边取代化合物;
[0020]
步骤三:碲吩衍生物的双边取代化合物与噻吩异靛蓝的双边碘化物或噻吩异靛蓝双边锡化物发生偶联反应得到半导体聚合物p。
[0021]
具体地,所述步骤一包括:噻吩异靛蓝在n-碘代琥珀酰亚胺作用下通过亲电取代反应得到噻吩异靛蓝的双边碘化物,噻吩异靛蓝在仲丁基锂和三甲基氯化锡作用下通过脱氢和加成得到噻吩异靛蓝双边锡化物;
[0022]
所述步骤二包括:碲吩衍生物ar1通过拔氢加锡的过程得到碲吩衍生物ar1的双边锡化物;碲吩并环己烷衍生物ar2通过亲电取代反应得到碲吩并环己烷衍生物ar2的双边溴化物;联碲吩ar3在n-碘代琥珀酰亚胺作用下通过亲电取代反应得到联碲吩的双边碘化物;
[0023]
所述步骤三包括:噻吩异靛蓝的双边碘化物与碲吩衍生物ar1的双边锡化物通过stille反应得到噻吩异靛蓝与碲吩耦合的半导体聚合物p1;噻吩异靛蓝的双边锡化物与碲吩并环己烷衍生物ar2的双边溴化物通过stille反应得到噻吩异靛蓝与碲吩并环己烷衍生物耦合的半导体聚合物p2;噻吩异靛蓝的双边锡化物与碲吩衍生物ar3的双边碘化物通过stille反应得到噻吩异靛蓝与联碲吩耦合的半导体聚合物p3;
[0024]
所述ar1、ar2、ar3以及p1、p2、p3的化学结构为:
[0025][0026]
一种用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的制备方法,包括:将用于治疗肿瘤的半导体聚合物和两亲性乳化剂溶解在两亲性溶剂中;在超声条件下,向其中加入去离子水,通过纳米沉淀法制备出半导体聚合物纳米颗粒。
[0027]
具体地,所述两亲性乳化剂选自pf-127、pva、peg;所述两亲性溶剂选自四氢呋喃、n,n-二甲基甲酰胺、二甲基亚砜;所述两亲性溶液中半导体聚合物的浓度为3mg
·
ml-1-5mg
·
ml-1
;所述两亲性乳化剂与半导体聚合物的质量比为5:1-10:1;所述去离子水与两亲性溶剂的体积比是5:1-10:1。
[0028]
一种半导体聚合物纳米颗粒在治疗肿瘤中的应用,所述半导体聚合物纳米颗粒被用作光热试剂,在近红外二区激光的照射下,半导体聚合物纳米颗粒提升水溶液局部温度,杀伤肿瘤细胞;和/或半导体聚合物纳米颗粒被用作光敏剂,在近红外二区激光的照射下,半导体聚合物纳米颗粒在水溶液中产生活性氧物种,在乏氧条件下可以杀伤肿瘤细胞。
[0029]
本发明的有益效果:本发明合成的半导体聚合物在近红外二区表现出宽且强的吸收,有利于提高材料的光热转化效率。重原子的引入,促进活性氧物种的产生。由于半导体
聚合物纳米颗粒三线激发态能量不足不能将氧气敏化产生单线态氧。但是,可以产生超氧阴离子自由基,用于近红外二区的乏氧肿瘤的光动力治疗。
附图说明
[0030]
图1为本发明的用于治疗乏氧肿瘤的半导体聚合物的紫外可见近红外吸收图谱;
[0031]
图2为本发明的用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的透射电子扫描显微镜图;
[0032]
图3为本发明的用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的光热转化效率;
[0033]
图4为本发明的用于治疗乏氧肿瘤的半导体聚合物纳米颗粒在细胞内产生的活性氧物种种类;
[0034]
图5为本发明的用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的细胞光毒性结果;
[0035]
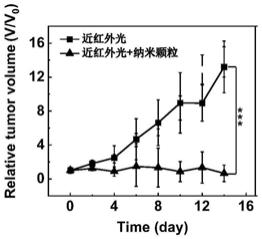
图6为本发明的用于治疗乏氧肿瘤的半导体聚合物纳米颗粒抑制肿瘤生长效果。
具体实施方式
[0036]
下面结合附图和具体实施方式对本发明进行详细说明。下面所示的实施例不对权利要求所记载的发明内容起任何限定作用。另外,下面实施例所表示的构成的全部内容不限于作为权利要求所记载的发明的解决方案所必需的。
[0037]
实施例1
[0038]
用于治疗乏氧肿瘤的半导体聚合物的合成步骤如下:
[0039]
步骤一:根据文献所述步骤(adv.funct.mater.2013,23,5317),合成噻吩异靛蓝的双边碘化物。
[0040]
步骤二:根据文献所述步骤(angew.chem.int.ed.2014,53,10691),合成碲吩的双边锡化物。
[0041]
步骤三:在氮气保护下,将噻吩异靛蓝的双边碘化物((e)-2,2'-diiodo-4,4'-bis(2-octyldodecyl)-[6,6'-bithieno[3,2-b]pyrrolylidene]-5,5'(4h,4'h)-dione)(0.05mmol)和碲吩的双边锡化物(0.05mmol)添加到schlenk反应瓶中。反应瓶脱气再充氮气3次后,加入干燥的甲苯(2.0ml),用氮气鼓泡15分钟。然后,在氮气保护下加入pd2(dba)3(0.0025mmol)和三(邻甲基苯基)磷(0.010mmol)。然后再次用氮气鼓泡溶液15分钟。上述混合物在110℃下加热48小时,颜色由紫色逐渐变为黑绿色。然后,每间隔6小时将2-(三丁基甲锡烷基)噻吩(0.050mmol)和2-溴噻吩(0.10mmol)陆续加入混合物中。最后,将混合物冷却至室温,真空浓缩除去甲苯,然后逐滴加入到甲醇中。过滤收集粗聚合物,在空气中干燥后,用丙酮、正己烷、四氢呋喃和三氯甲烷对其进行索氏提取。将正己烷部分滴加到甲醇中,得到黑绿色固体,收集并在空气中干燥。
[0042]
用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的制备如下:
[0043]
首先将用于治疗乏氧肿瘤的半导体聚合物(5.0mg)和乳化剂pf127(50.0mg)溶解在thf(1.0ml)中,然后将溶液进行超声处理5分钟。聚合物完全溶解后,加入去离子水(5.0ml)。使用超声波细胞破碎机(200w)将溶液超声10分钟以自组装制备纳米颗粒。然后,将获得的纳米颗粒溶液在室温下搅拌过夜以蒸发thf。用截留分子量为3500的透析袋透析两天以去除多余的乳化剂pf127后得到聚合物纳米颗粒水溶液。
[0044]
实施例2
[0045]
用于治疗乏氧肿瘤的半导体聚合物的合成如下:
[0046]
步骤一:根据文献所述步骤(polym.chem.2016,7,1181),合成噻吩异靛蓝的双边锡化物。
[0047]
步骤二:根据文献所述步骤(organometallics 2016,35,2140),合成碲吩并环己烷的双边溴化物。
[0048]
步骤三:在氮气保护下,将噻吩异靛蓝的双边锡化物((e)-4,4'-bis(2-hexyldecyl)-2,2'-bis(trimethylstannyl)-[6,6'-bithieno[3,2-b]pyrrolylidene]-5,5'(4h,4'h)-dion)(0.05mmol)和碲吩并环己烷的双边溴化物(0.05mmol)添加到schlenk反应瓶中。反应瓶脱气再充氮气3次后,加入干燥的甲苯(2.0ml),用氮气鼓泡15分钟。然后,在氮气保护下加入pd2(dba)3(0.0025mmol)和三(邻甲基苯基)磷(0.010mmol)。然后再次用氮气鼓泡溶液15分钟。上述混合物在110℃下加热48小时,颜色由紫色逐渐变为黑绿色。然后,每间隔6小时将2-(三丁基甲锡烷基)噻吩(0.050mmol)和2-溴噻吩(0.10mmol)陆续加入混合物中。最后,将混合物冷却至室温,真空浓缩除去甲苯,然后逐滴加入到甲醇中。过滤收集粗聚合物,在空气中干燥后,用丙酮、正己烷、四氢呋喃和三氯甲烷对其进行索氏提取。将正己烷部分滴加到甲醇中,得到黑绿色固体,收集并在空气中干燥。通过gpc测试表明,半导体聚合物的数均分子量mw=19975da,分散系数pdi=2.05。
[0049]
用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的制备如下:
[0050]
首先将用于治疗乏氧肿瘤的半导体聚合物(5.0mg)和乳化剂pf127(30.0mg)溶解在thf(1.0ml)中,然后将溶液进行超声处理5分钟。聚合物完全溶解后,加入去离子水(8.0ml)。使用超声波细胞破碎机(200w)将溶液超声10分钟以自组装制备纳米颗粒。然后,将获得的纳米颗粒溶液在室温下搅拌过夜以蒸发thf。用截留分子量为3500的透析袋透析两天以去除多余的乳化剂pf127后得到聚合物纳米颗粒水溶液。
[0051]
实施例3
[0052]
步骤一:根据文献所述步骤(polym.chem.2016,7,1181),合成噻吩异靛蓝的双边锡化物。
[0053]
步骤二:根据文献所述步骤(angew.chem.int.ed.2010,49,10140),合成联碲吩的双边碘化物。
[0054]
步骤三:在氮气保护下,将噻吩异靛蓝的双边锡化物((e)-4,4'-bis(2-hexyldecyl)-2,2'-bis(trimethylstannyl)-[6,6'-bithieno[3,2-b]pyrrolylidene]-5,5'(4h,4'h)-dion)(0.05mmol)和联碲吩的双边碘化物(0.05mmol)添加到schlenk反应瓶中。反应瓶脱气再充氮气3次后,加入干燥的甲苯(2.0ml),用氮气鼓泡15分钟。然后,在氮气保护下加入pd2(dba)3(0.0025mmol)和三(邻甲基苯基)磷(0.010mmol)。然后再次用氮气鼓泡溶液15分钟。上述混合物在110℃下加热48小时,颜色由紫色逐渐变为黑绿色。然后,每间隔6小时将2-(三丁基甲锡烷基)噻吩(0.050mmol)和2-溴噻吩(0.10mmol)陆续加入混合物中。最后,将混合物冷却至室温,真空浓缩除去甲苯,然后逐滴加入到甲醇中。过滤收集粗聚合物,在空气中干燥后,用丙酮、正己烷、四氢呋喃和三氯甲烷对其进行索氏提取。将正己烷部分滴加到甲醇中,得到黑绿色固体,收集并在空气中干燥。
[0055]
用于治疗乏氧肿瘤的半导体聚合物纳米颗粒的制备如下:
[0056]
首先将半导体聚合物(3mg)和乳化剂peg-2000(30.0mg)溶解在thf(1.0ml)中,然后将溶液进行超声处理5分钟。聚合物完全溶解后,加入去离子水(3.0ml)。使用超声波细胞破碎机(200w)将溶液超声10分钟以自组装制备纳米颗粒。然后,将获得的纳米颗粒溶液在室温下搅拌过夜以蒸发thf。用截留分子量为3500的透析袋透析两天以去除多余的乳化剂pf127后得到聚合物纳米颗粒水溶液。
[0057]
实施例4
[0058]
通过紫外可见近红外吸收光谱测试和tem扫描电镜测试测定实施例1得到的聚合物和纳米颗粒。附图1光谱显示半导体聚合物的紫外可见吸收最大吸收波长是1044nm,处于近红外二区。附图2结果显示纳米的颗粒的尺寸在91.5
±
13.2nm。
[0059]
实施例5
[0060]
对实施例1制备的半导体聚合物纳米颗粒进行光热转换效率的测试。半导体聚合物纳米颗粒在1064nm激光照射下(1.0w cm-2
),测得附图3中的数据。根据文献的计算公式(angew.chem.int.ed.2020,59,12756),计算出光热转换效率为47.5%。半导体聚合物纳米颗粒可以被用于光热治疗,抑制肿瘤细胞增殖。
[0061]
实施例6
[0062]
对实施例1制备的半导体聚合物纳米颗粒进行活性氧物种种类的测试。dhe是细胞内超氧阴离子自由基检测的特异性探针。小鼠乳腺癌细胞被导体聚合物纳米颗粒处理后,在1064nm激光照射下(1.0w cm-2
)光照,产生的活性氧物种的种类用dhe染色后,通过荧光照片进行测定。如附图4所示,相比于未处理细胞,半导体聚合物纳米颗粒处理的细胞内显示出明显的超氧阴离子自由基的生成,可以用于乏氧条件下的光动力治疗。
[0063]
实施例7
[0064]
对实施例1制备的半导体聚合物纳米颗粒进行常氧和乏氧条件下的细胞光毒性测试。常氧和乏氧条件下的小鼠乳腺癌细胞被导体聚合物纳米颗粒处理后,在1064nm激光照射下(1.0w cm-2
)光照,细胞光毒性结果通过cck-8测试。如附图5所示,乏氧条件下,ic50明显小于常氧条件下的ic50。半导体聚合物纳米颗粒在两种条件下均可以有效抑制细胞增殖。
[0065]
实施例8
[0066]
对实施例1制备的半导体聚合物纳米颗粒进行小鼠抑制肿瘤生长实验。接种了小鼠乳腺癌细胞的小鼠被分成2组,一组小鼠的肿瘤进行光照(1064nm,1.01.0w cm-2
,10min),另外一组额外瘤内注射纳米颗粒(5mg kg-1
)。每隔一天对肿瘤的体积进行测定,整个过程持续14天。如附图6所示,与单独进行光照的组别小鼠肿瘤相比,纳米颗粒和光照同时处理的组别小鼠肿瘤被有效抑制。乏氧肿瘤的增殖可以被纳米颗粒有效抑制。
[0067]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
