抗prl蛋白单克隆抗体、细胞系及其应用
技术领域
1.本发明涉及生物检测领域,特别涉及抗prl蛋白单克隆抗体、细胞系及其应用。
背景技术:
2.催乳素(prolactin,简称prl,又叫促乳素或催乳激素),是垂体前叶嗜酸性细胞和胎盘分泌的一种蛋白激素,也是繁殖成功所必须的垂体前叶肽类激素。prl是由单基因编码的多肽类激素,其化学结构与生长激素十分相似,均属于造血因子家族。人促乳素cdna长度为914个核苷酸,其中含681个核苷酸的开放阅读框,编码227个氨基酸的促乳素前体,其中28个氨基酸信号肽,成熟的人促乳素由199个氨基酸组成。其化学结构和分子量在各种动物有所不同,促乳素多肽链中6个半胱氨酸形成了3个分子内二硫键,并在氨基末端形成一个特有的二硫环。prl中有4个保守区是其主要功能结构域。prl的二级结构研究表明它含有50%的α螺旋,形成4个反平行的螺旋结构,与相应受体结合的胞外域也高度保守。每个螺旋含25~32个残基,在第l、2及3、4螺旋间有延伸片段,形成拓扑结构。不同动物的prl成熟蛋白分子均存在2个氨基酸数目一致并且比较保守的活性区域,分别位于57~90位和175~192位,其氨基酸的组成和序列存在一些差别。
3.prl功能很多,但在哺乳动物中,最重要的功能仍然是促乳和与生殖有关的作用。prl在血液循环中存在3种分子形式,它们是分子量约23kda的小分子prl(sprl),为单体非糖基化的激素,具有高生物学活性和免疫反应性,是prl的主要组成形式;分子量为40—60kda的大分子p1ll(bprl),是由糖基化prl的二聚体组成;分子量在100kda以上的巨分子prl(mprl),主要是prl与自身抗体形成的免疫复合物,也是prl免疫学检测的重要组成部分。
技术实现要素:
4.发明人提供了一种抗prl蛋白单克隆抗体,所述单克隆抗体重链和轻链可变区的氨基酸序列分别是seq id no.2和seq id no.3所示的氨基酸序列。
5.进一步地,所述单克隆抗体重链和轻链可变区氨基酸序列分别是seq id no.4和seq id no.5所示的核苷酸序列所编码。
6.进一步地,所述单克隆抗体制备过程中,免疫小鼠所用的抗原为seq id no.1所示核苷酸序列编码,经由大肠杆菌重组表达的重组蛋白。
7.进一步地,所述单克隆抗体特异性识别人prl蛋白。
8.进一步地,所述单克隆抗体由保藏号为cgmcc no.22311的杂交瘤细胞系产生。所述细胞株为小鼠杂交瘤细胞系2c10d5h11,分类命名为:小鼠杂交瘤细胞系,该细胞系已于2021年04月29日在中国微生物菌种保藏管理委员会普通微生物中心保藏,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
9.进一步地,所述抗prl蛋白为小鼠igg1亚型单克隆抗体。
10.发明人还提供了一种抗prl蛋白单克隆抗体的制备方法,其免疫小鼠所用的抗原
为seq id no.1所示核苷酸序列编码,经由大肠杆菌重组表达的重组蛋白。
11.发明人还提供了一株分泌抗prl蛋白的杂交瘤细胞系,所述细胞株为小鼠杂交瘤细胞系2c10d5h11,所述细胞系保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为:cgmcc no.22311。
12.发明人还提供以上任一所述的抗prl蛋白单克隆抗体在人prl蛋白免疫检测中的用途。
13.进一步地,所述免疫检测包括免疫组织化学法,免疫印迹法和酶联免疫法。
14.发明人再提供了一种人prl蛋白免疫检测试剂,所述免疫检测试剂内含有以上任一的抗prl蛋白单克隆抗体为有效成分。
15.区别于现有技术,上述技术方案依据prl蛋白的结构、抗原性、组成氨基酸的亲疏水性以及二级结构,上述技术方案选取prl蛋白第78位至第224位氨基酸片段和其对应的核苷酸片段,通过大肠杆菌进行重组表达,对小鼠进行免疫,经细胞融合、筛选和克隆,获得高效分泌抗prl蛋白单克隆抗体的单克隆细胞系2c10d5h11,并对单克隆细胞系2c10d5h11进行体外培养,并获得由该细胞系所分泌的抗prl蛋白单克隆抗体。本方案得到的抗体具有高特异性、敏感性,可以特异性识别表达prl蛋白的细胞,适用于免疫学检测,特别是免疫组化检测。
附图说明
16.图1为实施例3纯化后prl蛋白的电泳结果图;m:分子量标记,
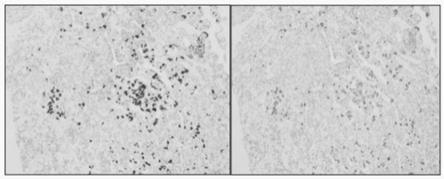
17.图2为垂体瘤免疫组化染色结果图;其中左为2c10d5h11分泌的的prl,右为市售prl(兔多抗)。
具体实施方式
18.实施例1重组prl蛋白片段的制备
19.一、抗原片段选择
20.从uniprot数据库(http://www.uniprot.org)中选择编号p01236的prl蛋白序列作为标准序列。本发明选取人prl蛋白第78位至第224位氨基酸片段作为抗原,根据其对应碱基序列(seq id no.1)利用软件primer 5.0设计prl蛋白的特异性上游引物5’cgggatccttcattaccaaagcgat’(seq id no.6酶切位点,bamh i)和下游引物:5’catctcgaggttgtggatgatacgacat 3’(seq id no.7,酶切位点,xho i),反转录扩增编码第78位至第224位氨基酸的基因片段seq id no.1。
21.将pcr产物经琼脂糖凝胶电泳分离后回收,分别对回收的目的基因和用于表达的质粒载体pet27b进行bamh i和xho i双酶切,再次电泳回收,以t4 dna连接酶连接。连接产物转化大肠杆菌感受态细胞bl21,挑取平板上的克隆接种扩培,提取质粒dna,进行pcr鉴定。将pcr显示目的基因阳性的克隆进行测序分析,序列完全正确的克隆用于进行下一步实验。
22.二、重组prl蛋白片段的表达和纯化
23.取出-80℃保存的感受态细胞100ul(bl21),解冻后加入5ul prl质粒dna,冰上放置30min。42℃热激90秒后冰浴5min后,加入800μl无抗性的lb培养基。37℃复苏培养60min,
涂板,过夜培养。从转化的平板挑单克隆到4ml的lb液体培养基中,37℃,200rpm过夜培养后保菌。
24.取4ul菌液到4ml lb液体培养基中,过夜培养复苏。将培养的菌液转接到200ml lb液体培养基混合,37℃,200rpm,培养至od=0.6-0.8,加入iptg(0.5mm)低温过夜诱导。400ml大离心筒,4000rpm,离心10min收集菌体,弃上清。沉淀用20-30ml 10mm tris-hcl(ph 8.0)和终浓度为0.5m的nacl溶液吹散,超声破碎菌体。12000rpm离心20分钟,取离心上清上样到ni-nta镍柱(qiagen)进行纯化,之后分别用含50mm咪唑、250mm咪唑、500mm咪唑的10mm tris-hcl(ph 8.0)(含0.5m氯化钠)溶液洗脱,分别收集蛋白峰,电泳检测,备用。
25.实施例2 2c10d5h11杂交瘤细胞系的建立
26.一、免疫
27.将实施例1中获得的重组prl蛋白,与等体积的完全弗氏佐剂(cfa,sigma公司)混合乳化,对18-20g的balb/c小鼠(购自福州吴氏实验动物)进行腹部注射免疫,注射剂量为50μg/只。此后每14天加强免疫一次,抗原使用弗氏非完全佐剂(ifa,sigma公司)乳化,剂量为25μg/只。第2次加强免疫后14天以间接elisa(波长450nm)检测小鼠血清中抗免疫原的多抗效价,效价最高的小鼠以尾静脉注射冲击免疫,抗原用pbs溶液混匀,剂量为50μg/只。
28.二、细胞融合:
29.无菌制备免疫达标的小鼠脾细胞悬液,与小鼠骨髓瘤细胞sp2/0(atcc)以5:1比例混合,1000rpm离心10min,弃上清后,在1分钟内由慢到快加入1ml预热至37℃的peg(sigma公司)溶液,加入过程中需轻轻转动离心管,使细胞与peg充分接触。室温静置90s后,2min内由慢到快加入4ml预热至37℃的无血清dmem(hyclone公司)培养基,随后的2min内再加入10ml预热无血清dmem培养基,最后2min内加完剩余的预热无血清dmem培养基,定容至50ml,整个加入过程需要缓慢摇动离心管,确保混合均匀,减轻对细胞的伤害。室温静置10min后离心(1000rpm,5min),弃上清,用10-20mlhat(sigma公司)培养基重悬细胞,并用hat培养基稀释至终浓度为0.5
×
106cells/ml,所有溶液转移至96孔板中,200μl/孔,并做好标记。将96孔培养板小心转移至37℃,5%co2培养箱中培养。定期检查细胞的生长状态及潜在的污染,注意尽量少开合培养箱,确保培养环境稳定。融合后第5天,向培养板中补加hat培养基,50μl/孔。
30.三、克隆化及elisa筛选阳性杂交瘤细胞:
31.当融合细胞直径长至大概为1-2mm时,吸取50-200μl培养液上清进行首次细胞筛选(elisa、ihc-p及其他方法检测),同时往培养孔中补加hat培养基至200μl。elisa检测该培养液上清,将检测得到阳性结果的培养孔内细胞培养液全部转移至24孔培养板,补加ht培养基,2ml/孔,培养3天。
32.重复筛选24孔板中各细胞株,剔除不是阳性结果的培养孔细胞,获得阳性结果较好的培养孔细胞。将这些24孔培养板得到的阳性孔细胞采用有限稀释法进行亚克隆筛选,即将有限稀释法得到细胞液加入96孔培养板中转移至co2培养箱培养11天,待克隆细胞直径为1-2mm时,重复进行细胞筛选。根据检测结果,每个亚克隆细胞株,选取4个生长良好的单克隆阳性培养孔,并转移至24孔板中继续培养。一段时间后再次筛选24孔板中克隆得到的阳性克隆细胞株,即为分泌特定单克隆抗体的杂交瘤细胞株2c10d5h11。将此细胞株转入t-75培养瓶中扩增至对数生长期保种或进行后续实验。
33.实施例3体外培养法制备单克隆抗体
34.一、体外培养
35.获得稳定的杂交瘤细胞系后,主要采用体外培养法获取单抗。
36.以含10%胎牛血清的dmem完全培养基培养杂交瘤细胞,然后低速离心后收集培养上清,4℃储存备用。
37.二、单克隆抗体的纯化
38.用rprotein a sepharose fast flow(ge公司)亲和层析柱纯化抗体:
①
装柱,将购买的proteina填料适量装于重力层析柱中用平衡缓冲液(含1.5mnacl的0.1m tris溶液,ph7.0)冲洗至平衡;
②
上样,将经过0.22μm滤膜过滤的细胞上清加入装好的层析柱中,控制流速1滴/秒;
③
平衡,上完样液后使用平衡缓冲液冲洗至平衡;
④
洗脱,加入洗脱缓冲液(0.1m柠檬酸溶液,ph4.5)冲洗柱子并收集洗脱液;
⑤
再生,洗脱完成后加入平衡缓冲液冲洗柱子至平衡,2倍柱体积的20%乙醇冲洗后置于4℃保存。最后采用sds-page法鉴定抗体纯度。结果见图1,纯化后prl单克隆抗体的聚丙烯酰胺凝胶电泳图,纯度达95%以上,紫外微量分光光度计法测定抗体浓度,浓度达到3.0mg/ml以上。
39.实施例4单克隆抗体特性鉴定
40.一、亚型鉴定
41.将抗原蛋白稀释成1μg/ml包被酶标板,每孔加100μl,4℃包被过夜,倾空液体,用含0.05%tween的pbs(pbs-t)洗板3次,每孔加入200μl封闭液(含2%bsa的pbs-t溶液),37℃孵育1h。倾空液体,用pbs-t清洗3次。每孔加入稀释5倍的0.1ml杂交瘤细胞株培养液上清,37℃孵育1h。倾空液体,用pbs-t清洗3次。用封闭液1:400稀释hrp标记的羊抗鼠(κ,λ,igm,igg1,igg2a,igg2b,igg3,iga)抗体(southern biotech公司),每孔分别加入0.1ml,37℃孵育1h。倾空液体,用pbs-t清洗3次。每孔加100μltmb(湖州英创生物科技有限公司)底物(a、b等体积混合溶液)进行显色,室温反应15min,每孔加入50μl 1n hcl溶液终止显色反应,然后酶标仪测定450nm波长下的od值。结果显示,本发明单克隆抗体为igg1型鼠源单克隆抗体。
42.二、亲和常数测定
43.包被prl蛋白,包被浓度为100μg/ml,100μl/孔,4℃包被过夜,pbs-t洗3次。每孔加200μl封闭液37℃封闭1h,pbs-t洗3次。实施例3中纯化的单克隆抗体,稀释成以下浓度(单位:ng/ml):2000、500、125、62.5、31.25、15.625、3.125、0.625,37℃孵育1h,pbs-t洗3次。hrp标记的羊抗鼠二抗1:5000稀释,每孔100μl,37℃孵育1h,pbs-t洗3次。每孔加入100μl tmb(湖州英创生物科技有限公司)显色液,显色13min,加100μl 1.0n盐酸溶液终止反应。用酶标仪测定波长450nm的吸光值。画出od值对应抗体稀释倍数的曲线,找出1/2“平台od值”对应的抗体浓度a。利用下列公式计算出亲和常数为5.63
×
109。
[0044][0045]
实施例5组织芯片染色和鉴定
[0046]
一、组织蜡块制备
[0047]
对样本组织进行he切片染色,以确定肿瘤病变部位。对病变位点画圈,预备打孔。制作受体蜡块时,将塑料架置于模具上,将融化的石蜡(熔点在56~58℃)倒入模具,将组织
块放入模具中的蜡液中后再加入适量蜡液使组织块完全包埋在蜡液中,冷却至室温后将模具放入-20℃冰箱6min,将蜡块从模具中取出,切片或放入4℃冰箱内保存备用。修片后进行连续切片,厚度定为4μm,将连续切片漂40%酒精中,让其自然展开,再将分开的切片转移到45℃的温水中展片30秒,用经2%apes丙酮液处理过的载玻片裱贴切片,将制成的组织芯片放入60℃烤箱内烤片2小时,取出室温冷却,放入-4℃冰箱保存。
[0048]
二、ihc染色及分析
[0049]
常规二甲苯脱蜡3次,每次6分钟,100%、100%、95%、95%、85%梯度乙醇中水化,每次3分钟,最后自来水冲洗。进行抗原修复,然后将切片放入湿盒中,pbs冲洗3
×
3分钟。滴加3%h2o2孵育10分钟,pbs冲洗3
×
3分钟。甩去pbs,滴加过氧化物酶阻断剂室温孵育10分钟。甩干切片,滴加适当比例稀释的一抗(首次稀释根据抗体浓度来设计抗体的稀释比例)室温(25℃)孵育1小时,pbs冲洗3
×
3分钟,滴加二抗室温孵育30分钟,pbs冲洗3
×
3分钟,甩去pbs,用新鲜配置的dab显色液显色3-10分钟。苏木素复染20秒,pbs返蓝。按照85%(3分钟)、95%(3分钟)、95%(3分钟)、100%(3分钟)、100%(3分钟)的酒精梯度依次脱水,最后两次二甲苯透明10分钟,中性树胶封片。
[0050]
免疫组化染色结果分为:阳性和阴性。阳性表达必须在细胞和组织特定的抗原部位才能视为阳性。在组织染色分布清晰及细胞定位准确的情况下,染色结果根据染色强度的差异进行进一步划分,具体如下:
[0051]
1、样本为弱阳性;标记为“+”;
[0052]
2、样本为中度阳性;标记为“++”;
[0053]
3、样本为高度阳性;标记为“+++”。
[0054]
4、样本为阴性,标记为
“‑”
。
[0055]
三、样本检测结果:
[0056]
用本发明所制备的抗prl蛋白单克隆抗体(2c10d5h11)和市售抗prl蛋白单克隆抗体(兔多抗)在9例结垂体瘤进行同步检测,结果如下表所示
[0057][0058]
结果显示:抗prl蛋白单克隆抗体(2c10d5h11)的染色定位准确,染色清晰且无非特异性染色,背景干净,说明抗prl蛋白单克隆抗体(2c10d5h11)特异性强。在9例垂体瘤中,使用抗prl蛋白单克隆抗体(2c10d5h11)的阳性率虽然与市售抗体阳性率相当,但阳性细胞数和阳性强度均高于使用对照试剂,说明抗prl蛋白单克隆抗体(2c10d5h11)对垂体瘤的鉴别诊断相对市售抗体更具敏感度,可避免结垂体瘤漏检的风险。图2为垂体瘤免疫组化染色结果图;其中左为2c10d5h11分泌的的prl,右为市售prl(兔多抗)。
[0059]
而采用抗prl蛋白单克隆抗体(2c10d5h11)和对照抗体(兔多抗),在30种正常组织芯片上进行同步检测,样本阳性和阴性结果一致,说明本抗体在市售组织的特异性同市售抗体相当。
[0060]
30种正常组织包括:大脑、心脏、小脑、食管、肾上腺、胃、卵巢、小肠、胰腺、结直肠、
甲状旁腺、肝脏、垂体、唾液腺、睾丸、肾、甲状腺、前列腺、乳腺、子宫、脾、膀胱、扁桃体、骨骼肌、胸腺(幼儿)、皮肤、骨髓、外周神经、肺、间皮细胞。
