用于牛膝及川牛膝药材、标准汤剂及中药配方颗粒多重pcr鉴别的引物及其应用
技术领域
1.本发明涉及中药鉴别技术领域,尤其涉及一种用于牛膝及川牛膝药材、标准汤剂及中药配方颗粒多重pcr鉴别的引物及其应用。
背景技术:
2.牛膝为苋科植物牛膝achyranthes videntata bi.的干燥根,有逐瘀通经、补肝肾、强筋骨、利尿通淋、引血下行功效,用经闭、痛经、腰膝酸痛、筋骨无力、淋证、水肿、头痛、眩晕、牙痛、口疮、吐血、衄血。川牛膝为苋科植物川牛膝cyathula officinalis kuan的干燥根,有逐瘀通经、通利关节、利尿通淋功效,用于经闭癥瘕、胞衣不下、跌打损伤、风湿痹痛、足痿筋挛、尿血血淋。牛膝与川牛膝外形相似,但功效差异较大,川牛膝无滋补肝肾功效。牛膝和川牛膝配方颗粒是经水加热提取后制得,采用传统鉴别方法对二者在失去药材性状后,难以进行有效的质量控制,质量控制的风险较大,亟需解决提取物在失去饮片外形特征后的真伪优劣评价问题。
技术实现要素:
3.本发明所要解决的技术问题在于,提供一种用于牛膝及川牛膝药材、标准汤剂及中药配方颗粒多重pcr鉴别的引物,其可有效鉴别牛膝及川牛膝。
4.本发明还要解决的技术问题在于,提供一种上述引物的应用。
5.本发明还要解决的技术问题在于,提供一种基于上述引物的鉴别方法。
6.为了解决上述技术问题,本发明提供了一种用于牛膝及川牛膝药材、标准汤剂及中药配方颗粒多重pcr鉴别的引物,其包括第一引物对和第二引物对;
7.其中,所述第一引物对的上游引物的序列如seq id no:1所示,其下游引物的序列如seq id no:2所示;
8.所述第二引物对的上游引物的序列如seq id no:3所示,其下游引物的序列如seq id no:4所示。
9.相应的,本发明还公开了一种上述引物在(1)或(2)中的应用:
10.(1)鉴别待测样品是否为牛膝和/或川牛膝;
11.(2)制备用于鉴别牛膝和/或川牛膝的试剂盒。
12.作为上述技术方案的改进,所述牛膝为药材、标准汤剂或中药配方颗粒,所述川牛膝为药材、标准汤剂或中药配方颗粒。
13.相应的,本发明还公开了一种上述引物在(1)或(2)中的应用:
14.(1)鉴别待测样品是否含有牛膝和/或川牛膝;
15.(2)制备用于鉴别待检测样品是否含有牛膝和/或川牛膝的试剂盒。
16.相应的,本发明还公开了一种试剂盒,其包括如上述的引物。
17.作为上述技术方案的改进,还包括pcr预混液。。
18.相应的,本发明还公开了一种基于上述的用于牛膝及川牛膝药材、标准汤剂及中药配方颗粒多重pcr鉴别的引物的鉴别方法,其包括:
19.提取待检测样品的基因组dna;
20.以所述基因组dna为模板,采用上述的引物进行pcr扩增,若扩增产物中含有160-170bp的dna条带,则待检测样品含有川牛膝药材、川牛膝标准汤剂和/或川牛膝中药配方颗粒;
21.若扩增产物中含有180-190bp的dna条带,则待检测样品含有牛膝药材、牛膝标准汤剂和/或牛膝中药配方颗粒。
22.作为上述技术方案的改进,提取待检测样品的基因组dna的方法如下:
23.取待检测样品,加入ctab沉淀液、蛋白酶k沉淀提取2~3次;取沉淀物加入ctab提取液、β-巯基乙醇提取,然后加入氯仿-异戊醇萃取2~3次;取萃取后上清液,加入异丙醇或异丙醇-乙酸钠沉淀提取,沉淀物经洗涤、孵育后用水溶解,即得待检测样品的基因组dna。
24.作为上述技术方案的改进,提取待检测样品的基因组dna的方法如下:
25.取待检测样品0.03~0.08g,研磨成粉末,置离心管中,加入1~1.8ml的ctab沉淀液、15~25μl蛋白酶k,混合均匀,在50~60℃下加热45~65min,冷却至室温后离心,弃去上清液;加入800~1000μl ctab沉淀液、15~25μl蛋白酶k,混合均匀,在50~60℃下加热45~65min,冷却至室温后离心,弃去上清液;取沉淀加入800~1000μl ctab提取液,5~15μlβ-巯基乙醇,混合均匀,在60~70℃加热100~150min,冷却至室温后取上清液,加入等体积的氯仿-异戊醇混合液,震荡混匀后离心,取上清液700~800μl,再加入等体积的氯仿-异戊醇混合液,震荡混匀后离心,取上清液400~500μl,加入等体积的异丙醇或异丙醇-乙酸钠混合液,于-30~-20℃静置30~60min,离心后弃去上清液,再用乙醇洗涤沉淀2~4次,弃去上清液,沉淀于35~38℃孵育20~40min,待乙醇挥发后,加入30~50μl灭菌水溶解,即得到待检测样品的基因组dna。
26.作为上述技术方案的改进,所述ctab沉淀液包括ctab、tris-hcl、edta和水;其中,ctab的浓度为1~3%(w/v),tris-hcl的浓度为80~120mmol/l,edta的浓度为10~30mmol/l;
27.所述ctab提取液包括ctab、tris-hcl、edta、nacl、pvp40和水;其中,ctab的浓度为1~3%(w/v),tris-hcl的浓度为80~120mmol/l,edta的浓度为10~30mmol/l;nacl的浓度为1~3mol/l,pvp40的浓度为10~30%(w/v)。
28.作为上述技术方案的改进,将模板、引物、pcr预混液、水混合均匀,得到pcr扩增体系;
29.将所述pcr扩增体系按照预设扩增程序进行扩增,得到扩增产物;
30.将所述扩增产物进行电泳分析,记录其电泳图谱,若图谱中含有164bp的dna条带,则待检测样品含有川牛膝药材、川牛膝标准汤剂和/或川牛膝中药配方颗粒;
31.若图谱中含有187bp的dna条带,则待检测样品含有牛膝药材、牛膝标准汤剂和/或牛膝中药配方颗粒。
32.作为上述技术方案的改进,所述pcr扩增体系由下述物质组成:
33.pcr预混液12.5μl;第一引物对上游引物、下游引物各0.3μl,第二引物对的上游引物、下游引物各0.3μl,模板1μl,ddh2o 10.3μl。
34.作为上述技术方案的改进,所述pcr扩增程序为:
35.将所述扩增体系在92~95℃预变性4~6min,然后在预设程序下循环35~45次,最后在71~75℃延伸4~6min;
36.其中,所述预设程序为:将扩增体系在94~96℃变性28~32s,然后在60~62℃退火26~32s,再在70~73℃延伸28~35s。
37.作为上述技术方案的改进,所述pcr扩增程序为:
38.将所述扩增体系在95℃预变性5min,然后在预设程序下循环40次,最后在72℃延伸5min;
39.其中,所述预设程序为:将扩增体系在95℃变性30s,然后在61℃退火30s,再在72℃延伸30s。
40.作为上述技术方案的改进,所述电泳分析方法为:将所述扩增产物稀释后点样于1.5~2%的琼脂糖凝胶上,于145~160v电压条件下电泳45~60min,经gelred显色,得到电泳图谱。
41.实施本发明,具有如下有益效果:
42.1,本发明的引物,可进行多重位点特异性pcr反应,有效鉴别牛膝及川牛膝,其效率高,检测精度高。
43.2,本发明中的引物、鉴别方法,可有效克服dna提取过程中辅料干扰的问题,且可解决标准汤剂、中药配方颗粒在失去形态后难以鉴别的难题。
附图说明
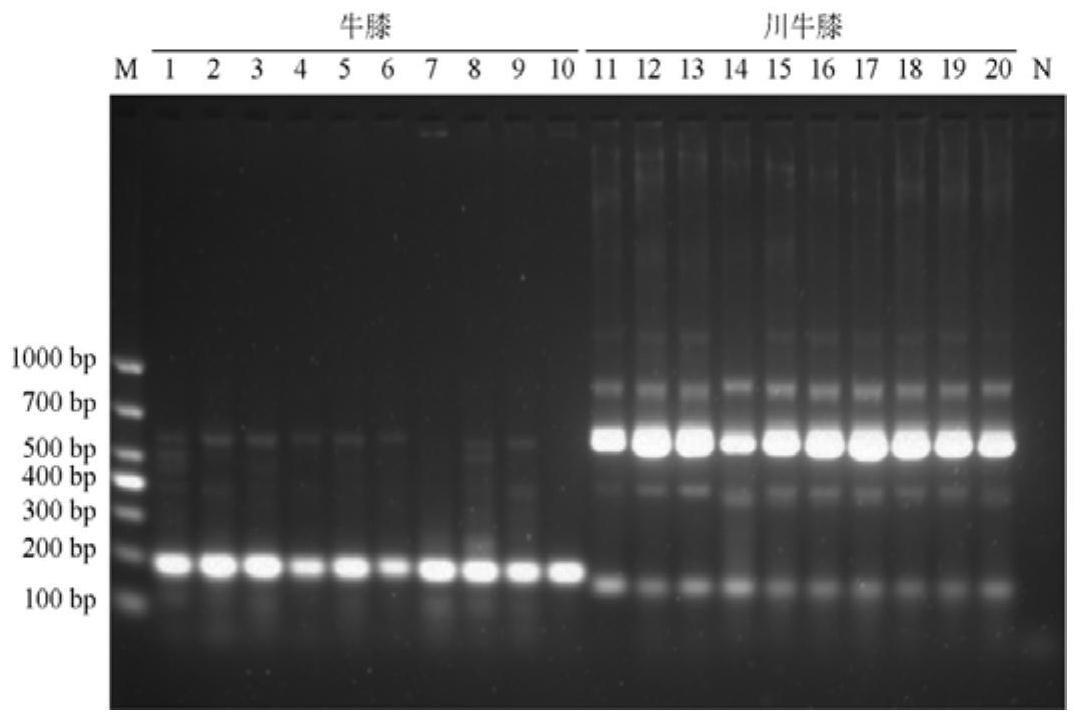
44.图1是实施例3中牛膝及川牛膝样品多重pcr扩增后电泳检测结果图;其中,m为dna分子量标准,1-10为牛膝药材,11-20为川牛膝药材,n为为空白对照(ddh2o);
45.图2是实施例3中牛膝及川牛膝样品多重pcr扩增后电泳检测结果图;其中,m为dna分子量标准,21-30为牛膝标准汤剂(冻干粉),31-40为川牛膝标准汤剂(冻干粉),n为空白对照(ddh2o);
46.图3是实施例3中牛膝及川牛膝样品多重pcr扩增后电泳检测结果图;其中,m为dna分子量标准,41-50为牛膝配方颗粒,51-60为川牛膝配方颗粒,n为空白对照(ddh2o)。
具体实施方式
47.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图及具体实施方式对本发明作进一步地详细描述。
48.本发明提供一种用于牛膝及川牛膝药材、标准汤剂、中药配方颗粒多重pcr鉴别的引物,其包括第一引物对和第二引物对,其具体序列如下表所示:
[0049][0050]
[0051]
上述引物可在同一pcr反应体系中进行多重pcr反应,其相互之间无干扰,易于扩增。
[0052]
基于上述特性,本发明中的引物可实现以下应用:
[0053]
(1)鉴别待检测样品是否为牛膝的药材、标准汤剂、中药配方颗粒;或川牛膝的药材、标准汤剂、中药配方颗粒。
[0054]
(2)鉴别待检测样品是否含有牛膝和/或川牛膝。
[0055]
(3)制备用于鉴别牛膝和/或川牛膝的试剂盒。
[0056]
(4)制备用于鉴别待检测样品是否含有牛膝和/或川牛膝的试剂盒。
[0057]
相应的,本发明公开了一种试剂盒,其包括上述引物,还包括pcr预混液和水。其中,pcr预混液可选用2
×
pfu pcr mix(天根生化科技(北京)有限公司,kp201),但不限于此。
[0058]
本发明还公开了一种基于引物的鉴别方法,其包括:
[0059]
一、提取待检测样品的基因组dna;
[0060]
其中,待检测样品以固态形式提供,标准汤剂以冻干粉的形式提供(即将标准汤剂冷冻干燥后得到冻干粉)。
[0061]
具体的,提取方法如下:
[0062]
(一)取待检测样品,加入ctab沉淀液、蛋白酶k沉淀提取2~3次,得到沉淀物;
[0063]
具体的,取待检测样品0.03~0.08g,研磨成粉末,置离心管中,加入1~1.8ml的ctab沉淀液、15~25μl蛋白酶k,混合均匀,在50~60℃下加热45~65min,冷却至室温后离心,弃去上清液;加入800~1000μl ctab沉淀液、15~25μl蛋白酶k,混合均匀,在50~60℃下加热45~65min,冷却至室温后离心,弃去上清液,即得。
[0064]
其中,ctab沉淀液的组成为2%(w/v)ctab,100mmol/l tris-hcl(ph=8.0),20mmol/l edta(ph=8.0)。
[0065]
(二)取沉淀物加入ctab提取液、β-巯基乙醇提取;然后加入氯仿-异戊醇萃取2~3次,得萃取后上清液;
[0066]
具体的,在沉淀物加入800~1000μl ctab提取液,5~15μlβ-巯基乙醇,混合均匀,在60~70℃加热100~150min,冷却至室温后取上清液,加入等体积的氯仿-异戊醇(24:1)混合液,震荡混匀后离心,取上清液700~800μl,再加入等体积的氯仿-异戊醇(24:1)混合液,震荡混匀后离心,取上清液400~500μl,即得。
[0067]
需要说明的是,在本步骤中,在采用ctab提取液、β-巯基乙醇提取结束后,可直接加入氯仿-异戊醇,也可取提取后所得上清液再加入氯仿-异戊醇,取上清液再加入氯仿-异戊醇可提升提取准确度。
[0068]
其中,ctab提取液:1~3%(w/v)ctab,80~120mmol/l tris-hcl(ph=8.0),10~30mmol/l edta(ph=8.0),1~3mol/lnacl,10~30%(w/v)pvp40。
[0069]
(三)取提取液加入异丙醇或异丙醇-乙酸钠沉淀提取,沉淀物经洗涤、孵育后用水溶解,即得待检测样品的基因组dna。
[0070]
具体的,取提取液,加入等体积的异丙醇或异丙醇-3mol/l乙酸钠混合液,于-30~-20℃静置30~60min,离心后弃去上清液,再用乙醇洗涤沉淀2~4次,弃去上清液,沉淀于35~38℃孵育20~40min,待乙醇挥发后,加入30~50μl灭菌水溶解,即得到待检测样品
的基因组dna。
[0071]
需要说明的是,申请人在面临牛膝/川牛膝标准汤剂、牛膝/川牛膝中药配方颗粒中基因组dna提取时,尝试了传统的ctab法、螯合树脂法、曲拉通-100法、sds法、碱式裂解法、dneasy blood&tissue kit法、磁珠法,但均得到了不溶性沉淀。故,本发明人在传统ctab法的基础上,对ctab沉淀液、ctab提取液以及提取程序加以改进,得到了上述提取方法。上述提取方法尽量多地保留牛膝/川牛膝标准汤剂、牛膝/川牛膝中药配方颗粒中的基因组dna信息,同时可克服辅料干扰的问题。
[0072]
二、形成pcr扩增体系,并进行扩增,得到扩增产物;
[0073]
具体的,将模板、引物、pcr预混液、水混合均匀,得到pcr扩增体系;
[0074]
更具体的,pcr扩增体系的总体积为25μl,其包括:pcr预混液12.5μl;第一引物对的上游引物、下游引物各0.3μl,第二引物对的上游引物、下游引物各0.3μl,模板1μl,ddh2o 10.3μl。
[0075]
其中,pcr预混液可选用2
×
pfu pcr mix(天根生化科技(北京)有限公司,kp201),但不限于此。
[0076]
扩增程序为:92~95℃预变性4~6min;94~96℃变性28~32s,60~62℃退火26~32s,70~73℃延伸28~35s,循环35~45次;最后在71~75℃延伸4~6min。
[0077]
优选的,扩增程序为:95℃预变性5min,95℃变性30s,61℃退火30s,72℃延伸30s,循环40次,最后在72℃延伸5min。
[0078]
(3)将扩增产物进行分析;
[0079]
具体的,可采用电泳法或荧光染色法对扩增产物进行分析,但不限于此。
[0080]
优选的,采用电泳法对扩增产物进行分析,具体如下:
[0081]
取扩增产物,所述扩增产物稀释后点样于1.5~2%的琼脂糖凝胶上,于145~160v电压条件下电泳45~60min,经gelred显色,得到电泳图谱。
[0082]
若图谱中含有164bp的dna条带,则待检测样品含有川牛膝药材、川牛膝标准汤剂和/或川牛膝中药配方颗粒;若图谱中含有187bp的dna条带,则待检测样品含有牛膝药材、牛膝标准汤剂和/或牛膝中药配方颗粒。
[0083]
下面以具体实施例对本发明进行说明。
[0084]
实施例1引物设计
[0085]
以中国药典2020年版牛膝属药用植物的its、psba-trnh、matk、trnl-trnf等序列分析为基础,利用bioedit软件对genebank数据库中常见牛膝属药用植物的its序列进行同源比对,校对后分析川牛膝的特异性snp位点,将包含snp位点的碱基序列导入到primer premier 5软件中,进行引物设计。
[0086]
经序列对比发现,川牛膝在第70位特异性位点为c,而其他为t,在第204位特异性位点为a,而其他为c或g,确定该snp位点后,使snp位点分别接近正反向引物3’端,通过移动上游引物位置,调节引物得分及gc含量,并借助primer premier 5软件,进一步调节反向引物位置,通过最终引物评分、产物条带得分以确定最佳组合。在设计过程中,还需考虑到经高温提取后,对dna碱基序列的破坏作用。
[0087]
综合以上因素,获得的引物组合如下:
[0088]
nx-f:5
’‑
agcagaatgaccagcgaac-3’;
[0089]
nx-r:5
’‑
ccaggaaatccgagtaagg-3’;
[0090]
cnx-f:5
’‑
gttttcaagggtcctacgagc-3’;
[0091]
cnx-r:5
’‑
gtggggaaaggatgatgg-3’。
[0092]
实施例2鉴定方法建立
[0093]
(1)dna提取及浓度调节
[0094]
取干燥的样品0.05g,研磨成粉末,置于2ml离心管中,加入1.5ml在56℃预热的ctab沉淀液、20μl蛋白酶k,混匀,56℃水浴加热60min,冷却至室温后,以10000r/min离心5min,弃上清液,再加入900μl ctab沉淀液、20μl蛋白酶k,同法操作。向该离心管中依次加入900μl ctab提取液、10μlβ-巯基乙醇,混匀,65℃水浴加热120min,离心,待冷却至室温后取上清液;加入等体积的氯仿-异戊醇(24﹕1),震荡3min,混匀;再以12000r/min,4℃离心10min,取上清液750μl加入新的2ml离心管中,加入等体积的氯仿-异戊醇(24﹕1),震荡3min,混匀,12000r/min,4℃离心10min;再取上清液450μl于1.5ml离心管中,加入等体积异丙醇,于-20℃静置30~60min。取出该离心管以12000r/min离心5min,弃上清液,再分别用75%乙醇及无水乙醇洗涤沉淀两次,弃上清液,沉淀于37℃孵育30min,待乙醇挥发后,加灭菌水30μl使溶解。
[0095]
其中,ctab沉淀液组成如下:2%(w/v)ctab(上海源叶生物科技有限公司),100mm tris-hcl(ph=8.0)(beijing solarbio),20mm edta(ph=8.0)(shanghai yu bo biotech co.,ltd)。
[0096]
ctab提取液组成如下:2%(w/v)ctab(上海源叶生物科技有限公司),100mm tris-hcl(ph=8.0)(beijing solarbio),20mm edta(ph=8.0)(shanghai yu bo biotech co.,ltd),2.5mol/l nacl(西陇科学股份有限公司),20%pvp40(上海源叶生物科技有限公司)。
[0097]
取上述dna样品,采用biospec-nano微量紫外分光光度计测定dna浓度,同时记录od260/od230,od260/od280,并调整浓度到100ng/μl,得到dna模板。
[0098]
(2)设计引物
[0099]
引物序列如seq id no:1~6所示。
[0100]
(3)pcr扩增
[0101]
pcr扩增体系:2
×
pfu pcr mix(天根生化科技(北京)有限公司,kp201)12.5μl,10μmol/l的nx-f引物0.3μl,10μmol/l的nx-r引物0.3μl,10μmol/l的cnx-f引物0.3μl,10μmol/l的cnx-r引物0.3μl,100ng/μl的dna模板1μl,去离子水10.3μl。上述液体振荡混匀,瞬时离心,即得pcr扩增体系。
[0102]
pcr扩增程序:95℃预变性5min;95℃变性30s,61℃退火30s,72℃延伸30s,共40个循环;最后72℃延伸5min。
[0103]
(4)电泳检测
[0104]
取扩增产物,加入6
×
loading buffer 5μl,混匀,取混合产物6μl点样于2%的琼脂糖凝胶上,于150v电压的条件下电泳45min,经gelred显色,最后于凝胶成像仪观察记录结果。
[0105]
若图谱中含有164bp的dna条带,则待检测样品含有川牛膝药材、川牛膝标准汤剂和/或川牛膝中药配方颗粒;若图谱中含有187bp的dna条带,则待检测样品含有牛膝药材、牛膝标准汤剂和/或牛膝中药配方颗粒。
[0106]
实施例3鉴定方法验证
[0107]
取不同产地、不同样品形态的牛膝、川牛膝样品60批次。采用实施例2建立的鉴别方法对样品进行鉴定。
[0108]
鉴定结果如图1、图2所示,从图中可以看出,牛膝药材、牛膝标准汤剂(冻干粉)、牛膝中药配方颗粒均存在187bp的条带;而川牛膝样品并无该条带。从图中可以看出,川牛膝药材、川牛膝标准汤剂(冻干粉)、川牛膝中药配方颗粒以均存在164bp的条带;而牛膝样品均未得到该条带。该结果表明,本发明中的鉴别方法准确率达到100%。
[0109]
以上所述是发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
[0110]
[0111]
