一种新型的表达cxcl10的复制型溶瘤腺病毒和应用
技术领域
1.本发明涉及溶瘤腺病毒领域,具体涉及一种新型的表达cxcl10的复制型溶瘤腺病毒和应用。
背景技术:
2.pd-1是t细胞免疫检查点之一,能够作为负性调控因子调节t细胞的功能。尽管抗pd-1治疗对肿瘤治疗产生了重要的影响,但是它在临床的响应能力仍然有限。研究表明,抗pd-1治疗的有效率与肿瘤患者的基因微卫星状态、肿瘤微环境(tme)中免疫细胞浸润情况、ifn-γ信号等等相关。以晚期结直肠癌(mcrc)为例,单药pd-1治疗仅提高了微卫星高度不稳定(msi-h)患者的客观缓解率,但对微卫星稳定(mss)患者效果甚微。然而,大部分的mcrc患者为mss型,这意味着他们可能对pd-1单药治疗无效。因此寻找能够增加pd-1单抗疗效的联合治疗方法显得尤为重要。
3.以往多项研究均表明,tme中cxcr3及配体相关信号对于肿瘤预后和pd-1疗效响应有积极作用。cxcr3是一种表达于细胞毒性淋巴(ctl)、nk细胞、nkt细胞、dc细胞和b细胞等的趋化因子受体,可以受其配体cxcl9/10/11趋化,到达指定部位发挥作用。血清cxcr3可以作为一个预测pd-1疗效的生物标志物,而外源性地增加瘤内cxcl9/10浓度,可以促进tme中cxcr3+t细胞比例增加,协同pd-1抗体产生更加强的抑制肿瘤生长作用。此外,一些其他的研究也表明,瘤内cxcl10信号与免疫检查点疗效呈正相关,其机制在于瘤内cxcl10信号使得更多的cxcr3+t细胞出现在tme中,使肿瘤从免疫细胞浸润较少的“冷”肿瘤成为了有较多效应免疫细胞浸润的“热”肿瘤,从而增强了pd-1抗体的抗肿瘤作用。以上证据说明了cxcr3及其配体在免疫检查点治疗中的重要作用,而瘤内高浓度的趋化因子维持又是其中的重点。
4.然而趋化因子在体内半衰期较短,cxcl10也因为这个原因,被限制了其作为药物直接使用的潜力。因此使cxcl10等趋化因子能长效地在tme中表达、维持高浓度梯度并持续招募cxcr3+t细胞的策略有待开发。
5.近年来,溶瘤病毒正作为一种新兴的肿瘤生物治疗药物被广泛地研究,从机制上讲,溶瘤病毒可以直接裂解肿瘤细胞,也可以在裂解细胞的同时使得肿瘤释放肿瘤相关抗原(taa)、病原相关分子模式(pamps)信号、危险相关分子模式(damps)信号等,诱发机体产生天然免疫和适应性免疫攻击肿瘤细胞。更值得一提的是,溶瘤病毒也可以作为一种出色的外源基因载体应用于抗肿瘤治疗,而趋化因子就是一种常见的被插入病毒中的外源基因,因为他们可以用来招募免疫细胞。例如非常著名的溶瘤病毒t-vec,就是将粒细胞-巨噬细胞集落刺激因子(gm-csf)装入了改良后的单纯疱疹病毒,在2015年已被fda批准上市。
6.结合以上几点我们设想,可以构建一种新型的重组溶瘤病毒,将cxcl10插入其中通过瘤内注射实现cxcl10在tme的持续表达以招募更多效应t细胞,达到更好的肿瘤杀伤作用和协同抗pd-1等抗免疫检查点治疗的抗肿瘤作用。
技术实现要素:
7.1.发明目的:
8.本发明的目的是提供一种可以增加肿瘤微环境(tme)中cxcr3
+
t细胞浸润的新型溶瘤腺病毒,能够直接杀伤肿瘤的同时使cxcl10持续在tme中表达的复制型溶瘤腺病毒和相应应用。
9.2.技术方案:
10.本发明目的是通过下列技术方案实现的:
11.一种表达cxcl10的复制型溶瘤腺病毒,其特征在于,含有鼠源的或人源或cxcl10,其中鼠源的cxcl10的核苷酸序列为seq id no.1,人源的cxcl10核苷酸为seq id no.2。
12.装载cxcl10基因的腺病毒穿梭质粒ad5-pshuttle-cmv-e1a-ef1a-cxcl10,线性化后转染padeasy-bj5183,获得adv-cxcl10全长质粒,adv-cxcl10全长质粒线性化转染293t细胞,培养,离心,收集上清,纯化获得表达cxcl10的复制型溶瘤腺病毒,其中所述的ad5-pshuttle-cmv-e1a-ef1a-cxcl10核苷酸序列为seq id no.3。
13.所述的一种表达cxcl10的复制型溶瘤腺病毒在制备抗肿瘤药物中的应用。
14.所述的肿瘤为结直肠癌、黑色素瘤、肝癌、胃癌、食管癌、肺癌、卵巢癌、乳腺癌、脑胶质瘤。
15.本发明所述的新型的表达cxcl10的复制型溶瘤腺病毒,所述的复制型溶瘤腺病毒可以溶瘤。
16.本发明所述的新型的表达cxcl10的复制型溶瘤腺病毒在制备活化肿瘤微环境药物中的应用。
17.本发明所述的新型的表达cxcl10的复制型溶瘤腺病毒在协同其他免疫治疗药物中的应用。
18.本发明所述的新型的表达cxcl10的复制型溶瘤腺病在制备刺激ifn-γ表达药物中的应用。
19.本发明所述的新型的表达cxcl10的复制型溶瘤腺病在制备刺激granzyme b表达药物中的应用。
20.本发明一种新型的表达cxcl10的复制型溶瘤腺腺病毒的构建方法,通过质粒构建、病毒拯救于病毒扩增三个步骤实现。
21.本发明原理:
22.本发明的一种可以表达并分泌趋化因子cxcl10并增加tme中cxcr3
+
t细胞浸润的新型复制型重组溶瘤腺病毒,所述的新型复制型溶瘤腺病毒在肿瘤细胞内复制,并且表达和分泌趋化因子cxcl10,所述的cxcl10可以招募外周cxcr3
+
t细胞,增加tme中cxcr3
+
t细胞的比例;所述的新型溶瘤腺病毒可以增加瘤内ifn-γ、granzyme b的浓度,最终克服pd-1单抗的耐药问题,增加pd-1单抗的抗肿瘤效果。
23.有益效果
24.本发明中的新型复制型溶瘤腺病毒adv-cxcl10具有直接杀伤肿瘤作用,且能够持续地在瘤内表达cxcl10,能够趋化更多的cxcr3
+
t细胞进入tme,并且诱导tme表达更多的ifn-γ和granzyme b,同与pd-1单抗联用显著抑制肿瘤增长,具有出色的抗肿瘤作用,是用来制备抗肿瘤药物的优秀原材料,也可以作为肿瘤化疗、免疫治疗的优秀辅助材料。具体而
言:
25.(1)adv-cxcl10所表达的cxcl10可以持续性地在肿瘤微环境中表达,从而解决了直接给予重组趋化因子导致因体内半衰期短而难以长时间维持药效的问题,起到长期建立肿瘤内持续高浓度cxcl10梯度的作用。
26.(2)adv-cxcl10所表达并分泌的cxcl10可以趋化并活化外周血中的cxcr3
+
t细胞进入tme,从而使tme呈现出免疫杀伤状态,且联合免疫检查点抑制剂如pd-1抗体共同使用时,能够诱导tme中ifn-γ和granzyme b介导的免疫活化,从而增强免疫浸润,解决了tme免疫浸润少而导致的pd-1单抗单药不敏感的问题,起到更强的杀伤肿瘤的作用,有望攻克多数肿瘤患者对pd-1单抗单药不敏感的临床壁垒。
27.(3)adv-cxcl10可以通过对肿瘤细胞直接溶瘤作用诱导产生免疫原性的细胞死亡,并且促使肿瘤相关抗原的释放,从而进一步活化和趋化免疫细胞,使得肿瘤细胞对免疫细胞的攻击更加敏感。
28.(4)adv-cxcl10作为溶瘤病毒可以在肿瘤细胞中特异性复制,又不损伤正常体细胞,规避了溶瘤病毒作为生物药物对机体可能造成的副反应。
29.(5)本发明的新型的表达cxcl10的复制型溶瘤腺病毒adv-cxcl10可以在肿瘤内持续表达cxcl10并形成局部高cxcl10浓度梯度,具有强大的趋化cxcr3
+
t细胞进入肿瘤微环境中的作用,并且可以诱导ifn-γ、granzyme b的表达增加,动物模型中与pd-1抗体联用明显增强了pd-1抗体的抗肿瘤效果,具有很强的活化免疫微环境和协同抗肿瘤作用,可以用来制备抗肿瘤药物。
附图说明
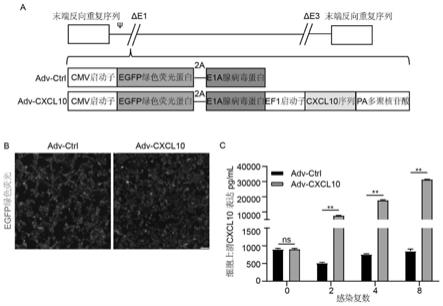
30.图1为本发明的表达cxcl10的重组溶瘤腺病毒的构建(a)重组溶瘤腺病毒adv-ctrl(对照病毒)、adv-cxcl10(本发明所述病毒)基因结构示意图。(b)使用moi=5感染293t细胞48h的细胞荧光表达。(c)使用moi=0、2、4、8的adv-ctrl或adv-cxcl10感染mc38-car细胞,48h后收集细胞上清,通过elisa法检测上清中cxcl10的表达和分泌。数据代表三次独立性重复实验。数据表示为mean
±
sem,*p《0.05,**p《0.01,ns,无统计学差异,比例尺:100μm。
31.图2为本发明的表达cxcl10的重组溶瘤腺病毒adv-cxcl10的复制能力和溶瘤能力(a)使用moi=10的adv-ctrl或adv-cxcl10感染mc38-car细胞,12、24、48、72、96、120h后收取细胞,提取病毒基因组dna,通过qpcr检测病毒的拷贝数。(b)使用moi=0、5、10、20、40、80的adv-ctrl或adv-cxcl10感染mc38-car细胞,在48h收集细胞并进行cck8检测肿瘤细胞的活性。(c)使用moi=0、5、10、20、40、80的adv-ctrl或adv-cxcl10感染mc38-car细胞,在48、72、96h收集细胞并进行结晶紫染色检测病毒的体外溶瘤效果。数据表示为mean
±
sem,*p《0.05,**p《0.01,ns,无统计学差异。
32.图3为本发明的表达cxcl10的重组溶瘤腺病毒adv-cxcl10在mc38-car结肠癌模型中活化免疫的作用(a)在mc38-car小鼠结肠癌模型中评估adv-cxcl10趋化cxcr3
+
t细胞进入肿瘤微环境的实验流程图。c57bl/6小鼠右侧胁肋部皮下注射106个mc38-car细胞,待肿瘤长至50-100mm3左右时随机分组,每组6只,并进行瘤内注射pbs、adv-ctrl或adv-cxcl10治疗。在第三次注射结束后2天进行小鼠血清、肿瘤收集。(b)对小鼠外周血血清、小鼠肿瘤组织匀浆进行elisa检测,分析cxcl10的表达和分泌。(c-d)对肿瘤组织进行切片和免疫荧
光(if)染色,检测tme中cd4、cd8的表达。(e-g)研磨肿瘤组织并制成单细胞悬液、提取肿瘤浸润淋巴细胞(tils)进行流式细胞术,检测cxcr3
+
t细胞的比例变化。数据表示为mean
±
sem,*p《0.05,**p《0.01,ns,无统计学差异,比例尺:100μm。
33.图4为本发明的表达cxcl10的重组溶瘤腺病毒adv-cxcl10协同pd-1抗体在mc38-car结肠癌模型中的免疫活化作用。(a)在mc38-car小鼠结肠癌模型中评估adv-cxcl10协同pd-1抗体趋化cxcr3
+
t细胞进入肿瘤微环境激活免疫的实验流程图。c57bl/6小鼠右侧胁肋部皮下注射106个mc38-car细胞,待肿瘤长至50-100mm3左右时随机分组,每组6只,共6组,单药组进行瘤内注射pbs、adv-ctrl或adv-cxcl10治疗,联用组增加腹腔pd-1抗体注射治疗。在治疗结束后1周进行肿瘤收集。(b-e)对肿瘤组织进行切片和免疫荧光(if)染色,检测tme中cd4、cd8的表达。(f-i)研磨肿瘤组织并制成单细胞悬液、提取肿瘤浸润淋巴细胞(tils)进行流式细胞术,检测cxcr3
+
t细胞的比例变化。(j-k)对肿瘤组织匀浆进行elisa检测,分析ifn-γ、granzyme b的表达和分泌。数据表示为mean
±
sem,*p《0.05,**p《0.01,ns,无统计学差异,比例尺:100μm。
34.图5为本发明的表达cxcl10的重组溶瘤腺病毒adv-cxcl10协同pd-1抗体在mc38-car结肠癌模型中的抗肿瘤作用。(a)mc38-car荷瘤小鼠肿瘤实物图。(b)mc38-car荷瘤小鼠肿瘤生长曲线。(c)mc38-car荷瘤小鼠体重变化。(d-f)mc38-car荷瘤小鼠肿瘤组织增殖、凋亡情况分析。
35.数据表示为mean
±
sem,*p《0.05,**p《0.01,ns,无统计学差异,比例尺:100μm。
具体实施方式
36.通过以下实施例进一步详细说明本发明,但应注意本发明的范围并不受这些实施例的任何限制。
37.实施例1
38.新型表达cxcl10的重组溶瘤腺病毒adv-cxcl10的构建、制备、激活肿瘤微环境作用评估和协同免疫检查点抑制剂pd-1抗体抗肿瘤作用评价
39.1.实验材料和方法
40.1.1实验材料和仪器
41.1.1.1实验细胞系人肾胚细胞株293t、小鼠结肠癌细胞株mc38-car,使用含10%胎牛血清、100 u/i青霉素和1 mg/ml链霉素的高糖dmem培养基培养,在37℃、5%co2的培养箱中培养。
42.1.1.2实验用小鼠
43.实验采用6-8周龄spf级别c57bl/6小鼠,购自维通利华公司,给予无菌水及实验小鼠专用饲料喂养,小鼠均在25℃,无他叔病菌,12 h昼夜交替,自由饮食下饲养及繁殖。
44.1.1.3实验仪器
45.生物安全柜(cat.esco/ac2-4s1)购买自esco(上海)贸易有限公司(上海,中国),thermo scientific水套式二氧化碳培养箱(cat.3111)购买自赛默飞世尔科技(中国)有限公司(上海,中国);高速低温离心机(cat.5424r)购买自eppendorf(hamburg,germany);涡旋仪(mx-s)购买自大龙仪器(北京,中国);多用途旋转摇床(cat.qb-208),平面摇床(cat.ts-1000)购买自海门市其林贝尔仪器制造有限公司(海门,中国);qpcr仪
(cat.c1000)购买自bio-rad(hercules,california);多功能酶标仪(cat.elx808)购买自美国伯腾仪器有限公司(vermont,usa);奥林巴斯普通荧光显微镜(cat.ix51)购买自奥林巴斯(日本);数显水浴锅购买自国华电器有限公司(江苏,中国);细胞计数仪(biomed,中国);所有移液器均购自eppendorf(德国);流式细胞仪购买自赛默飞世尔科技(中国)有限公司(上海,中国);数据分析采用软件graphpad prism version 7.0。
46.1.1.4实验试剂与耗材
47.引物由金斯瑞公司合成;胎牛血清(cat.10099141c)和dmem培养基(cat.11965118)均购买自美国gibcolife technologies公司(grand island,ny);双抗购自碧云天生物技术有限公司(上海,中国);qpcr试剂购自诺唯赞生物科技股份有限公司(南京,中国);流式抗体均购自biolegend生物公司(美国);病毒dna提取试剂盒购自翌圣生物(上海,中国)、cxcl10、ifn-γ、granzyme b elisa试剂盒购自联科生物(杭州,中国。其余试剂均为国产,购自国内试剂公司。
48.1.2实验方法
49.1.2.1 adv-cxcl10的病毒构建
50.1.2.1.1装载cxcl10基因的腺病毒穿梭质粒ad5-pshuttle-cmv-e1a-ef1a-cxcl10载体的构建采用基因合成的方法进行cmv-e1a-ef1a-cxcl10核酸片段合成,该片段5’端带有hind iii酶切位点,3’端带有bgl ii酶切位点。
51.使用限制性内切酶hind iii和bgl ii对ad5-pshuttle线性化,纯化后片段按照cmv-e1a-ef1a-cxcl10:ad5-pshuttle=2:1的比例使用infusion试剂盒(clontech lab.inc.)进行连接,后经转化扩增验证获得装载cxcl10基因的腺病毒穿梭质粒ad5-pshuttle-cmv-e1a-ef1a-cxcl10。其中cmv-e1a-ef1a-cxcl10基因序列如seq.no.3所示。
52.1.2.1.2 adv-cxcl10病毒构建(质粒构建、病毒拯救、扩增纯化与滴度测定)
53.a.adv-cxcl10全长质粒的构建:将构建好的穿梭质粒ad5-pshuttle-cmv-e1a-ef1a-cxcl10用pmei线性化后转入感受态padeasy-bj5183中,使用含50ug/ml卡那霉素lb平板的进行筛选,挑取阳性克隆培养鉴定,鉴定正确的克隆质粒重新转化dh5a感受态进行二次筛选鉴定,鉴定正确后进行质粒大提获得adv-cxcl10全长质粒。
54.b.adv-cxcl10病毒拯救:ad5-cxcl10全长质粒使用paci线性化,纯化后6孔板中2.5μg/孔转染293t细胞,5%co2、37℃培养,2天后将细胞消化后转入10cm平皿,2-3天半量换液,至50%细胞出现病变,使用10ml培养基将细胞吹下收集至15ml离心管,反复冻融3次,3000rpm/min离心15min,收集病毒上清-80℃保存做为毒种。
55.c.病毒扩增与纯化:取病毒种液50μl加入60%293t细胞10cm平皿中,5%co2、37℃培养,细胞密度至90%以上,按照1:3比例传代,直至80%细胞出现病变,大约有10个平皿细胞,按上述方法收病毒,使用氯化铯密度梯度离心纯化病毒。
56.d.病毒滴度测定;使用tcid50方法进行滴度测定。
57.(1)293t细胞种于96孔板,每孔约1
×
104个细胞,待细胞贴壁后进行滴度测定。
58.(2)病毒梯度的稀释:准备ep管,每个ep管加入1170μl含胎牛血清的dmem;往第一个ep管中加入130μl病毒溶液,混匀,标记为10-1
;从第一个ep管中吸取130μl于第二个ep管中,标记为10-2
,依此类推,直至稀释到所需梯度为止。
59.(3)每孔中加入100ul相应梯度的病毒稀释液,每个梯度做10个重复孔,37℃、5%
co2培养过夜。
60.(4)在7天内观察96孔板荧光egfp,记录每个梯度有egfp的孔,用于病毒滴度计算。
61.(5)病毒滴度tcid50计算公式:
62.log10(tcid50)=l+d(s-0.5)+log10(1/v)
63.l=log10最高稀释度(如最高稀释度为10倍稀释,l=1)
64.v=最初每孔细胞培养液的体积(ml/well)
65.d=log10稀释度(如为10倍稀释,d=1)
66.s=各个梯度gfp比率之和
67.1.2.2 adv-cxcl10的病毒功能评价(复制能力、溶瘤杀瘤能力、分泌cxcl10功能)
68.1.2.2.1病毒复制能力:提取病毒dna进行pcr测定,检测病毒的相对拷贝数。
69.(1)将mc38-car种植于12孔板中,每孔3
×
105个,等待细胞贴壁后进行病毒感染。
70.(2)将adv-ctrl或adv-cxcl10以moi=10感染细胞,37℃、5%co2培养,分别在12、24、48、72、96、120h收集细胞,经过-80℃半小时、37℃水浴、涡旋振荡反复冻融三次,3000rpm/min离心15min收集上清即为病毒成分,根据试剂商说明书进行病毒dna提取并进行滴度测定。
71.(3)实时定量pcr
72.10μl体系组成:模板+depc水:上下游引物+sybr green qpcr mix荧光染料=4μl:6μl,模板上样量为每孔20ng,其余采用depc水补齐。上下游引物采腺病毒骨架hexon基因的引物序列,序列如表1所示:
73.表1
74.引物名称 核酸序列(5
’‑3’
)
75.f hexon 5
’‑
accgtgaggatactgcgtac-3’76.r hexon 5
’‑
ttgctcgtctacttcgtctt-3’77.以感染12h后收集的病毒dna拷贝数作为参考,根据cq值进行其他时间点病毒拷贝数的相对计数。
78.1.2.2.2病毒溶瘤功能:采用结晶紫和cck8对病毒的溶瘤杀瘤作用进行检测。
79.a.结晶紫染色:
80.(1)将5000个mc38-car细胞种于96孔板,待细胞贴壁后进行病毒感染。
81.(2)将adv-ctrl或adv-cxcl10以moi=0、5、10、20、40、80感染细胞,每个moi设置3个复孔,37℃、5%co2培养,分别在48、72、96h收集细胞,去除孔内的培养基,pbs清洗一遍后用4%多聚甲醛进行固定30分钟后弃去,用pbs洗一遍后用0.1%结晶紫染色30分钟,弃去结晶紫后用pbs洗净残留,拍干96孔板后拍照。
82.b.cck8:
83.(1)将5000个mc38-car细胞种于96孔板,待细胞贴壁后进行病毒感染。
84.(2)将adv-ctrl或adv-cxcl10以moi=0、5、10、20、40、80感染细胞,每个moi设置5个复孔,每孔最终体系为200μl,37℃、5%co2培养,在48h收集细胞,每孔避光加入20μl cck8检验试剂,继续37℃培养,4小时内在用酶标仪在od=450nm测定吸光度(a)并计算杀伤效率。
85.细胞抑制率(%)=(a
moi=0-amoi=5,10,20,40,80
)/(a
moi=0-a
空白
)
×
100%
86.1.2.2.3病毒表达并分泌cxcl10的功能:采用elisa对感染病毒后的细胞上清进行cxcl10分泌检测。
87.(1)将mc38-car种植于12孔板中,每孔3
×
105个,等待细胞贴壁后进行病毒感染。
88.(2)将adv-ctrl或adv-cxcl10以moi=0、2、4、8感染细胞,37℃、5%co2培养,在48h收集细胞上清,6000rpm/min,离心1min,吸取上清进行elisa检测。
89.(3)根据试剂盒说明书进行细胞上清cxcl10 elisa检测,简要步骤为:用洗液浸泡酶标板30秒后拍干,每孔加入100μl细胞上清或100μl标准品,加入50μl检测抗体,在振荡仪上300rpm/min,振荡2小时,弃去孔内液体,用洗液清洗6遍,拍干后每孔加入100μl hrp标记的二抗,在振荡仪上300rpm/min,振荡45分钟,弃去孔内液体,用洗液清洗6遍,拍干后每孔加入100μl tmb,避光孵育30分钟后在酶标仪上在吸光度=450nm处进行检测并计算cxcl10浓度。
90.1.2.3 adv-cxcl10体内趋化cxcr3
+
t细胞能力评估
91.1.2.3.1植瘤、分组与给药
92.(1)选取6-8周c57bl/6小鼠在右侧胁肋部皮下注射106个mc38-car细胞建立皮下移植瘤模型,约5天后小鼠肿瘤长至50-100mm3,进行随机分组并分为3组,分别是:对照组、对照病毒adv-ctrl处理组、重组溶瘤腺病毒adv-cxcl10处理组。
93.(2)根据组别分别对小鼠进行瘤内注射:pbs、adv-ctrl、adv-cxcl10,pbs每次给100μl,病毒每次给3
×
108pfu,每两天一次,共三次。
94.1.2.3.2收样与检测
95.a.在最后一次注射后2天处死小鼠并收集小鼠外周血血清,取肿瘤,一部分做蜡块切片,一部分进行消化、percoll梯度离心制成肿瘤浸润细胞(tils)单细胞悬液,一部分制成匀浆备用。
96.b.流式细胞术检测tils中cxcr3
+
细胞比例
97.(1)取至少106个tils细胞,每管中加入相应含量的流式抗体,重悬细胞,冰上避光孵育半小时。
98.(2)500
×
g,5min离心后弃上清,加入1ml流式上样缓冲液重悬,再次离心后弃上清,重复2遍。
99.(3)用500μl流式上样缓冲液重悬细胞,用流式细胞仪检测。
100.c.组织免疫荧光检测肿瘤微环境中cd4
+
、cd8
+
细胞浸润
101.(1)切片的脱蜡与水化:将石蜡切片放于60℃烘箱2h后,二甲苯浸泡15min/次,3遍;100%乙醇5min/次,2遍;75%乙醇5min/次,2遍;50%乙醇5min/次,2遍;水5min。
102.(2)抗原修复:将50
×
柠檬酸钠抗原修复液使用纯水稀释至1
×
,待高压锅内修复液沸腾冒气后将切片放入,盖上盖子加热开始冒气时计时2min,关电源冷却至冒气减少后可打开盖子冷却(画圈)。
103.(3)取出冷却好的切片放置pbs中浸泡3min/次2遍。
104.(4)5%山羊血清室温封闭2h。
105.(5)甩掉山羊血清直接避光加荧光抗体cd4、cd8,湿盒避光4℃过夜。
106.(6)第二天甩去一抗,在摇床上pbs溶液洗片10min
×
3次。
107.(7)甩去二抗,用pbs溶液洗片5min
×
3次。
108.(8)取dapi每孔50ul染5min,pbs溶液清洗5min
×
3次。
109.(9)待组织片干后,滴加抗荧光淬灭剂,盖上盖玻片封片,防止产生气泡。
110.(10)荧光显微镜下拍照。
111.d.elisa法测定血清中及肿瘤组织中cxcl10含量
112.(1)将小鼠外周血3000rpm/min,15min离心后取上层澄清液体,即为血清。
113.(2)将肿瘤组织进行研磨获得匀浆,用ripa裂解液冰上裂解30min后,12000rpm,15min离心取上清并进行蛋白定量,定量至蛋白浓度为1μg/μl。
114.(3)根据试剂盒说明书进行血清及肿瘤组织蛋白cxcl10 elisa检测,简要步骤为:用洗液浸泡酶标板30秒后拍干,每孔加入100μ血清或100μl组织蛋白或cxcl10标准品,加入50μl检测抗体,在振荡仪上300rpm/min,振荡2小时,弃去孔内液体,用洗液清洗6遍,拍干后每孔加入100μl hrp标记的二抗,在振荡仪上300rpm/min,振荡45分钟,弃去孔内液体,用洗液清洗6遍,拍干后每孔加入100μl tmb,避光孵育30分钟后在酶标仪上在吸光度=450nm处进行检测并计算cxcl10浓度。
115.1.2.4 adv-cxcl10协同pd-1抗体体内抗肿瘤作用评估
116.1.2.4.1植瘤、分组与给药
117.(1)选取6-8周c57bl/6小鼠在右侧胁肋部皮下注射106个mc38-car细胞建立皮下移植瘤模型,约5天后小鼠肿瘤长至50-100mm3,进行随机分组并分为6组,分别是:对照组、对照病毒adv-ctrl处理组、重组溶瘤腺病毒adv-cxcl10处理组以及三组的联合pd-1单抗治疗组。
118.(2)根据组别分别对小鼠进行瘤内注射:pbs、adv-ctrl、adv-cxcl10,pbs每次给100μl,病毒每次给3
×
108pfu,每两天一次,共三次;腹腔注射:pbs每次100μl,pd-1抗体每次5mg/kg,每两天一次,共5次。
119.1.2.3.4肿瘤体积记录和小鼠体重记录
120.开始治疗后每两天记录一次小鼠肿瘤体积及小鼠体重,并绘制肿瘤生长曲线及体重变化曲线。
121.体积(v)计算公式:v=(肿瘤长径
×
肿瘤短径2)/2。
122.1.2.3.3收样与检测
123.a.在最后一次注射后7天处死小鼠并收集肿瘤,一部分做蜡块切片,一部分进行消化、percoll梯度离心制成肿瘤浸润细胞(tils)单细胞悬液,一部分制成匀浆备用。
124.b.流式细胞术检测tils中cxcr3
+
细胞比例
125.(1)取至少106个tils细胞,每管中加入相应含量的流式抗体,重悬细胞,冰上避光孵育半小时。
126.(2)500
×
g,5min离心后弃上清,加入1ml流式上样缓冲液重悬,再次离心后弃上清,重复2遍。
127.(c)用500μl流式上样缓冲液重悬细胞,用流式细胞仪检测。
128.c.组织免疫荧光检测肿瘤微环境中cd4
+
、cd8
+
细胞浸润
129.(1)切片的脱蜡与水化:将石蜡切片放于60℃烘箱2h后,二甲苯浸泡15min/次,3遍;100%乙醇5min/次,2遍;75%乙醇5min/次,2遍;50%乙醇5min/次,2遍;水5min。
130.(2)抗原修复:将50
×
柠檬酸钠抗原修复液使用纯水稀释至1
×
,待高压锅内修复
b浓度,从多个方面激活肿瘤免疫微环境,最终达到对pd-1抗体抗肿瘤的协同增效作用。该病毒可以用来制备肿瘤药物,也可以用来作为免疫检查点抑制剂的辅助用药,有效对抗肿瘤,尤其是本身对免疫检查点单药不敏感的肿瘤。
149.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
