1.本发明属于生物检测技术领域,具体涉及一种无精少精症染色体变异检测试剂盒。
背景技术:
2.随着社会快速发展,不孕不育的发病率呈上升趋势。其中,男性因素引起的不育约50%,遗传学因素约占20%。男性生殖遗传学异常包括染色体、基因、精子dna完整性及表观遗传学等多个方面,是导致男性不育的重要病因。随着基因测序技术的进步和辅助生殖技术的广泛应用,男性生殖遗传学已成为近年来的研究热点。开展男性生殖遗传学研究,不仅可以对不育的病因给出遗传学解释,而且对治疗方式的选择也具有重要的指导意义。
3.克氏综合征(klinefelter syndrome,ks)是一类由于染色体数目异常导致的男性不育,它是导致男性不育的第一大遗传学因素。克氏综合征是性染色体非整倍体中最常见的类型,也称47,xxy综合征,多出的x染色体来自父亲或母亲。克氏综合征的特征是男性乳房发育、卵泡刺激素升高和精液中无精子。据估计,只有25-30%的ks男性患者被确诊。在被诊断出的所有病例中,约有10%的病例是在产前检测中发现的。越来越多的证据表明,如果在适当的年龄对ks患者进行早期干预和治疗,例如:睾丸激素替代治疗、早期言语教育等,能够有效地提高患者的生活质量和延缓并发症的发生发展。目前克氏综合征面临着诊断率低、漏诊率高的现状。我国克氏综合征的检测方法主要还是依靠传统的核型分析。核型分析能够检测到包括性染色体在内的整个染色体组的数目异常与大片段的结构异常,一个完整的检测周期约为14天。但核型分析步骤多,耗时长,操作繁琐,检测通量较低,且对工作人员的专业技术水平要求比较高,同时,该方法需要培养细胞,而细胞培养的成功率容易受到多种因素的影响,因此传统核型分析很难满足大规模人群检测的需求。y染色体微缺失是第二大男性不育的常见遗传学病因,发病率次于克氏综合征,约占不育患者2.9%-10.8%,约占无精子症和严重少精子症患者的9.2%-14.4%。y染色体微缺失是指yq 1.1的无精子症因子(azoospermia factor,azf)在亚染色体层面的片段缺失。根据这一片段在染色体的相对位置及无精子症的发生机制及临床表型不同,可以分为3个不同的区域:azfa,azfb及azfc区。每个区域都包含几个调控精子形成的关键基因,这些基因的缺失或突变均可能导致少精或无精。其中,azfa区域的缺失几率较低,但其丧失将导致绝对无精子症。azfb区域缺失的患者表现为生精阻滞,精子生成被阻滞在精母细胞阶段,导致没有精子生成。azfc区缺失较为常见,是精子形成障碍的重要原因之一。azfc区缺失的精子表型存在很大差异,可以表现为精子数量正常、少精子症或无精子症。因此可以通过辅助生育手段进行治疗。可见,y染色体微缺失检测对男性在生殖遗传学方面的临床治疗、提高辅助生殖的疗效和安全性以及开展胚胎植入前的遗传学诊断均具有重要意义。此外,y染色体微缺失在代际遗传扩增中会有明显的缺失片段扩大,病情加重的现象。目前,临床中y染色微缺失检测使用有多重荧光定量pcr、多重连接探针扩增技术(multiplex ligation-dependent probe amplification,mlpa)、多重pcr-毛细管电泳技术。多重荧光定量pcr具有操作简便,对于仪
器设备需求低的特点,但目前其检测位点为欧洲泌尿外科推荐6位点,对于我国的适用性还有验证。而mlpa和多重pcr-毛细管电泳技术虽然检测位点较多,但其操作复杂检测周期较长,检测仪器近300万元,不利于临床大规模推广。因此,亟需针对中国男性无精少精症遗传学因素数据库建立符合中国人群特点的检测方法。
技术实现要素:
4.为了解决现有技术中针对中国男性无精少症的检测多采用外周血染色体核型分析、毛细管电泳或多重荧光定量pcr组合的现状,上述技术采用不同的方法体系;毛细管电泳方法要求检测位点较多,流程复杂且周期较长;传统欧洲检测6位点多重荧光定量pcr检测位点不完全适合中国人群特点,这些都是临床检测中试剂面临的问题,本发明目的在于提供一种无精少精症染色体变异检测试剂盒。
5.本发明所采用的技术方案为:一种无精少精症染色体变异检测试剂盒,所述试剂盒包括检测液、pcr扩增反应体系、正常对照品和缺失对照品;
6.所述检测液包括y染色体的检测液和ks染色体的检测液;
7.所述y染色体的检测液包括y染色体微缺失azfa区域的第一引物和第一探针、第二引物和第二探针;y染色体微缺失azfb区域的第三引物和第三探针、第四引物和第四探针;y染色体微缺失azfc区域的第五引物和第五探针、第六引物和第六探针;和内参基因的第七引物和第七探针,具体如seq id no.1-seq id no.21所示;
8.所述ks染色体的检测液包括ks染色体的第八引物和第八探针、第九引物和第九探针;和内参基因的第十引物和第十探针,具体如seq id no.22-seq id no.30所示。
9.作为优选地,所述y染色体的内参基因为rnase p。
10.作为优选地,所述ks染色体的内参基因为cftrf1。
11.作为优选地,所述pcr扩增反应体系包括taq酶和pcr反应缓冲物质的烘干粉。
12.作为优选地,所述正常对照品为含有x染色体靶序列、y染色体靶序列以及内参基因特异性片段的质粒。
13.作为优选地,所述y染色体靶序列包括azfa、azfb、azfc区域的y染色体靶序列。
14.作为优选地,所述缺失对照品分别为含有rnase p和cftrf1的内参基因特异性片段的质粒。
15.作为优选地,所述第一探针的5
′
端至第十探针的5
′
端均标记有荧光基团,所述第一探针的3
′
端至第十探针的3
′
端均标记有淬灭基团。
16.作为优选地,所述荧光基团包括fam、cy5、rox、vic和ned中的任意一种。
17.作为优选地,所述淬灭基团包括qsy、nfq、mgb和bhq1中的任意一种。
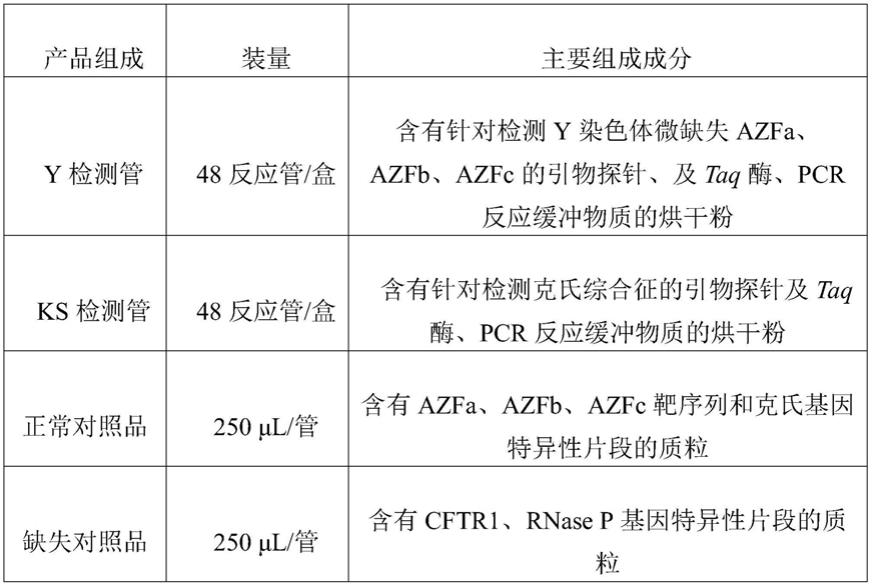
18.本发明的有益效果为:
19.(一)、本发明提供了一种无精少精症染色体变异检测试剂盒,该试剂盒填补临床空白,使用一次试剂盒即可同时完成对克氏综合征和y染色体微缺失的检测,将两大男性不孕遗传性成因整合于一次检测中,提高临床男性不育原因的检测效率,降低检测成本、缩短检测周期。
20.(二)、烘干新工艺:本方法采用对taq酶和pcr反应缓冲物质,进行烘干qpcr试剂的处理方式,预先将检测的引物和探针及qpcr聚合酶等置于反应管中,烘干后即可常温保存。
操作者仅需将dna模板/对照品加入到反应管中,即可上机检测。简单快速,一个小时即可获得检测结果,对操作人员要求低,便于推广使用。
21.(三)、检测灵敏度高:传统pcr反应体系受加样体积的限制,反应灵敏度很难再提高。而本试剂盒通过引物烘干工艺,使得上样量比传统qpcr提高5-10倍,这也使得本试剂盒的检测灵敏度提高5-10倍。
22.(四)、一个反应孔完成y染色体微缺失检测过程,突破了传统y染色体微缺失荧光定量pcr两个反应孔的问题,简化检测流程。本发明中检测位点基于北京朝阳医院近千名患者回顾性研究数据,专门针对中国人群,更加符合我国临床实际需求,提高阳性检出率。
23.(五)、本发明在北京市朝阳医院泌尿男科对近千例无精少精症患者染色体核型和y染色体微缺失检测结果进行回顾性分析建立了我国无精少精症遗传学数据库的基础上,通过多重荧光定量pcr方法建立一种一次性实现无精少精症染色体变异检测试引物探针及剂盒,提高临床男性不育原因的检测效率,降低检测成本、缩短检测周期;同时,本研究专门针对中国人群,更加符合我国临床实际需求,提高阳性检出率。从分子水平上明确男性不育的病因,从而避免不必要治疗,减少因应用icsc而带来男性子代临床突变缺失率增加问题。此外,本发明采用最先进的烘干技术工艺,能够增加检测灵敏度,简化临床检测过程,更方便实际使用和推广。
附图说明
24.图1为实施例4中四种检测方案结果对比分析示意图。
25.图中:y:y阳性检出率;ks:ks阳性检出率;salsa:probemix p360-b2 y-chromosome microdeletions试剂盒;m:某市售荧光pcr法检测试剂盒;r:染色体核型分析;wy:本技术的无精少精症染色体变异检测试剂盒。
具体实施方式
26.下面结合具体实施例对本发明做进一步阐释。本领域技术人员将会理解,下列所描述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为限制本发明的范围。所用试剂均为可以通过市售购买获得的常规产品。
27.实施例1:
28.本实施例的多重实时荧光pcr法,检测无精少精症染色体变异的引物探针及试剂盒(48反应/盒)包含组分,如表1所示:
29.(1)y检测管:含有针对检测y染色体微缺失azfa、azfb、azfc的引物探针、及taq酶、pcr反应缓冲物质的烘干粉,其包含引物探针序列为:
30.seq id no.1:azfa1-f:5'-agtgaaggaataacatgccgag-3'
31.seq id no.2:azfa1-r:5'-aaactgtatataccataatccct-3'
32.seq id no.3:azfa1-p:5'-fam-aagtggtgatggatgaggagt-3'-qsy
33.seq id no.4:azfa2-f:5'-ctgggcccaagacacattgt-3'
34.seq id no.5:azfa2-r:5'-acaactctgggaagccattacc-3'
35.seq id no.6:azfa2-p:5'-fam-ccatggatctcactttgcaggacagagac-3'-qsy
36.seq id no.7:azfb1-f:5'-tatagcccaaaactaatcagcatc-3'
37.seq id no.8:azfb1-r:5'-tggtagattccagtgggtgctatc-3'
38.seq id no.9:azfb1-p:5'-cy5-taataattcatagaggctaggctca-3'-qsy
39.seq id no.10:azfb2-f:5'-agagtgcgcgtcagcagttt-3'
40.seq id no.11:azfb2-r:5'-gagccgactgaactaagatgca-3'
41.seq id no.12:azfb2-p:5'-cy5-agctctgtagccagcctcttctgcgc-3'-qsy
42.seq id no.13:azfc1-f:5'-ggaagccggatttgatataaacttat-3'
43.seq id no.14:azfc1-r:5'-ccatctcctgacctcgtgatc-3'
44.seq id no.15:azfc1-p:5'-rox-tggctcacgcctgtaatctcagcagtt-3'-qsy
45.seq id no.16:azfc2-f:5'-ggattcggcgtgatttgg-3'
46.seq id no.17:azfc2-r:5'-aacgtctggcggaatcca-3'
47.seq id no.18:azfc2-p:5'-ned-ctgcaggtaggtttc-3'-mgb-nfq
48.seq id no.19:rnase p-f:5'-agatttggacctgcgagcg-3'
49.seq id no.20:rnase p-r:5'-gagcggctgtctccacaagt-3'
50.seq id no.21:rnase p-p:5'-vic-ttctgacctgaaggctctgcgcg-3'-bhq1。
51.(2)ks检测管:含有针对检测克氏综合征的引物探针及taq酶、pcr反应缓冲物质的烘干粉,其包含引物探针序列为:
52.seq id no.22:ks1-f:5'-attcttccaggaggcacagaaa-3'
53.seq id no.23:ks1-r:5'-ccttccgacgaggtcgatac-3'
54.seq id no.24:ks1-p:5'-ned-tacaggccatgcacagagagaaatacccg-3'-qsy
55.seq id no.25:ks2-f:5'-ttgccctcacactggtagca-3'
56.seq id no.26:ks2-r:5'-gcaatcggcatggacaatcag-3'
57.seq id no.27:ks2-p:5'-fam-aagctcacacacctgat-3'-mgb
58.seq id no.28:cftrf1:5'-gaatggacccaggacagatatag-3'
59.seq id no.29:cftrr1:5'-agcaggcatttgctggagttac-3'
60.seq id no.30:cftrp1:5'-vic-cagctgactctcttgtg-3'-mgb
61.(3)正常对照品:含有x染色体、y染色体靶序列以及内参基因特异性片段的质粒。
62.(4)缺失对照品:含有内参基因特异性片段的质粒。
63.表1试剂盒组分
[0064][0065]
实施例2
[0066]
采用实施例1所述的试剂盒进行人无精少精症染色体变异实时荧光定量pcr检测的方法:
[0067]
(1)核酸提取:
[0068]
取200μl全血离体样本,使用天隆全自动核酸提取仪(np968-3s)及配套天隆全血基因组dna提取试剂盒,提取edta抗凝管所采集的全血离体样本,提取后用微量紫外分光光度计测定核酸纯度及浓度,其od
260/280
在1.6-2.0之间;用灭菌双蒸馏水稀释基因组dna浓度至5ng/μl备用。
[0069]
(2)离体样本检测:
[0070]
将缺失对照品、正常对照品、待测离体样本dna分别加入y检测管和ks检测管反应孔位中,加样体积均为20μl。
[0071]
(3)扩增程序:
[0072]
95℃10min(1个循环);95℃10sec,60℃30sec(信号采集),共40个循环。本发明使用abi 7500进行检测。y检测管每一循环实时采集cy5、fam、ned、rox、vic荧光信号;ks检测管每一循环实时采集fam、ned、vic荧光信号。
[0073]
(4)结果分析:
[0074][0075][0076]
相对表达量(rq值)的计算方法:
[0077]
计算正常对照品在反应中sry/arse基因与内参基因间的
△
ct值,
△
ct=ct
fam/ned
–
ct
vic
。记为
△
cta;
[0078]
计算待测离体样本sry/arse基因与相应反应孔中内参基因间的
△
ct值,
△
ct=ct
fam/ned
–
ct
vic
,记为
△
cts;
[0079]
计算待测离体样本靶基因sry/arse
△△
ct=待测样本靶基因
△
cts‑△
cta;
[0080]
计算待测离体样本相对表达量(rq值)=待测样本目标基因相对拷贝数=2
‑△△
ct
。
[0081][0082]
(5)试剂盒性能:
[0083]
1)阳性符合率:如表2所示,采用实施例1所述的试剂盒对阳性企业参考品进行检测,结果均为阳性,阳性符合率100%。
[0084]
表2阳性符合率参考品
[0085][0086]
2)阴性符合率:如表3所示,采用实施例1所述的试剂盒对阴性企业参考品进行检测,结果均为阴性,阴性符合率为100%。
[0087]
表3阴性符合率参考品
[0088][0089]
3)精密度:如表4所示,采用实施例1所述的试剂盒对自建阳性企业参考品进行检测,每个样品重复10次,检测结果ct值的变异系数(cv%)≤5%。
[0090]
表4精密度参考品
[0091][0092]
4)最低检出限:如表5所示,采用实施例1所述的试剂盒对1ng/μl的最低检出限企业参考品进行检测,检测结果均为阳性,符合率100%。
[0093]
表5最低检出限参考品
[0094][0095]
实施例3
[0096]
采用实施例1所述的试剂盒和某市售y染色体微缺失检测试剂盒(荧光pcr法)对2例阴性样本进行实验。所用dna浓度进行梯度稀释,分别稀释至20ng/μl,10ng/μl,5ng/μl,2ng/μl,1ng/μl,检测内参信号ct值。两个试剂盒检测内参ct值如下:
[0097]
表6本试剂盒和某市售y染试剂盒内参信号检出限比较
[0098][0099]
由以上结果可以看出,本试剂盒采用烘干工艺后,总样本用量大幅减少,且灵敏度比传统荧光定量试剂盒高5倍。
[0100]
实施例4
[0101]
采用实施例1所述的试剂盒、probemix p360-b2y-chromosome microdeletions试剂盒、某市售荧光pcr法检测试剂盒和染色体核型分析对200例无精少精症患者进行检测,无精少精染色体变异阳性检出率如下图所示:
[0102]
由如图1可以看出,本试剂盒可检出44%的无精少精染色体变异类型,均高于市面上其他类型试剂盒及检测方法。
[0103]
同时,本发明所述试剂盒与现有市售试剂盒优缺点比较如下表所示:
[0104]
表7本发明试剂盒与市售试剂盒优缺点比较
[0105]
[0106][0107]
图1为实施例4中四种检测方案结果对比分析示意图。
[0108]
综上所述,本发明提供了一种人无精少精症染色体变异多重检测的方法及试剂盒,可同时快速检测克氏综合征和y染色体azf a区、azf b区、azf c区缺失情况,操作简单,重复性好,成本低廉,适于推广使用。
[0109]
本发明不局限于上述可选的实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,均属于本发明的保护范围。上述具体实施方式不应理解成对本发明的保护范围的限制,本领域的普通技术人员应当理解,在不背离本发明的范围下,可对前述各实施例所记载的技术方案进行修改,或对其中部分或者全部技术特征进行等同替换,与此同时这些修改或者替换,并不会使相应的技术方案的本质脱离本发明各实施例技术方案的范围。
