一种高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的野野村菌及其应用
技术领域
1.本发明涉及微生物技术领域,具体涉及一种高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的野野村菌及其应用。
背景技术:
[0002]2’‑
氨基-2
’‑
脱氧腺苷是一种对支原体有特殊活性的腺苷类似物,最早由matsuyama k等人(matsuyama et al.,1979)在筛选抗支原体活性的抗生素时,从一株放线菌actinomadura sp.sa-4427的发酵液中分离得到。研究证明,它除了具有抗支原体活性外,还是rna病毒复制的强有效抑制剂,可用于治疗麻疹病毒感染引起的疾病,同时2
’‑
氨基-2
’‑
脱氧腺苷还是一种应用非常广泛的医药中间体。
[0003]
喷司他丁是白血病和肿瘤等疾病治疗的一线用药,已经成为近几年治疗白血病研究领域的一大热点。喷司他丁是由野野村菌nonomuraea sp.atcc 39365所产生的一种嘌呤类的抗代谢药物,作为腺苷脱氨酶强抑制剂,其通过抑制腺苷脱氨酶的活性,促进癌变细胞中脱氧腺苷的积累,导致核酸合成受阻,从而起到治疗作用。从分子结构看,喷司他丁是腺苷的结构类似物,不同点在于嘌呤六元环中,插入一个一碳单位的扩环结构(1,3-二氮杂卓环结构),由于这种独特的化学结构使得喷司他丁在天然产物中具有特殊的生物活性。1991年,美国食品药品监督管理局(fda)批准喷司他丁作为注射剂上市,药品名为nipent,在临床上主要治疗急性t细胞淋巴细胞白血病、毛细胞白血病及慢性淋巴细胞白血病。
[0004]
目前国际上关于喷司他丁、2
’‑
氨基-2
’‑
脱氧腺苷的研究仍处在起步阶段。野生型野野村菌nonomuraea sp.atcc 39365中喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷产量极低,且其生物合成的调控机制并不清楚,因此如何提高其发酵产量是亟待解决的一大难题。化学合成喷司他丁或2
’‑
氨基-2
’‑
脱氧腺苷的反应条件苛刻、原料价格昂贵,加之化学合成法路线繁杂,反应过程中常用到强酸、强碱、有机溶剂,对中间产物需要多次提纯,导致成本较高,收率较低,难以实现工业化生产。
技术实现要素:
[0005]
本发明的目的在于提供一种高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的野野村菌及其应用,该野野村菌能够显著提高喷司他丁和/或2
’‑
氨基-2
’‑
脱氧腺苷的产量。
[0006]
为了实现上述发明目的,本发明提供以下技术方案:
[0007]
本发明提供了一种高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的野野村菌,所述野野村菌命名为(nonomuraea sp.)mm-46,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.18780。
[0008]
本发明还提供了上述野野村菌发酵得到的发酵液。
[0009]
优选地,所述发酵液的制备方法包括如下步骤:将野野村菌接种到发酵培养基中培养即得。
[0010]
优选地,所述发酵培养的温度为30~34℃,培养时间为5~7天。
[0011]
优选地,所述发酵培养的温度为32℃,培养时间为6天。
[0012]
优选地,所述发酵培养基由如下浓度的组分组成:麦芽浸粉25~35g/l,酵母浸粉7~17g/l,麦芽糖醇2~6g/l。
[0013]
优选地,所述发酵培养基由如下浓度的组分组成:麦芽浸粉30g/l,酵母浸粉12g/l,麦芽糖醇4g/l。
[0014]
优选地,所述发酵培养基的ph为7.6~8.0。
[0015]
本发明还提供了上述野野村菌或上述任意一项发酵液在制备喷司他丁和/或2
’‑
氨基-2
’‑
脱氧腺苷中的应用。
[0016]
优选地,所述喷司他丁和/或2
’‑
氨基-2
’‑
脱氧腺苷的产量显著提高。
[0017]
本发明提供了一种高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的野野村菌,命名为(nonomuraea sp.)mm-46,该野野村菌能够同时发酵得到喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷,本发明通过发酵得到的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷产量显著提高,发酵工艺简单、成本低,对工业化合成喷司他丁和/或2
’‑
氨基-2
’‑
脱氧腺苷具有重要的意义,具有良好的应用前景。
[0018]
生物保藏信息:
[0019]
本发明所述野野村菌(nonomuraea sp.)mm-46保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.18780,保藏日期为2019年11月01日,保藏地址为北京市朝阳区北辰西路1号院3号。
附图说明
[0020]
图1为野野村菌atcc 39365与野野村菌mm-46菌丝体形态对比图,a:野野村菌atcc 39365(
×
2000,10μm);b:野野村菌atcc 39365(
×
4000,5μm);c:野野村菌mm-46(
×
2000,10μm);d:野野村菌mm-46(
×
4000,5μm);
[0021]
图2为野野村菌atcc 39365和mm-46发酵上清液中产生的喷司他丁和2'-氨基-2'-脱氧腺苷及其标准品的色谱-质谱图,a为喷司他丁和2'-氨基-2'-脱氧腺苷标准品的色谱图,b为野野村菌atcc 39365和mm-46发酵上清液中喷司他丁和2'-氨基-2'-脱氧腺苷的色谱图,c为喷司他丁标准品的质谱图,d为2'-氨基-2'-脱氧腺苷标准品的质谱图,e为野野村菌atcc 39365和mm-46发酵上清液中喷司他丁特征碎片离子质谱图,f为野野村菌atcc 39365和mm-46发酵上清液中2'-氨基-2'-脱氧腺苷特征碎片离子质谱图;
[0022]
图3为喷司他丁和2'-氨基-2'-脱氧腺苷标准品的标准曲线,a为喷司他丁标准品的标准曲线,b为2'-氨基-2'-脱氧腺苷标准品的标准曲线;
[0023]
图4为野野村菌mm-46和野野村菌atcc 39365发酵过程中喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的积累量对比结果,其中a为野野村菌mm-46和野野村菌atcc 39365发酵过程中喷司他丁对比结果,b为野野村菌mm-46和野野村菌atcc 39365发酵过程中2
’‑
氨基-2
’‑
脱氧腺苷的积累量对比结果;
[0024]
图5为野野村菌mm-46和野野村菌atcc 39365发酵过程中菌体生物量积累对比图。
具体实施方式
[0025]
本发明提供了一种高产喷司他丁和2'-氨基-2'-脱氧腺苷的野野村菌,所述野野村菌命名为(nonomuraea sp.)mm-46,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.18780。
[0026]
在本发明中,所述野野村菌mm-46的菌落形态特征为呈不规则形状、纹路呈不规则花瓣状,边缘不整齐,本发明以野野村菌atcc 39365为出发菌株采用常压室温等离子体(artp)诱变联合核糖体工程筛选技术,使用链霉素对突变株进行抗性选育,获得野野村菌mm-46。
[0027]
本发明提供了上述野野村菌mm-46发酵得到的发酵液。
[0028]
在本发明中,所述发酵液的制备方法优选地包括如下步骤:将野野村菌接种到发酵培养基中培养即得。
[0029]
在本发明中,将野野村菌接种到发酵培养基中培养后还包括在4℃,10000r/min,离心15min获得发酵上清液。所述发酵培养的温度优选为30~34℃,更优选为32℃;所述培养时间优选为5~7天,更优选为6天。所述发酵培养基优选地由如下浓度的组分组成:麦芽浸粉25~35g/l,酵母浸粉7~17g/l,麦芽糖醇2~6g/l;更优选地由如下浓度的组分组成:麦芽浸粉30g/l,酵母浸粉12g/l,麦芽糖醇4g/l。所述发酵培养基的ph优选为7.8。本发明中所述发酵培养基的配制方法如下:将麦芽浸粉25~35g、酵母浸粉7~17g、麦芽糖醇2~6g混合均匀,加入1l的蒸馏水,30%koh调ph7.6~8.0,115℃灭菌30min。本发明对麦芽浸粉、酵母浸粉、麦芽糖醇的来源没有特殊的限定,采用本领域技术人员熟知的常规市售产品即可。
[0030]
本发明还提供了上述野野村菌或任意一种发酵液在制备喷司他丁和/或2
’‑
氨基-2
’‑
脱氧腺苷中的应用。
[0031]
在本发明中,通过高效液相色谱-质谱联用对野野村菌atcc 39365和野野村菌mm-46代谢产物的研究发现,野野村菌mm-46中喷司他丁、2
’‑
氨基-2
’‑
脱氧腺苷合成能力明显提高,相比野野村菌atcc39365分别提高了135.61%和169.23%。
[0032]
在本发明中,若无特殊说明,所有的原料组分均为本领域技术人员熟知的市售商品。
[0033]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0034]
实施例1
[0035]
野野村菌mm-46筛选
[0036]
(1)链霉素对野野村菌atcc 39365最低抑制浓度(mic)的测定
[0037]
将甘油保藏的野野村菌atcc 39365划线于isp2平板上,30℃培养7天,用无菌棉签或无菌接种环将平板上的孢子刮下,转移至无菌ep管中,加1ml无菌水清洗培养基表面孢子,重复清洗两次;将ep管内液体定容至3ml,加无菌玻璃珠涡旋振荡10min,破坏孢子链;孢子液在装有无菌脱脂棉花的漏斗中进行过滤,清除菌丝和琼脂;孢子液于10000r/min,4℃离心10min,去除上清;用2
×
yt培养基洗涤孢子两次,10000r/min,4℃离心10min;加入2.5ml 2
×
yt重悬孢子,制成2.5
×
108个/ml单孢子悬液,分装500μl于ep管中,加入250μ
l50%的无菌甘油,吹吸混匀,于-80℃保存备用;用无菌水稀释单孢子浓度达到1.0
×
105~106个/ml,便于能长成单克隆并进行计数。取100μl稀释后的单孢子悬液涂布到含有5、10、15、20、25mg/l链霉素的isp2培养基上,30℃培养箱中培养6~8d,观察菌落的生长情况,记录无菌落或有一个菌落生长的最小浓度,即为链霉素对该菌株的最小抑菌浓度20mg/l。
[0038]
其中,2
×
yt培养基培养基的制备方法为胰蛋白胨10g、酵母粉10g、氯化钠5g,加入1l的蒸馏水,混合均匀,用5mol/lnaoh调ph7.0,于115℃灭菌30min,即得。
[0039]
(2)基于常压室温等离子体(artp)诱变与链霉素筛选获得野野村菌mm-46
[0040]
预热artp诱变仪20min,设置参数:诱变功率130w,气流量12slm,诱变时间60s,处理距离2mm。
[0041]
取10μl2.5
×
108个/ml单孢子悬液,均匀涂于无菌载片上,移至诱变凹槽中运行仪器进行诱变,诱变结束后,将载片移至含有1ml无菌水的ep管中,涡旋震荡2min,菌悬液涂布于抗性isp2平板,于30℃培养6~8天,待菌落直径长至0.5cm,观察菌落形态、纹路及相关性状,选取差异较大的菌落,通过进一步的摇瓶发酵对高产喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷的突变株进行筛选,获得高产突变株野野村菌mm-46,将野野村菌mm-46孢子悬液与50%甘油按体积比为2:1混合后,-80℃冰箱保存备用。
[0042]
(3)野野村菌atcc 39365与野野村菌mm-46生理形态对比
[0043]
s1、分别将野野村菌atcc 39365与野野村菌mm-46摇瓶发酵,于32℃培养4天,分别得到野野村菌atcc 39365与野野村菌mm-46培养液;
[0044]
s2、将野野村菌atcc 39365培养液与野野村菌mm-46培养液分别移至离心管中,4℃,10000r/min离心15min,倒掉上清液,即得野野村菌atcc 39365菌丝体与野野村菌mm-46菌丝体;
[0045]
s3、将野野村菌atcc 39365菌丝体与野野村菌mm-46菌丝体分别加入3%的戊二醛固定12h;
[0046]
s4、用0.1mol/l的pbs缓冲液清洗菌丝体,于4℃、10000r/min离心15min,重复3次;
[0047]
s5、分别用30%、50%、70%、85%、90%的乙醇对野野村菌atcc 39365菌丝体与野野村菌mm-46菌丝体分别依次进行脱水处理,每次处理15min,分别于4℃,10000r/min离心15min;
[0048]
s6、用100%乙醇分别处理野野村菌atcc 39365菌丝体与野野村菌mm-46菌丝体,以完全除去菌体中的水分,处理20min,于4℃、10000r/min离心15min,重复2次;
[0049]
s7、加入乙酸异戊酯溶剂置换乙醇,分别处理野野村菌atcc 39365菌丝体与野野村菌mm-46菌丝体20min,于4℃、10000r/min离心15min,重复2次;
[0050]
s8、将样品分别置于-20℃、-40℃和-80℃条件下,冷冻12h后,转移至冷冻干燥机中,冻干30h。收集冻干后的样品,于扫描电镜下观察。
[0051]
结果如图1所示,与野野村菌atcc 39365相比,野野村菌mm-46菌丝形态发生明显变化,菌丝体密度较野野村菌atcc 39365大,野野村菌mm-46菌丝体出现不同程度的弯曲。野野村菌atcc 39365的单菌落形态为圆形,边缘光滑整齐,初始形状呈规则的三瓣或四瓣(数量偏多)花型纹路,随着培养时间的增加每瓣花型再均匀分裂为两瓣,孢子为白色,单菌落呈红棕色,野野村菌mm-46菌落形态呈不规则形状、纹路呈不规则花瓣状,边缘不整齐,菌落直径大于野野村菌atcc 39365,产孢能力强于野野村菌atcc 39365。
[0052]
(4)野野村菌atcc 39365与野野村菌mm-46发酵产物的高效液相色谱-质谱联用分析
[0053]
1)、将野野村菌atcc 39365与野野村菌mm-46分别接种到不含抗生素的isp2平板活化,然后制成2.5
×
108个/ml单孢子悬液,并按1:1000体积比转接到含种子培养基的摇瓶进行种子培养,培养48h后,按10%比例接种到发酵培养基摇瓶中,培养温度为32℃,发酵8天,分别得到野野村菌atcc 39365与野野村菌mm-46发酵液,在4℃、10000r/min离心15min,分别获得野野村菌atcc 39365与野野村菌mm-46发酵上清液;
[0054]
其中,发酵培养基的制备方法为将麦芽浸粉30g、酵母浸粉12g、麦芽糖醇4g混合均匀,加入1l的蒸馏水,30%koh调ph7.8,115℃灭菌30min;其中,种子培养基的制备方法为将麦芽浸粉4g、酵母浸粉4g、葡萄糖10g混合均匀,加入1l的蒸馏水,30%koh调ph7.8,115℃灭菌30min。
[0055]
2)分别取100μl野野村菌atcc 39365与野野村菌mm-46发酵上清液,用超纯水稀释后,0.22μm水系滤膜过滤,得到待分析样品;
[0056]
3)高效液相色谱-质谱联用分析
[0057]
高效液相色谱条件如下:
[0058]
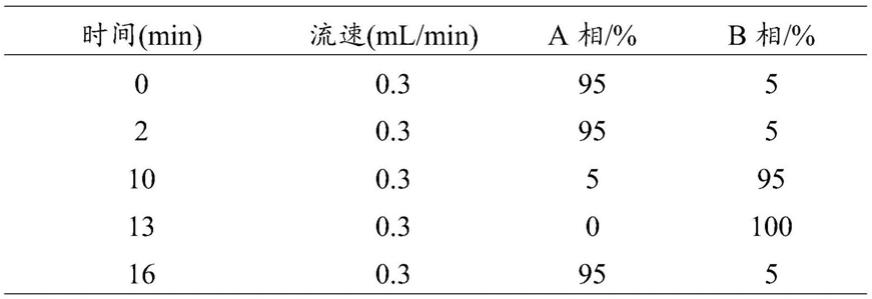
色谱柱:t3色谱柱(100mm
×
2.1mm,5μm);流动相:a相为10mmol/l甲酸铵(含0.1%甲酸),b相为甲醇(含0.02%甲酸);流速:0.3ml/min,进样量10μl;高效液相洗脱程序如表1所示,质谱条件参数设置见表2。
[0059]
表1高效液相洗脱程序
[0060][0061]
质谱条件为:
[0062]
优化的质谱条件如下所示:喷司他丁母离子为269.10m/z,子离子为135.1m/z和153.2m/z;2
′‑
氨基-2
′‑
脱氧腺苷母离子为267.10m/z,子离子为136.1m/z和114.1m/z;仪器自动优化功能获得的其他质谱参数详见表2。经ce优化后的各母离子被充分打碎,子离子响应值高、干扰也较低。通过以上优化,使得喷司他丁和2
′‑
氨基-2
′‑
脱氧腺苷的检测更具特异性(图2)。
[0063]
表2质谱条件参数设置
[0064][0065]
采用外标法进行野野村菌atcc 39365与野野村菌mm-46发酵液中的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷定量测定,其中喷司他丁标准曲线、2
’‑
氨基-2
’‑
脱氧腺苷标准曲线如图3所示,野野村菌atcc 39365与野野村菌mm-46发酵上清液中的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷最高产量的结果见表3。
[0066]
4)生物量的测定
[0067]
取50ml离心管,将上述发酵24、48、72、96、120、144、168、192h的发酵液分别移至离心管中,4℃
×
10000r/min离心15min,去除上清液,加蒸馏水清洗菌体沉淀,4℃
×
10000r/min离心15min,重复此步骤2~3次,以完全除去菌体沉淀中残留的发酵液。将离心管存于-80℃,冷冻12h后,在冷冻干燥机中冻干30~35h后,经称重,减去空管的重量即为菌体的生物量。
[0068]
表3 atcc 39365与mm-46发酵液中的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷产量对比
[0069][0070]
由图2的结果表明,野野村菌mm-46通过发酵成功制备得到了喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷。
[0071]
通过表3和图4的结果可知,野野村菌mm-46发酵上清液中的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷产量显著高于野野村菌atcc 39365,且由图4可知,发酵培养至第6天野野村菌mm-46发酵上清液中的喷司他丁和2
’‑
氨基-2
’‑
脱氧腺苷产量最高。
[0072]
由图5可知,野野村菌mm-46发酵生物积累量显著高于野野村菌atcc 39365。
[0073]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
