一种获取高产高稳定性异源
β-葡萄糖苷酶的方法
技术领域
1.本发明属于基因工程技术领域,具体涉及一种获取高产、高稳定性异源β-葡萄糖苷酶的方法和其专用工程菌株。
背景技术:
2.β-葡萄糖苷酶是具有良好生物学特性和重要生物学意义的酶,其在动物糖脂和外源糖苷代谢、防御、细胞壁木质化以及植物中芳香化合物的释放和微生物的生物质转化等多个方面发挥作用。由于通过酶促途径从生物质中提取生物燃料计划的出现,作为酶复合物限速成分的β-葡萄糖苷酶受到了广泛关注。β-葡萄糖苷酶能够将由外切葡聚糖酶和内切葡聚糖酶释放出的纤维二糖水解为葡萄糖,并解除纤维二糖对外切葡聚糖酶和内切葡聚糖酶的抑制。但是,在丝状真菌里氏木霉(trichoderma reesei)产生的纤维素降解酶系中,β-葡萄糖苷酶的不足严重影响了木质纤维素生物质的高效水解。因此,如何获得适量β-葡萄糖苷酶是生物质降解的一个主要挑战。
3.提升β-葡萄糖苷酶产量的方法主要有:基因突变、dna重组、发酵工艺优化等;通过过表达β-葡萄糖苷酶构建工程菌株是目前提高β-葡萄糖苷酶产量的常用方法。然而,现有的里氏木霉本源的β-葡萄糖苷酶底物特异性和比酶活不高,且对木质素的吸附能力强,不利于生物质的酶解。基于此,有利用选择黑曲霉来源的β-葡萄糖苷酶以弥补该不足。但是,里氏木霉分泌的多种蛋白酶会严重阻碍异源β-葡萄糖苷酶的高产,导致获得的β-葡萄糖苷酶的稳定性受到损害。因此,确保异源β-葡萄糖苷酶的活性保持稳定,不随时间而改变,同样是在工业生产中亟待解决的重大问题。
4.经检索,通过基因工程策略构建含vib1敲除表达盒的蛋白背景低的里氏木霉底盘菌株,再将黑曲霉来源β-葡萄糖苷酶(bgla)过表达盒转化该盘菌获得表达异源β-葡萄糖苷酶的工程菌株,并通过优选发酵条件和发酵培养基以实现获取高产、高稳定性异源β-葡萄糖苷酶的方法目前尚无报道。
技术实现要素:
5.针对现有技术的不足,本发明要解决的问题是提供获取高产、高稳定性异源β-葡萄糖苷酶的方法和其专用工程菌株。
6.本发明所述的获取高产高稳定性异源β-葡萄糖苷酶的方法,步骤是:
7.(1)制备vib1敲除表达盒:以里氏木霉qm53的基因组dna为模板,分别以vib1-2148-uf1/vib1-112-ur1、vib1-4-df1/vib1-1765-dr1为引物扩增vib1基因的上下游同源臂;然后将其上游同源臂、抗性基因hph、下游同源臂按顺序进行连接,即制得vib1敲除表达盒;其中:所述的抗性基因hph扩增于质粒t-hph;所述引物核苷酸序列如下:
8.vib1-2148-uf1:tctgttcttacgccttgg;
9.vib1-112-ur1:ctcccttcaatatcagttaaggtcgctggtgtcgcaatggata;
10.vib1-4-df1:aaattccgtcaccagccctgggttgttgcgacatcacttgagc;
11.vib1-1765-dr1:tagtgaactggcgacgatttt;
12.(2)构建蛋白背景降低的里氏木霉底盘菌株:以里氏木霉qm53为出发菌株;制备里氏木霉qm53原生质体,然后将vib1敲除表达盒转化进入里氏木霉qm53的原生体中,经筛选、验证,验证正确的菌株命名为里氏木霉底盘菌株δvib1;
13.(3)制备黑曲霉来源β-葡萄糖苷酶(bgla)过表达盒:以里氏木霉qm53的基因组dna为模板,扩增cbh1基因的上下游同源臂以及带有cbh1基因信号肽同源序列的cdna1基因的启动子;以黑曲霉的基因组dna为模板,扩增携带有cbh1基因的信号肽的bgla基因及其终止子区域;然后将其上游同源臂、抗性基因prta、cdna1启动子、携带cbh1信号肽的bgla基因及其终止子、下游同源臂按顺序进行连接,即制得β-葡萄糖苷酶(bgla)过表达盒;其中所述的抗性基因ptra扩增于质粒t-ptra;
14.(4)构建表达异源β-葡萄糖苷酶的工程菌株:制备里氏木霉底盘菌株δvib1的原生质体,将β-葡萄糖苷酶(bgla)过表达盒转化进入里氏木霉底盘菌株δvib1的原生质体,经筛选、验证,验证正确的菌株命名为表达异源β-葡萄糖苷酶的工程菌株qvb-1;
15.(5)发酵生产β-葡萄糖苷酶:将活化后的表达异源β-葡萄糖苷酶的工程菌株qvb-1以108个/ml的数量接种到发酵培养基中,在温度28-34℃、转速180-220r/min条件下发酵4-7天,即得到含异源β-葡萄糖苷酶的发酵液;其中,所述发酵培养基配方是:乳糖16-22g/l,cacl
2 0.9-1.2g/l,mgso4·
7h2o 0.4-0.8g/l,kh2po
4 3-5g/l,(nh4)2so
4 3-5g/l,玉米干粉10-16g/l,caco
3 0.6-0.8g/l,tween-80 0.5-2ml/l,甘油1-3ml/l,ph 4.8
±
0.1,115℃,灭菌30min。
16.上述获取高产高稳定性异源β-葡萄糖苷酶的方法中:所述工程菌株qvb-1的发酵条件优选是:温度为33℃,转速为210r/min,发酵培养时间为7天。
17.上述获取高产高稳定性异源β-葡萄糖苷酶的方法中:所述工程菌株qvb-1的发酵培养基配方优选是:乳糖18g/l,cacl
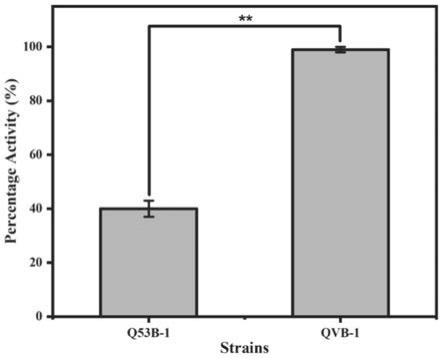
2 1.2g/l,mgso4·
7h2o 0.6g/l,kh2po
4 4g/l,(nh4)2so
4 3g/l,玉米干粉12g/l,caco
3 0.8g/l,tween-80 1ml/l,甘油2.5ml/l,ph 4.8。
18.本发明提供了一种用于获取高产高稳定性异源β-葡萄糖苷酶的工程菌,其特征在于:所述工程菌菌株命名为表达异源β-葡萄糖苷酶的工程菌株qvb-1,该菌株是以里氏木霉qm53为出发菌株,在其基因组中敲除了vib1基因且增加有黑曲霉来源的β-葡萄糖苷酶编码基因bgla;其中vib1基因被抗性基因hph替换;携带cbh1信号肽的bgla基因被整合到cbh1位点上,该bgla基因的上游为组成型启动子pcdna1,下游为bgla本源的终止子。
19.本发明公开了一种获取高产、高稳定性异源β-葡萄糖苷酶的方法,其显著的有益效果体现在:利用本发明所述方法生产的异源β-葡萄糖苷酶活力可达到65.4iu/mg,显著高于出发菌株qm53(1.1iu/mg);此外,本发明所述方法获得的发酵液具有更低的胞外蛋白背景,胞外蛋白酶分泌量显著下降,异源β-葡萄糖苷酶的稳定性明显提升,发酵液在30℃下孵育4周后,β-葡萄糖苷酶活力依旧保持稳定不变,而对照组的β-葡萄糖苷酶活性显著下降。本发明提供的方法较已有方法生产成本低,不仅能提高β-葡萄糖苷酶产量,而且异源β-葡萄糖苷酶稳定性也增强,长期储存时酶活力不受影响,具有良好的工业开发和应用前景。
附图说明
20.图1.低蛋白背景并适用于蛋白稳定性表达分泌的里氏木霉底盘菌株δvib1的构
建和验证。
21.其中:a是vib1缺失菌株里氏木霉底盘菌株δvib1构建的示意图;b是vib1缺失菌株里氏木霉底盘菌株δvib1的southern blot验证示意图;m为1kb dna marker,qm53为出发菌株。
22.图2.底盘菌株的滤纸酶活力和蛋白酶活力测定结果。
23.其中:a是滤纸酶活力(总纤维素酶活力)结果;b是蛋白酶活力测定结果;qm53为出发菌株,δvib1为里氏木霉底盘菌株δvib1。
24.图3.利用工程菌株获取的异源β-葡萄糖苷酶酶活力平板检测图。
25.其中:qvb-1是以δvib1为出发菌株构建的bgla表达菌株;q53b-1是以qm53为出发菌株构建的bgla表达菌株。
26.图4.利用工程菌株获取的异源β-葡萄糖苷酶活力测定结果。
27.其中:a是分泌到培养基中的β-葡萄糖苷酶的sds-page分析,b是β-葡萄糖苷酶活力测定结果。
28.图5.异源β-葡萄糖苷酶发酵上清液中的酶活稳定性测定结果。
29.其中:将β-葡萄糖苷酶活性的下降程度作为分析稳定性的指标;q53b-1为对照菌株。
具体实施方式
30.下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
31.下述实施例中,所用的菌株里氏木霉qm53购自美国菌种保藏中心。其他所使用的材料、质粒、试剂等,如无特殊说明,均从商业途径得到。
32.实施例1.vib1敲除表达盒和β-葡萄糖苷酶(bgla)过表达盒的构建。
33.首先以里氏木霉qm53的基因组dna为模板,分别以vib1-2148-uf1/vib1-112-ur1、vib1-4-df1/vib1-1765-dr1为引物扩增vib1基因的上下游同源臂,然后将上游同源臂、抗性基因hph、下游同源臂按顺序进行连接,得到vib1敲除表达盒;其中所述的抗性基因hph扩增于质粒t-hph;表达盒示意图见图1a所示。
34.以里氏木霉qm53的基因组dna为模板,使用引物对cbh1-3870-uf1/cbh1-2021-ur1和cbh1-1-df1/cbh1-1690-dr1扩增cbh1的上下游同源臂。并且使用引物对ptra-f1/ptra-r1从t-ptra质粒中扩增ptra表达盒。使用引物对cdna1-f/cdna1-r(cbh1)扩增带有cbh1基因信号肽同源序列的cdna1基因的启动子。以黑曲霉(a.niger)的基因组dna为模板,利用引物对bgla-f1(cbh1)/bgla-r1扩增携带有cbh1基因的信号肽的bgla基因及其终止子区域;然后将其上游同源臂、抗性基因prta、cdna1启动子、携带cbh1信号肽的bgla基因及终止子、下游同源臂按顺序进行连接,得到β-葡萄糖苷酶(bgla)过表达盒;其中,bgla基因(genbank accession no.am270402)。
35.上述引物对具体核苷酸序列如下:
36.vib1-2148-uf1:tctgttcttacgccttgg;
37.vib1-112-ur1:ctcccttcaatatcagttaaggtcgctggtgtcgcaatggata;
38.vib1-4-df1:aaattccgtcaccagccctgggttgttgcgacatcacttgagc;
39.vib1-1765-dr1:tagtgaactggcgacgatttt;
40.cbh1-3870-uf1:tacgccactgtgaggaggcc;
41.cbh1-2021-ur1:
42.ggaagcataaagtgtaaagcctggggtcggtgagccacgtgcttttt;
43.cbh1-1-df1:agctccgtggcgaaagcc;
44.cbh1-1690-dr1:gaatcacaaaccgccaaagc;
45.ptra-f1:ccccaggctttacactttat;
46.ptra-r1:ccgctcttgcatctttgtt;
47.cdna1-f:taatacaaacaaagatgcaagagcggcagacaatgatggtagcagc;
48.cdna1-r(cbh1):
49.agcacgagctgtggccaagaaggccgagatgacggccaacttccgat
50.acatgagagaagttgttggattgat;
51.bgla-f1(cbh1):
52.caatagtcaaccgcggactgcgcatcatgaggttcactttgatcgaggc;
53.bgla-r1:tgcgtcaggctttcgccacggagctttagtgaacagtaggcagagacg。
54.实施例2.利用vib1敲除表达盒转化里氏木霉qm53构建里氏木霉底盘菌株δvib1,再利用bgla过表达盒转化里氏木霉底盘菌株δvib1构建表达异源β-葡萄糖苷酶的工程菌株
55.里氏木霉qm53的遗传转化是利用peg/cacl2介导的原生质体转化方法,潮霉素b抗性基因hph为选择标记。
56.将纯化的vib1敲除表达盒转化里氏木霉qm53原生质体构建里氏木霉底盘菌株δvib1。其中所述peg/cacl2介导的原生质体转化的具体方法如下:
57.(1)里氏木霉qm53原生质体的制备:
58.准备新鲜的里氏木霉孢子(2周之内),涂布于5个铺有玻璃纸的pda平板上,每个平板涂布100μl浓度为108个/ml的孢子悬液。30℃培养13.5h,待菌丝生长到合适的长度后,将菌丝从玻璃纸上轻轻洗到细胞壁裂解液中(0.1g裂解酶溶解到20ml溶液i),混匀后30℃静置裂解90min;将裂解物用四层擦镜纸过滤,50ml离心管收集滤液;将滤液4℃,2,000rpm离心15min,弃上清;用溶液ii将轻轻地重新悬浮沉淀,4℃,2,000rpm再次离心15min后弃上清;加入200-1,200μl溶液ii重悬浮沉淀,其置于冰上以备后续实验。整个制备原生质体细胞的过程需在冰上进行,所用枪头应剪掉头部。
59.其中pda培养基组成为:土豆200g,加水煮沸1h,8层纱布过滤,滤液添加葡萄糖20g,并补足水分至1l,自然ph,2%琼脂粉,115℃灭菌30min;
60.溶液i:1.2m山梨醇,0.1m kh2po4,ph 5.6,115℃灭菌30min;
61.溶液ii:1m山梨醇,50mm cacl2,10mm tris-hcl,ph 7.5,115℃灭菌30min。
62.(2)vib1敲除表达盒转化里氏木霉qm53的原生质体获得里氏木霉底盘菌株:
63.将vib1敲除表达盒、预冷的peg溶液、qm53原生质体按体积比1:5:20的比例混合,冰浴20min,后在混合液中加2ml常温的peg溶液,37℃水浴3min,最后加4ml溶液ii,轻轻混
匀;将上述溶液加入到含300μg/ml潮霉素b(购自roche公司)的50ml转化上层培养基中,混匀后倒入预先凝固的转化下层培养基平板,冷却凝固后,30℃培养3-5天,挑选生长良好的转化株,提取染色体,进行southern blot验证。
64.利用引物对probe-vib1-f/probe-vib1-r从qm53基因组中扩增出包含vib1基因上游的探针,基因组dna经bamhⅰ酶切后与dig标记探针杂交,结果如图2a所示,其中出发菌株产生1.6kb的条带,而转化子能够产生出2.8kb的条带,证明δvib1表达盒被成功转入qm53中,将验证成功的里氏木霉底盘菌株菌株命名为里氏木霉底盘菌株δvib1。
65.其中:涉及引物序列是:
66.probe-vib1-f:ccctccatcatctgccgttct;
67.probe-vib1-r:acagaggcaagtgacgaagc。
68.(3)bgla过表达盒转化里氏木霉底盘菌株δvib1获得的表达异源β-葡萄糖苷酶的工程菌株:
69.首先,参照步骤(1)方法制备好里氏木霉底盘菌株δvib1的原生质体,将bgla过表达盒、预冷的peg溶液、里氏木霉底盘菌株δvib1原生质体按体积比1:5:20的比例混合,冰浴20min,后在混合液中加2ml常温的peg溶液,37℃水浴3min,最后加4ml溶液ii,轻轻混匀;然后,将上述溶液加入到含0.3μg/ml吡啶硫胺素氢溴酸盐(购自sigma公司)的50ml转化上层培养基中,混匀后倒入预先凝固的转化下层培养基平板,30℃培养3-5天,挑选转化株进行分子验证,将验证正确的β-葡萄糖苷酶过表达工程菌株命名为表达异源β-葡萄糖苷酶的工程菌株qvb-1。
70.同理,以相同方法将bgla过表达盒转化入qm53菌株中,筛选、验证,将验证正确的菌株命名为表达异源β-葡萄糖苷酶的工程菌株q53b-1,将其作为对照菌株。
71.其中上述peg培养基为:25%peg 6000,50mm cacl2,10mm tris-hcl,ph 7.48。
72.上层培养基(g/l):葡萄糖10,mgso4·
7h2o 1,kh2po
4 10,(nh4)2so
4 6,c6h5na3o
7 3,山梨醇182.18,琼脂糖6;
73.下层培养基(g/l):葡萄糖10,mgso4·
7h2o 1,kh2po
4 10,(nh4)2so
4 6,c6h5na3o
7 3,琼脂粉20;以上培养基均经115℃灭菌30min后使用。
74.实施例3.利用工程菌株获取高产、高稳定性异源β-葡萄糖苷酶的发酵方法:
75.将实施例2获得的表达异源β-葡萄糖苷酶的工程菌株qvb-1、对照菌株q53b-1以及里氏木霉底盘菌株δvib1、出发菌株里氏木霉qm53按108个/ml分别接种到50ml(250ml的三角瓶)种子培养基中,摇瓶培养36小时后分别取10ml再各自接种到发酵培养基中。
76.其中上述种子培养基为(g/l):葡萄糖10g/l,乳糖5g/l,cacl
2 1.2g/l,mgso4·
7h2o 0.6g/l,kh2po
4 8g/l,(nh4)2so
4 1.5g/l,115℃灭菌30min。
77.将四种菌株在温度26℃、转速170r/min条件下培养3天,发酵培养基为:乳糖16-22g/l,cacl
2 0.9-1.2g/l,mgso4·
7h2o 0.4-0.8g/l,kh2po
4 3-5g/l,(nh4)2so
4 3-5g/l,玉米干粉10-16g/l,caco
3 0.6-0.8g/l,tween-80 0.5-2ml,甘油1-3ml,简称为a;
78.将四种菌株在温度36℃、转速230r/min条件下培养8天,发酵培养基为:乳糖16-22g/l,cacl
2 0.9-1.2g/l,mgso4·
7h2o 0.4-0.8g/l,kh2po
4 3-5g/l,(nh4)2so
4 3-5g/l,玉米干粉10-16g/l,caco
3 0.6-0.8g/l,tween-80 0.5-2ml,甘油1-3ml,简称为b;
79.将四种菌株在温度28-34℃、转速180-220r/min条件下培养4-7天,发酵培养基为:
乳糖16-22g/l,cacl
2 0.9-1.2g/l,mgso4·
7h2o 0.4-0.8g/l,kh2po
4 3-5g/l,(nh4)2so
4 3-5g/l,玉米干粉10-16g/l,caco
3 0.6-0.8g/l,tween-80 0.5-2ml,甘油1-3ml,简称为c;
80.将四种菌株在温度28-34℃、转速180-220r/min条件下培养培养4-7天,发酵培养基为:乳糖14g/l,cacl
2 0.6g/l,mgso4·
7h2o 0.2g/l,kh2po
4 2g/l,(nh4)2so
4 2g/l,玉米干粉8g/l,caco
3 0.4g/l,简称为d;
81.将四种菌株在温度28-34℃、转速180-220r/min条件下培养培养4-7天,发酵培养基为:乳糖24g/l,cacl
2 1.5g/l,mgso4·
7h2o 1.0g/l,kh2po
4 7g/l,(nh4)2so
4 7g/l,玉米干粉18g/l,caco
3 1.0g/l,tween-80 2.5ml,甘油4ml,简称为e;
82.分别取a,b,c,d,e条件下获得发酵液,测定β-葡萄糖苷酶活力(pnpgase)确定最适的发酵条件和发酵培养基。
83.β-葡萄糖苷酶活力(pnpgase)测定方法是:
84.取100μl适当稀释的含酶发酵液,加入50μl 10mmol/l对硝基苯-β-d-吡喃葡萄糖苷(pnpg)柠檬酸buffer溶液(ph 4.8),混匀,50℃水浴30min后加入150μl 10%na2co3终止反应。405nm测od值。同时以未加酶液的管为空白对照。
85.酶活的定义:在50℃、ph4.8条件下,每毫升酶液每分钟产生对硝基酚(pnp)的微摩尔数。
86.β-葡萄糖苷酶活力(pnpgase)测定结果显示,c组结果β-葡萄糖苷酶活性较高,特别是工程菌株qvb-1最高,因此确定c组为工程菌株qvb-1最适的发酵条件和发酵培养基,即:将菌株在温度28-34℃、转速180-220r/min条件下培养4-7天,发酵培养基为:乳糖16-22g/l,cacl
2 0.9-1.2g/l,mgso4·
7h2o 0.4-0.8g/l,kh2po
4 3-5g/l,(nh4)2so
4 3-5g/l,玉米干粉10-16g/l,caco
3 0.6-0.8g/l,tween-80 0.5-2ml,甘油1-3ml。
87.优选的,所述工程菌株qvb-1发酵的条件如下:培养温度为34℃,转速为210r/min,培养时间为7天;
88.优选的,所述工程菌株qvb-1的发酵培养基组分如下:乳糖18g/l,cacl
2 1.2,mgso4·
7h2o 0.6,kh2po
4 4,(nh4)2so
4 3,玉米干粉12,caco
3 0.8,tween-80 1ml,甘油2.5ml,ph 4.8,115℃,灭菌30min。
89.实施例4.利用工程菌株获取的高产、高稳定性异源β-葡萄糖苷酶的产物分析。
90.将实施例2获得的表达异源β-葡萄糖苷酶的工程菌株qvb-1、对照菌株q53b-1以及里氏木霉底盘菌株δvib1、出发菌株里氏木霉qm53,利用β-葡萄糖苷酶活力平板检测方法对转化株酶活力进行检测,具体方法是:取等量菌丝接种至七叶苷平板上,30℃培养1天后,观察菌落周围的黑色晕圈的形成。如图3所示,qvb-1菌株和q53b-1菌株菌落周围出现明显的黑色区域,而δvib1和qm53的菌落周围无表型圈,说明异源β-葡萄糖苷酶活性得到显著提升。
91.上述七叶苷平板培养基(g/l)为:cmc-na 10,七叶苷4,柠檬酸铁0.5,(nh4)2so
4 2,mgso4·
7h2o 0.5,k2hpo
4 1,酵母膏1,2%琼脂粉,115℃灭菌30min。
92.将实施例2获得的工程菌株qvb-1、对照菌株q53b-1以及里氏木霉底盘菌株δvib1、出发菌株里氏木霉qm53的发酵液进行离心,取上清,并测定酶活力。图2a显示底盘菌株δvib1的滤纸酶活力显著下降;图2b显示底盘菌株δvib1的胞外蛋白酶活性显著下降。图4b显示工程菌株qvb-1的β-葡萄糖苷酶活力为65.4iu/mg,对照菌株q53b-1中的β-葡萄糖
甘酶活力为35.9iu/mg,而底盘菌株δvib1以及出发菌株qm53的β-葡萄糖苷酶活力分别为0iu/mg和1.1iu/mg;图5显示qvb-1的发酵上清液放置于30℃孵育4周后,β-葡萄糖苷酶活力保持稳定不变,而q53b-1菌株β-葡萄糖苷酶活力下降程度超过放置前的60%。这表明,当利用通过本发明所获取的工程菌株在进行生产时,可以避免不需要的降解,提高了该异源蛋白的生产水平和稳定性。
93.将上述获得的工程菌株qvb-1、对照菌株q53b-1以及里氏木霉底盘菌株δvib1、出发菌株里氏木霉qm53所制备的发酵液用于sds-page分析中。结果如图4a所示,qvb-1菌株酶液中呈现出纯净的胞外背景,而q53b-1菌株胞外蛋白背景高。上述结果表明:利用本发明构建的以δvib1为底盘的异源β-葡萄糖苷酶过表达菌株表达的蛋白纯度更高,生产的β-葡萄糖苷酶具有更少副产物。
94.基于此,可以确定利用本发明公开的获取高产、高稳定性异源β-葡萄糖苷酶的方法能够提高β-葡萄糖苷酶的产量,且发酵液中蛋白酶背景低,能有效缓解异源蛋白被错误降解的问题,保持极高的异源蛋白稳定性。该方法具有较高的实际应用价值。
95.滤纸酶活力根据中华人民共和国轻工业标准qb 2583-2003测定。
96.1)滤纸酶活力测定方法:
97.将1
×
6cm(50
±
1mg)滤纸折叠放入试管底部,加入1.5ml ph 4.8的柠檬酸缓冲液和0.5ml适当稀释的粗酶液,混匀。50℃水浴60min后加入3ml dns,漩涡震荡混匀后煮沸10min,加蒸馏水定容到25ml,摇匀,540nm测od值。空白对照是先加dns再加酶液。
98.蛋白酶活力根据中华人民共和国轻工业标准sb/t 10317-1999测定。
99.2)蛋白酶活力测定方法:
100.取100μl适当稀释的酶液,加入100μl偶氮酪蛋白底物溶液(ph 7.2),混匀,37℃水浴30min后加入500μl 5%三氯乙酸溶液,10,000rpm离心1分钟,440nm测od值。以未加酶液的管为空白对照。
