1.本发明属于生物技术领域,涉及一种构建高产羟基化甾体原料药的重组大肠杆菌及应用。具体说,是通过构建一种含新型细胞色素p450酶scye与还原伴侣的共表达重组大肠杆菌对甾体药物进行生物转化从而获得16α-羟基孕酮、16α-羟基雄烯二酮、16α-羟基睾酮等16α-羟基甾体类化合物的方法。
背景技术:
2.甾体类药物是目前市场上最重要的药物之一,分布广泛,具有多种生理活性。至今为止,全球生产的甾体药物高达400多种,其中包括甾体激素类、甾体生物碱、甾体皂苷类等。近年来,随着甾体生物转化技术的不断发展,甾体药物被广泛应用于治疗风湿、心血管、胶原性疾病、淋巴性白血病、人体器官移植、抗肿瘤、细菌性脑炎、皮肤病、内分泌失调等疾病。据统计,甾体激素药物销售额早在十年前就已高于280亿美元,约占全球医药总销售额的6%,成为产量第二大类药物,仅次于抗生素。
3.甾体类化合物是自然界广泛存在的一类天然化学成分,结构中具有环戊烷多氢菲甾体母核,而其生理功能取决于它们结构骨架中官能团的类型、数量和位置。因此,功能基团(如羟基化)的区域和立体选择性引入对于类固醇药物在广泛治疗应用中的生物活性很重要。例如,类固醇类药物的11-羟基化在抗炎方面具有重要作用;19-羟基化可用于合成炔诺酮、米非司酮、苯丙酸诺龙、替勃龙等多种高效甾体激素药物的中间体,具有巨大的市场价值;此外,16α-羟基化是皮质类固醇合成中的一个重要反应,能够有效降低药物副作用又能维持其抗炎作用和糖代谢。甾体药物的工业生产主要通过改造天然的化合物而获得,但是应用化学方法改造时,合成步骤多,得率低,价格昂贵,因此寻找一种合理、高效的方法对甾体类药物进行羟基化修饰是至关重要的。细菌细胞色素p450单加氧酶能够以高度区域和立体选择性的方式在特定位置羟基化不同结构的甾体类药物,通过构建含p450酶及还原伴侣的重组大肠杆菌对甾体药物进行生物转化使得羟基化甾体药物的生产更加方便、经济,这对制药工业具有重要意义。
技术实现要素:
4.本发明的目的在于公开了一种构建高产羟基化甾体原料药重组大肠杆菌的方法。
5.本发明的目的是通过以下技术方案来实现的:一种构建高产羟基化甾体原料药重组大肠杆菌的方法与工艺,该方法包括以下步骤:
6.一种高产羟基化甾体原料药的重组大肠杆菌,所述的重组大肠杆菌通过如下方法构建获得:
7.利用dna重组技术将scye基因克隆至pt7ns-camab载体中,获得重组载体pet11::scye::cama-camb,将其导入到大肠杆菌bl21(de3)中,最终获得共表达重组大肠杆菌;所述scye基因序列为seq id no.1所示,载体pt7ns-camab的基因序列如seq id no.2所示,重组载体pet11::scye::cama-camb的基因序列如seq id no.3所示。
8.一种高产羟基化甾体原料药的重组大肠杆菌的应用,具体为:
9.(1)在od
600
值为0.6-0.8的重组大肠杆菌菌液中加入5-氨基乙酰丙酸盐和异丙基-β-d-硫代半乳糖苷,同时将温度降至20℃,继续培养22h。其中,5-氨基乙酰丙酸盐的浓度为0.5mm,异丙基-β-d-硫代半乳糖苷的浓度为0.2mm。
10.(2)将步骤1培养得到的菌液在4℃,8000rpm条件下离心10min,收集沉淀的菌体,并用预冷的磷酸盐缓冲液对菌体进行洗涤,磷酸盐缓冲液的ph为7.2。收集洗涤后的菌体,将其悬浮于磷酸盐缓冲液中得到菌体磷酸盐缓冲液。
11.(3)利用所述菌体磷酸盐缓冲液进行生物转化实现16α羟基化:将甾体原料药加入菌体磷酸盐缓冲液中在25℃下振荡反应24h。待反应结束后,加入等体积乙酸乙酯停止反应,对反应液中的产物进行提取、分离,得到16α-羟基化甾体药物。
12.进一步地,所述步骤2中,悬浮的磷酸盐缓冲液为离心前的菌液的体积比为1:5。所述甾体原料药溶解在质量浓度为36%的助溶剂羟丙基-β-环糊精中,加入菌体磷酸盐缓冲液后的终浓度为0.1~1.5g/l。
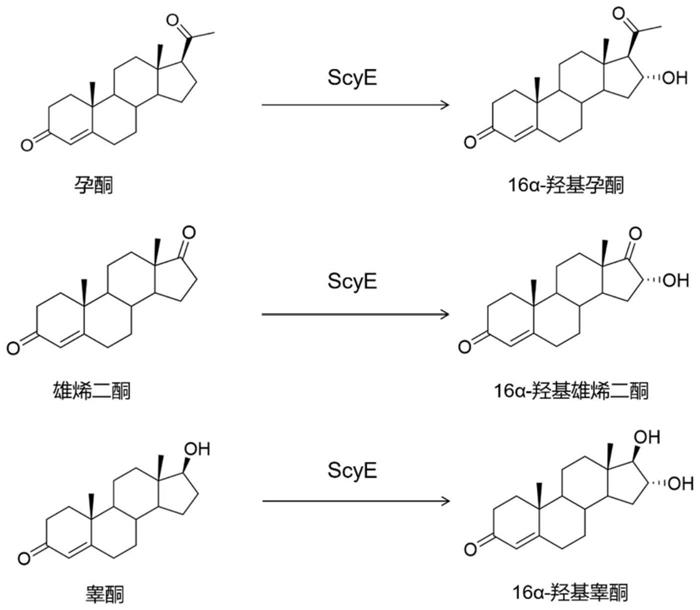
13.进一步地,所述甾体原料药为孕酮、雄烯二酮、睾酮等。其中,孕酮经生物转化,得到16α-羟基孕酮。雄烯二酮经生物转化,得到16α-羟基雄烯二酮。睾酮经生物转化,得到16α-羟基睾酮。
14.进一步地,ph为7.2的磷酸盐缓冲液由终浓度为50mm的磷酸盐和甘油组成,甘油体积为所述磷酸盐缓冲液的10%。
15.本发明的有益效果是:本发明提供了一种高产羟基化甾体原料药的方法及工艺,利用含新型p450酶及还原伴侣的重组大肠杆菌对甾体药物进行生物转化,得到16α-羟基化甾体类化合物。该方法也证明了新型p450酶scye对孕酮、雄烯二酮和睾酮进行区域选择性单加氧化,并定向生成羟基化化合物。本发明的优势在于
①
本发明涉及的scye为一种新型细胞色素p450酶,其重组菌可转化孕酮、雄烯二酮和睾酮等甾体药物产生16α位羟基化产物,这些产物现阶段在工业上主要由化学合成方法获得,存在着合成方法困难、副产物多等缺陷,而本发明很好的解决了现阶段存在的问题;
②
scye对甾体类药物具有严格的区域选择性和立体选择性,可产生唯一产物即16α位羟基甾体类化合物,可有效分离提取到相应的产物;
③
本发明构建的催化体系可以在温和条件下选择性地进行氧化反应,相比于传统化学反应的复杂工艺流程,其在生物制药领域具有很大的应用价值;
④
本发明构建的催化体系在扩大规模时,对高浓度甾体药物依然保持较好的转化率,产量可观,在工业生产上具有极大的优势。
附图说明
16.图1为利用重组大肠杆菌生物转化甾体药物的流程图;
17.图2为实验样品的hplc图谱,其中图2a为孕酮,图2b为雄烯二酮,图2c为睾酮;
具体实施方式
18.据我们的研究发现,含pet11::scye::cama-camb的重组大肠杆菌可催化甾体药物16α-羟基化反应。据研究表明,16α-羟基化是皮质类固醇合成中的一个重要反应,可以使药物副作用大大减少,但是可以使其抗炎和糖代谢作用保持不变。构建重组大肠杆菌进行生
物转化可大大减少副反应产物,易于分离出所要的产物,提高生产效率,是高效生产羟基化甾体药物的有效方法。
19.以下结合实施例详细对本发明作进一步地说明。实施方案为便于更好的理解本发明,但并非对本发明的限制。
20.实施例1
21.图1为利用重组大肠杆菌生物转化甾体药物的流程图,具体包括如下步骤:
22.1、制备共表达重组大肠杆菌:
23.用nde i和spe i限制性内切酶对scye和载体pt7ns-camab进行酶切。载体pt7ns-camab(国际专利号us 2006/0234337a1,其基因序列如seq id no.2所示)的cama基因与camb基因分别编码恶臭假单胞菌的假单胞氧还蛋白还原酶与假单胞氧还蛋白。
24.将线性化载体与双酶切后的scye基因按一定比例混合后,在t4 dna ligase的催化下,16℃反应30min,得到重组质粒pet11::scye::cama-camb,所述pet11::scye::cama-camb基因序列如seq id no.3所示。将重组质粒pet11::scye::cama-camb转入到大肠杆菌bl21(de3)感受态细胞,利用含有氨苄青霉素的lb固体培养基筛选出单克隆,得到多酶共表达的重组大肠杆菌。
25.2、重组大肠杆菌培养:
26.将共表达重组大肠杆菌接种到含氨苄青霉素抗性的lb液体培养基中,lb培养基的ph为7.4,在37℃、220rpm条件下过夜培养,得到重组大肠杆菌的种子液。将种子液以1:100(v/v)的接种量接到10ml含氨苄青霉素抗性的tb培养基中进行扩大培养、发酵;接种后,重组的大肠杆菌继续在37℃,180rpm的条件下培养3-4h,直至菌液od
600
值达到0.6-0.8,然后加入5-氨基乙酰丙酸盐和异丙基-β-d-硫代半乳糖苷诱导菌体大量表达蛋白,同时将温度降低至20℃,继续培养22h。所述氨苄青霉素在培养基中的浓度为100μg/ml,所述5-氨基乙酰丙酸盐在tb培养基中的浓度为0.5mm,所述异丙基-β-d-硫代半乳糖苷在tb培养基中的浓度为0.2mm。
27.lb培养基的制备方法:称取10g胰蛋白胨、5g酵母提取物、10g nacl溶于950ml去离子水中,用5m naoh调ph至7.4,最后用去离子水定容至1l,在15psi高压下蒸汽灭菌20min。
28.tb培养基的制备方法:称取24g酵母提取物、12g胰蛋白胨、2.31g磷酸二氢钾、12.56g磷酸氢二钾和4ml甘油溶于950ml去离子水中,用5m naoh调ph至7.4,最后用去离子水定容至1l,在15psi高压下蒸汽灭菌20min。
29.3、菌体的收集:
30.重组大肠杆菌在扩大培养22h后,在4℃、8000rpm条件下离心10min,收集沉淀的菌体;并采用预冷的ph为7.2磷酸盐缓冲液对菌体进行洗涤,所述磷酸盐缓冲液由终浓度为50mm的磷酸盐和10%的甘油组成。收集洗涤后的菌体,并将其悬浮于上述磷酸盐缓冲液中,用于对甾体类药物进行生物转化。
31.4、甾体药物的溶解:
32.将甾体药物溶解在质量浓度为36%的助溶剂羟丙基-β-环糊精中,甾体药物原液浓度为30mm。
33.5、甾体药物的生物转化:
34.将悬浮于ph为7.2的磷酸盐缓冲液中的菌体中加入甾体药物孕酮,在25℃振荡反
应24h后,加入等体积乙酸乙酯萃取两次,收集合并乙酸乙酯层,待乙酸乙酯彻底挥干后,得到16α-羟基孕酮。所述离心前发酵液与磷酸盐缓冲液的体积比为5:1(例如:1l发酵液离心后的菌体加200ml磷酸盐缓冲液),所述孕酮在上述反应体系中的浓度为300μm。
35.实施例2
36.按照实施例1步骤2进行扩大培养(1l),收集得到22g菌体,向菌体中加入200ml磷酸盐缓冲液。在悬浮于磷酸盐缓冲液的菌体中投入300mg溶于助溶剂的孕酮,25℃下振荡反应24h。用等体积乙酸乙酯对产物进行萃取,利用薄层色谱分析羟基化产物的产量。
37.实施例3
38.将实施例1步骤3中的底物换成雄烯二酮,所述雄烯二酮在上述反应体系中的终浓度为300μm,其余条件不变,最终得到16α-羟基雄烯二酮。
39.实施例4
40.将实施例1步骤3中的底物换成睾酮,所述睾酮在上述反应体系中的浓度为300μm,其余条件不变,最终得到16α-羟基睾酮。
41.实施例5
42.向上述挥干后的样品中分别加入100μl甲醇溶解,进行高效液相色谱检测分析。本发明中所使用的高效液相色谱仪是waters e2695高效液相色谱系统和cosmosil填充柱,流动相采用的是35vt%-100vt%甲醇-水梯度洗脱20min,检测波长是240nm,流速是1ml/min。
43.图2为实验样品的hplc图谱,其中图2a为孕酮的标准品和反应后获得的16α-羟基孕酮图谱,孕酮和16α-羟基孕酮的保留时间分别为16.625min和12.302min,本实验的转化率计算公式为产物的峰面积/(产物的峰面积与底物的峰面积之和)。根据上述计算公式可得出该重组菌催化孕酮得到16α-羟基孕酮的转化率为100%。图2b为雄烯二酮的标准品和反应后获得的16α-羟基雄烯二酮图谱,雄烯二酮和和16α-羟基雄烯二酮保留时间分别为13.352min和10.238min,根据上述计算公式可得出该重组菌催化雄烯二酮得到16α-羟基雄烯二酮的转化率为100%。图2c为睾酮的标准品和反应后获得的16α-羟基睾酮图谱,睾酮和和16α-羟基睾酮保留时间分别为14.278min和10.430min,根据上述计算公式可得出该重组菌催化睾酮得到16α-羟基睾酮的转化率为100%。hplc图谱结果显示均获得单一产物并且完全转化,说明了具有严格的底物选择性和催化的高效性。
44.另外,实施例2中1l扩大培养后的薄层色谱分析结果中转化率达到50%左右,理论产量可达约150mg/l发酵液,产业化优势非常突出。
45.此发明所构建的含新型细胞色素p450酶的重组大肠杆菌可以高效转化孕酮、雄烯二酮及睾酮等甾体药物并生成16α-羟基化甾体类化合物,与化学合成法相比,可以在低污染、低能耗、高选择性的条件下进行,并产生单一产物,因此在制备甾体原料药的工业生产上具有良好的发展前景。
