1.本发明涉及工业废渣综合利用技术领域,特别的涉及钢渣的综合利用方法。
背景技术:
2.在2019年,全球粗钢产量达到18.699亿吨,并伴随有大量冶金渣和co2气体的产生。然而,由于活性低、易磨性差等原因,钢渣处理成本高,现成为冶金渣中最难被处理利用的固废,国内外对如何有效地利用钢渣做了大量的研究,目前其利用主要是作为凝胶材料、废水处理中的吸附剂、化肥、建筑材料和土壤调节剂等,但这些方法只能处理部分废渣,利用率不到30%,且工艺复杂,处理成本高,产品附加值较低,大量废渣只能堆存处理,这不仅占用土地,而且对水体或土壤均存在潜在的危害,同时,钢铁企业是人为co2排放的主要源头之一,目前,由co2引起的温室效应已经对人类产生了严重的威胁。1990年,nature上提出一种捕获和利用co2的技术-矿物碳酸化,其概念源于自然界中co2被矿物吸收的过程,碳被硅酸盐矿化固定为碳酸盐,由于该工艺原料来源广泛、无需监测、可永久储存且封存潜力巨大等优点,被认为是地质封存的替代路线,是一种极具潜力的大规模、低成本减排co2的方式。随着研究的深入,由于渣中钙含量高,渣的碱度大,能就地处理二氧化碳进行矿物碳酸化,所以钢渣也被广泛用于固定二氧化碳。
3.近年来,利用钢渣进行矿物碳酸化生成高纯碳酸钙沉淀(pcc)成为了研究热点,其中,氯化铵溶液作为浸出剂进行碳酸化具有高选择性、高效率和溶液纯度高等特点,其主要化学反应如下:2cao
•
sio2(s)+4nh4cl(aq)
→
2cacl2(aq)+2h2o(l)+sio2(s)
↓
+4nh3(aq)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)4nh3(aq)+2co2(aq)+2cacl2(aq)+4h2o(l)
→
2caco3(s)
↓
+4nh4cl(aq)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)可见,氯化铵还可以循环使用。该工艺能够处理冶金废渣并就地固定二氧化碳制备高纯度碳酸钙,但铵盐浸出后钢渣后的废渣又变成了二次废渣,如果能够利用矿物碳酸化产生的二次渣将有助于减缓该工艺所面临的挑战,从而使该工艺在经济上更具有可行性。
4.微晶玻璃是由基础玻璃经过核化、晶化一种含有大量微晶体的多晶固体材料。在一定工艺下,微晶玻璃可具有良好的化学稳定性和机械性能,因此在化工、冶金、生物、建筑或电力等方面都有应用。以cao、mgo、sio2、al2o
3 为主要成分的微晶玻璃(cmas体系)的主晶相一般由casio3或caosio2和camgsi
206
等多种晶相组成,其中以camgsi
206
成分为主的透辉石类微晶玻璃具有很高的抗酸碱侵蚀的能力,同时具有更加优异的性能,有望在不久的将来成为新式的建筑装饰材料,因此,以camgsi
206
为主成分的透辉石相微晶玻璃的制备及其性能研究是当前的一个热点。
5.利用废渣作为建筑材料的原料可大大提高其利用率,尤其是以工业废渣为原料制备的微晶玻璃,不仅在抗折强度、体积密度等方面性能相较于同类建材更为优异,而且十分环保,应用前景十分广阔。由于冶金渣的主要含量有cao,sio2,al2o3和mgo,与cao-mgo-al2o
3-sio
2 (cmas)系微晶玻璃成分相似,国外已经有国家成功地将高炉渣和其它废渣制备了矿渣微晶玻璃。我国利用高炉渣、钢渣等冶金废渣制取微晶玻璃己有报道。但以钢渣为原
料制备cmas系微晶玻璃时,由于渣中含有大量的氧化钙,需要添加二氧化硅、三氧化二铝作为玻璃网络形成体才能获得稳定的微晶玻璃。因此,为了获得适宜的基础玻璃成分以使微晶玻璃的碱度为 0.5 左右,需要加入大量的改质剂,但这显然会增加工艺成本。目前,国内外未见到将利用钢渣浸出液制备碳酸钙并将滤渣提铁制备微晶玻璃的研究报道。
技术实现要素:
6.针对现有技术存在的上述不足,本发明的目的在于提供一种钢渣的综合利用方法,解决现有技术对钢渣的利用率过低、工艺复杂、生产成本高、产品附加值低、会产生废气和废渣、造成二次污染等问题。
7.为了解决上述技术问题,本发明采用如下的技术方案:一种钢渣的综合利用方法,包括以下步骤:1)向钢渣中加入氯化铵溶液进行浸出反应,得到cacl
2-nh4cl-nh
3-h2o体系的浸出液和干燥的滤渣,备用;2)将步骤1)得到浸出液中通入二氧化碳,当所述浸出液的ph值为7.1时停止反应,再经真空抽滤、润洗和干燥后,得到碳酸钙,反应溶液返回循环浸出钢渣;3)将步骤1)得到的滤渣中加入少量的二氧化硅和还原剂混合并研磨,然后将上述混合物置于高温炉进行碳热还原反应,渣铁熔融分离后将其进行分离,得到铁和熔融还原渣;4)将步骤3)得到的熔融还原渣中加入添加剂后进行充分的澄清均化,然后在600℃下退火2 h并随炉冷却至室温,制得基础玻璃,再将进行热处理得到微晶玻璃。
8.进一步,所述浸出反应温度为40~60℃。
9.进一步,所述浸出液中cacl2的浓度为0.4mol/l,nh4cl的浓度为1mol/l,nh4ho的浓度为0.8mol/l。
10.进一步,所述二氧化碳的流量为45 ml/min。
11.进一步,所述还原剂为煤粉或碳粉。
12.进一步,所述二氧化硅的加入量为滤渣的20~40wt%。
13.进一步,所述碳热还原反应是在1500℃保温0.5~2h。
14.进一步,所述澄清和均化是在1300~1350℃保温0.5~2h。
15.进一步,所述热处理是在780~820℃下核化保温0.5~1h,940~980℃下晶化保温0.5~1h。
16.进一步,所述添加剂为tio2、cr2o3或b2o3。
17.进一步,所述微晶玻璃的晶相主要为透辉石。
18.相比现有技术,本发明具有如下有益效果:1、本发明通过氯化铵对钢渣进行浸出,利用浸出液就地固封二氧化碳制备高纯度的碳酸钙产品,然后把浸出后的二次残渣在高温还原提铁后,直接将熔融状态的废渣制备成微晶玻璃。该工艺具有能处理钢渣和二氧化碳,并在提铁的同时制备碳酸钙和微晶玻璃等高附加值产品,氯化铵溶液也重复循环利用,过程无废水废气产生等优点。本发明有效的提高了钢渣的利用率,同时改善钢渣和二氧化碳造成的环境问题,也避免了环境污染和资源浪费,解决现有技术对钢渣的利用率过低、工艺复杂、生产成本高、产品附加值低、会产生废气和废渣、造成二次污染等问题。
19.2、本发明利用浸出后的残渣还原提铁并制备透辉石微晶玻璃,由于浸出反应选择性的只浸出了钙离子,因此降低了残渣中cao的含量,并可显著的提高渣的碱度,从而提高了二氧化硅和al2o3的含量,一方面避免大量二氧化硅、三氧化二铝等改质剂的加入就能提高还原提铁的效率并制备透辉石相的微晶玻璃,另外一方面,降低了渣系的熔点,有利于渣铁分离和冶炼成本。
20.3、本发明以炼钢过程中产生的废弃物钢渣为原料,制备的产物中碳酸钙的纯度高,铁的回收率达到98%以上以及微晶玻璃的晶相主要为透辉石,具有更加优异的力学性能。可见,本发明不仅可以全部利用钢渣,使原来的工业废渣资源化,变废为宝,实现钢渣的高附加值利用。同时本方法工艺简单,就地利用现有设备,生产成本低,产品附加值高。无三废排出,因而,本发明具有很大的经济效益和社会效益,具有良好的应用前景。
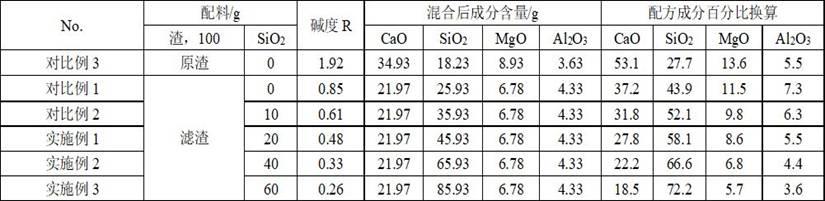
附图说明
21.图1为样品的xrd衍射图谱;a为钢渣原渣,b为滤渣。
22.图2为碳热还原反应产物宏观图片。
23.图3为碱度对钢渣中铁的回收率xfe及渣中全铁质量分数wfe的影响。
24.图4为不同al2o3下sio
2-cao-mgo-al2o3四元相图的变化趋势图。
25.图5为碳热还原反应后熔融还原渣的xrd分析图谱;φ尖晶石,θ黄长石,
●
透辉石,*sio2;δca2sio4,χmgo。
26.图6为热处理后微晶玻璃的xrd分析图谱;λ钙长石, θ黄长石,
●
透辉石。
具体实施方式
27.下面结合实施例对本发明作进一步的详细说明。以下实施例所用钢渣来源于武汉钢铁集团鄂城钢铁有限责任公司。所用试剂无特别说明均为普通市售产品。以下实施例中化学组成分析采用x射线荧光光谱仪进行定量分析,并采用化学分析分析渣中的全铁和金属铁含量。物相分析是将试样研磨过200目分样筛后,采用x射线衍射仪检测,差热分析是将试样研磨至250目,采用微机差热天平进行分析。
28.一、一种钢渣的综合利用方法实施例1一种钢渣的综合利用方法,包括以下步骤:1)将研磨至过60目的钢渣中加入4 mol/l的nh4cl溶液,按照固液比1:20 g/ml在翻转摇匀仪中于60℃反应了24 h,然后过滤,得到cacl
2-nh4cl-nh
3-h2o体系的浸出液和过滤后的渣,其中,cacl2的浓度为0.4mol/l,nh4cl的浓度为1mol/l,nh4ho的浓度为0.8mol/l;将所述滤渣在110 ℃下鼓风干燥箱中干燥24 h,得到滤渣。
29.2)将步骤1)得到浸出液中通入45ml/min的二氧化碳,当所述浸出液的ph值为7.1时停止反应,再经真空抽滤、润洗和干燥后,得到碳酸钙,反应溶液可返回循环用于浸出钢渣。
30.3)将步骤1)将得到的干燥后的滤渣研磨后与煤粉和sio2混合,使sio2的加入量为残渣质量的20%,并在研钵中研磨20 min,使试样充分混合,称重后放入刚玉坩埚中,外套石墨坩锅置于立式高温气氛管式炉中,在80 ml/min的氮气下升温至1500℃,保温60min,渣铁
熔融分离后将其进行分离,得到铁和熔融还原渣。
31.4)将还原提铁后得到的熔融还原渣加入添加剂tio2升温至1350℃,并保温120min,待熔化、澄清均化后,在600℃下退火2h,随炉冷却至室温,制得基础玻璃。
32.5)将制得的基础玻璃试样研磨至250目以下,在常压氩气保护下以10℃/min的升温速率升温至1200℃,并以此对基础玻璃在790℃核化1h,970℃下晶化1h进行热处理,制备微晶玻璃。
33.实施例2一种钢渣的综合利用方法,包括以下步骤:1)将研磨至过60目的钢渣中加入4 mol/l的nh4cl溶液,按照固液比1:20 g/ml在翻转摇匀仪中于60℃反应了24 h,然后过滤,得到cacl
2-nh4cl-nh
3-h2o体系的浸出液和过滤后的渣,将所述滤渣在110 ℃下鼓风干燥箱中干燥24 h,得到滤渣。
34.2)将步骤1)得到浸出液中通入45ml/min的二氧化碳,当所述浸出液的ph值为7.1时停止反应,再经真空抽滤、润洗和干燥后,得到碳酸钙,反应溶液可返回循环用于浸出钢渣。
35.3)将步骤1)将得到的干燥后的滤渣研磨后与碳粉和sio2混合,使sio2的加入量为残渣质量的40%,并在研钵中研磨20 min,使试样充分混合,称重后放入刚玉坩埚中,外套石墨坩锅置于立式高温气氛管式炉中,在80 ml/min的氮气下以5~10℃/min的速度升温至1500℃,保温60min,渣铁熔融分离后将其进行分离,得到铁和熔融还原渣。
36.4)将还原提铁后得到的熔融还原渣中加入添加剂cr2o3,以5~10℃/min的速度升温至1350℃,并保温120min,待熔化、澄清均化后,在600℃下退火2h,随炉冷却至室温,制得基础玻璃。
37.5)将制得的基础玻璃试样研磨至250目以下,在常压氩气保护下以10℃/min的升温速率升温至1200℃,并以此对基础玻璃在800℃核化1h,960℃下晶化1h进行热处理,制备微晶玻璃。
38.实施例3一种钢渣的综合利用方法,包括以下步骤:1)将研磨至过60目的钢渣中加入4 mol/l的nh4cl溶液,按照固液比1:20 g/ml在翻转摇匀仪中于60℃反应了24 h,然后过滤,得到cacl
2-nh4cl-nh
3-h2o体系的浸出液和滤渣,其中,cacl2的浓度为0.4mol/l,nh4cl的浓度为1mol/l,nh4ho的浓度为0.8mol/l;将所述滤渣在110 ℃下鼓风干燥箱中干燥24 h,得到滤渣。
39.2)将步骤1)得到浸出液中通入45ml/min的二氧化碳,当所述浸出液的ph值为7.1时停止反应,再经真空抽滤、润洗和干燥后,得到碳酸钙,反应溶液可返回循环用于浸出钢渣。
40.3)将步骤1)将得到的干燥后的滤渣研磨后与煤粉和sio2混合,使sio2的加入量为滤渣质量的60%,并在研钵中研磨20 min,使试样充分混合,称重后放入刚玉坩埚中,外套石墨坩锅置于立式高温气氛管式炉中,在80 ml/min的氮气下以5~10℃/min的速度升温至1500℃,保温60min,渣铁熔融分离后将其进行分离,得到铁和熔融还原渣。
41.4)将还原提铁后得到的熔融还原渣中加入添加剂b2o3,以5~10℃/min的速度升温至1350℃,并保温120min,待熔化、澄清均化后,在600℃下退火2h,随炉冷却至室温,制得基
础玻璃。
42.5)将制得的基础玻璃试样研磨至250目以下,在常压氩气保护下以10℃/min的升温速率升温至1200℃,并以此对基础玻璃在800℃核化1h,970℃下晶化1h行热处理,制备微晶玻璃。
43.对比例1未添加sio2,其它实验步骤同实施例1。
44.对比例2sio2的添加量为滤渣的10%,其它实验步骤同实施例1。
45.对比例3未进行氯化铵的浸出反应,其它实验步骤同实施例1。
46.二、产物检测1、将钢渣原渣和本发明得到的滤渣的主要化学成分进行分析,如表1所示,然后将钢渣原渣和滤渣进行x射线衍射分析,结果如图1所示。
47.表1 钢渣原渣和滤渣的xrf化学成分(wt%) caofe2o3sio2mgomnoal2o3p2o5其他合计原渣34.9325.9118.238.933.773.632.512.09残渣21.9731.9825.936.783.994.333.491.53从表1中可以看出,与原渣相比,通过氯化铵浸出后得到的滤渣,钙含量降低,sio2和铁含量相对增加,这有利于铁的提取和基础玻璃的调配。图1为钢渣原渣和残渣的x射线衍射图谱,可知钢渣中主要存在4种物相:ro相、feo、ca2sio4和cafe2o4,对比浸出后滤渣中物相,可知氯化铵在浸出过程中钙的硅酸盐发生了反应,钙被浸出。
48.2、将钢渣原渣和本发明得到的滤渣加入不同量sio2,并分析各渣系的化学成分和碱度,结果如表2所示。
49.表2从表2可以看出,各渣系均为典型的cao-mgo-sio
2-al2o3系,渣的成分应在目标析晶区内,这是因为主晶相在一定程度上决定了微晶玻璃产品的性能,考虑cmas微晶玻璃的机械强度以及耐磨性、化学稳定性等性能,透辉石为目标物相。忽略其他成分并加入不同含量的sio2后,将ca、si、mg和al的氧化物换算为100%,此时al2o3的含量为3.6%~7.3%,如图2为factsage计算的sio
2-cao-mgo-al2o3四元相图,可见在本文研究范围内,渣的熔点随着al2o3含量升高而降低,但透辉石相区则随着al2o3的增加向cao含量增加的方向缓慢扩大。al2o3含量在3%~9%范围内时,透辉石相区的cao、sio2和mgo的含量分别在16%~34%、51%~67%和6%~23%之间。
50.综上,表明本发明的残渣的熔点较低,这有利于渣铁分离和冶炼成本;与原渣相
比,由于本发明的残渣选择性的只浸出了钙离子,降低了cao的含量,因此可显著的提高渣的碱度,显著提高sio2的含量,从而避免大量二氧化硅、三氧化二铝等改质剂的加入就能还原提铁并制备透辉石的微晶玻璃,大大降低生产成本。
51.3、碳热反应结束后,对实施例和对比例还原试样进行宏观拍照,如图2所示。取出坩埚中的渣和铁进行化学分析(国标yb/t 148-2009)和称量,并按照式(1)和式(2)计算铁回收率和金属还原率。
52.x
fe
=m
回收fe
/m
钢渣tfe
×
100%
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1)m
钢渣tfe
=m
回收fe
+m
还原后渣tfe
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(2)式中:x
fe
—钢渣中铁的回收率;m
回收fe
—回收的铁量;m
钢渣tfe
—钢渣中tfe量;m
还原后渣tfe
—还原后渣中tfe量;从图3可以看出,对比例3为原渣的碳热还原产物,此时原渣熔点较高,在1500℃下并未达到熔点,因此钢渣中的铁被高温渣包裹,而难以被煤粉还原聚集,依旧呈粉状。对比例1为滤渣的碳热还原产物,可以看到有金属铁的产生,但大量还原金属铁仍然被包裹在渣中,并没有生成饼状铁块。在1500℃下,对比例2、实施例1、实施例2和实施例3中加入不同量sio2后均实现了较为良好的渣-铁分离。检测结果表明渣中全铁质量分数为0.62%,计算得到铁的还原率为98.47%,这是由于渣中总有一部分铁以铁珠的形式弥散于其中,回收率很难达到100%。值得注意的是除了试样实施例3中观察到大块的玻璃相外,其他试样并未观察到明显玻璃相,这是由于试样实施例3中加入了过量的sio2,起网络形成体作用,在玻璃结构网络中单独形成玻璃。
53.从图4可知,随渣的碱度降低,铁的回收率增加,渣中全铁含量减少,当r为1.9时,渣铁无法实现分离,铁的回收量为零。当碱度减小到0.9,即滤渣中未加入二氧化硅时,渣-铁分离效果较差,但铁的回收率达到66.5%,碱度继续减少到小于0.9,即滤渣中加入一定量的二氧化硅时,渣-铁都能够实现良好的分离,渣中全铁含量继续减少,由于渣中总有一部分铁以铁珠的形式弥散于其中,回收率很难达到100%。当碱度减少到0.26时,此时渣中加入了大量的二氧化硅,使渣的熔点增高,流动性变差,影响了铁的回收。
54.4、将实施例和对比例碳还原提铁后的熔融还原渣进行xrd分析,结果如图5所示。
55.从图5的物相图谱来看,原渣经碳还原后,主要含有ca2sio4;而滤渣经碳还原后主要晶相为黄长石,还含有少量熔点较高的尖晶石,这可能是没有形成饼状铁块的主要原因,并且随着sio2的增加,晶相从黄长石向透辉石,再向sio2演变,这与产物的宏观图片一致。
56.5、将对比例2和实施例1~2热处理后得到的微晶玻璃物相如图6所示。
57.从图中可以看出,经过热处理后,部分基础玻璃转化为了微晶玻璃,其中对比例2的晶相主要为黄长石,实施例1的晶相主要为透辉石,并有部分黄长石,而实施例2的晶相主要为透辉石,并有部分的钙长石,说明本发明制备的微晶玻璃主要以透辉石为主。
58.以上所述仅为本发明的较佳实施例而已,并不以本发明为限制,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
