1.本发明涉及有机小分子荧光探针制备技术领域,具体涉及一种比率型光学/光声双模式荧光探针及其制备方法和应用。
背景技术:
2.近年来,一氧化碳(co)的研究不断引起人们的兴趣,这种气体分子长期以来一直被认为是有毒、有害、甚至致命。然而,它现在被认为是一种重要的气体信号分子,它不仅可以在人类体内内源性产生,而且在我们的生活中起着非常重要的生理作用,co作为一种重要的气体递质,参与许多重要的生理过程,如血管舒张、神经传递、抗炎和抗凋亡,越来越多的证据表明,许多疾病与体内co含量的异常有关,如氧化应激、心力衰竭等,虽然co具有许多重要的生理作用和药理意义,但co的许多生物学功能尚不清楚,为此,开发有效的分析方法来敏感和选择性地检测复杂生命系统中co的动态变化是非常有价值的。
3.目前虽然有许多荧光探针可以检测到细胞内co,但可视化内源性co的释放行为仍然是一个挑战,荧光有限的组织穿透深度(《1mm)使得光学成像只能显示表面,这一缺点可以通过光声(pa)成像来克服,它在组织中的成像深度为几厘米,但光声(pa)成像的灵敏度和分辨率较低,因此,设计一种成像深度好、灵敏度和分辨率高的荧光探针具有重要的意义。
技术实现要素:
4.针对现有技术的不足,本发明的目的在于提供一种比率型光学/光声双模式荧光探针及其制备方法和应用,解决现有的荧光探针成像深度不好以及灵敏度和分辨率不佳的技术问题。
5.为了实现上述目的,本发明采取如下技术方案:
6.一种比率型光学/光声双模式荧光探针dop-co,所述荧光探针的结构式如下:
[0007][0008]
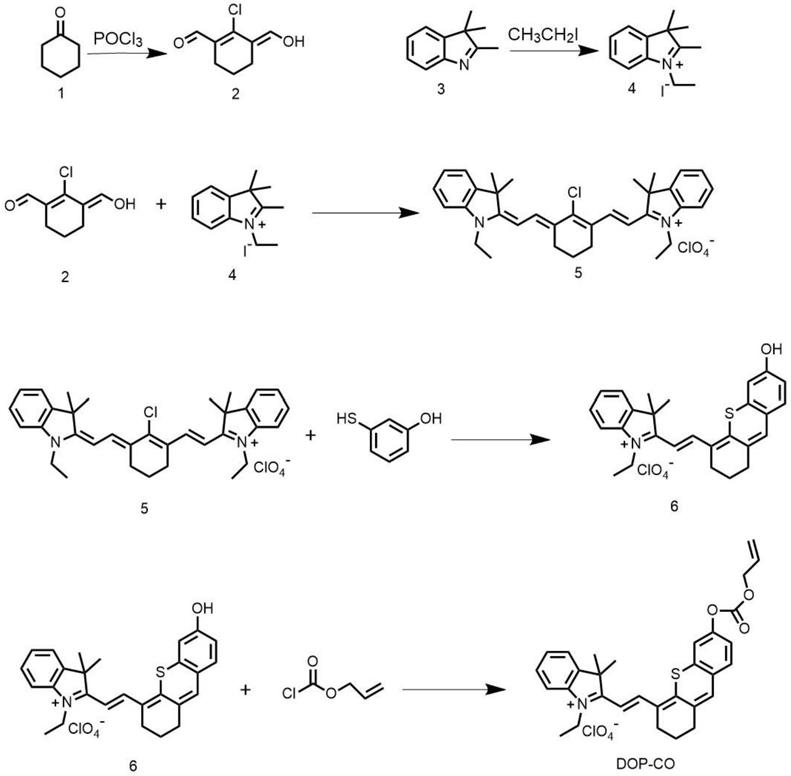
本发明提供上述比率型光学/光声双模式荧光探针dop-co的制备方法,其合成路线如下:
[0009][0010]
优选的,所述制备方法包括如下步骤:
[0011]
(1)化合物2的制备:在冰浴条件下,将三氯氧磷逐滴加入到dmf和ch2cl2的混合溶液中,再逐滴加入市售原料1,搅拌均匀,然后撤去冰浴,升温进行反应,待反应结束后,将反应产物进行分离提纯,得到化合物2;
[0012]
(2)化合物4的制备:将市售原料3溶解在乙腈中,然后加入碘乙烷和碳酸钾,混合均匀后进行反应,待反应结束后,将反应产物进行分离提纯,得到化合物4;
[0013]
(3)化合物5的制备:将步骤(1)得到的化合物2和步骤(2)得到的化合物4溶解在正丁醇和甲苯的混合溶液中,进行反应,待反应结束后,加入高氯酸,然后将反应产物进行分离提纯,得到化合物5;
[0014]
(4)化合物6的制备:将步骤(3)得到的化合物5溶解在dmf中,加入间巯基苯酚,搅拌均匀,然后再加入氢化钠进行反应,待反应结束后,将反应产物进行分离提纯,得到化合物6;
[0015]
(5)荧光探针dop-co的制备:将步骤(4)得到的化合物6溶解在二氯甲烷中,再加入三乙胺,搅拌均匀,然后在冰浴条件下加入氯甲酸烯丙酯进行反应,待反应结束后,将反应产物进行分离提纯,即得到荧光探针dop-co。
[0016]
优选的,步骤(1)中,原料1和三氯氧磷的摩尔比为1:1.5,dmf和ch2cl2的体积比为1:1,反应条件为:在氮气保护气氛下进行回流反应,反应温度为80-100℃,反应时间为2-6h。
[0017]
优选的,步骤(2)中,所述原料3、碘乙烷和碳酸钾的摩尔比为1-3:1-3:2-3,反应条件为:在氮气保护气氛下进行回流反应,反应温度为80-100℃,反应时间为12-18h。
[0018]
优选的,步骤(3)中,化合物2和化合物4的摩尔比为1:2,正丁醇和甲苯的体积比为7:3,反应条件为:在氮气保护气氛下进行回流反应,反应温度为100-120℃,反应时间为8-10h。
[0019]
优选的,步骤(4)中,化合物5、间巯基苯酚和氢化钠的摩尔比为1:3:2,反应条件为:在氮气保护气氛下进行回流反应,反应温度为45-60℃,反应时间为10-16h。
[0020]
优选的,步骤(5)中,化合物6、三乙胺和氯甲酸烯丙酯的摩尔比为1-3:3-5:3-5,反应条件为:在氮气保护气氛下进行回流反应,反应温度为25-45℃,反应时间为8-16h。
[0021]
本发明还提供上述比率型光学/光声双模式荧光探针在检测co中的应用。
[0022]
优选的,所述应用具体包括如下步骤:
[0023]
(1)将荧光探针dop-co溶于二甲亚砜(dmso),制成探针母液;
[0024]
(2)将探针母液加入到待测液和生物样品中;
[0025]
(3)加入co后,用紫外分光光度计和荧光光谱仪观察含有探针母液的待测液的紫外和荧光光谱的变化;
[0026]
(4)将探针母液稀释后静脉注射到小鼠体内,然后进行近红外荧光和光声成像,从而得到动物活体内co近红外荧光和光声图像。
[0027]
与现有技术相比,本发明具有如下有益效果:
[0028]
(1)本发明提供的探针dop-co合成步骤简单、纯化方便,成像优异;
[0029]
(2)本发明提供的探针dop-co采用双比率型荧光和光声检测,检测信号精准;
[0030]
(3)本发明提供的探针dop-co生物相容性好,对细胞或动物的伤害小;
[0031]
(4)本发明提供的探针dop-co具有使用非电离辐射、无创辐射、对正常组织无影响的优点。
附图说明
[0032]
图1是所制备的探针dop-co的1h nmr图谱;
[0033]
图2是所制备的探针dop-co的
13
c nmr图谱;
[0034]
图3是所制备的探针dop-co对co的滴定紫外和光声谱图的变化测试结果;
[0035]
图4是所制备的探针dop-co对co的滴定荧光光谱图的变化情况及其线性关系测试结果;
[0036]
图5是所制备的探针dop-co对co选择性的测试结果;
[0037]
图6是所制备的探针dop-co的细胞毒性测试结果;
[0038]
图7是所制备的探针dop-co共定位测试结果;
[0039]
图8是所制备的探针dop-co用于检测细胞外源性co测试结果;
[0040]
图9是所制备的探针dop-co用于检测小鼠肝脏内co荧光成像实验结果;
[0041]
图10是所制备的探针dop-co用于检测小鼠肝脏内co光声成像实验结果。
具体实施方式
[0042]
以下通过具体较佳实施例对本发明作进一步详细说明,但本发明并不仅限于以下
的实施例。
[0043]
需要说明的是,无特殊说明外,本发明中涉及到的化学试剂均通过商业渠道购买。
[0044]
实施例1
[0045]
一种比率型光学/光声双模式荧光探针dop-co的制备方法,包括如下步骤:
[0046]
(1)化合物2的制备:在冰浴条件下,将0.15mol三氯氧磷逐滴加入到100ml dmf和ch2cl2的混合溶液中,其中dmf和ch2cl2的体积比为1:1,再逐滴加入0.1mol市售原料1,搅拌均匀,然后撤去冰浴,在氮气保护气氛下进行回流反应,反应温度为80℃,反应时间为3h,待反应结束后,将反应产物进行分离提纯,得到化合物2;
[0047]
(2)化合物4的制备:将0.1mol市售原料3溶解在100ml乙腈中,然后加入0.1mol碘乙烷和0.2mol碳酸钾,混合均匀,在氮气保护气氛下进行回流反应,反应温度为80℃,反应时间为12h,待反应结束后,将反应产物进行分离提纯,得到化合物4;
[0048]
(3)化合物5的制备:将2.8g化合物2和10g化合物4溶解在100ml正丁醇和甲苯的混合溶液中,其中正丁醇和甲苯的体积比为7:3,然后在氮气保护气氛下进行回流反应,反应温度为100℃,反应时间为8h,待反应结束后,加入10ml高氯酸,然后将反应产物进行分离提纯,即得到化合物5;
[0049]
(4)化合物6的制备:将100mg化合物5溶解在10ml无水dmf中,加入50μl间巯基苯酚,搅拌5min后,加入10mg的氢化钠,然后在氮气保护气氛下进行反应,反应温度为50℃,反应时间为10h,待反应结束后,将反应产物进行分离提纯,即得到化合物6;
[0050]
(5)荧光探针dop-co的制备:将332mg化合物6溶解在5ml二氯甲烷中,加入310mg三乙胺,室温下搅拌10min,在冰浴条件下缓慢加入1.04g氯甲酸烯丙酯进行反应,反应在氮气保护气氛下进行,反应温度为25℃,反应时间为8h,待反应完毕后,将反应液减压蒸馏蒸出溶剂,然后采用硅胶层析柱分离提纯反应产物,洗脱剂为二氯甲烷/乙醇(v/v=10:1),即得到荧光探针dop-co。
[0051]
将实施例1所制备的荧光探针dop-co进行核磁及质谱表征,图1是探针dop-co的1h nmr图谱;图2是探针dop-co的
13
c nmr图谱;
[0052]1h nmr(600mhz,dmso-d6)δ8.27(d,j=14.8hz,1h),7.86(d,j=11.6hz,1h),7.82(d,j=8.0hz,1h),7.74(d,j=2.4hz,1h),7.66(s,1h),7.61(d,j=6.2hz,1h),7.55(t,j=7.4hz,1h),7.33(t,j=8.0hz,1h),7.30(s,1h),6.90(d,j=14.8hz,1h),6.09
–
5.94(m,1h),5.43(d,j=17.3hz,1h),5.34(d,j=10.5hz,1h),4.78(dd,j=19.3,8.5hz,2h),4.54(d,j=7.2hz,2h),2.74(dt,j=30.3,5.9hz,4h),1.99(d,j=6.0hz,2h),1.76(s,6h),1.41(t,j=7.2hz,3h)。
[0053]
13
c nmr(151mhz,dmso)δ178.87,174.77,152.82,151.26,149.65,145.74,142.98,140.64,134.72,134.05,132.82,132.08,130.14,128.15,127.64,127.20,123.54,121.68,119.60,118.00,114.58,109.24,69.60,51.58,35.58,31.76,27.92,27.02(2c),25.58,14.43.hrms(esi)m/z calcd for c
31h32
no3s
+
([m]
+
):498.2097;found 498.2123。
[0054]
将实施例1所制备的荧光探针dop-co进行实验测试:
[0055]
(1)荧光探针dop-co与co反应的紫外吸收光谱和光声谱图实验
[0056]
将实施例3所制备的荧光探针dop-co溶于dmso溶剂中,配制成5mm的探针母液,然后分别在紫外皿和ep管中加入1998μl液体(pbs:dmso=7:3)和4μl探针母液,再加入co和
pdcl2,将上述溶液用紫外分光光度计和多光谱光声断层扫描成像系统测试其吸收光谱和光声光谱图,测试结果见图3。
[0057]
从图3a可以观察到在加入co后,紫外光谱峰在610nm下降,740nm上升,光声谱图从670nm红移到740nm,呈现一个比值的变化。
[0058]
(2)荧光探针dop-co与co反应的荧光发射及其线性关系实验
[0059]
将实施例1所制备的荧光探针dop-co溶于dmso溶剂中,配制成5mm的探针母液,在荧光皿中加入1998μl液体(pbs:dmso=7:3)和4μl探针母液,然后在皿中加入co和pdcl2,将上述溶液用荧光光谱仪测试其荧光发射光谱,测试结果见图4。
[0060]
从图4a中可以观察到随着co的加入,荧光光谱峰在715nm下降,785nm上升,从图4b中可以观察到荧光强度比值与co浓度呈现良好的线性关系。
[0061]
(3)荧光探针dop-co对co的选择性实验
[0062]
将实施例1所制备的荧光探针dop-co溶于dmso溶剂中,配制成5mm的探针母液,考察在浓度为10μm的探针母液和10μm pd
2+
溶液中分别加入gsh,cys,hcy,ala,leu,trp,gly,lle,lys,hs-,hso3-,so
32-,h2o2,clo-,
·
oh,onoo-,no,no
2-,no
3-,n
3-,f-,cl-,br-,.i-,cn-,
·
tbuoo和co的荧光响应情况,测试结果见图5。
[0063]
如图所示,只有在加入co时,荧光比值才显著增强,说明与其它组分相比,探针dop-co对co有极好的选择性,可以在复杂的生物环境中特异性检测co。
[0064]
(4)荧光探针dop-co的细胞毒性测试
[0065]
分别将消化好的hela,hepg2,hl7702细胞悬浮液以每孔1
×
105个细胞180μl-1
的密度接种于96孔培养板中,放入细胞培养箱培养24小时,在显微镜中观察到细胞密度为80%时,分别向每个孔中加入20μl探针(0、2、4、6、8和10μm),继续培养24小时后加入mtt试剂(10μl,5mg/ml mtt)孵育4小时,除去细胞上清液,每孔加入100ml dmso,放置于摇床上低速震荡10分钟以充分溶解紫色的甲瓒结晶物,通过酶标仪测试甲瓒在570nm处的吸光度并计算细胞的存活率;细胞存活率用实验组平均值与空白组平均值的百分比来表示,测试结果如图6所示。
[0066]
从图中可以看到,探针dop-co在细胞内的细胞毒性较低说明探针的生物相容性较好。
[0067]
(5)荧光探针dop-co的共定位实验
[0068]
将hepg2细胞贴壁培养于内含10%胎牛血清的低糖培养液中,在37℃,5%co2的饱和湿度孵箱中培养,每隔3天更换培养液,并进行传代培养和将细胞移入共聚焦皿中进行培养,取出1个共聚焦皿将里面培养液换成1ml新鲜培养液,将5mm的探针母液,取2μl于共聚焦皿中与商业探针lydg(200nm)孵育15分钟;再取出1个共聚焦皿将里面培养液换成1ml新鲜培养液,将5mm的探针母液,取2μl于共聚焦皿中与商业探针mtdg(200nm)孵育15分钟;将共同染色的4t1细胞进行共聚焦显微镜成像,其中探针的绿色通道激发波长为488nm,荧光收集波长为505-560nm;红色通道激发波长为638nm,荧光收集波长为650-715nm;测试结果如图7所示。
[0069]
从图中可以看到,探针dop-co定位于溶酶体。
[0070]
(6)荧光探针dop-co在细胞中外源性响应co共聚焦荧光成像实验
[0071]
将密度为80%的hepg2细胞接种到共聚焦皿(35mm),培养24h后,用吸管吸除瓶内
的培养基,加入1ml新鲜培养基,荧光探针dop-co在细胞中co的外源性响应实验设置1个空白组和3个实验组,空白组加入10μm的荧光探针孵育15min,移除培养基,用pbs润洗2遍,进行成像,实验组先加10μm的探针孵育15min,移除培养基,加入1ml新鲜培养基,再分别加5eq,10eq,15eq的co孵育30min,用吸管吸除皿内的培养基,用pbs润洗2遍,进行成像,荧光成像实验过程中,激发源选择638nm,收集波段分别为660nm-715nm和720nm-795nm,实验结果如图8所示。
[0072]
从图中可以看出,空白组不加入co时通道1发出荧光,而通道2没有荧光,实验组中当加入不同当量的co时,通道2的荧光不断增强,以剂量依赖的方式,同时,通道1的荧光不断减弱,说明探针dop-co具有比值荧光成像能力,且能在细胞环境中很好的响应co。
[0073]
(7)荧光探针dop-co用于急性肝损伤小鼠活体荧光成像实验
[0074]
实验组小鼠腹腔注射apap,对照组小鼠腹腔注射等量生理盐水,八小时后,静脉注射探针dop-co进行荧光成像,实验结果如图9所示。
[0075]
从图中可以看出,在实验组中,通道1(λex=630nm滤片700nm)的图像显示,小鼠肝脏区域荧光在下降,而通道2(λex=720nm滤片790nm)的图像显示,小鼠肝脏区域明显的荧光增强;而在对照组中,通道1(λex=630nm滤片700nm)的图像显示,小鼠肝脏区域荧光增强,而通道2(λex=720nm滤片790nm)的图像显示,小鼠肝脏区域荧光基本没有变化,说明探针dop-co成功应用于急性肝损伤模型小鼠活体成像。
[0076]
(8)荧光探针dop-co用于急性肝损伤小鼠活体光声成像实验
[0077]
实验组小鼠腹腔注射apap,对照组小鼠腹腔注射等量生理盐水,八小时后,静脉注射探针dop-co进行光声成像,实验结果如图10所示。
[0078]
将探针dop-co和co注射到小鼠肝脏区域后,在pa
670
和pa
740
通道中均观察到明显的光声信号,实验结果如图10所示。
[0079]
从图中可以看出,在实验组中,通道pa
670
的图像显示,小鼠肝脏区域光声信号在下降,而通道pa
740
的图像显示,小鼠肝脏区域光声信号增强功能;而在对照组中,通道pa
670
的图像显示,小鼠肝脏区域光声信号在增强,而通道pa
740
的图像显示,小鼠肝脏区域光声信号基本不变,说明探针dop-co可能适合作为小鼠肝脏中定量检测co的pa探针。
[0080]
最后需要说明的是:以上实施例不以任何形式限制本发明。对本领域技术人员来说,在本发明基础上,可以对其作一些修改和改进。因此,凡在不偏离本发明精神的基础上所做的任何修改或改进,均属于本发明要求保护的范围之内。
