一种psma靶向核素/荧光双模态配体和分子探针与应用
技术领域
1.本发明属于核医学领域,具体地,涉及一种psma靶向核素/荧光双模态配体、一种psma靶向核素/荧光双模态分子探针,以及它们的应用。
背景技术:
2.前列腺癌(pca)作为全球男性的第二大癌症,每年患者总数接近130万,占新发癌症的13.5%,随着我国人均寿命的延长、饮食结构和生活习惯西化,我国的前列腺癌发病率更是呈快速上升趋势,成为威胁男性健康的难题之一。前列腺癌早期的准确检测对患者的治疗效果和生存至关重要。
3.前列腺癌由于进展相对缓慢往往较难及早发现,前列腺特异性抗原(psa)联合磁共振成像以及穿刺活检能有效诊断pca,但目前缺乏能界定其生物学行为的高灵敏度及特异性的功能性成像设备,近十年来pet/ct得到了长足的发展,pet/ct整合了pet兼具高灵敏度与特异度的核医学分子影像以及ct精细的解剖图像,已在原发性前列腺癌的术前诊断与分期以及治疗决策制定等多个方面发挥出巨大的潜力。在治疗上,根治性前列腺癌切除术是治疗局限性及局部进展前列腺癌最有效的方法之一,术者确定切缘范围主要依靠术前影像学检查、术中肉眼所见及探查和术者自身经验。手术切除范围过大会损伤正常组织,影响尿控等正常功能;而切除范围过小会导致阳性切缘,患者容易出现复发。因此,如何在手术中尽可能保留正常组织和功能,同时对前列腺癌侵犯区域进行彻底切除是临床医生经常需要面对和解决的问题。
4.靶向荧光术中导航技术正是解决这一问题的良方,在前列腺癌领域,存在高特异性的前列腺癌分子标志物—前列腺特异性膜抗原(psma)。psma在90%的前列腺癌中过度表达,而正常组织如泪腺唾液腺、肾脏近端小管中仅有少量表达。psma在前列腺癌中的表达水平与肿瘤的侵袭和恶性程度高度相关。因此,psma成为前列腺癌病灶精准定位显像和术中导航的理想生物标志物。靶向psma的近红外荧光手术导航技术主要利用近红外染料具有波长较长、组织穿透力较强、散射较小等优点,可在术中点亮病灶,让术者清晰地了解病灶的范围,从而对其进行更加完整有效的切除,因此,靶向psma的近红外荧光手术导航将是治疗前列腺癌的一种非常有前景的手术方式。进一步,光学-核医学双模态的分子影像探针可结合两种显像模态的优势,高灵敏度、高精确度在手术前通过核医学模态识别和定位病变组织、在手术中精准荧光标记病灶位置引导外科手术的切除。
5.目前临床实验中使用的靶向psma的核素诊疗和手术导航药物都是以谷氨酸-脲基为基本骨架。这些探针对psma具有良好的靶向性和亲和力,但是存在膀胱内核素滞留严重及肾脏内核素背景高的问题,膀胱内大量核素滞留严重影响前列腺癌早期诊断准确率,而双肾高核素背景对肾脏具有一定的毒副作用。因此亟需通过改变药物结构,开发高特异性、低肾脏排泄的psma分子影像探针,对于实现前列腺癌病灶的精准定位与分级具有重要意义。本课题组开发了新一代odap-脲基psma抑制剂,将psma分子影像探针的结合力提升至80pm,这类抑制剂具有更低的肾排泄特性。以新型odap-脲基为核心结构,在保持与psma高
亲和力的前提下,通过改变linker调节亲脂性来优化药物的体内代谢动力学特性。本课题组开发了以odap-urea-lys为全新靶向结构的探针
68
ga-p137,与经典谷氨酸类探针
68
ga-psma617相比,该探针在保持肿瘤区域摄取的同时,明显降低了在膀胱内放射性滞留,有利于原位前列腺癌精准诊断。
技术实现要素:
6.本发明的目的是提供一种新型的psma靶向核素/荧光双模态配体和分子探针与应用。
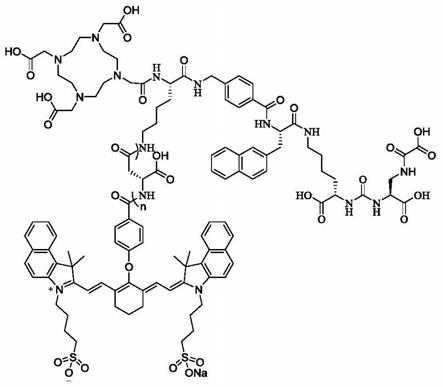
7.为了实现上述目的,本发明提供一种psma靶向核素/荧光双模态配体,具有式i所示结构,
[0008][0009]
其中,
[0010]
r为核素螯合基团;
[0011]
q为荧光基团;
[0012]
n为0-6,具体可以为0、1、2、3、4、5、6,优选为0、1、2、3、4、5,更优选为2、3、4。
[0013]
根据本发明,所述核素螯合基团通常指双功能螯合剂形成的基团,所述双功能螯合剂可以为dota、nota、noda、nodaga、dotp、teta、atsm、ptsm、edta、ec、hbedcc、dtpa、bapen、df、dfo、tacn、no2a、notam、cb-do2a、cyclen、do3a、do3ap、hynic、mas3、mag3或异腈。
[0014]
上述双功能螯合剂的结构为本领域技术人员公知,例如,dota和nota结构分别如下所示:
[0015][0016]
根据本发明一些优选实施方式,所述荧光基团为近红外荧光基团,由于近红外染料具有波长较长、组织穿透力较强、散射较小等优点,可适用于手术导航。优选地,所述近红外荧光基团为近红外一区(nir-i,700-1000nm)和/或近红外二区(nir-ii,1000-1700nm)的荧光基团。
[0017]
根据本发明一种优选实施方式,所述荧光基团如下所示,该荧光基团兼具近红外一区荧光和近红外二区荧光,更好地适用于手术导航:
[0018][0019]
更具体地,所述psma靶向双模态配体优选具有式ii所示结构,其中n为0、1、2、3、4、5、6,优选为0、1、2、3、4、5,更优选为2、3、4。
[0020][0021]
本发明的双模态配体可采用如图2-1所示的合成路线制得。反应条件:(a)三光气,三乙胺,无水dcm;(b)三乙胺,无水dcm;(c)pd/c,h2,甲醇;(d)nahco3,二氧六环,水;(e)n,n-二异丙基乙胺,2-氯三苯甲基树脂,dcm,dmf;(f)20%哌啶的dmf溶液,fmoc-3-(2-萘基)-l-丙氨酸、hbtu、hobt和dipea的dmf溶液;(g)20%哌啶的dmf溶液,fmoc-(4-氨甲基)苯甲酸、hbtu、hobt和dipea的dmf溶液;(h)20%哌啶的dmf溶液,dde-fmoc-l-赖氨酸、hbtu、hobt和dipea的dmf溶液;(i)20%哌啶的dmf溶液,dota、hbtu、hobt和dipea的dmf溶液;(j)2%联氨(hydrazine)的dmf溶液,fmoc-l-天冬氨酸-1-叔丁酯、hbtu、hobt和dipea的dmf溶液;(k)20%哌啶的dmf溶液,ly-12、pybop和dipea的dmf溶液;(l)三氟乙酸,水和三异丙基硅烷。所用原料均可商购获得或通过常规有机合成方法制得。
[0022]
本发明的第二方面提供一种psma靶向核素/荧光双模态分子探针,该探针为放射性核素标记的上述psma靶向核素/荧光双模态配体,具体地,所述放射性核素与所述核素螯合基团螯合。
[0023]
本发明的双模态分子探针可由psma靶向双模态配体经放射性核素标记制得,具体地,将配体溶于放射性标记缓冲液中,随后加入不同的放射性核素进行反应,得到相应的分
子探针。
[0024]
根据本发明,所述放射性核素可以为诊断用放射性核素,也可以为治疗用放射性核素。
[0025]
根据本发明一些优选实施方式,所述诊断用放射性核素为
68
ga、
64
cu、
18
f、
86
y、
90
y、
89
zr、
111
in、
99m
tc、
11
c、
123
i、
125
i和
124
i中的至少一种。
[0026]
根据本发明一些优选实施方式,所述治疗用放射性核素为
177
lu、
125
i、
131
i、
211
at、
111
in、
153
sm、
186
re、
188
re、
67
cu、
212
pb、
225
ac、
213
bi、
212
bi和
212
pb中的至少一种。
[0027]
本发明还提供上述psma靶向核素/荧光双模态配体或psma靶向核素/荧光双模态分子探针在制备靶向psma的核素诊疗试剂和/或手术导航药物中的应用。
[0028]
本发明以三七素-脲基为psma的靶向结构,通过优化linker,然后进行核素/荧光双功能化,设计合成了一系列靶向psma的双模态分子探针,并在体外和体内方面进行了详细的评估。该类核素/荧光双模态探针,可以用于术前pet/ct显像以制定手术路线,术中进行荧光指导,进行精准肿瘤定位和边界划分,提高术后疗效,从而应用于临床。
[0029]
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
[0030]
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。
[0031]
图1示出了ly-13至ly-16的结构式;ly-13,n=0;ly-14,n=2;ly-15,n=4;ly-16,n=6。
[0032]
图2-1示出了ly-13至ly-16的制备总路线。
[0033]
图2-2示出了ly-12的制备路线。
[0034]
图3-1至图3-5分别为ly-12的质谱图、ly-13的质谱图、ly-14质谱图、ly-15的质谱图和ly-16的质谱图。
[0035]
图4示出了ly-13-16的ki值。
[0036]
图5示出了lncap和pc3细胞实验结果。
[0037]
图6示出了
68
ga标记的ly-13-16的荷瘤小鼠pet/ct结果。
[0038]
图7示出了
68
ga-ly-15注射60min、120min后的生物分布和注射后120min的抑制实验结果,数据为组织%id/g
±
sd,n=4。
[0039]
图8示出了ly-15的荷瘤小鼠荧光成像图。
具体实施方式
[0040]
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
[0041]
odap-psma靶向双模态配体合成
[0042]
配体ly-13、ly-14、ly-15、ly-16的制备
[0043]
四种odap-psma配体(ly-13至ly-16)的结构如图1所示,合成总路线如图2-1所示,试剂均购买于试剂公司,未经纯化,氨基酸的偶连按照标准的fmoc固相合成法进行。
[0044]
反应条件:(a)三光气,三乙胺,无水dcm;(b)三乙胺,无水dcm;(c)pd/c,h2,甲醇;
(d)nahco3,二氧六环,水;(e)n,n-二异丙基乙胺,2-氯三苯甲基树脂,dcm,dmf;(f)20%哌啶的dmf溶液,fmoc-3-(2-萘基)-l-丙氨酸、hbtu、hobt和dipea的dmf溶液;(g)20%哌啶的dmf溶液,fmoc-(4-氨甲基)苯甲酸、hbtu、hobt和dipea的dmf溶液;(h)20%哌啶的dmf溶液,dde-fmoc-l-赖氨酸、hbtu、hobt和dipea的dmf溶液;(i)20%哌啶的dmf溶液,dota、hbtu、hobt和dipea的dmf溶液;(j)2%联氨(hydrazine)的dmf溶液,fmoc-l-天冬氨酸-1-叔丁酯、hbtu、hobt和dipea的dmf溶液;(k)20%哌啶的dmf溶液,ly-12、pybop和dipea的dmf溶液;(l)三氟乙酸,水和三异丙基硅烷。
[0045]
配体ly-13至ly-16的制备:如图2-1所示,取100mg树脂(0.03mmol)于10ml固相合成管,加入2ml二氯甲烷(dcm)溶胀,重复三次,每次5分钟,随后用n,n-二甲基甲酰胺(dmf)洗涤三次,每次5分钟。使用含20%哌啶的dmf溶液(v/v)脱去氨基保护基fmoc,具体操作为2ml20%哌啶的dmf溶液反应2分钟、10分钟、10分钟,随后使用2mldmf洗涤3-5次,每次2分钟。相对于树脂(0.03mmol),3倍化学量的fmoc氨基酸在7.2倍化学量的dipea存在下,经3.6倍化学量的hbtu或pybop活化后加入到合成管中,电磁搅拌下反应1小时。除脱氨基保护基dde这一步骤之外,所有的脱保护基、活化和偶连步骤依上述方法进行。使用含2%联氨的dmf溶液(v/v)脱去氨基保护基dde,具体操作为2ml 2%联氨的dmf溶液反应2分钟、3分钟、3分钟。配体从树脂上解离和叔丁酯的脱去使用5ml三氟乙酸/三异丙基硅烷/水(95:2.5:2.5,v/v/v)搅拌2小时完成,并用2ml三氟乙酸清洗树脂,收集所有滤液,经减压除去三氟乙酸后,粗产物经反相hplc制备,冻干后得到目标配体ly-13至ly-16。配体结构经质谱鉴定,分别如图3-2至图3-5及表1所示。
[0046]
树脂ly-12的制备
[0047]
制备路线如图2-2所示。反应条件:(a)碳酸钾,乙腈,50℃;(b)三氟乙酸,二氯甲烷。
[0048]
制备过程:取新吲哚菁绿(17,200mg,0.24mmol)和对羟基苯甲酸叔丁酯(18,45mg,0.26mmol)于50ml圆底烧瓶中,加入20ml乙腈使之溶解,加入碳酸钾(50mg,0.36mmol),电磁搅拌下加热至50℃,反应20小时后停止。经反相hplc制备后得绿色固体(ly-18,134mg,0.13mmol)。取上步产物于圆底烧瓶中,加入4ml二氯甲烷和4ml三氟乙酸,电磁搅拌下反应3小时。反应完成后除去溶剂,得到绿色固体(ly-12,120mg,产率100%)。结构经质谱鉴定,如图3-1和表1所示。
[0049]
表1化合物ly-12,13,14,15,16的质谱结果汇总如下:
[0050][0051]
树脂ly-6的制备
[0052]
取n6-cbz-l-赖氨酸苄酯盐酸盐(1,1g,2.46mmol)和三乙胺(995mg,9.85mmol)溶于50ml dcm中,冰盐浴下将混合液缓慢滴加入三光气(240mg,0.82mmol)的dcm中,滴加完成后,继续在室温下反应3h,取化合物2(708mg,2.46mmol,其制备参照本实验室专利cn 109748896 b和专利cn 111233758b)和三乙胺(745mg,7.38mmol)加入到反应液中,反应经过柱纯化得到无色油状物ly-3(1.23g)。将ly-3在100mg10%pd/c催化下与氢气在甲醇中脱去苄酯和cbz,粗产物经硅胶柱纯化后得到无色油状物ly-4(744mg)。将ly-4(300mg,0.65mmol)溶于20ml二氧六环/水(2.5/1,v/v)中,加入碳酸氢钠(164mg,1.95mmol)和fmoc-cl(201mg,0.78mmol),室温下搅拌15分钟。反应完成后往反应液中加入200ml乙酸乙酯,水洗两次,收集有机相,经无水硫酸钠干燥后减压除去溶剂,粗产物经硅胶柱纯化后得白色固体产物ly-5(290mg)。取1g 2-ctc树脂于50ml固相合成管中,加二氯甲烷溶胀1小时,抽干溶剂后,加入ly-5(290mg)的dcm/dmf溶液(1:1,v/v),室温反应3小时后,使用dcm/meoh/dipea(10:10:1,v/v/v)封端四次,每次10分钟,经甲醇清洗后干燥至恒重,得到1.2克树脂ly-6,负载量0.33mmol/g。树脂ly-6的制备参照本实验室专利cn 109748896 b。
[0053]
ly-13至ly-16的ki测定
[0054]
1、溶液的配制
[0055]
(1)硼砂缓冲液
[0056]
取4.7625g四硼酸钠将其溶解于200ml去离子水中,用naoh将其ph调至10.0,最后用容量瓶定容至250ml,保存于4℃待用。
[0057]
(2)opa检测试剂
[0058]
将10mg opa溶于100μl甲醇中,用步骤(1)中的溶液稀释到10ml,最后加25μl 2-巯基乙醇,混匀后避光保存于4℃。
[0059]
(3)hepes buffer
[0060]
50mm hepes;0.1m nacl;ph 7.5。
[0061]
2、测定步骤
[0062]
将psma重组蛋白用hepes buffer稀释到0.4μg/ml,naag用hepes buffer稀释到160μm,探针用hepes buffer稀释成不同的浓度,(400μm、40μm、4μm、400nm、40nm、4nm、400pm、40pm)。在ep管中加入25μl naag、25μl探针和50μl蛋白,离心3-5秒,混合溶液置于37℃孵育1小时,每组设置3个平行。孵育结束后,95℃金属浴5分钟,高温变性蛋白终止反应。随后每管加入100μl配制好的opa检测试剂,涡旋2-3秒使其充分混匀,避光室温孵育3分钟。从每管中取出100μl溶液,加入96孔黑板内,然后用酶标仪立即进行检测(检测条件:ex/em=350/450nm,增益100)。
[0063]
ly-13至ly-16与psma的结合亲和力如表2和图4所示,所有化合物的ki值均为纳摩尔级,表现出与psma的高亲和力,具有进一步应用的潜力。
[0064]
表2ly-13至ly-16的ki值
[0065]
配合物ki(nm)ly-135.28nmly-141.54nmly-151.78nmly-163.09nm
[0066]
标记与质控
[0067]
标记:
[0068]
68
ga:精确称取1.0mg配体于样品管中,加入200μl dmso(二甲基亚砜)使之溶解,将配体浓度稀释至5μg/μl。吸取6μl配体溶液和130μlnaoac溶液(1mol/l)于西林瓶中,加入2ml新淋洗得到的
68
ga
3+
离子溶液(溶剂为0.05mol/l的盐酸溶液,放射活度为10-17mci),摇匀后密封,在90℃下反应10分钟。反应液冷却至室温后经hplc分析质控。
[0069]
质控:
[0070]
68
ga配合物的放射化学纯度使用hplc(高效液相色谱)测定,流动相为含40%乙腈的水溶液(含0.1%tfa),所有配合物的放射化学纯度均大于90%,未经纯化即可进行下一步研究。
[0071]
68
ga标记产物的细胞结合及内化实验
[0072]
将lncap细胞和pc3细胞分别接种于24孔板中,每个孔板接种1
×
105个细胞,将细胞放置在含5%co2的37℃恒温培养箱中,使之成为单层贴壁细胞。将放射性配合物使用培养基稀释到7.4mbq/ml,各取50μl(含放射性0.37mbq)于三个小试管中,作为total activity。吸净旧培养基后,用新鲜培养基洗两次,每孔先加入400μl新鲜培养基,然后实验组(n=6)加入50μl新鲜培养基,抑制组(n=6)加入50μl 1mmol/l的抑制剂(zj-43),37℃孵育15min;孵育后每孔加入0.37mbq
68
ga标记的配合物(50μl)37℃孵育1h;孵育后吸净培养基,用1ml含0.2%bsa的冷pbs洗2次,随后实验组用50mm ph=2.8的甘氨酸nacl溶液洗2次,每次5min,分别收集甘氨酸溶液,最后实验组与抑制组用0.5m naoh溶液孵育10min破碎细胞,收集naoh溶液,用γ计数器分别计数。
[0073]
细胞实验结果如图5所示,
68
ga-ly-13-16在psma阳性细胞(lncap)中的摄取显著高于psma阴性细胞(pc3),并且可以被zj-43抑制,说明
68
ga-ly-13-16与psma结合具有特异性。
68
ga-ly-13-16在lncap细胞中具有较高的内化比率,在63.1%-81.9%之间。
[0074]
68
ga标记产物的显像
[0075]
取0.1ml新制备的
68
ga标记配合物(5.6mbq-7.4mbq)经尾静脉注射到雄性荷22rv1肿瘤的balb/c裸鼠体内(肿瘤直径为0.6cm左右),分别于1h、2h后用异氟烷麻醉,进行小动物pet/ct(super-nova,平生科技,中国)显像,对感兴趣区域进行标准摄取值suv的勾画。
[0076]
68
ga-ly-13-16在荷瘤鼠体内的pet-ct显像及数据如图6和表3所示,结果表明:
68
ga配合物都能在肿瘤区域明显浓集,其中
68
ga-ly-15和
68
ga-ly-14在肿瘤区域的摄取值高于
68
ga-ly-13、
68
ga-ly-16,特别是,
68
ga-ly-15肿瘤/肌肉和肿瘤/肝脏的比值均高于
68
ga-ly-13、
68
ga-ly-14、
68
ga-ly-16。
[0077][0078]
68
ga-ly-15的生物分布
[0079]
取0.1ml新制备的
68
ga-ly-15(0.74mbq)经尾静脉注射到雄性荷22rv1肿瘤的balb/
c裸鼠体内,在抑制实验中,提前半小时经小鼠尾静脉注射50mg/kg zj43(一种常用的psma蛋白抑制剂)。注射
68
ga标记配合物60min、120min后,将小鼠断头处死,取出肿瘤、肌肉和其他感兴趣组织和器官织进行称重和放射性计数的测定,最后计算各组织的每克百分注射剂量(%id/g)。
[0080]
68
ga-ly-15在荷瘤鼠体内的生物分布数据如表4和图7所示,结果表明:在注射2小时后,
68
ga-ly-15主要浓集在肿瘤区域,在代谢器官肾脏中有一定的摄取,
68
ga-ly-15在肿瘤内的摄取为8.98
±
1.91%id/g,肿瘤与肌肉的比值为7.47
±
1.42。在抑制实验中,zj43能明显抑制肿瘤对
68
ga-ly-15的摄取(8.98%id/g vs 2.13%id/g),表明了
68
ga-ly-15对psma蛋白进行了特异性结合,这些结果表明
68
ga-ly-15是一种非常有潜力的前列腺癌核素显像试剂。
[0081]
表4
68
ga-ly-15荷瘤小鼠生物分布
[0082][0083][0084]
ly-15的荧光显像
[0085]
ly-15在荷瘤鼠体内的荧光显像数据如图8和表5所示,结果表明:探针ly-15能快速靶向肿瘤区域,主要聚集在肿瘤区域及泌尿系统器官包括肾脏和膀胱,同时在血液循环
中的探针能快速清除从而降低背景的信号,静脉注射ly-15后,在1h时间点肿瘤区域的荧光信号最强,4h后荧光信号明显减弱,8h时肿瘤/肌肉显示最佳。
[0086]
表5ly-15在肿瘤、肌肉中roi值及其比值(mean
±
sd,n=4)
[0087][0088]
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
