一种表达热休克蛋白hsp70的重组乳酸乳球菌及其制备方法和应用
技术领域
1.本发明涉及重组蛋白制备以及乳酸菌发酵的技术领域,尤其涉及一种表达热休克蛋白hsp70的重组乳酸乳球菌及其制备方法和应用。
背景技术:
2.1978年,laskey等首次提出了分子伴侣(molecular chaperone)的概念,并将辅助组蛋白和dna在体外组装成核小体的蛋白质命名为“molecular chaperone”。经过四十多年的研究,发现分子伴侣具有辅助蛋白质折叠、运输,降解错误折叠的蛋白质以及抑制蛋白质聚集的功能,对维持蛋白质稳态(proteostasis)至关重要,从而给出了“molecular chaperone”的定义。热休克蛋白(heat shock protein,hsp)是一类重要的分子伴侣,按相对分子质量大小分为小热休克蛋白(small heat shock protein,shsp)、hsp40、hsp60、hsp70、hsp90和hsp110,其中hsp70参与了机体的各种生命活动,包括人的神经退行性疾病、动物病毒病、动物肺炎链球菌感染、动物中毒性疾病等。
3.热休克蛋白70(heat shock protein 70,hsp70)家族是一类高度保守的蛋白,属于应激反应性蛋白,在自身免疫性疾病中发挥重要的功能,在机体内主要起到协同免疫的作用,也是生物细胞中含量最多的一种热激蛋白,高度保守且可诱导,通常因生物体温度的变化而被激活。目前,对于hsp70家族的功能研究主要集中在细胞对有害环境的耐受保护、细胞免疫、先天免疫反应、抗氧化、抗细胞凋亡等,同时hsp70也参与和调控蛋白质的折叠修饰。
4.赭曲霉毒素(ochratoxin)主要是由青霉属和曲霉属微生物产生的次级代谢真菌毒素。在a、b、c、d四种类型中,赭曲霉毒素a(ota)污染最重,分布最广,主要存在与小麦、玉米、大麦、燕麦、黑麦、大米和黍类等作物中,动物摄入了霉变的饲料后,这种毒素也可能出现在猪和母鸡等的肉中。猪采食了含ota的饲料后会引起严重的肾脏损伤,大量的毒素也可能引起肠黏膜炎症和坏死,还在动物试验中观察到它的致畸作用,对怀孕母猪产生巨大损害。伏马菌素(fumonisin b,fb)是一种霉菌毒素,是由串珠镰刀菌(fusarium moniliforme sheld)产生的水溶性代谢产物,是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物,广泛存在于玉米及玉米制品中,可引起猪的肾损伤和肺水肿,严重危害人畜健康,成为粮食行业和畜牧业防治的重点。
5.目前,养殖业中的饲料或饲料原料中霉菌毒素污染是非常严重的,霉菌毒素的感染是不能被随时监测的,而且它的感染也具有一定的隐蔽性,达到一定量之后被动物采食很有可能引起动物机体的损伤,内脏受损,严重者造成死亡,对养殖业经济效益造成巨大影响。尽管有各种去霉剂,但并不能保证能够百分之百去除霉菌毒素;另外不同的霉菌毒素需要不同的去霉剂,使用之前需要确定霉菌毒素的种类,对于大量的饲料或原料,检测起来还是比较费时费力的,因此过程比较繁琐。
6.由此看来,单纯靠去除饲料或者原料中的霉菌毒素来解决其对养殖业的危害显然
是不够的,还需要着眼于动物本身。hsp70分布的广泛性和多功能性让其成为目前研究最多的应激蛋白质之一;乳酸菌具有提高sod酶活力,消除机体自由基,提高机体抵抗力,控制体内毒素水平,保护肝脏并增强肝脏的解毒、排毒功能等作用,因此研制一种后期干预的制剂就显得十分重要,期望研制的制剂能保护动物,使得在一定程度上能够防止动物在摄入毒素(包括细菌毒素、霉菌毒素、重金属等)后引起的中毒现象,目前hsp70对缓解动物摄入毒素方面的研究还鲜有报道。
技术实现要素:
7.为了克服现有技术中存在的问题,基于目前的研究表明hsp70具有抗细胞凋亡、抗氧化、提高动物机体抵抗力等功能,且这种蛋白也是动物机体本身就会产生的,同时乳酸菌也具有调节动物肠道、提高动物免疫力等功能,发明人首次将热休克蛋白hsp70和乳酸菌结合进行研究发现高效表达hsp70的重组乳酸乳球菌对由于摄入毒素(包括细菌毒素、霉菌毒素、重金属等)而中毒的动物在一定程度上起到了较好的保护作用。
8.为实现上述目的,本发明采用如下技术方案:
9.本发明的第一个方面是提供一种表达热休克蛋白hsp70的重组乳酸乳球菌,其为转化了重组表达质粒pnz8149-hsp70的乳酸乳球菌。
10.进一步地,所述热休克蛋白hsp70的基因序列为猪hsp70全基因序列,具体地,上述hsp70基因序列的长度为1932bp。
11.进一步地,所述热休克蛋白hsp70的基因序列如seq id no.1所示。
12.进一步地,所述重组乳酸乳球菌表达的hsp70重组蛋白序列如seq id no.2所示。
13.本发明的第二个方面是提供一种任一上述的表达热休克蛋白hsp70的重组乳酸乳球菌的制备方法,其包括以下步骤:
14.s1.扩增hsp70基因全序列,制备pnz8149线性化载体,将所述hsp70基因全序列与所述线性化载体进行同源重组连接反应,得到重组表达质粒pnz8149-hsp70;
15.s2.制备感受态细胞,将所述重组表达质粒pnz8149-hsp70通过电转化转入所述感受态细胞,制得所述重组乳酸乳球菌。
16.为了进一步优化上述制备方法,本发明采取的技术措施还包括:
17.进一步地,在上述制备方法中,步骤s1中,所述扩增hsp70基因全序列包括以下步骤:根据猪hsp70全基因序列及乳酸菌质粒pnz8149的同源臂设计hsp70引物,并在上游引物和下游引物分别添加酶切位点;提取猪肾细胞总rna,通过反转录得到cdna后再进行pcr扩增以及胶回收得到hsp70目的基因。
18.进一步地,所述hsp70引物的序列如seq id no.3~seq id no.4所示;更进一步地,所述seq id no.3所示的上游引物添加ncoⅰ酶切位点,所述seq id no.4所示的下游引物添加xbaⅰ酶切位点。
19.更进一步地,所述扩增hsp70基因全序列的具体步骤为:根据猪hsp70全基因序列及乳酸菌质粒pnz8149的同源臂设计hsp70引物,其引物序列如seq id no.3~seq id no.4所示,其扩增片段全长为1932bp;提取猪肾细胞总rna,通过反转录得到cdna,再进行pcr扩增(40个循环)得到hsp70基因全序列,回收dna片段。优选,上述pcr扩增采用的反应体系(25μl)包括:cdna 2μl、2
×
taq master mix 12.5μl、上游引物f1μl、下游引物r1μl、ddh2o 8.5
μl,反应程序为:95℃5min、95℃45s、61℃30s、72℃45s、72℃10min、4℃∞。
20.进一步地,在上述制备方法中,步骤s1中,所述制备pnz8149线性化载体包括以下步骤:提取pnz8149载体质粒并对其进行双酶切消化,回收酶切产物,之后进行反向pcr扩增,对pcr产物进行回收获得pnz8149线性化载体。
21.进一步地,所述反向pcr扩增采用的引物序列如seq id no.5~seq id no.6所示。
22.进一步地,所述双酶切消化反应体系(20μl)包括:quick buffer 4μl、pnz8149 3μl、nco i 0.5μl(10u/μl)、xba i 0.5μl(10u/μl)、ddh2o 12μl,37℃消化过夜。
23.进一步地,将所述酶切产物进行回收得到可进行反向pcr的片段,利用所述反向pcr引物进行扩增,将得到的pcr产物回收,获得pnz8149线性化载体。
24.进一步地,所述酶切产物的回收步骤具体为:将产物转到1.5ml离心管中,用ddh2o洗涤干净,并稀释到250μl;加入等体积的酚和氯仿(v:v=1:1),涡旋混匀,室温静置1min;最大速度(13,000rpm)离心1min,将上清移到另一管中,加入等体积的氯仿,涡旋混匀,室温静置1min;最大速度(13,000rpm)离心2min之后将上清移到另一管中,加入2.5倍体积-20℃预冷的无水乙醇,0.1倍体积的3m乙酸钠(ph=5.2),轻轻振荡混匀,室温静置5min;4℃最大速度(13,000rpm)离心10~15min后弃去上清,并且尽量除去管壁上的液体;加入1ml-20℃预冷的70%乙醇,轻轻颠倒几次,最大速度(13,000rpm)离心5min;除去乙醇,在超净台上平放,将管壁上的乙醇挥发掉,20~40μl ddh2o溶解,-20℃保存备用。
25.进一步地,所述反向pcr扩增的反应体系(50μl)为:2
×
phanta max master mix 25μl、上游引物f 2μl、下游引物r 2μl、dna(pnz8149)4μl、ddh2o 17μl,反应程序为:95℃3min、95℃15s、65℃15s、72℃60s、72℃5min、4℃∞。
26.进一步地,在上述制备方法中,所述同源重组连接反应体系包括:同源重组mix 5μl、线性化载体150ng、目的片段(猪hsp70基因回收产物)与载体摩尔比2:1,加ddh2o至终体积10μl,混匀,50℃反应15min,获得重组表达质粒,命名为pnz8149-hsp70。
27.进一步地,在上述制备方法中,步骤s2中,所述制备感受态细胞包括以下步骤:取乳酸乳球菌nz3900接种、培养,待培养至od
600nm
=0.2-0.3,收集菌体沉淀;使用solutionⅰ或solutionⅱ多次重悬菌体,冰上静置,离心,弃去上清,将残留液体彻底吸干后,加入solutionⅰ重悬沉淀,获得所述感受态细胞。更进一步地,制备感受态细胞的具体步骤如下:取30℃过夜培养的nz3900以1:100的比例接种于12.5ml gsgm17培养液中,30℃静置培养过夜后全部接种于100ml gsgm17培养液中,静置培养至od
600nm
=0.2-0.3,收集菌体沉淀;使用100ml solutionⅰ重悬菌体,冰上静置15min;4℃6000
×
g离心20min,弃去上清;使用50ml solutionⅱ重悬菌体,冰上静置15min;4℃6000
×
g离心20min,弃去上清;再次使用25ml solutionⅰ重悬菌体,同样冰上静置15min;4℃6000
×
g离心20min,弃去上清;将残留液体彻底吸干后,加入1ml solutionⅰ重悬沉淀,50μl/管分装于无菌1.5ml ep管中。感受态细胞分装完成之后,迅速用液氮冷冻,保存于-80℃冰箱备用。
28.进一步地,在上述制备方法中,步骤s2中,所述电转化包括以下步骤:取感受态细胞和经过预处理的重组表达质粒pnz8149-hsp70在预定条件下进行电转化,电转化结束后立即加入电转复苏液,静置,取出电转化产物,离心,弃去部分上清,重悬菌体沉淀,获得所述重组乳酸乳球菌。
29.进一步地,所述重组表达质粒pnz8149-hsp70的预处理步骤包括:将重组表达质粒
pnz8149-hsp70滴在去离子膜上,置于超纯水上,4℃反应1h以去除离子。
30.进一步地,所述电转化的具体步骤包括:将冻存的乳酸菌感受态细胞nz3900置于冰水混合物上融化,加入所述预处理的重组表达质粒pnz8149-hsp70 10μl,冰上静置20min;将上述混合物小心吸入2mm电击杯,确保无气泡,冰上静置10min之后拿出电击杯并彻底擦干电击杯外部水分,在2.0kv,25μf,200ω条件下进行电转;然后立即加入800μl电转复苏液,吹打混匀后吸入无菌1.5ml ep管中,冰上静置10min,然后30℃静置2h以恢复温度,最后取出产物4000
×
g离心5min,弃去部分上清,留100μl重悬沉淀。
31.进一步地,在上述制备方法中,还包括步骤:对所述重组乳酸乳球菌进行扩增并进行鉴定,具体包括步骤:菌体沉淀重悬之后涂布于elliker平板中培养,挑取黄色菌落接种、培养至浑浊,提取质粒进行pcr鉴定,获得构建成功的重组乳酸乳球菌。更进一步地,将所述重组乳酸乳球菌的沉淀重悬之后涂布于平板中,30℃培养2-4d;挑取黄色菌落接种到含有0.5%乳糖的m17培养基中,30℃静置培养至浑浊,提取质粒进行pcr鉴定,目的片段大小为1932bp,即为构建成功的重组乳酸乳球菌。
32.进一步地,在上述制备方法中,还包括步骤:对所述重组乳酸乳球菌进行诱导表达,具体包括步骤:挑取构建成功的重组乳酸菌单菌落,接种、培养至od
600nm
=0.6,加入诱导剂nisin至预定终浓度,静置诱导,诱导结束后,将产物离心收集菌体沉淀,洗涤菌体,重悬菌体沉淀并冻存,反复冻融之后超声破碎,上清液经超滤管浓缩,收集超滤后的浓缩液,分别检测上清和沉淀中hsp70蛋白的表达。更进一步地,挑取构建成功的重组乳酸菌单菌落,接种于gm17培养液中,30℃静置培养过夜;以1:25比例转摇至200ml gm17培养液中,30℃静置培养至od
600nm
=0.6,然后加入诱导剂nisin至终浓度为25ng/ml,30℃静置诱导5h;诱导结束后,将产物离心收集菌体沉淀,用pbs洗涤菌体2次,使用500μlpbs重悬菌体沉淀并冻存于-80℃,反复冻融之后超声破碎,上清液经超滤管浓缩,收集超滤后的浓缩液;wb分别检测上清和沉淀中hsp70蛋白的表达。
33.上述热休克蛋白hsp70的基因序列、表达的hsp70重组蛋白序列及制备过程采用的引物序列信息具体如下表1所示:
34.表1
–
序列信息表
35.[0036][0037]
本发明的第三个方面是提供一种由任一上述的重组乳酸乳球菌诱导表达获得的hsp70蛋白。
[0038]
本发明的第四个方面是提供一种含有任一上述的表达热休克蛋白hsp70的重组乳酸乳球菌的产品或含有由所述重组乳酸乳球菌诱导表达获得的hsp70蛋白的产品,其中所述产品包括但不限于:液体菌液制剂、动物复配饲料等。
[0039]
本发明的第五个方面是提供一种任一上述的表达热休克蛋白hsp70的重组乳酸乳球菌及其制备方法在制备缓解、抑制、预防或治疗动物摄入毒素中毒的产品中的应用。
[0040]
进一步地,在上述应用中,所述摄入毒素包括细菌毒素、真菌毒素(包括霉菌毒素)、重金属等;更进一步地,所述摄入毒素为霉菌毒素,其包括赭曲霉毒素、伏马菌素。
[0041]
进一步地,在上述应用中,所述产品为对所述重组乳酸乳球菌进行蛋白诱导表达获得的菌液、含有上述菌液的制剂、或由上述菌液再加工制得的制剂;或者,所述产品为对所述重组乳酸乳球菌进行蛋白诱导表达获得的hsp70蛋白、含有上述hsp70蛋白的制剂、或由上述hsp70蛋白再加工制得的制剂。
[0042]
进一步地,在上述应用中,所述产品包括但不限于:液体菌液制剂、动物复配饲料等。
[0043]
进一步地,在上述应用中,所述重组乳酸乳球菌进行蛋白诱导表达后获得的菌液含有hsp70蛋白,其无需进行纯化即可将菌液进行应用;或者,在制备重组乳酸乳球菌的过程中按照常规方式添加his标签,然后将发酵菌液进行纯化处理,获得hsp70蛋白,再将所述hsp70蛋白进行应用。
[0044]
进一步地,所述动物包括但不限于:小鼠、猪、鸡等。
[0045]
进一步地,在一具体实施方式中,其应用具体为:采用含hsp70蛋白的菌液进行灌胃。
[0046]
与现有技术相比,本发明采用上述技术方案具有以下有益效果:
[0047]
本发明通过提取猪肾细胞pk15的总rna,用反转录pcr获得cdna,利用特异性引物扩增得到猪热休克蛋白70(hsp70)基因全长序列,运用分子生物学方法进行基因片段的体
外重组技术构建重组菌,然后利用乳酸乳球菌发酵技术扩增重组菌并诱导蛋白的表达,上述重组乳酸乳球菌能够高效表达hsp70蛋白,且通过验证可知采用上述菌液蛋白混合物灌胃小鼠之后对其具有很好的保护作用。
[0048]
本发明构建了猪hsp70蛋白的乳酸乳球菌表达体系,通过诱导可以快速大量表达hsp70蛋白;且由于乳酸乳球菌载体不含内毒素,也未添加his标签,因此上述融合蛋白无需纯化,其发酵混合菌液可共同使用,非常便捷、安全;上述蛋白菌液混合物可直接饲喂动物,能够对由于毒素中毒的动物起到很好的保护作用。
附图说明
[0049]
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明仅用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0050]
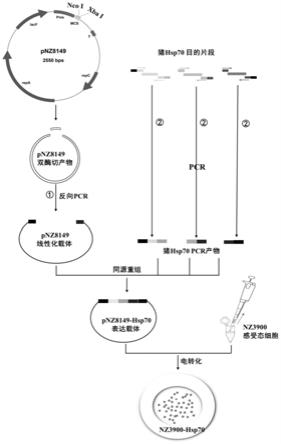
图1为本发明一实施例中重组表达质粒及重组乳酸乳球菌的构建步骤示意图;
[0051]
图2为本发明一实施例中猪hsp70重组表达质粒的pcr鉴定电泳结果图;
[0052]
图3为本发明一实施例中猪hsp70重组蛋白诱导表达的western blotting结果图;
[0053]
图4为本发明一实施例中将含重组蛋白hsp70的菌液应用于小鼠攻毒试验后的小鼠血清生化指标变化结果图;
[0054]
图5为本发明一实施例中将含重组蛋白hsp70的菌液应用于小鼠攻毒试验后的小鼠内脏(肾脏、肝脏、心脏、脾脏、肺脏)指数变化结果图;
[0055]
图6为本发明一实施例中将含重组蛋白hsp70的菌液应用于小鼠攻毒试验后的小鼠肾脏组织h&e染色病理变化结果图;
[0056]
图7为本发明一实施例中将含重组蛋白hsp70的菌液应用于小鼠攻毒试验后的凋亡基因mrna表达结果图;
[0057]
图8为本发明一实施例中将含重组蛋白hsp70的菌液应用于小鼠攻毒试验后的凋亡基因蛋白表达结果图。
具体实施方式
[0058]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。下列实施例中未注明具体条件的实验方法,通常按照国家标准测定。下述实施例中未注明出处的实验材料,均为市售原料。下述实施例中的各步骤中采用的设备均为常规设备。若没有相应的国家标准,则按照通用的国际标准、常规条件、或按照制造厂商所建议的条件进行。除非另外说明,否则所有的份数为重量份,所有的百分比为质量百分比。除非另有定义或说明,本发明中所使用的所有专业与科学用语与本领域技术熟练人员所熟悉的意义相同。此外任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。
[0059]
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
[0060]
在下述实施例中,乳酸乳球菌的培养基如m17、gm17、gsgm17、elliker等培养基均
为商品化培养基,购自索莱宝。
[0061]
在下述实施例中,pcr反应中2
×
taq master mix、2
×
phanta max master mix、dl 5000dna marker,酶连反应中quick buffer、同源重组mix、solutionⅰ/ⅱ、xbaⅰ、nco i等试剂均购自南京诺唯赞生物科技股份有限公司,蛋白marker购自takara生物技术有限公司,反转录试剂购自湖南艾科瑞生物工程有限公司。
[0062]
实施例1
–
表达hsp70的重组乳酸乳球菌的构建
[0063]
本实施例为一较佳的表达热休克蛋白hsp70的重组乳酸乳球菌的制备方法,如图1所示,其包括以下步骤:扩增猪hsp70基因全序列,制备pnz8149线性化载体,将猪hsp70基因全序列与线性化载体进行同源重组连接反应,得到重组表达质粒pnz8149-hsp70;制备感受态细胞,将重组表达质粒pnz8149-hsp70通过电转化转入感受态细胞,制得重组乳酸乳球菌。
[0064]
上述重组乳酸乳球菌的具体构建步骤如下:
[0065]
(1)猪hsp70目的基因的获取
[0066]
根据猪hsp70全基因序列(seq id no.1)及乳酸菌质粒pnz8149的同源臂设计hsp70引物,并分别在上、下游添加ncoⅰ,xbaⅰ酶切位点,引物序列具体如seq id no.3~seq id no.4所示。在生工生物科技有限公司合成引物序列(上游引物f设计原则:5
’‑
pnz8149质粒上游同源臂-ncoⅰ酶切位点-猪hsp70基因特异性正向引物序列-3’;下游引物r设计原则:5
’‑
pnz8149质粒下游同源臂-xbaⅰ酶切位点-猪hsp70基因特异性反向引物序列-3’);提取猪肾细胞pk15的总rna,通过反转录得到cdna,之后再进行pcr扩增(40个循环)得到hsp70基因全序列。
[0067]
上述hsp70基因全序列的制备步骤具体如下:首先使用trizol提取细胞总rna,并测定浓度,然后利用反转录试剂将提取的总rna反转录成cdna,最后使用seq id no.3和seq id no.4引物序列进行pcr扩增得到hsp70全基因序列,反应体系和程序如下:
[0068]
反应体系:
[0069][0070]
反应程序:
[0071][0072]
经过40个循环,然后进行1%凝胶电泳鉴定目的基因,片段全长为1932bp,利用天根凝胶回收试剂盒回收dna片段并测定其浓度。
[0073]
(2)pnz8149线性化载体的制备
[0074]
2.1)限制性内切酶消化:提取pnz8149的质粒并测定浓度,质粒双酶切消化,条件如下:
[0075][0076]
37℃消化过夜,获得pnz8149双酶切产物,凝胶电泳检测酶切效果。
[0077]
2.2)回收双酶切消化产物dna,回收步骤如下:
[0078]
①
将步骤2.1)中的酶切产物转到1.5ml离心管中,用ddh2o洗涤干净,并稀释到250μl;
[0079]
②
加入等体积的酚和氯仿(v:v=1:1),涡旋混匀,室温静置1min;
[0080]
③
最大速度(13,000rpm)离心1min,将上清移到另一管中,加入等体积的氯仿,涡旋混匀,室温静置1min;
[0081]
④
最大速度(13,000rpm)离心2min之后将上清移到另一管中,加入2.5倍体积-20℃预冷的无水乙醇,0.1倍体积的3m乙酸钠(ph=5.2),轻轻振荡混匀,室温静置5min;
[0082]
⑤
4℃最大速度(13,000rpm)离心10~15min后弃去上清,并且尽量除去管壁上的液体;
[0083]
⑥
加入1ml-20℃预冷的70%乙醇,轻轻颠倒几次,最大速度(13,000rpm)离心5min。
[0084]
⑦
除去乙醇,在超净台上平放,将管壁上的乙醇挥发掉,20~40μl ddh2o溶解,-20℃保存备用。
[0085]
2.3)反向pcr制备pnz8149线性化载体:将回收的pnz8149双酶切消化产物dna进行反向pcr,反应体系和反应程序如下:
[0086]
反应体系:
[0087][0088]
反应程序:
[0089][0090]
其引物序列分别如seq id no.5~seq id no.6所示,经过35个循环,将得到的pcr产物利用天根凝胶回收试剂盒回收,产物即为pnz8149线性化载体。
[0091]
(3)重组表达质粒pnz8149-hsp70的构建
[0092]
将步骤(1)中制得的猪hsp70基因目的片段与步骤(2)中制得的pnz8149线性化载体进行同源重组反应,条件如下:
[0093]
同源重组mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5μl
[0094]
线性化载体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150ng
[0095]
目的片段
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
与载体摩尔比2:1
[0096]
加ddh2o至终体积10μl,混匀,50℃反应15min,获得构建成功的重组表达质粒,命名为pnz8149-hsp70。
[0097]
(4)表达hsp70蛋白的重组乳酸乳球菌的构建
[0098]
4.1)感受态细胞nz3900的制备
[0099]
取过夜培养的乳酸乳球菌nz3900以1:100的比例接种于12.5ml gsgm17培养液中,30℃静置培养过夜后全部接种于100ml gsgm17培养液中,静置培养至od
600nm
=0.2-0.3,收集菌体沉淀;使用100ml solutionⅰ重悬菌体,冰上静置15min;4℃6000
×
g离心20min,弃去上清;使用50ml solutionⅱ重悬菌体,冰上静置15min;4℃6000
×
g离心20min,弃去上清;再次使用25ml solutionⅰ重悬菌体,同样冰上静置15min;4℃6000
×
g离心20min,弃去上清;将残留液体彻底吸干后,加入1ml solutionⅰ重悬沉淀,置于冰上,获得感受态细胞。
[0100]
4.2)电转化制备表达hsp70的重组乳酸乳球菌
[0101]
将重组表达质粒pnz8149-hsp70滴在去离子膜上,置于超纯水上,4℃反应1h以去除离子;取200μl感受态细胞置于冰水混合物上融化,加入上述处理过的重组表达质粒pnz8149-hsp70 10μl,冰上静置20min;小心吸入2mm电击杯,确保无气泡,冰上静置10min之
后拿出电击杯并彻底擦干电击杯外部水分,在2.0kv,25μf,200ω条件下进行电转,然后立即加入800μl电转复苏液,吹打混匀后吸入无菌1.5ml ep管中,冰上静置10min,然后30℃静置2h以恢复温度。最后取出产物4000
×
g离心5min,弃去部分上清,留100μl重悬沉淀,获得能够表达hsp70的重组乳酸乳球菌。
[0102]
4.3)重组表达质粒pnz8149-hsp70的扩增与鉴定
[0103]
将重组乳酸乳球菌的菌体沉淀重悬之后涂布于elliker平板中,30℃培养2-4d;挑取黄色菌落接种到含0.5%乳糖的m17培养基中,30℃静置培养至浑浊,提取质粒进行pcr鉴定,目的片段大小为1932bp。其pcr鉴定电泳结果图如图2所示,其中泳道1为dna marker(5000bp);泳道2、3、4均为提取的重组表达质粒;泳道5为阳性对照。由图2可知,挑取的菌落均在2000bp附近(1932bp)有一条带,说明重组表达质粒构建成功。
[0104]
(5)重组乳酸乳球菌的诱导表达
[0105]
挑取构建成功的重组乳酸菌单菌落,接种于gm17培养液中,30℃静置培养过夜;以1:25比例转摇至200ml gm17培养液中,30℃静置培养至od
600nm
=0.6,然后加入诱导剂nisin至终浓度为25ng/ml,30℃静置诱导5h。
[0106]
诱导结束后,将产物离心收集菌体沉淀,用pbs洗涤菌体2次,使用500μl pbs重悬菌体沉淀并冻存于-80℃,反复冻融之后超声破碎,上清液经超滤管浓缩,收集超滤后的浓缩液。wb检测上清和沉淀中hsp70蛋白的表达。猪hsp70重组蛋白诱导表达的western blotting结果图如图3所示,其中泳道1为蛋白marker;泳道2为猪hsp70重组蛋白上清表达;泳道3为猪hsp70重组蛋白菌体沉淀表达。由图3可知,在70kda附近有单一蛋白条带,表明利用上述方法构建的重组乳酸乳球菌可以成功表达hsp70重组蛋白,而且获得的蛋白为单一组分,且上清和菌体沉淀的蛋白表达量均较高。上述表达的猪hsp70重组蛋白序列具体如seq id no.2所示。
[0107]
实施例2-表达hsp70的重组乳酸乳球菌在小鼠攻毒试验中的应用
[0108]
按照实施例1中步骤(5)进行重组乳酸乳球菌的猪hsp70蛋白的诱导表达,其获得的菌液无需纯化,采用含hsp70的菌液直接进行试验。
[0109]
将体重相近的雄性icr小鼠分组,8只/组,分为空白组、毒素组、毒素+蛋白菌液组。毒素+蛋白菌液组小鼠在攻毒之前先用含hsp70的菌液连续灌胃1w,1ml/只,其他组正常饮水采食。1w之后,该组小鼠腹腔注射伏马毒素b1(fb1)和赭曲霉毒素a(ota);空白对照组注射等体积的生理盐水;毒素组腹腔注射伏马毒素b1(fb1)和赭曲霉毒素a(ota),连续注射16天。其中,伏马毒素b1(fb1)的用量为1.0mg/kg b.w,赭曲霉毒素a(ota)的用量为0.4mg/kg b.w,两种毒素简写为fo。
[0110]
攻毒结束后,分别对小鼠眼球采血,采集肝脏,肾脏,脾脏,肺脏,心脏并称重;在试验期间每隔4d称取一次体重并记录,同时在处死小鼠之前进行最后一次称重,然后将采集的组织样品保存于-80℃待用,血液离心收集血清保存于-80℃待用。检测小鼠血清中肌酐、尿素氮、mda和sod含量,体重变化,脏器指数,肾组织he染色病理变化,肾组织凋亡指标等结果。
[0111]
(1)小鼠体重变化
[0112]
小鼠的体重变化如下表2所示:
[0113]
表2-攻毒期间小鼠体重变化
[0114][0115]
在上述试验过程中,分别在0、4、8、12、16dpi对小鼠进行称重,并计算平均体重。从试验结果可以看出,灌胃蛋白菌液混合物的小鼠平均体重下降水平明显低于单纯攻毒组小鼠。
[0116]
(2)小鼠血清生化指标变化
[0117]
试验结束之后,采集血清,并检测各组血清肌酐(cr)、尿素氮(bun)、丙二醛(mda)、超氧化物歧化酶(sod)变化,其结果如下表3和图4所示:
[0118]
表3-小鼠血清中mda、sod、cr、bun水平变化
[0119][0120][0121]
由试验结果可以看出,灌胃蛋白菌液混合物的小鼠的血清肌酐(cr)、尿素氮(bun)、丙二醛(mda)的水平尽管高于对照组小鼠,但明显低于单纯攻毒组小鼠,而超氧化物歧化酶(sod)水平正好相反。
[0122]
(3)小鼠脏器指数
[0123]
试验结束后,采集各组小鼠内脏并称重,计算与对应小鼠体重的比值,其结果如下表4和图5所示:
[0124]
表4-小鼠脏器指数
[0125][0126]
由上述计算结果可以看出,灌胃了蛋白菌液混合物的小鼠各内脏的脏器指数异常情况明显低于单纯攻毒组。
[0127]
(4)小鼠肾组织病理损伤
[0128]
将小鼠肾脏组织固定之后,h&e染色观察结果如图6所示。由染色结果可以看出,与单纯攻毒组相比,灌胃蛋白菌液混合物之后,小鼠肾小球肿胀情况明显减轻。
[0129]
(5)小鼠肾组织凋亡基因mrna表达水平
[0130]
提取小鼠肾脏组织mrna,检测凋亡基因apaf-1、casp3、casp9、cyto c、bax、bcl2的表达水平,其结果如下表5和图7所示:
[0131]
表5-小鼠肾组织qpcr检测结果
[0132][0133]
从上述检测结果可以看出,灌胃蛋白菌液的小鼠肾组织apaf-1、casp3、casp9、cyto c、bax的mrna表达水平明显低于单纯攻毒组小鼠,而bcl2的mrna水平高于单纯攻毒组小鼠。
[0134]
(6)小鼠肾组织凋亡基因蛋白表达水平。
[0135]
提取小鼠肾脏组织总蛋白,检测凋亡基因apaf-1、casp3、cl3、casp9、cl9、bax、bcl2的蛋白表达水平,其结果图如下表6和图8所示:
[0136]
表6-小鼠肾组织蛋白wb检测结果(图8)
[0137][0138]
从上述检测结果可以看出,灌胃蛋白菌液混合物的小鼠肾组织apaf-1、cl3/casp3、cl9/casp9、bax的蛋白表达水平明显低于单纯攻毒组小鼠,而bcl2蛋白水平高于单纯攻毒组小鼠。
[0139]
由上述实施例可知,相比于单纯攻毒组小鼠,灌胃菌液蛋白混合物之后再攻毒组小鼠的氧化指标、平均体重下降、脏器指数异常、肾组织病理损伤、肾组织凋亡基因均有所缓解,表明实施例1制备的重组蛋白hsp70及含有重组蛋白hsp70的如乳酸乳球菌菌液对于毒素中毒的小鼠具有一定保护作用。
[0140]
以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围。
