1.本发明涉及生物技术领域,尤其涉及荧光素酶突变体及其应用。
背景技术:
2.北美萤火虫(photinus pyralis)中提取的荧光素酶相对分子质量60kda,由2个亚基组成,酶活区域位于大亚基和小亚基之间的疏水口袋。荧光素酶的催化反应过程是:在氧气存在的环境中,由atp提供能量,荧光素酶在mg
2+
作为辅因子的条件下催化底物荧光素的氧化,同时将化学能转换为光能。
3.荧光素酶广泛应用于基因工程,可以追踪目的基因在动植物体内的转录、翻译和表达,以非入侵的形式监控生物学过程,同时还可以用于分析蛋白与蛋白的互作。荧光素-荧光素酶发光体系灵敏度高,发光强度与体系中的atp含量成正比,可以应用于焦磷酸测序技术中。同时还可以用于微生物检测,在食品卫生监管、环境监测、有毒物质检测和药敏实验中也有广泛的应用价值。随着荧光素酶应用的普及,需求持续增多,研究具有高活性且对温度、ph耐受性良好,成本低廉的荧光素酶具有重要意义。
4.野生型萤火虫荧光素酶在体外37℃放置3min就会丧失活性。经分析,荧光素酶含有大量疏水氨基酸残基的单一多肽链,二级结构中含有大量的无规则卷曲结构,不利于维持蛋白质的结构稳定。软件预测荧光素酶不含二硫键,而二硫键对蛋白质的结构稳定有重要作用。这些原因可能是导致荧光素酶热稳定性差的原因。因此对荧光素酶的改造在酶的应用上有重要的意义。
技术实现要素:
5.有鉴于此,本发明要解决的技术问题在于提供活性高且稳定性良好的荧光素酶突变体及其应用。
6.本发明提供的萤火虫荧光素酶的突变体的野生型的氨基酸序列如seq id no:1所示。所述突变体包括l17r、i47r、f176r、e354k突变位点中的至少一个。
7.本发明所述火虫荧光素酶的突变体是在野生型北美萤火虫荧光素酶的基础上发生的突变。其突变位点的个数为1~4个。所述突变位点包括第17位氨基酸由l突变为r,第47位氨基酸由i突变为r,第176位氨基酸由f突变为r,第354位氨基酸由e突变为k。一些具体实施例中,所述突变体的氨基酸序列如seq id no:2所示。
8.本发明还提供了编码本发明所述的突变体的核酸。
9.一些实施例中,所述编码突变体的核酸经密码子优化,其核酸序列如seq id no:3所示。
10.本发明还提供了一种表达载体,其包括本发明所述的核酸。即本发明提供了包括编码本发明所述突变体核酸的表达载体。
11.一些实施例中,所述表达载体的骨架载体选自pet系列载体。一些具体实施例中,所述表达载体的骨架载体为pet28a。一些具体实施例中,所述编码突变体的核酸的序列如
seq id no:3所示,其在骨架载体中的插入位点为nde i和xho i。
12.本发明还提供了转化或转染本发明所述表达载体的宿主细胞。
13.本发明中,所述宿主细胞为原核生物细胞,一些实施例中,所述宿主细胞为大肠杆菌。一些具体实施例中,所述宿主细胞为大肠杆菌e.coli bl21(de3)。
14.本发明还提供了所述的突变体的制备方法,包括:培养所述的宿主细胞,诱导所述突变体的表达。
15.本发明所述的制备方法中,所述培养的培养基为lb培养基。具体实施例中,所述tb培养基中含有卡那霉素。所述诱导的诱导剂为iptg,所述iptg的浓度为1mm。
16.一些实施例中,所述突变体的制备方法还包括对诱导后菌体进行破碎和提取、纯化的步骤。所述破碎采用高压均质的方法。所述提取采用ni金属螯合层析。所述纯化采用中空纤维膜脱盐洗滤。
17.本发明所述的突变体、所述的核酸,所述的表达载体,所述的宿主细胞或所述制备方法制得的产物,在制备荧光素酶检测试剂中的应用。
18.本发明所述荧光素酶检测试剂用于药敏检测、毒性物质检测、饮用水安全快速验证。
19.一种荧光素酶检测试剂,其包括:所述的突变体和镁离子。
20.所述荧光素检测试剂中还包括:荧光素、atp、hepes缓冲液和edta。
21.一些具体实施例中,所述荧光素检测试剂中包括1μg荧光素酶、15nm荧光素,40pm atp,200mm hepes,3mm edta,2mm mgso4。
22.本发明还提供了一种荧光素酶检测的方法,其以本发明所述的检测试剂进行检测。
23.本发明还提供了一种药敏检测方法,其包括添加荧光素检测试剂后调整发光水平,然后加入铜绿假单胞菌培养基中,添加待测药物,37℃共同孵育5小时,检测发光值。
24.本发明提供的荧光素酶突变体为野生型的氨基酸序列如seq id no:1所示。所述突变体包括l17r、i47r、f176r、e354k突变位点中的至少一个。其在宿主中能够高效表达,且表达产物具有高活性,高热稳定性的特点。实验表明,每升发酵后的培养基可以得到360mg荧光素酶,酶活可以达到1.29
×
109u/mg,是野生型的12倍;在药敏实验中铜绿假单胞菌培养条件下5小时后酶活显著优于野生型荧光素酶。
附图说明
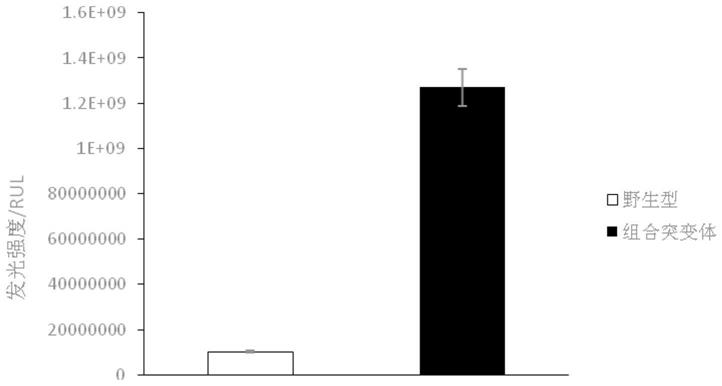
25.图1为野生型萤火虫荧光素酶及突变型酶atp标准液体系酶活统计。
具体实施方式
26.本发明提供了荧光素酶突变体及其应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
27.除非另有定义,本文使用的所有科技术语具有本领域普通技术人员所理解的相同
含义。关于本领域的定义及术语,专业人员具体可参考current protocols in molecular biology(ausubel)。氨基酸残基的缩写是本领域中所用的指代20个常用l-氨基酸之一的标准3字母和/或1字母代码。
28.所述北美萤火虫荧光素酶突变体的氨基酸序列如seq id no:2所示:
29.medaknikkgpapfypredgtageqlhkamkryalvpgtiaftdahrevdityaeyfemsvrlaeamkryglntnhrivvcsenslqffmpvlgalfigvavapandiynerellnsmgisqptvvfvskkglqkilnvqkklpiiqkiiimdsktdyqgfqsmytfvtshlppgrneydfvpesfdrdktialimnssgstglpkgvalphrtacvrfshardpifgnqiipdtailsvvpfhhgfgmfttlgylicgfrvvlmyrfeeelflrslqdykiqsallvptlfsffakstlidkydlsnlheiasggaplskevgeavakrfhlpgirqgygltettsailitpkgddkpgavgkvvpffeakvvdldtgktlgvnqrgelcvrgpmimsgyvnnpeatnalidkdgwlhsgdiaywdedehffivdrlkslikykgyqvapaelesillqhpnifdagvaglpdddagelpaavvvlehgktmtekeivdyvasqvttakklrggvvfvdevpkgltgkldarkireilikakkggkiav
30.编码所述北美萤火虫荧光素酶突变体的核苷酸序列如seq id no:3所示:
31.atggaagatgcgaaaaacattaaaaaaggcccggcgccgttttatccgcgggaagatggcaccgcgggcgaacagctgcataaggcgatgaaacgctatgcactggtgccgggcaccattgcgtttaccgatgcgcatagagaagtggatattacctatgcggaatattttgaaatgagcgtgcgcctggcggaagcaatgaagcgctatgggctgaacaccaaccatcgcattgtggtgtgcagcgaaaacagcctgcagttttttatgccggtgctgggcgcgctgtttattggcgtggcggtggcgccggcgaacgatatttataacgaacgcgaactgctgaacagcatgggcattagtcagccgaccgtagtttttgtgagcaaaaaaggcctgcagaaaattctgaacgtgcagaaaaaactgccgattattcagaaaattattattatggatagcaaaaccgattatcaaggctttcagagcatgtatacctttgtgacgagccatctgccgccgggcagaaacgaatatgattttgtgccggagagctttgatcgcgataaaaccattgcgctgattatgaatagcagcggcagcaccggccttccaaagggcgtggcacttccccaccgcaccgcgtgcgtgcgctttagccatgcgcgcgatccgatttttggcaatcagattattccggataccgcgattctgagcgtggtaccctttcatcatggctttggcatgtttaccaccctgggctatctgatttgcggctttcgcgtggtgctgatgtatcgctttgaagaagaactgtttctgcgcagcctgcaagattataaaattcagagcgcgctgctggtgccgaccctgtttagcttttttgcgaaaagcaccctgattgacaagtatgatctgagcaacctgcatgaaattgcgagcggcggcgcgccgctgagcaaagaagtgggcgaagcggtggcgaaacgctttcatctgccgggcattcgccaaggctatggcctgactgaaaccacgagcgcgattctgattaccccgaagggcgatgataaaccgggcgcggtgggcaaagttgttccgttcttcgaagcgaaagtggtggatctggataccggcaaaaccctgggcgtgaatcagcgcggcgaactgtgcgtgcgcggcccgatgattatgagcggctatgtgaacaacccggaagcgaccaacgcgctgattgataaggatggctggctgcatagcggcgatattgcgtattgggatgaagatgaacatttttttattgtggatcgcctgaaaagcctgattaaatataaaggctatcaagtggcgcctgcggagctggaaagcattctgctgcagcatccgaacatttttgatgcgggcgtggcgggcctgccggatgatgatgcgggcgaactgccggcggcggtggtggtgctggaacatggcaaaaccatgaccgaaaaagaaattgtggattatgtggcgagccaagtgaccaccgcgaaaaaactgcgcggcggcgttgtatttgtggatgaggtgccgaaaggcctgaccggcaaactggatgcgcgcaaaattcgcgaaattctgattaaagcgaaaaaaggcggcaaaattgcggtgtaa
32.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
33.实施例1组合的荧光素酶优化突变方案构建
34.包含突变位点的北美萤火虫(p.pyralis)基因经过密码子优化后由苏州金唯智公
司合成(seq id no:3),利用nde i和xho i双酶切连接至pet28a载体(购自novagen公司),命名为luc-mut-pet28a。
35.采用t7和t7t通用引物对luc-mut-pet28a进行测序,测序由上海生工生物技术公司完成。测序结果显示,luc-mut-pet28a插入基因序列与seq id no:3所示序列相同。
36.实施例2组合的荧光素酶优化突变基因的表达
37.将实例1中luc-mut-pet28a载体转入bl21(de3)感受态细胞中,lb液体培养基按1:1000加入卡那霉素进行筛选,平板挑取单菌落接入3mllb培养基,置于台式恒温振荡器37℃230rpm,培养值od600值至0.6-1.0,取1ml菌液转移至1.5ml离心管,加入1μl 1m iptg,诱导培养3-4h,取菌液20μl送样sds-page检测表达情况。筛选表达的菌液,接种至tb培养基中于20l发酵罐中16℃诱导培养16h,收获菌体360g。
38.实施例3组合的荧光素酶优化突变蛋白的纯化制备
39.(1)从-20℃取出200g菌体,以1:20的比例计算所需破菌缓冲液(50mm tris-hcl+300mm nacl+20mm咪唑ph7.4)的体积,并准确量取(如200g菌需量取4l50mm tris-hcl+300mm nacl+20mm咪唑ph7.4)。
40.(2)菌体重悬:菌体冰上解冻后,分次加入遇冷的破菌缓冲液(50mm tris-hcl+300mm nacl+20mm咪唑ph7.4),并倒入5l烧杯中,用剩余缓冲液冲洗离心管,并倒入同一烧杯中,样品在冰浴条件下搅拌,在磁力搅拌器上充分搅拌30min左右至无明显菌体固体。
41.(3)破菌处理;将菌悬液倒入高压匀质机料杯,按下“run”键开始运行,流出的样品接入到烧杯中。待流出液均匀流出后按下冷却水循环机循环冷却键,缓慢调节压力阀,压力表示数800~850bar之间,开始匀质,循环4次(一次循环以所有样品全部通过为准),期间当压力显示示数低于800bar时,调节压力阀,至示数恢复到800~850bar之间。循环结束后,调节压力阀至示数为
‘
000’。
42.(4)高压匀质好的样品装入1000ml离心杯中,配平后离心,离心条件:4℃,8500rpm,30min。离心后马上倒出上清于5l烧杯中。
43.(5)过滤:使用蠕动泵,0.8μm/0.45μm孔径的囊氏滤器过滤,滤液收集至另一洁净的5l烧杯中。(过滤过程中时刻关注连接囊氏滤器的橡胶管压力,压力过高则降低蠕动泵转速,蠕动泵转速不得高于300转/分钟。)
44.(6)使用aktaprime plus进行ni金属螯合层析。洗杂:上样再平衡后,程序运行至5%b开始洗脱,观察紫外曲线变化趋势,待紫外吸收值上升时将废液管放入到干净的500ml烧杯中收集5%洗脱液,紫外值水平时结束收集然后将废液管放回废液桶。
45.(7)目的蛋白解离:程序运行至50%b开始洗脱,观察紫外曲线变化趋势,待紫外值上升时开始收集样品,需将废液管放于1l棕色瓶中,并将棕色瓶至于冰上。
46.(8)利用分子截留量10kd的中空纤维膜进行脱盐洗滤,洗滤缓冲液为50mmtris-hcl+2%海藻糖ph7.4。
47.实施例4野生型萤火虫荧光素酶及突变型酶atp标准液体系活性测定
48.配制100μl的荧光素酶酶活测定体系(1μg荧光素酶,15nm荧光素,40pm atp,200mm hepes,3mm edta,2mm mgso4,ph 7.6),使用安图生物lumo化学发光免疫分析仪迅速测定发光强度。如图1所示,在相同体系中,优化改造的荧光素酶发光值为1.29
×
109u,是野生型的12倍。
49.实施例5 seq id no:2所示突变体稳定性评估
50.通过预实验调整荧光素酶添加量使seq id no:2所示突变体和野生型荧光素酶发光值处于同一水平,seq id no:2所示突变体和野生型荧光素酶同步放置37℃放置10天,-20℃冰箱放置作为对照,利用实施例4中荧光素酶酶活测定方法评估突变体酶的稳定性,三次测定取平均值。如表1所示:
51.表1为野生型萤火虫荧光素酶及seq id no:2所示突变体稳定性结果
52.样品37℃加速9天-20℃保存9天降幅野生型酶(冻干)4,043,2914,490,0379.9%组合突变体酶(冻干)4,363,8264,429,8001.5%
53.野生型荧光素酶发光值下降9.9%,seq id no:2所示突变体发光值仅下降1.5%。seq id no:2所示突变体稳定性显著优于野生型荧光素酶。
54.实施例6 seq id no:2所示突变体在药敏实验中的应用
55.利用实例4所述酶活测定方法,调整野生型和组合突变型荧光素酶的用量,使发光值处于同一水平,加入铜绿假单胞菌培养基中,添加不同的头孢噻肟用量,37℃共同孵育5小时,结果如表2。结果显示:检测发光值组合突变体酶显著高于野生型荧光素酶,药敏体系对组合突变型荧光素酶的影响更小。
56.表2为野生型荧光素酶及seq id no:2所示突变体与铜绿假单胞菌共培养5小时后的发光值
57.抗生素浓度(μg/ml)野生型酶组合突变体酶ctx-643786684936ctx-3210407697258ctx-1614223718816ctx-83797163161ctx-439212395ctx-22888280ctx-12708007ctx-0.51627669
58.以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
