1.本发明属于有机荧光探针领域,具体涉及一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针及制备和应用。
背景技术:
2.荧光探针辅助的荧光成像技术因其无侵入性、高灵敏度以及亚细胞水平上生物物种的原位和实时可视化,已成为一种强大的工具。目前,许多探针已经被开发出来用于细胞内活性物质和/或单/双细胞器的成像。然而,由于π-π堆积和其他非辐射途径,传统荧光团往往存在聚集荧光猝灭(aggregation-caused quenching,acq)效应,可能导致聚集状态下荧光发射变弱,容易发生光漂白。唐本忠团队于2001年首次提出的一类新型聚集诱导发光(aggregation induced emission,aie)发光剂可以完美地解决acq问题(j.luo,z.xie,j.w.y.lam,l.cheng,h.chen,c.qiu,h.s.kwok,x.zhan,y.liu,d.zhu and b.z.tang,aggregation-induced emission of 1-methyl-1,2,3,4,5-pentaphenylsilole,chem.commun.,2001,18,1740-1743.)。aie发光剂(aiegens)在溶液中无放射性或微放射性,但由于分子内动力的限制(restriction of intramolecular motions,rim),在聚集状态下发出强烈的荧光。利用其固有特征,aie发光剂通常表现出较大的stokes位移、优越的光稳定性和高灵敏度,在监测生命系统中酯酶活性等生物活性物质方面具有良好的潜力。例如,李振等人研究了一种基于aie原理的生物探针(deam),通过与酯酶可识别的乙酰氧基单元整合来感知细胞内酯酶活性。此外,最近的证据表明,一些aie荧光探针也可以在光照射下产生活性氧(reactive oxygen species,ros),使其成为光动力治疗(photodynamic therapy,pdt)的有效光敏剂。例如,唐本忠等人合理构建了一个h2o2响应的aie探针ttpy-h2o2,用于成像引导下的细胞器靶向和光动力癌细胞消融。王建国等人研发了一种lds靶向和aie活性光敏剂tpecnpb,作用于癌细胞内h2o2激活荧光引导pdt。赵娜等人通过将苯丁酸氮芥的抗癌药物与aie活性光敏剂偶联,开发了一种协同化疗-光动力癌症治疗进行溶酶体/线粒体双靶向和图像引导的癌症治疗方法。虽然现有基于aie原理的生物探针具有优越的性能,但一种能够进行线粒体/脂滴(lds)双成像、检测细胞活力和同时用于癌细胞pdt的aie荧光探针确很少被研究。
技术实现要素:
3.本发明的目的在于提供一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针,该荧光探针mito-ttpe含有吡啶阳离子部分,通过与电负性线粒体膜静电作用来靶向线粒体;另外,该荧光探针mito-ttpe选择乙酰氧基作为酯酶可激活位点,其在活细胞中被线粒体酯酶水解后,部分转化为蓝色放射性的ld-ttp,可在lds中特异性积累,由于mito-ttpe这种独特的双色放射和双细胞器靶向变化被酯酶水解控制,所以mito-ttpe可以用于评估细胞活力;此外,荧光探针mito-ttpe具有更强的d-π-a效应,产生ros的能力明显
高于ld-ttp,因此对光动力癌细胞消融具有强大的作用。
4.为实现上述目的,本发明采用如下技术方案:
5.一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针,其化学结构为式(i)所示的化合物:
[0006][0007]
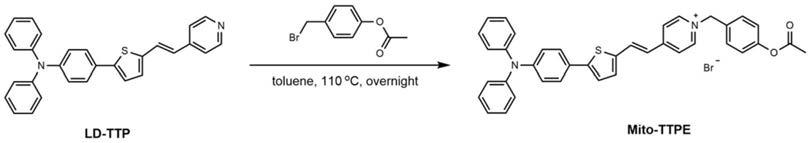
本发明还提供上述的双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针的制备方法,该方法以ld-ttp和乙酸4-(溴甲基)苯酯为反应原料,常压下在有机溶剂中回流反应,反应结束后冷却至室温,减压除溶剂,之后通过硅胶色谱纯化即可制得本发明所述的荧光探针mito-ttpe;该方法合成途径简洁,收率较高,操作简单。
[0008]
进一步,上述反应需要在惰性气体保护下进行,所述有机溶剂为乙腈,甲醇,乙醇,二氯甲烷或无水甲苯;反应温度为60~120℃,反应时间为6h~36h;硅胶色谱纯化使用的溶剂为二氯甲烷与甲醇,二氯甲烷与甲醇的体积比为10~60:1~2。
[0009]
更进一步,本发明在制备荧光探针mito-ttpe时的合成路线如下:
[0010][0011]
具体步骤为:
[0012]
(1)将ld-ttp和乙酸4-(溴甲基)苯酯在无水甲苯中氩气保护下回流过夜;其中,反应温度为110℃,所述ld-ttp与乙酸4-(溴甲基)苯酯物质的量之比为1~2:1.1~50。
[0013]
(2)反应结束后冷却至室温,减压除溶剂,用ch2cl2/meoh=10~60:1~2硅胶色谱纯化残渣,得到紫色固体mito-ttpe。
[0014]
本发明提供的荧光探针mito-ttpe具有典型的aie特征,其在乙醇/己烷混合溶剂中时,当己烷组分为0%(100%乙醇)时,表现出微弱的发光,当己烷组分高于60%时,荧光强度迅速增加,从712nm向646nm缓慢移动;当己烷组分为60%到90%之间时,荧光强度迅速增加,当己烷组分达到95%时,荧光强度最强。
[0015]
另外,本发明提供的荧光探针mito-ttpe是一种红色发射的线粒体靶向探针,红色发射的mito-ttpe在活细胞中可被活性酯酶水解成蓝色发射的ld-ttp,而mito-ttpe的发射峰与ld-ttp之间存在约110nm的发射位移,且水解产物ld-ttp可以特异性定位于lds;因此,该荧光探针mito-ttpe可在评估细胞活力方面和/或荧光成像中应用;或,在制备评估细胞活力的试剂中应用。
[0016]
本发明还提供一种细胞成像方法,该方法是将荧光探针mito-ttpe接触靶细胞,并使用成像方法识别细胞目的靶标;其中,所述目的靶标包括线粒体、lds。
[0017]
本发明还提供一种细胞活力评估方法,该方法是将细胞与荧光探针mito-ttpe染
色或孵育,之后进行双通道成像实验,通过clsm分别捕捉水解液中ld-ttp和mito-ttpe的荧光图像,根据双通道荧光强度的不同变化,评估不同细胞的生存能力。
[0018]
本发明提供的荧光探针mito-ttpe具有更强的d-π-a效应,在白光照射下能高效生成ros;因此,该荧光探针mito-ttpe可在光动力癌细胞消融方面中应用;或,在制备抗肿瘤药物中应用;其中,所述肿瘤药物为光动力治疗的药物;所述光动力治疗,可通过近红外光直接照射体表肿瘤或通过光纤导入照射体内深层肿瘤,有效抑制肿瘤生长。
[0019]
本发明还提供一种杀死癌细胞的方法,该方法是用荧光探针mito-ttpe接触靶癌细胞,当化合物接触靶癌细胞时,使用成像方法对靶癌细胞进行成像;和当化合物接触靶癌细胞时,将靶癌细胞置于白光照射下,以杀死靶癌细胞。
[0020]
本发明还提供一种产生单线态氧的方法,该方法是用白光照射荧光探针mito-ttpe。
[0021]
本发明的优点和有益效果:
[0022]
(1)本发明首次制备了一种酯酶敏感的aie探针,用于双细胞器成像、细胞活力评估和光动力癌细胞消融。该荧光探针mito-ttpe相对于其他探针在实时监测细胞凋亡和癌细胞的光动力消融方面有巨大的潜力,能有效的评价活细胞双通道荧光强度变化,早期凋亡,晚期凋亡和死亡细胞的不同细胞活力,且合成途径简洁,收率较高,操作简单。
[0023]
(2)本发明成功合成了mito-ttpe,这是首次报道的一种以nir荧光靶向线粒体的aie探针。mito-ttpe在活细胞中被线粒体酯酶水解后,部分转化为蓝色放射性的ld-ttp,可在lds中特异性积累;由于这种独特的双色放射和双细胞器靶向变化被酯酶水解控制,mito-ttpe被成功地用于评估细胞活力。
[0024]
(3)本发明合成的mito-ttpe具有更强的d-π-a效应,在白光照射下能高效生成ros和单线态氧,而且产生ros的能力明显高于ld-ttp,因此mito-ttpe可被应用为癌细胞上有效的pdt指标。
附图说明
[0025]
图1是荧光探针mito-ttpe的化学结构以及作用机制;其中,a)为mito-ttpe的化学结构;b)为mito-ttpe对酯酶的反应机制;
[0026]
图2是实施例的实验结果表征图;其中,a)为mito-ttpe(5μm)在乙醇/己烷混合溶剂中的己烷组分(fh)从0%增加到95%的荧光光谱,λ
ex
=488nm;b)为相对荧光发射强度(i/i0)与fh的曲线图;c)为mito-ttpe(2μm)与人羧酸酯酶2(human carboxylesterase 2,ces2)(2μg/ml)在不同时间的荧光光谱,λ
ex
=410nm;d)为mito-ttpe(2μm)与ces2(2μg/ml)在不同时间的荧光光谱,λ
ex
=495nm;e)为使用2',7'-二氯二氢荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,dcfh-da)作为指示剂在白光照射(1.75mw/cm2)时,mito-ttpe(10μm)和ld-ttp(10μm)的总活性氧(reactive oxygen species,ros)生成;f)为使用9,10-蒽二基-双(亚甲基)二丙二酸(9,10-anthracenediyl-bis(methylene)dimalonic acid,abda)(100μm)作为指示剂,在白光照射(1.75mw/cm2)下,mito-ttpe(10μm)和ld-ttp(10μm)的单线态氧(1o2)生成。
[0027]
图3是mito-ttpe和ld-ttp双通道成像对比图;其中,a)、e)是用5μm mito-ttpe和5μm ld-ttp染色的活hela细胞荧光图像,λ
ex
=488nm,λ
em
=600-710nm;b)、f)是蓝色通道,λ
ex
=405nm,λ
em
=540-600nm;c)、g)是合并后的图像;d)、h)是亮场图像;比例尺:20μm。
[0028]
图4是活的hela细胞分别与5μm mito-ttpe(a、e)和1μm mtg(b)或0.3μm nile red(f)共染色的荧光图像;其中,c)、g)是合并后的图像;d)、h)是亮场图像;红色通道mito-ttpe:λ
ex
=488nm,λ
em
=600-710nm;蓝色通道mito-ttpe:λ
ex
=405nm,λ
em
=540-600nm;mtg:λ
ex
=488nm,λ
em
=495-540nm;nile red:λ
ex
=561nm,λ
em
=600-670nm;比例尺:20μm。
[0029]
图5是用5μm mito-ttpe染色的活hela细胞的时间依赖性荧光图像;其中,红色通道:λ
ex
=488nm,λ
em
=600-710nm;蓝色通道:λ
ex
=405nm,λ
em
=540-600nm;比例尺:20μm。
[0030]
图6是用5μm mito-ttpe染色活的、早期凋亡的、晚期凋亡的和死亡的hela细胞的荧光图像;其中,红色通道:λ
ex
=488nm,λ
em
=600-710nm;蓝色通道:λ
ex
=405nm,λ
em
=540-600nm;比例尺:20μm。
[0031]
图7是使用dcfh-da作为指示剂,在5μm mito-ttpe白光照射(50mw/cm2)下不同时间的活hela细胞中的细胞内ros水平;λ
ex
=488nm,λ
em
=500-550nm;比例尺:20μm。
[0032]
图8是用5μm mito-ttpe孵育hela活细胞后,用白光照射(50mw/cm2,30min),用钙绿素染色的hela细胞pdt的荧光成像,绿色通道:λ
ex
=488nm,λ
em
=500-550nm;红色通道:λ
ex
=561nm,λ
em
=630-700nm;比例尺:20μm。
[0033]
图9是mito-ttpe的合成路线。
[0034]
图10是荧光探针mito-ttpe典型的aie特征表征图;其中,a)为mito-ttpe在组分(fh)为95%的乙醇/己烷混合溶剂中的动态光散射数据;b)为mito-ttpe的固态荧光谱图,插图为在365nm紫外照射下拍摄的固态mito-ttpe荧光照片。
[0035]
图11是mito-ttpe和mito-ttpe与ces2反应的质谱图。
[0036]
图12是图2e)各化合物的荧光光谱;其中,a)为mito-ttpe+dcfh的荧光谱图;b)为ld-ttp+dcfh的荧光谱图;c)为mito-ttpe的荧光谱图;d)为ld-ttp的荧光谱图;e)在磷酸缓冲盐溶液(phosphate bufferd saline,pbs)后不同时间的白光照射的荧光谱图。
[0037]
图13是hela细胞与mito-ttpe和ld-ttp在黑暗和白光照射(50mw/cm2)孵育30min下的活力;其中,a)为hela细胞与mito-ttpe孵育30min下的活力;b)为hela细胞与ld-ttp孵育30min下的活力。
[0038]
图14是mito-ttpe的核磁共振氢谱图。
[0039]
图15是mito-ttpe的核磁共振碳谱图。
[0040]
图16是以dcfh-da为指示剂在白光照射(50mw/cm2)下的活hela细胞内ros水平;dcfh-da:λ
ex
=488nm,λ
em
=500-550nm;比例尺:20μm。
具体实施方式
[0041]
下面结合附图和具体实施例来进一步说明本发明,但本发明的实施方式不限于此。对于未特别注明的工艺参数,可参照常规技术进行。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0042]
实施例1一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针,化学结构式如图1中的a)所示,该化合物的光物理性能如表1所示。
[0043]
表1 mito-ttpe的光物理性能
[0044][0045]
表1中λ
abs
为吸收最大值;λ
em
为发射最大值;ε为最大吸收波长的摩尔吸收率;φ为荧光量子产率,使用xds 307作为标准参考,在乙醇中的量子产率为0.56。
[0046]
实施例2一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针的制备
[0047]
一种双细胞器成像、细胞活力评估和光动力癌细胞消融的荧光探针的制备方法,合成路线如图9所示,具体合成步骤为:将ld-ttp(50mg,0.12mol)和乙酸4-(溴甲基)苯酯(55mg,0.24mol)在无水甲苯(2.5ml)中氩气回流过夜;冷却至室温,减压除溶剂,用ch2cl2/meoh=30:1(v/v)硅胶层析纯化残渣,得到紫色固体mito-ttpe(72mg,78%)。
[0048]1h nmr(600mhz,dmso-d6)δ9.03(s,j=6.0hz,2h),8.24-8.21(m,3h),7.62-7.63(d,2h),7.59-7.58(d,2h),7.51(s,2h),7.35-7.34(m,4h),7.23-7.21(d,j=8.4hz,2h),7.15-7.08(m,7h),6.98-6.97(d,j=8.4hz,2h),5.72(s,2h),2.27(s,3h).见图14。
[0049]
13
c nmr(150mhz,dmso-d6)δ169.60,153.54,151.49,148.33,147.98,147.00,144.48,139.12,134.89,134.53,132.64,130.43,130.24,127.32,126.68,125.27,124.41,124.09,123.13,122.60,121.61,61.89,21.31,hr-ms m/z:[m+h]
+
calculated for c
38h31
n2o2s
+
,579.2101;measured,579.2099.见图15。
[0050]
实施例3 mito-ttpe在乙醇/己烷混合溶剂中随己烷组分增加的aie特性。
[0051]
将mito-ttpe溶于二甲基亚砜中制备原液(1.0mm);研究mito-ttpe(5μm)在不同己烷组分的乙醇/己烷混合溶剂中的aie性能。如图2a所示,mito-ttpe在100%乙醇中表现出微弱的发光,当己烷组分高于60%时,荧光强度迅速增加,从712nm向646nm缓慢移动;己烷组分为60%到90%之间时,荧光强度迅速增加,当己烷组分达到95%时,荧光强度最强,αaie(1/10)约为28(图2b);mito-ttpe在组分(fh)为95%的乙醇/己烷混合溶剂中的动态光散射数据如图10a所示,mito-ttpe的固态荧光谱图如图10b所示,实验结果表明,mito-ttpe具有典型的aie特征。
[0052]
实施例4 mito-ttpe对酯酶的响应
[0053]
在室温下的pbs(ph 7.4)中,测量了在没有和存在ces2的情况下mito-ttpe的光学特性,用pbs(ph 7.4)检测mito-ttpe(2μm)与ces2(2μg/ml)在不同时间的光谱。图2c和d为mito-ttpe与ces2反应的荧光光谱;在有ces2的情况下,仅在660nm左右观测到最大发射量(图2c);随着反应时间的延长,荧光发射逐渐减少,在没有ces2的情况下,随着反应时间的延长,荧光发射逐渐增强,峰值在550nm左右(图2d),这与ld-ttp在pbs中的荧光光谱一致,说明mito-ttpe可被活性酯酶水解成ld-ttp。
[0054]
值得注意的是,mito-ttpe的发射峰与ld-ttp之间存在约110nm的发射位移,这有
利于mito-ttpe在红色通道和蓝色通道上的双成像。
[0055]
为了确定mito-ttpe对ces2的响应机制,本发明进行了如图11所示的hr-ms分析。mito-ttpe与ces2反应后,不再观察到m/z=579.2099([mito-ttpe]
+
,calcd:579.2101)的游离mito-ttpe的质量峰,而捕捉到一个新的m/z=430.6963的峰,对应于加成物的形成([ttpb-ces2]
+
),与ld-ttp([ld-ttp]
+
,calcd:430.1504)一致。因此,研究结果进一步证明了mito-ttpe可被活性酯酶水解成ld-ttp(见图1b)。
[0056]
实施例5 mito-ttpe的目的靶标
[0057]
将活hela细胞分别与mito-ttpe和ld-ttp在37℃下,细胞培养箱中孵育30分钟,并在双通道成像模式(红色和蓝色通道)下观察。mito-ttpe在红色和蓝色通道中均表现出明显的荧光发射(图3a-c),而在ld-ttp染色的细胞中仅检测到蓝色荧光信号(图3e-g)。在mito-ttpe的红色通道中观察到清晰而典型的线粒体丝状结构,在mito-ttpe和ld-ttp的蓝色通道中观察到lds的球形斑点形态(图3d-e)。这些现象表明,红色发射的mito-ttpe在活细胞中可被水解成蓝色发射的ld-ttp。
[0058]
本发明分别用商用线粒体染色染料mtg和lds染色染料nile red进行共定位成像实验。hela细胞分别与mito-ttpe和ld-ttp(5μm)、mtg(mito tracker green)(1μm)和nile red(0.3μm)共孵育30min;荧光图像使用clsm捕获;mito-ttpe红光通道:λex=488nm,λem=600-710nm;mtg:λex=488nm,λem=495~540nm;尼罗红:λex=561nm,λem=600-670nm;mito-ttpe在蓝色通道或ld-ttp:λex=405nm,λem=540-600nm。mito-ttpe的红色荧光发射与mtg的红色荧光发射重叠良好,pearson的共定位系数较高,为0.93(图4a-d);同样,mito-ttpe的蓝色荧光信号与nile red的荧光信号有很好的重叠(pearson的共定位系数为0.95)(图4e-h)。结果表明,mito-ttpe是一种红色发射的线粒体靶向探针,而水解产物ld-ttp可以特异性定位于lds。
[0059]
另外,本发明研究mito-ttpe在活hela细胞中的实时和现场成像性能。如图5所示,mito-ttpe首次在红色通道中染色线粒体;大约20分钟后,蓝色通道内的lds也被特异性点亮,蓝色通道的荧光强度随时间增加。结果表明,mito-ttpe通过静电相互作用对线粒体进行特异性染色,并被细胞内羧酸酯酶水解为亲脂水解产物,并逐渐在lds中积累。
[0060]
实施例6用mito-ttpe评估细胞活力
[0061]
活细胞:活hela细胞用mito-ttpe(5μm)染色30分钟。
[0062]
早期凋亡细胞:活hela细胞用10mm h2o2预处理1小时后,再用mito-ttpe(5μm)再在37℃下,细胞培养箱中孵育30分钟。
[0063]
晚期凋亡细胞:活hela细胞用h2o2预处理后(10mm)5小时,再用mito-ttpe(5μm)再在37℃下,细胞培养箱中孵育30分钟。
[0064]
死细胞:活hela细胞先用4%的多聚甲醛处理30分钟,再用mito-ttpe(5μm)再在37℃下,细胞培养箱中孵育30分钟。
[0065]
分别在存活、早期凋亡、晚期凋亡和死亡的hela细胞中进行双通道成像实验,用clsm分别捕捉水解液中ld-ttp和mito-ttpe的荧光图像,分别用蓝色通道(λex=405nm,λem=540-600nm)和红色通道(λex=488nm,λem=600-710nm)。由于酯酶在活细胞中活性较高,在mito-ttpe染色的活细胞中,蓝色通道和红色通道的荧光发射信号都很清晰(见图6),蓝色通道说明mito-ttpe被活性酯酶部分水解为ld-ttp,蓝色通道中的荧光发射信号越强,生
存能力越强,晚期凋亡细胞的蓝色荧光信号弱于早期凋亡细胞。红色通道中的荧光发射信号越强,生存能力越弱,由于死细胞中酯酶活性失活,所以采集不到蓝色荧光信号,但在mito-ttpe染色的死亡hela细胞中可以检测到强烈的红色发射。因此,实验数据表明,mito-ttpe通过活细胞、早期凋亡、晚期凋亡和死亡细胞中双通道荧光强度的不同变化,可以有效评估不同细胞的生存能力。
[0066]
实施例7 mito-ttpe和ld-ttp的ros生成能力
[0067]
采用abda(9,10-蒽二基-双(亚甲基)二丙二酸)(100μm)的紫外/可见光谱和二氯荧光素(dcfh,10μm)的荧光光谱分别监测mito-ttpe(10μm)和ld-ttp(10μm)在白光(1.75mw/cm2)照射下的单重态氧(1o2)和总ros生成能力,结果见图2e、2f、图12。
[0068]
通过监测二氯荧光素(dcfh)在525nm处增强的荧光强度,评估mito-ttpe和ld-ttp各种ros生成能力的总含量,如图2e和图12所示,随着白光照射时间的增加,在mito-ttpe和ld-ttp的存在下,dcfh的荧光强度迅速提高,在20分钟内达到167倍和56倍的增强,表明mito-ttpe和ld-ttp能高效生成ros,而且abda在419nm左右的吸收强度在白光照射下逐渐降低,而在没有pss的情况下几乎没有明显的降解,说明mito-ttpe和ld-ttp可以有效地生成ros来消耗abda。本发明mito-ttpe产生ros的能力明显高于ld-ttp,这可能与mito-ttpe具有更强的d-π-a效应有关。
[0069]
另外,本发明将2,7-二氯二氢荧光素二乙酸酯(dcfh-da)作为ros荧光指示剂,把活hela细胞与mito-ttpe在37℃下,细胞培养箱中共孵育30分钟后,再用dcfh-da(10μm)处理,用dcfh-da绿色通道clsm(λex=488nm,λem=500-550nm)捕捉荧光图像,监测细胞内ros的变化,结果如图7、图16所示。图7中上面一组图为没有mito-ttpe的对照组细胞,显示出可忽略的辐射;图7中下面一组图是在有mito-ttpe存在下,随着照射时间的增加,荧光明显增强,表明mito-ttpe在光照射下在活细胞中产生有效的ros,ros可由线粒体中的mito-ttpe和ld-ttp共同产生。
[0070]
实施例8 pdt(光动力疗法)对癌细胞的消融
[0071]
calcein-am/pi试剂盒检测细胞毒性
[0072]
用calcein-am/pi试剂盒检测细胞活力和hela细胞的形态。对于h2o2诱导的细胞凋亡:h2o2(10μm)处理4.5小时后,用mito-ttpe(5μm)孵育30分钟,然后用calcein-am(0.67μm)/pi(1.5μm)染色30分钟。对于白光诱导的细胞凋亡:孵化后mito-ttpe(5μm)30分钟,hela细胞在50mw/cm2光照或不光照条件下处理30分钟,然后用calcein-am(0.67μm)/pi(1.5μm)再染色30分钟;采用绿色通道clsm(λex=488nm,λem=500-550nm)捕捉钙黄素-am的荧光图像(λex=561nm,λem=630~700nm)。
[0073]
另外,将活hela细胞与mito-ttpe孵育30分钟后,再用钙黄绿素-am(活细胞的绿色荧光)/pi(死细胞的红色荧光)试剂盒处理15分钟,将am和pi配成工作液,吸取一定的体积(加入1微摩尔级别的量),加入细胞培养皿中进行孵育;具体可参考共定位加的商业化探针。如图8所示,在光照射后,对照细胞呈现绿色钙黄绿素-am信号,表明mito-ttpe和ld-ttp在黑暗条件下都具有良好的生物相容性。而光照射30min后,pi呈亮红色发射,绿色通道几乎未检测到荧光,表明pdt对癌细胞的有效消融。
[0074]
此外,通过mtt法进一步证实mito-ttpe和ld-ttp对hela细胞的细胞活力。在黑暗条件下,mito-ttpe和ld-ttp表现出相对较低的细胞毒性,如图13,表明它们具有良好的生
物相容性。在白光照射下,细胞毒性表现出明显的剂量依赖性,照射30分钟后,10μm mito-ttpe和ld-ttp的细胞存活率分别只有20%和30%。这些结果表明,mito-ttpe和ld-ttp对癌细胞消融的pdt都具有强大的作用,而且mito-ttpe比ld-ttp表现出更有效的治疗输出,这与图2e中的ros,2f中的单线态氧(1o2)生成能力一致。
