1.本技术要求于2019年4月22日提交的韩国专利申请第10-2019-0046866号的优先权,该韩国专利申请的整个说明书通过引用以其整体并入本文。
2.本发明涉及鞭毛蛋白融合蛋白及其用途,更具体地说,涉及包含鞭毛蛋白、其片段;或其变体;以及免疫球蛋白fc区的融合蛋白和用途,其中使用其toll样受体5(tlr5)刺激活性。
背景技术:
3.鞭毛是确定细菌运动性的重要组分,主要由钩状体、基础小体和丝状体构成。还已知鞭毛具有确定细菌泳动或群游运动性、细菌趋性和形成生物膜以确定病原微生物粘附能力的功能。构成鞭毛丝状体的结构单位蛋白被称为鞭毛蛋白,并且鞭毛蛋白有规律地进行组装以形成丝状体。hayashi等报道,哺乳动物表达的tlr5识别革兰氏阴性和革兰氏阳性细菌的鞭毛蛋白,并且激活nf-κb(hayashi f,smith kd,ozinsky a,hawn tr,yi ec,goodlett dr,eng jk,akira s,underhill dm,aderem a:nature 410:1099-1103,2001)。
4.鞭毛蛋白是一种结构蛋白,其组装成细菌鞭毛的鞭茎样丝状体,丝状体从细胞表面延伸出来,并且起到使细菌移动的作用。通过充当毒力因子,鞭毛蛋白促进病原菌对宿主细胞进行渗透和侵袭。因为鞭毛蛋白仅存在于细菌中,并且是生有鞭毛的细菌中含量最丰富的蛋白之一,所以鞭毛蛋白是宿主免疫监视的主要目标。细菌侵袭后,鞭毛蛋白激活先天性免疫,该先天性免疫可通过宿主中的toll样受体5(tlr5)和naip5/nlrc4检测到,并且有助于立即将病原体从宿主中清除。
5.tlr5是一种位于细胞表面上的先天性免疫受体,由细胞外富含亮氨酸重复序列(lrr)结构域、跨膜结构域和细胞内结构域组成。tlr5使用细胞外结构域将鞭毛蛋白识别为病原体相关分子模式,并且激活myd88依赖性信号传导通路和nf-κb介导的炎性细胞因子产生。
6.鞭毛蛋白作为疫苗载体蛋白或疫苗佐剂的开发目标一直备受关注,因为它是抵御鞭毛病原菌的第一道防线。已经证实,抗原与鞭毛蛋白的融合蛋白是可有效抵御多种传染性疾病的实验性疫苗,这些传染性疾病包括西尼罗热、疟疾、感染性疾病和结核病,并且据报道,鞭毛蛋白诱导的tlr5激活还保护造血细胞和辐射诱导的胃肠组织,并影响癌细胞的存活和生长。
7.鞭毛蛋白含有两个至四个结构域。例如,枯草芽孢杆菌(bacillus subtilis)hag鞭毛、铜绿假单胞菌(pseudomonas aeruginosa)a型flic鞭毛、肠道沙门氏菌肠道亚种鼠伤寒血清型(salmonella enterica subspecies enterica serovar typhimurium)flic鞭毛蛋白各自含有2个(d0和d1)、3个(d0、d1和d2)和4个(d0、d1、d2和d3)结构域。其中常见的d0和d1结构域通过介导鞭毛间相互作用而位于鞭毛丝状体的中心处,并且由于丝状体形成的功能重要性而在细菌物种中是高度保守的。由于鞭毛蛋白单体而非聚合丝状体激活tlr5,因此认为前述d0和d1结构域可能是tlr5的主要刺激物。在3结构域和4结构域鞭毛蛋白中,
d1结构域延伸至鞭毛丝状体表面上的辅助结构域(d2和d3),对丝状体形成几乎没有贡献。与d0和d1结构域不同,d2或d3结构域在序列和结构上表现出显著变化,并且被认为在基于鞭毛蛋白的疗法中激活适应性免疫并诱导不良的毒性。因此,通过从沙门氏菌属(salmonella)鞭毛蛋白中去除高变区(d2和d3结构域),开发了含有d0/d1的放射疗法生物药物cblb502。
8.许多革兰氏阳性细菌,如枯草芽孢杆菌和艰难梭菌(clostridium difficile),在高变区表达缺乏鞭毛蛋白,因此鞭毛丝状体含有tlr5激活和鞭毛蛋白聚合所需的最小区域(d0和d1区)。
9.已使用沙门氏菌鞭毛蛋白对鞭毛蛋白-tlr5相互作用及其细胞后果进行了广泛研究。通过对肠道沙门氏菌肠道亚种都柏林血清型(salmonella enterica subspecies enterica serovar dublin)鞭毛蛋白d1-d2区(sdflagellin d1-d2)与斑马鱼tlr5的n端片段之间的复合物进行结构和生物化学研究,已知鞭毛蛋白和tlr5通过“主键”形成1:1复合物,然后其通过“二次二聚化”同型二聚体化成2:2复合物。
10.基于对鞭毛蛋白与tlr5之间相互作用的许多研究的结果,正在进行各种研究以通过修饰鞭毛蛋白来增强tlr5激活,但还没有对针对鞭毛蛋白-tlr5 2:2复合物结构的新型鞭毛蛋白进行研究。
11.发明详述
12.技术问题
13.因此,本发明者专注于当鞭毛蛋白激活tlr5时2:2复合体结构的形成,并且根据对开发具有改进的tlr5激活能力的新型蛋白进行反复研究的结果,发现与野生型鞭毛蛋白、已知鞭毛蛋白片段等相比,融合了鞭毛蛋白和免疫球蛋白fc的新型融合蛋白表现出显著优越的tlr5激活能力,并且完成了本发明。
14.因此,本发明的目的是提供融合蛋白,该融合蛋白包含鞭毛蛋白、其片段或其变体;以及免疫球蛋白fc区。
15.本发明的另一目的是提供编码该融合蛋白的多核苷酸。
16.本发明的另一目的是提供包含该多核苷酸的载体。
17.本发明的另一目的是提供用该载体转化的转化体。
18.本发明的另一目的是提供包含该融合蛋白作为活性成分的药物组合物。
19.还提供由该融合蛋白组成的药物组合物。
20.还提供基本上由该融合蛋白组成的药物组合物。
21.本发明的另一目的是提供包含该融合蛋白作为活性成分的疫苗佐剂。
22.还提供由该融合蛋白组成的疫苗佐剂。
23.还提供基本上由该融合蛋白组成的疫苗佐剂。
24.本发明的另一目的是提供该融合蛋白用于制备药剂的用途,该药剂用于治疗由辐射暴露引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症。
25.本发明的另一目的是提供一种方法,该方法用于治疗因暴露于辐射而引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症,该方法包含将有效量的包含该融合蛋白作为活
性成分的组合物施用于有需要的对象。
26.技术方案
27.为了实现本发明的上述目的,本发明提供鞭毛蛋白、其片段或其变体;以及免疫球蛋白fc区。
28.为了实现本发明的另一目的,本发明提供编码该融合蛋白的多核苷酸。
29.为了实现本发明的另一目的,本发明提供包含该多核苷酸的载体。
30.为了实现本发明的另一目的,本发明提供用该载体转化的转化体。
31.为了实现本发明的另一目的,本发明提供包含该融合蛋白作为活性成分的药物组合物。
32.本发明还提供由该融合蛋白组成的药物组合物。
33.本发明还提供基本上由该融合蛋白组成的药物组合物。
34.为了实现本发明的另一目的,本发明提供包含该融合蛋白作为活性成分的疫苗佐剂。
35.本发明还提供由该融合蛋白组成的疫苗佐剂。
36.本发明还提供基本上由该融合蛋白组成的疫苗佐剂。
37.为了实现本发明的另一目的,本发明提供该融合蛋白用于制备药剂的用途,该药剂用于治疗由辐射暴露引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症。
38.为了实现本发明的另一目的,本发明提供一种方法,该方法用于治疗因暴露于辐射而引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症,该方法包含将有效量的包含该融合蛋白作为活性成分的组合物施用于有需要的对象。
39.在下文中,将详细地描述本发明。
40.本发明提供鞭毛蛋白、其片段或其变体;以及免疫球蛋白fc区。
41.在本发明中,当有鞭毛的细菌被感染时,鞭毛蛋白可以在受感染的宿主中诱导免疫应答。更具体而言,存在于人体细胞膜表面上的toll样受体5(tlr5)通过与鞭毛蛋白相互作用来诱导细胞内信号转导,并且由此增加转录因子nf-kb的表达以诱导先天性免疫信号的激活,以及调节获得性免疫应答。
42.鞭毛蛋白例如在以下各项中被被很好地描述:美国专利号6,585,980、6,130,082;5,888,810;5,618,533;4,886,748和美国专利公开号us2003/0044429a1;以及donnelly等,(2002)j.biol.chem.43:4045等。大多数革兰氏阴性细菌表达鞭毛,鞭毛是一种提供运动性的表面结构。鞭毛由基础小体、丝状体和连接两者的钩状体组成。丝状体由鞭毛蛋白的长聚合物组成,鞭毛蛋白是一种单一蛋白,其顶端形成小的cap蛋白。
43.鞭毛蛋白的聚合由n端和c端处保守的区域介导,然而鞭毛蛋白的中间高变区在物种之间的序列和长度上是高度可变的。
44.在本发明中,鞭毛蛋白可以是衍生自任何合适细菌的鞭毛蛋白。大量鞭毛蛋白基因在本领域中已被克隆和测序,并且可以参考。
45.在本发明中,鞭毛蛋白的非限制性来源为芽孢杆菌属(bacillus)、沙门氏菌属、螺杆菌属(helicobacter)、弧菌属(vibrio)、沙雷氏菌属(serratia)、志贺氏菌属
(shigella)、密螺旋体属(treponema)、军团菌属(legionella)、疏螺旋体属(borrelia)、梭菌属(clostridium)、农杆菌属(agrobacterium)、巴尔通氏体属(bartonella)、变形杆菌属(proteus)、假单胞菌属(pseudomonas)、埃希氏菌属(escherichia)、李斯特氏菌属(listeria)、耶尔森氏菌属(yersinia)、弯曲杆菌属(campylobacter)、罗斯氏菌属(roseburia)或海杆菌属(marinobacter)微生物,优选为芽孢杆菌属、沙门氏菌属或弧菌属微生物。
46.更优选地,在本发明中,鞭毛蛋白可以衍生自肠炎沙门氏菌(salmonella enteritidis)、鼠伤寒沙门氏菌(salmonella typhimurium)、都柏林沙门氏菌(salmonella dublin)、肠道沙门氏菌(salmonella enterica)、幽门螺杆菌(helicobacter pylori)、霍乱弧菌(vibrio cholera)、创伤弧菌(vibrio vulnificus)、溶纤弧菌(vibrio fibrisolvens)、粘质沙雷氏菌(serratia marcesens)、弗氏志贺氏菌(shigella flexneri)、梅毒密螺旋体(treponema pallidum)、博氏疏螺旋体(borrelia burgdorferei)、艰难梭菌、根癌农杆菌(agrobacterium tumefaciens)、bartonella clarridgeiae、奇异变形杆菌(proteus mirabilis)、枯草芽孢杆菌、蜡样芽孢杆菌(bacillus cereus)、耐盐芽孢杆菌(bacillus halodurans)、铜绿假单胞菌、大肠杆菌(escherichia coli)、单核细胞增多性李斯特氏菌(listeria monocytogenes)、鼠疫耶尔森氏菌(yersinia pestis)、弯曲杆菌(campylobacter spp)、罗斯氏菌(roseburia spp)或海杆菌(marinobacter spp)。
47.甚至更优选地,在本发明中,鞭毛蛋白可以衍生自肠炎沙门氏菌、鼠伤寒沙门氏菌、都柏林沙门氏菌、肠道沙门氏菌、霍乱弧菌、创伤弧菌、溶纤弧菌、枯草芽孢杆菌、蜡样芽孢杆菌或耐盐芽孢杆菌,
48.最优选地,鞭毛蛋白可以是衍生自枯草芽孢杆菌的鞭毛蛋白。
49.tlr5识别鞭毛丝状体组装和移动所需的细菌鞭毛蛋白进化上保守的区域,但一些α和ε变形菌(空肠弯曲杆菌(campylobacter jejuni)、幽门螺杆菌和杆菌状巴尔通体(bartonella bacilliformis))鞭毛蛋白不被tlr5识别,如以下论文中所报道的。[(2003)microbes infect.5,1345-1356.;j.infect.dis.189,1914-1920.;(2002)nat.rev.cancer 2,28-37;(2001)clin.infect.dis.32,1201-1206.pmid:11283810]。被tlr5识别的细菌鞭毛蛋白在d0和d1结构域中具有类似保守的主要氨基酸序列,而不被tlr5识别的细菌鞭毛蛋白具有不同的氨基酸序列(pnas june 28,2005 102(26)9247-9252;scientific reports|7:40878|doi:10.1038/srep40878)。因此,在本发明中,鞭毛蛋白可以是在d0和d1结构域中包括被tlr5识别的保守序列的鞭毛蛋白。
[0050]
在本发明的一个实施方式中,参考先前报道的论文,制备了5种代表性细菌的鞭毛蛋白作为fc融合蛋白,其中被tlr5识别的共同氨基酸序列在d0和d1结构域中是保守的。
[0051]
鞭毛蛋白的n端和c端恒定区在本领域中被很好地表征,并且例如,可以参考文献[mimori-kiyosue等,(1997)j.mol.byrol.270:222-237;iino等,(1977)ann.genet.11:161-182;以及schoenhals等,(1993)j.bacteriol.175:5395-5402]。如本领域技术人员将容易理解的,恒定区的大小可以根据鞭毛蛋白的来源而稍有变化。一般而言,n端恒定结构域包含蛋白质的约170或180个n端氨基酸,然而c端恒定结构域通常包含约85-100个c端氨基酸。中央高变区根据细菌的大小和顺序而有相当大的变化,并且分子质量的差异大部分
可以通过高变区来解释。来自各种细菌的鞭毛蛋白的n端和c端恒定区是已知的,并且来自细菌的尚未已知的鞭毛蛋白也可以由本领域技术人员使用本领域已知的确定鞭毛蛋白单体晶体结构的技术来容易地确定。
[0052]
如本文所用,术语“鞭毛蛋白”、“鞭毛蛋白n端恒定区”和“鞭毛蛋白c端恒定区”包括衍生自任何上述实例性细菌的鞭毛蛋白活性片段和变体。此外,野生型鞭毛蛋白或鞭毛蛋白的多个部分可以被修饰以增加安全性和/或免疫应答和/或作为克隆程序或其他实验室操作的结果,并且此类修饰(或变体)也包括在本发明的范围内。
[0053]
在本发明中,鞭毛蛋白可以包括全长鞭毛蛋白或其活性片段。此外,如“鞭毛蛋白”、“鞭毛蛋白n端恒定区”和“鞭毛蛋白c端恒定区”等术语包括天然存在的氨基酸序列,或者这些术语分别还可以包含与天然存在的鞭毛蛋白、鞭毛蛋白n端恒定区或鞭毛蛋白c端恒定区的氨基酸序列基本上相同或类似的氨基酸序列。
[0054]
在本发明中,鞭毛蛋白、鞭毛蛋白n端恒定区、鞭毛蛋白c端恒定区或鞭毛蛋白任何其他部分的“活性片段”包含至少约50、75、100、125、150、200、250或至少300个连续氨基酸和/或少于约300、250、200、150、125、100或75个氨基酸的连续氨基酸,并且只要下限少于上限,还可以包括这些的组合。活性片段可以是指能够在宿主中激活tlr5通路的片段。
[0055]
在某些实施方式中,活性片段能够用至少约50%、75%、80%、85%、90%或95%的全长鞭毛蛋白激活tlr5通路,或者以与全长鞭毛蛋白或鞭毛蛋白区域相同或基本相同的程度激活tlr5通路,或者以与全长鞭毛蛋白或鞭毛蛋白区域相比更高的程度激活tlr5通路。
[0056]
在本发明中,活性片段可以是指表现出tlr5通路活性的鞭毛蛋白的至少一个部分。“至少一个部分”可以是指鞭毛蛋白的结构域0、1、2和3中表现出tlr5通路活性的部分。更具体地,活性片段可以从全长鞭毛蛋白中去除高变区。高变区可以根据衍生出鞭毛蛋白的细菌的类型而变化,并且在特定鞭毛蛋白的整个序列中,对应于高变区的序列可以被本领域技术人员容易地识别和去除。例如,在包含c端结构域2、1、0的全长鞭毛蛋白的情况下,n端结构域0、1、2;结构域3;以及结构域3或结构域2和3可能是高变区,并且在包括c端结构域1和0的全长鞭毛蛋白的情况下,n端结构域0、1;结构域2;结构域2可能是高变区。替代地,在不包含高变区的形式的鞭毛蛋白的情况下(例如衍生自许多革兰氏阳性细菌的鞭毛蛋白可能不含有高变区),发生鞭毛蛋白折叠的铰链区的序列可能会被部分地去除。
[0057]
本发明中所使用的术语“高变区”可以被表达为螺旋桨结构域或区域、铰链、高变区、可变结构域或区域等。
[0058]
在本发明中,高变区的去除可以意味着可以去除对应于高变区的整个结构域,或者也可以去除高变区的一部分序列。
[0059]
在本发明中,活性片段可以是呈以下形式的鞭毛蛋白:野生型鞭毛蛋白的高变区被去除,并且将人工序列(即人工序列的铰链或接头)插入到被去除的高变区中。
[0060]
在本发明中,本发明的鞭毛蛋白片段可以是指表现出tlr5通路活性的片段,该片段包含选自以下的至少一种:野生型鞭毛蛋白的c端结构域0、c端结构域1、c端结构域2、n端结构域2、n端结构域1、n端结构域0以及表现出与所述结构域中的每一种至少80%的氨基酸序列同源性的结构域。
[0061]
在某些实施方式中,活性片段能够通过至少约50%、75%、80%、85%、90%或95%的全长鞭毛蛋白激活tlr5通路,或者以与全长鞭毛蛋白或鞭毛蛋白区域相同或基本相同的
程度激活tlr5通路,或者与全长鞭毛蛋白或鞭毛蛋白区域相比更高地激活tlr5通路。
[0062]
本发明还包括具有野生型鞭毛蛋白全长序列以及其氨基酸序列变体的蛋白质。在本发明中,变体是指由于野生型鞭毛蛋白或其片段的一些氨基酸残基的缺失、插入、非保守性或保守性替换、氨基酸类似物替换或其组合而具有不同序列的蛋白质。不完全改变分子活性(即激活tlr5通路的能力)的氨基酸交换是本领域已知的(h.neurath,r.l.hill,the proteins,academic press,new york,1979)。
[0063]
在一些情况下,本发明的变体可以是通过磷酸化、硫酸化、丙烯酸化、糖基化、甲基化、法呢基化等修饰的全长鞭毛蛋白或其片段。
[0064]
在某些实施方式中,全长鞭毛蛋白或其片段的变体能够通过至少约50%、75%、80%、85%、90%或95%的全长鞭毛蛋白或其片段激活tlr5通路,或者以与全长鞭毛蛋白或其片段相同或基本相同的程度激活tlr5通路,或者与全长鞭毛蛋白或其片段相比更高地激活tlr5通路。
[0065]
在本发明中,鞭毛蛋白、其片段或其变体可以呈包含另一多肽的融合蛋白的形式。例如,鞭毛蛋白可以是包含一种或多种抗原的融合蛋白。抗原的非限制性实例包括肺炎链球菌(s.pneumoniae)pspa1抗原、肺炎链球菌pspa2抗原、肺炎链球菌pspa3抗原、肺炎链球菌pspa4抗原、肺炎链球菌pspa5抗原和/或肺炎链球菌pspa6抗原。替代地,例如,鞭毛蛋白可以呈结合一种或多种免疫调节物质的融合蛋白的形式。可以没有限制地包括免疫调节物质,只要其是本领域已知的增加免疫应答的免疫调节物质,并且其非限制性实例包括干扰素-α、干扰素-β、干扰素-γ、干扰素-ω、干扰素-τ、白介素-1α、白介素-1β、白介素-2、白介素-3、白介素-4、白介素-5,白介素-6、白介素-7、白介素-8、白介素-9、白介素-10、白介素-11、白介素-12、白介素-13、白介素-14、白介素-18、b细胞生长因子、cd40配体、tnf-α、tnf-β、ccl25、ccl28或其活性片段。
[0066]
如本文所用,术语“百分比(%)序列同源性”被定义为在比对序列并引入间隙之后,候选序列中与参考多肽中的氨基酸残基相同的氨基酸残基的百分比,不考虑任何保守性替换作为序列同一性的一部分以在如有必要时实现最大百分比序列同一性。可以例如使用公开可用的计算机软件程序和本领域技术范围内的各种方法,并且使用blast、blast-2、align或megalign(dnastar)软件来实现用于确定百分比氨基酸同源性的目的的比对。本领域技术人员可以确定用于比对测量的适当参数,包括在被比较的序列的整个长度上实现最大比对所需的任何算法。出于本文的目的,给定氨基酸序列b或给定氨基酸序列a与该给定氨基酸序列b的百分比(%)氨基酸序列同源性如下计算出来:100乘以分数x/y,其中x是在a和b的程序比对中通过序列比对程序所匹配相同的氨基酸残基得分的数目,并且y是b中氨基酸残基的总数目。将理解的是,如果氨基酸序列a的长度不等于氨基酸序列b的长度,则a与b的百分比(%)氨基酸序列同源性将不等于b与a的百分比(%)氨基酸序列同一性。
[0067]
在某些实施方式中,鞭毛蛋白、其片段或其变体可以由选自seq id no:1-5的氨基酸序列或者与其具有至少80%序列同源性的氨基酸序列组成。
[0068]
如本文所用,术语“fc区”是指免疫球蛋白链恒定区的c端部分,并且具体是指免疫球蛋白重链恒定区或其部分。
[0069]
本发明的免疫球蛋白fc区包括天然氨基酸序列以及其突变体。氨基酸序列突变体意味着天然氨基酸序列中的一个或多个氨基酸残基通过缺失、插入、非保守性或保守性取
代或其组合而具有不同的序列。例如,在igg fc的情况下,已知对结合重要的氨基酸残基214-238、297-299、318-322或327-331可以用作合适的修饰位点。另外,各种类型的突变体都是可能的,如其中能够形成二硫键的位点被去除、天然fc的n端处的一些氨基酸被去除、或者可以向天然fc的n端中添加甲硫氨酸残基的那些突变体。另外,为了消除效应子功能,可以去除补体结合位点(例如c1q结合位点),或者可以去除adcc位点。用于制备此种免疫球蛋白fc区序列突变体的技术公开在国际专利公布号97/34631和国际专利公布号96/32478等中。
[0070]
蛋白质和肽中不完全改变分子活性的氨基酸交换是本领域已知的。最常见发生的交换是氨基酸残基ala/ser、val/ile、asp/glu、thr/ser;ala/gly、ala/thr、ser/asn、ala(val)、ser/gly(thr/phe)、ala/pro、lys/arg(asp/asn)、leu/iles、leu/val(ala/glu)、asp/gly之间的交换。
[0071]
在一些情况下,它可以通过磷酸化、硫酸化、丙烯酸化、糖基化、甲基化、法呢基化、乙酰化、酰胺化等进行修饰。
[0072]
上述fc突变体是表现出与本发明的fc区相同的生物学活性但其fc区对热、ph等的结构稳定性增加的突变体。
[0073]
此外,此种fc区域可以获得自动物(如人和牛、山羊、猪、小鼠、兔、仓鼠、大鼠、豚鼠等)体内分离出来的天然形式,或者可以是获得自转化的动物细胞或微生物的重组形式或其突变体。此处,获得自天然形式的方法可以通过将完整的免疫球蛋白从人或动物的身体中分离出来然后用蛋白酶进行处理来获得。当用木瓜蛋白酶处理时,它裂解成fab和fc,当用胃蛋白酶处理时,它裂解成pf'c和f(ab)2。在这种情况下,可以使用尺寸排阻色谱法等来分离fc或pf'c。
[0074]
此外,免疫球蛋白fc区可以是天然糖链、与天然形式相比糖链增加、与天然形式相比糖链减少或糖链已被去除的形式。常规方法,如化学方法、酶法和使用微生物的基因工程方法,可以用于增加或消除免疫球蛋白fc糖链。此处,fc糖链已被去除的免疫球蛋白fc区显著降低补体(c1q)的结合能力,降低或消除抗体依赖性细胞毒性或补体依赖性细胞毒性,并且因此不会在体内诱导不必要的免疫应答。在这方面,更适合于药物载体的原始目的的形式将被称为免疫球蛋白fc区,其中糖链被去除或是非糖基化的。
[0075]
在本发明中,术语“去糖基化”是指已通过酶去除糖的fc区,而“无糖基化(aglycosylation)”意指在原核动物(优选大肠杆菌)中产生的且未被糖基化的fc区。
[0076]
另外,免疫球蛋白fc区可以是衍生自igg、iga、igd、ige、igm或其组合或其杂合的fc区。它可以优选地来自人血液中含量最丰富的igg或igm,并且最优选地来自已知提高配体结合蛋白的半衰期的igg。
[0077]
另一方面,在本发明中,“组合”意味着在形成二聚体或多聚体时,编码相同来源的单链免疫球蛋白fc区的多肽与不同来源的单链多肽形成键。也就是说,有可能从两个或更多个选自igg fc、iga fc、igm fc、igd fc和ige的fc片段的片段来制备二聚体或多聚体。
[0078]
本发明中的术语“杂合”意味着在单个免疫球蛋白fc区中存在对应于至少两个不同来源的免疫球蛋白fc片段的序列。对于本发明,若干种类型的杂合是可能的。也就是说,来自igg fc、igm fc、iga fc、ige fc和igd fc的ch1、ch2、ch3和ch4中的一至四个结构域的结构域的杂合是可能的,并且可以包含铰链。
[0079]
另一方面,igg还可以被分为亚类igg1、igg2、igg3和igg4,并且在本发明中,其组合或其杂交也是可能的。它可以优选地衍生自人免疫球蛋白igg1的fc。
[0080]
在另一实施方式中,免疫球蛋白fc区可以包含选自免疫球蛋白重链恒定区的ch1、ch2、ch3和ch4结构域的一种或多种。例如,可以用于制备本发明的融合蛋白的免疫球蛋白fc区可以包含:(a)ch1结构域、ch2结构域、ch3结构域和ch4结构域;(b)ch1、ch2和ch3结构域;(c)ch1结构域、ch2结构域和ch4结构域,(d)ch1结构域、ch3结构域和ch4结构域;(e)ch2结构域、ch3结构域和ch4结构域:(f)ch1结构域和ch4结构域);(g)ch1结构域和ch3结构域;(h)ch1结构域和ch2结构域;(i)ch2结构域和ch4结构域;(j)ch2结构域和ch3结构域;(k)ch3结构域和ch4结构域;或者两个或更多个结构域和免疫球蛋白铰链区的组合。最优选地,免疫球蛋白fc区可以由重链恒定区的ch2和ch3结构域组成。
[0081]
除人免疫球蛋白fc区之外,本发明还可以使用其他免疫球蛋白fc区或其片段序列,包括由公开在genbank和/或embl数据库中的核苷酸序列编码的氨基酸序列,如例如af045536.1(食蟹猴(macaca fascicularis))、af045537.1(恒河猴(macca mulatta))、ab016710(家猫(felix catus))、k00752(穴兔(oryctolagus cuniculus))、u03780(sus scra)、z48947(单峰骆驼(camelus fromedarius))、x62916(牛(bos taurus))、l07789(北美水貂(mustela vision))、x6997(绵羊(ovis aries))、u17166(灰仓鼠(cricetulus migratorius))、x07189(鼠(rattus ratus))、af57619.1(帚尾袋貂(trichosurus vulpecula))或af035195(灰短尾负鼠(monodelphis domestica))等。
[0082]
在本发明中,融合蛋白可以是其中鞭毛蛋白、其片段或其变体的n端或c端与免疫球蛋白fc区的n端或c端结合的融合蛋白。具体地,鞭毛蛋白、其片段或其变体的n端可以与免疫球蛋白fc区的c端结合,或者鞭毛蛋白、其片段或其变体的c端与免疫球蛋白fc区的n端结合。优选地,鞭毛蛋白、其片段或其变体的c端可以与免疫球蛋白fc区的n端结合。
[0083]
在特定实施方式中,本发明的免疫球蛋白fc区可以由seq id no:6或7的氨基酸序列或者表现出与其至少80%序列同源性的氨基酸序列组成。
[0084]
同时,在本发明中,构成融合蛋白的每个组分(即鞭毛蛋白、其片段或其变体以及免疫球蛋白fc区)可以直接彼此连接或通过接头连接。一般而言,术语“接头”是指可以插入在一个或多个分子之间的核酸、氨基酸或非肽残基,例如,至少一个组分结构域。例如,接头可以用于在组件之间提供感兴趣的期望位点,以促进操作。还可以提供接头以增强来自转化体的融合蛋白的表达,并且减少空间位阻,使得组分可以采用其最佳三级结构和/或与目标分子适当地相互作用。接头序列可以包含一个或多个与受体组分自然连接的氨基酸,或者可以是用于增强融合蛋白表达的添加序列,以提供特定感兴趣的期望位点、以允许组分结构域形成最佳三级结构、和/或以增强组分与其目标分子的相互作用。
[0085]
优选地,接头可以在不干扰融合蛋白中每个组分的结构的情况下增加融合蛋白的柔韧性。在一些实施方式中,接头残基是长度为2-100个氨基酸的肽接头。实例性接头包括具有至少两个氨基酸残基的线性肽,如gly-gly、gly-ala-gly;gly-pro-ala;gly(g)n;以及gly-ser(gs)接头。本文描述的gs接头包括但不限于(gs)n、(gsgsg)n、(g2s)n、g2s2g、(g2sg)n、(g3s)n、(g4s)n、(ggsgg)ngn、gsg4sg4sg和(ggggs)n,其中n为1或更大。(g)n接头的一个实例包括g9接头,并且(gggs)n接头的实例包括gggs或(ggggs)3接头。合适的线性肽包括聚甘氨酸、聚丝氨酸、聚脯氨酸、聚丙氨酸和由丙氨酰和/或丝氨酰和/或脯氨酰和/至
少甘氨酰氨基酸残基组成的寡肽。接头残基可以用于连接本文公开的融合蛋白的组分。
[0086]
在本发明中,接头可以由seq id no:8或9的氨基酸序列组成。
[0087]
本文描述的融合蛋白可以或可以不包含信号肽,该信号肽的功能是从宿主细胞分泌融合蛋白。编码信号肽的核酸序列可以与编码感兴趣的蛋白质的核酸序列可操作地连接。在一些实施方式中,融合蛋白包含信号肽。在一些实施方式中,融合蛋白不包含信号肽。
[0088]
本文描述的融合蛋白还可以包含蛋白质结合肽的修饰形式。例如,融合蛋白组分可以具有翻译后修饰,包括例如对任何蛋白质结合肽的糖基化、唾液酸苷化、乙酰化和磷酸化。
[0089]
除非另有声明,否则本发明的融合蛋白以多肽(或编码多肽的核酸)的形式施用,这些多肽本身不是活的、灭活的或重组的细菌性或病毒性载体化疫苗的一部分。进一步地,除非另有说明,否则本发明的融合蛋白是分离的融合蛋白,例如,未并入到鞭毛中。
[0090]
本发明背景下的“融合”是指具有不同或相同功能或结构的两个分子的整合,其可以是通过任何物理、化学或生物方法所进行的融合,肽可以使用这些方法进行结合。融合蛋白或构成融合蛋白的多肽可以通过本领域已知的化学肽合成方法产生,或者编码融合蛋白的基因可以通过pcr(聚合酶链反应)扩增或通过已知方法合成,然后克隆到表达载体中并表达。
[0091]
在本发明的某些实施方式中,融合蛋白可以由选自seq id no:10-16的氨基酸序列组成。
[0092]
本发明还提供包含编码融合蛋白的核苷酸序列的多核苷酸。
[0093]
多核苷酸不特别局限于构成多核苷酸的碱基的组合,只要它能够编码本发明的多肽。多核苷酸可以被提供为呈单链或双链形式的核酸分子,包括dna、cdna和rna序列。
[0094]
优选地,本发明的多核苷酸可以具有选自seq id no:17-23的核苷酸序列。
[0095]
本发明还提供包含多核苷酸的载体。
[0096]
本发明的载体包括但不限于质粒载体、粘粒载体、噬菌体载体、病毒载体等。本发明的载体可以是常规克隆载体或表达载体,并且该表达载体除包含表达控制序列(如启动子、算子、起始密码子、终止密码子、聚腺苷酸化信号和增强子(启动子))之外还可以包含用于膜靶向或分泌的信号序列或前导序列,并可以根据目的不同地进行制备。根据本发明的多核苷酸序列可以与表达控制序列可操作地连接,并且可操作地连接的基因序列和该表达控制序列可以包含在一个含有选择标记和复制起点的表达载体中。“可操作地连接”是指合适的分子以使基因表达能够进行的方式与表达控制序列的连接,其中一个核酸片段与另一核酸片段连接,使得其功能或表达受到该另一核酸片段的影响。“表达控制序列”是指调节特定宿主细胞中所可操作地连接的多核苷酸序列的表达的dna序列。此类调节序列包括影响转录的启动子、控制转录的任何算子序列、编码合适的mrna核糖体结合位点的序列、以及控制转录和翻译的终止的序列。载体还包括用于选择含有该载体的宿主细胞的选择标记,并且如果该载体是可复制的载体,则包括复制起点。
[0097]
本发明还提供用该载体转化的转化体。
[0098]
用载体转化可以通过本领域技术人员已知的转化技术来进行。优选地,可以使用微粒轰击、电穿孔、磷酸钙(capo4)沉淀、氯化钙(cacl2)沉淀、peg介导的融合、显微注射以及脂质体介导的方法。
[0099]
术语“转化体”可以与“宿主细胞”可互换地使用,并且是指包含通过任何手段(例如,电穿孔、磷酸酶钙沉淀、显微注射、转化、病毒性感染等)引入到细胞中的异源dna的原核或真核细胞。
[0100]
在本发明中,转化体可以用作克隆领域中所常用的各种单细胞生物的宿主细胞,例如,原核细胞(如各种细菌(例如梭菌属、大肠杆菌(e.coli)等))、低等真核细胞(如酵母)以及衍生自高等真核生物(包括昆虫细胞、植物细胞、哺乳动物等)的细胞,但不限于此。由于蛋白质的表达水平和修饰根据宿主细胞而表现得不同,因此本领域技术人员可以选择并使用最合适的宿主细胞以用于预期目的。
[0101]
本发明还提供包含融合蛋白作为活性成分的药物组合物。
[0102]
根据本发明的一个实施方式,已经发现与野生型鞭毛蛋白相比,融合蛋白表现出显著提高的tlr5通路激活能力。因此,本发明的融合蛋白可以对已知可通过激活tlr5通路预防、改善或治疗的疾病、综合征等表现出预防性、改善性或治疗性效果。
[0103]
已知可通过激活tlr5通路预防、改善或治疗的疾病、综合征可能是由辐射暴露引起的损害:再灌注损伤;炎性肠病;自身免疫性疾病;病毒性感染;衰老;免疫功能下降;或癌症。
[0104]
因此,本发明的药物组合物可以被表征为用于以下各项的药物组合物:预防或治疗由辐射暴露导致的损害;预防或治疗再灌注损伤;预防或治疗炎性肠病;预防或治疗自身免疫性疾病;预防或治疗病毒性感染;预防或治疗衰老;增强免疫功能;或治疗癌症。
[0105]
具体地,本发明的融合蛋白可以被理解为对未来将发现能够通过tlr5通路激活预防、改善或治疗的疾病施加预防性、改善性或治疗性效果,并且因此要被本发明的药物组合物治疗的疾病在范围上没有特别限制。
[0106]
tlr5通路的激活与辐射暴露损害的治疗的关联可以参考kr20067010934a等,tlr5通路的激活与再灌注所致组织损害的治疗的关联可以参考us8324163等,激活tlr5通路与治疗炎性肠病的关联可以参考us7361733等,激活tlr 5通路与用于自身免疫性疾病的疗法的关联可以参考ep03010523b1等,激活tlr 5通路与病毒性感染的疗法的关联可以参考us9872895等,tlr5通路的激活与由衰老导致的疾病之间的关系可以参考kr20150049811a等,tlr5通路的激活与免疫力的增强之间的关系可以参考wo17031280a1等,tlr5通路的激活与癌症治疗之间的关系可以参考kr20177005615a等。
[0107]
在本发明中,由辐射暴露引起的损害可能是由于辐射暴露而导致的胃肠综合征或造血综合征。
[0108]
在本发明中,由衰老导致的疾病可能是衰老所致脱发、白内障、脱发、结肠炎、骨质疏松症或骨软化。
[0109]
在本发明中,癌症可能是乳腺癌、肺癌、结肠癌、肾癌、肝癌、卵巢癌、前列腺癌、睾丸癌、泌尿生殖道癌、淋巴系统癌、直肠癌、胰腺癌、食道癌、胃癌、宫颈癌、甲状腺癌、皮肤癌、白血病、急性淋巴细胞白血病、急性成淋巴细胞性白血病、b细胞淋巴瘤、t细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、毛细胞淋巴瘤、组织细胞淋巴瘤和伯基特淋巴瘤、急性和慢性髓细胞性白血病、骨髓增生异常综合征、骨髓性白血病、早幼粒细胞性白血病、星形细胞瘤、成神经细胞瘤、胶质瘤、神经鞘瘤、纤维肉瘤、横纹肌肉瘤、骨肉瘤、着色性干皮病、角化棘皮瘤(keratoctanthoma)、精原细胞瘤、甲状腺滤泡状癌、畸胎瘤或胃肠道癌症。
[0110]
根据施用途径,以本领域已知的方式,除融合蛋白之外,本发明的药物组合物还可以与药物上可接受的载体一起配制。“药物上可接受的”是指生理上可接受的无毒材料,其不会干扰活性成分的作用,并且在施用于人时通常不会产生过敏性或类似反应,如肠胃病症、晕眩。此类载体包括各种溶剂、分散介质、水包油或水油乳状液、水性组合物、脂质体、微珠和微粒体。
[0111]
施用途径可以是口服施用或胃肠外施用。胃肠外施用方法包括但不限于静脉内、肌内、动脉内、髓内、鞘内、心内、透皮、皮下、腹膜内、鼻内、肠内、局部、舌下或直肠施用。
[0112]
在口服施用本发明的药物组合物的情况下,可以根据本领域已知的方法,将其与合适的口服载体一起配制成粉剂、颗粒剂、片剂、丸剂、糖衣丸、胶囊剂、液体、凝胶剂、糖浆剂、悬浮体、薄片剂(wafer)等形式。合适载体的实例可以包括:糖类,其包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇和麦芽糖醇等;以及淀粉类,其包括玉米淀粉、小麦淀粉、大米淀粉和马铃薯淀粉等;纤维素类,其包括纤维素、甲基纤维素、羧甲基纤维素钠和羟丙基甲基纤维素等;以及填料,如明胶、聚乙烯吡咯烷酮。而且,如果需要,可以添加交联聚乙烯吡咯烷酮、琼脂、海藻酸或海藻酸钠等作为崩解剂。此外,药物组合物可以进一步包含抗凝聚剂、润滑剂、润湿剂、调味剂、乳化剂、防腐剂等。
[0113]
另外,对于胃肠外施用,本发明的药物组合物可以根据本领域已知的方法,与合适的胃肠外载体一起配制成注射剂、透皮施用和鼻用吸入剂的形式。在注射剂的情况下,必须对其进行消毒并保护其免受细菌和真菌等微生物的污染。用于注射的合适载体的实例可以是溶剂或分散介质,包括但不限于水、乙醇、多元醇(如丙三醇、丙二醇和液体聚乙二醇等)、其混合物和/或植物油。更优选地,可以使用hanks溶液、林格氏液、磷酸盐缓冲盐水(pbs)或等渗溶液(如无菌注射用水、10%乙醇、40%丙二醇和5%右旋糖等)作为合适的载体。为了保护注射剂免受微生物污染,可以进一步包括各种抗菌剂和抗真菌剂,如对尼泊金(paraben)、氯丁醇、苯酚、山梨酸、硫柳汞等。另外,在大多数情况下,注射剂可以进一步包含等渗剂,如糖类或氯化钠。
[0114]
在透皮施用的情况下,包括如软膏剂、乳膏剂、洗剂、凝胶剂、外用溶液剂、面食制剂、搽剂、气雾剂等形式。在上述中,“透皮施用”意味着将药物组合物局部施用于皮肤,使得将有效量的包含在药物组合物中的活性成分递送到皮肤中。例如,本发明的药物组合物可以通过将其制备成可注射配制剂并且用30号细注射针刺破皮肤或直接应用于皮肤的方法来施用。这些配制剂描述在药物化学中普遍已知的配制剂中。
[0115]
在吸入施用的情况下,借助于合适的推进剂,例如二氯氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体,可以方便地从加压包装或雾化器中以气雾剂喷剂的形式递送根据本发明使用的化合物。在加压气雾剂的情况下,剂量单位可以通过提供阀以递送经计量的量来确定。例如,用于吸入器或吹入器的明胶胶囊和药筒可以被配制成含有化合物与合适粉末基质(如乳糖或淀粉)的粉末混合物。
[0116]
至于其他药物上可接受的载体,可以参考本领域已知的那些载体。
[0117]
另外,根据本发明的药物组合物可以进一步包含一种或多种缓冲液(如盐水或pbs)、碳水化合物(如葡萄糖、甘露糖、蔗糖或葡聚糖)、抗氧化剂、抑菌剂、螯合剂(如edta或谷胱甘肽)、佐剂(如氢氧化铝)、悬浮剂、增稠剂和/或防腐剂。
[0118]
本发明的药物组合物还可以使用本领域已知的方法来配制,以在施用于哺乳动物
后提供活性成分的快速、持续或延迟释放。
[0119]
另外,本发明的药物组合物可以与已知具有预防或治疗以上所列每种疾病效果的物质组合施用。
[0120]
本发明还提供包含融合蛋白作为活性成分的疫苗佐剂。
[0121]
疫苗佐剂最重要的要求之一是具有免疫调节功能,如调节抗原呈递细胞表面上的共刺激分子表达和调节由于抗原特异性t细胞的诱导而导致的细胞因子分泌。
[0122]
顺便提一下,prr(如tlr5)分布在宿主细胞的细胞表面或细胞质中,并且通过刺激各种pamp诱导“先天性免疫应答”,并且进一步调节“适应性免疫应答”。因此,tlr5激动剂可能是开发各种“免疫调节剂”(尤其是“疫苗佐剂”)的合适目标。
[0123]
因此,具有激活tlr5通路能力的本发明的融合蛋白可以激活tlr5通路以增强先天性免疫应答和获得性免疫应答,从而可以显著提高宿主对共同施用抗原的免疫力。
[0124]
本发明的疫苗佐剂可以通过本领域众所周知的常规方法来制备,并且可以任选地进一步包含本领域中可以用于制备疫苗的各种添加剂。
[0125]
本发明还提供融合蛋白用于制备药剂的用途,该药剂用于治疗由辐射暴露引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症。
[0126]
另外,本发明提供一种方法,该方法用于治疗因暴露于辐射而引起的损伤;治疗再灌注损伤;治疗炎性肠病;治疗自身免疫性疾病;治疗病毒性感染;治疗代谢性疾病;治疗衰老;增强免疫功能;或治疗癌症,该方法包含将有效量的包含融合蛋白作为活性成分的组合物施用于有此需要的对象。
[0127]
本发明的“有效量”是指当施用于对象时,表现出改善、治疗、预防、检测、诊断、或抑制或减少以下各项的效果的量:由辐射暴露导致的损害;再灌注损伤;炎性肠病;自身免疫性疾病;病毒性感染;代谢性疾病;衰老;增强免疫功能;或癌症。“对象”可以是动物、优选哺乳动物、尤其是包括人的动物,以及动物衍生的细胞、组织、器官等。对象可以是需要该效果的患者。
[0128]
本发明的“治疗”泛指改善由辐射暴露引起的损伤;再灌注损伤;炎性肠病;自身免疫性疾病;病毒性感染;代谢性疾病;衰老;免疫功能增强;或癌症,或疾病的症状,这可以包括但不限于治愈、基本上预防或改善疾病的病况,并且包括改善、治愈或预防因疾病而导致的一种或大多数症状。
[0129]
如本文所用,术语“包含”以与“包括”或“特征在于”相同的含义使用,并且在根据本发明的组合物或方法中,不排除未具体提及的方法的额外组分或步骤。此外,术语“由
……
组成”意指不包括未单独描述的额外元件、步骤或成分。术语“基本上由
……
组成”意味着,在组合物或方法的范围内,除了所描述的物质或步骤之外,它还可以包括基本上不影响其基本特性的物质或步骤。
[0130]
有利效果
[0131]
与野生型鞭毛蛋白、其片段或其变体相比,本发明提供的融合蛋白具有显著优越的toll样受体5(tlr5)通路激活能力,并且其可以非常有效地用于开发用于可以通过激活tlr5通路来预防、改善或治疗的疾病的治疗剂和/或疫苗佐剂。
附图说明
[0132]
图1是简单地示出本发明中所提供的各种微生物衍生鞭毛蛋白与人igg4 fc(higg4)的fc融合鞭毛蛋白的制备的示意图。
[0133]
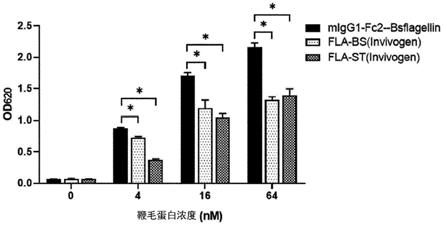
图2是以下各项的结果:通过培养用酶切割的每个菌株的菌落来确认克隆、以及检查每个菌株的鞭毛蛋白和载体的大小以确认所制备的微生物衍生fc-higg4-flagellin(bs,bsflagellin;ec,ecflagellin;pa,paflagellin;sd,sdflagellin;sh,shflagellin)的融合。
[0134]
图3是示出每个fc-higg4-flagellin融合蛋白形成二聚体的结果。
[0135]
图4是示出衍生自每种微生物的fc-higg4-flagellin融合蛋白的tlr5依赖性nf-κb活性的比较的结果。
[0136]
图5是被制备成用于bsflagellin动物实验的诱导最高tlr5活性的fc-migg1-bsflagellin的产生的示意图。使用两个不同长度的接头来构建融合蛋白。
[0137]
图6是确认使用两个不同长度的接头制备的fc-migg1-bsflagellin的克隆的结果。
[0138]
图7是通过蛋白质印迹法确认本发明融合蛋白的表达的结果(#1:fc-migg1-linker-bsflagellin,#2:fc-migg1-linker
*
3-bsflagellin)。
[0139]
图8是通过蛋白质印迹法确认本发明的融合蛋白是否形成二聚体的结果。
[0140]
图9是评价枯草芽孢杆菌的fc融合bs鞭毛蛋白(migg1-fc2-bsflagellin)和纯化鞭毛蛋白(fla-bs)以及鼠伤寒沙门氏菌的纯化鞭毛蛋白的(fla-st)nf-κb激活能力的结果。
实施例
[0141]
在下文中,将详细地描述本发明。
[0142]
然而,以下实施例仅用于说明本发明,并且本发明的内容不限于以下实施例。
[0143]
实施例1:fc-flagellin融合蛋白的制备(克隆)
[0144]
(1)实验方法
[0145]
试图产生fc-flagellin融合蛋白,其中衍生自各种微生物的鞭毛蛋白与抗体的fc区融合(图1)。
[0146]
如图1,根据以下方法进行克隆,以便构建各自表达以下形式的质粒:衍生自枯草芽孢杆菌(bs)、都柏林沙门氏菌(sd)、铜绿假单胞菌(pa)、弗氏志贺氏菌(sf)和大肠杆菌(ec)的鞭毛蛋白与人igg4-fc(higg4)结合。
[0147]
1)根据下表1中所示的条件,使用ecorv和ncoi限制性酶位点引物(表2),针对所有鞭毛蛋白进行pcr:
[0148]
表1
[0149][0150][0151]
表2
[0152][0153]
2)在向pcr产物中添加4.4ul的10x dna染料之后,进行凝胶电泳,检查大小,并且使用megaquick-spintm plus(目录号17290)提取鞭毛蛋白条带。
[0154]
3)根据下表3中的条件,将纯化的dna用ecorv和ncoi消化:
[0155]
表3
[0156][0157]
[0158]
4)向载体切割样品中添加1ul的caff碱性磷酸酶,并且在37℃下反应2小时。
[0159]
5)通过添加4.4ul的10x dna染料进行凝胶电泳之后,使用megaquick-spintm plus(目录号17290)提取每个条带。
[0160]
6)分子比率载体:插入=1:3,并且根据下表4中的条件进行连接。
[0161]
表4
[0162][0163]
7)在zeocin(+)lb板中进行转化,并且培养18小时。
[0164]
8)进行小型制备(mini prep),并且使用ecorv和ncoi进行酶消化。
[0165]
(2)实验结果
[0166]
首先,通过分别选取三个菌落进行凝胶电泳,其结果如图2所示,所有五种类型的bsflagellin、ecflagellin、paflagellin、sfflagellin和sfflagellin均被确认成具有相同的载体大小,并且通过测序确认序列100%相同,无突变。
[0167]
实施例2:fc-higg4-flagellin融合蛋白的制备(分离和纯化)
[0168]
(1)实验方法
[0169]-将5ml的蛋白a树脂[repligen,#10-2500-01]用20ml的结合缓冲液(ph 5.0;含有0.02%叠氮化钠)[thermo fisher scientific,21019]总共洗涤三次。
[0170]
1)每次洗涤后让树脂自然沉降5分钟,然后去除上清液。
[0171]-将经洗涤的树脂缓慢地倒入一次性柱[thermo fisher scientific,29920]中。通过将结合缓冲液倒入所制备的柱中,使柱和树脂处于相同状态。
[0172]-然后将室温下制备的细胞培养物缓慢地倒入柱中。然后使溶液缓慢地从柱流出。一旦去除了所有细胞培养物,就用结合缓冲液洗涤柱。
[0173]-在洗脱前将中和溶液(1m tris,ph 9.2)预先浸泡在微量离心管中之后,将柱放入到所制备的微量离心管中,并且将洗脱缓冲液(ph 2.8;基于胺)[thermo fisher scientific,21004]与树脂进行充分混合。等到所有的树脂都下沉之后,使溶液缓慢地流动。
[0174]-使用旋转脱盐柱[thermo fisher scientific,89891]来将分离的蛋白质的缓冲溶液更换为磷酸盐缓冲盐水(pbs)。
[0175]
1)在柱中平衡5ml pbs共5次,然后将提取的蛋白质溶液缓慢地倒入柱中,并且运
行一部分初始溶液。再次向柱中添加pbs溶液,并且向新管中缓慢地添加溶液。
[0176]-使用内毒素去除旋转柱[thermo fisher scientific,88273]将存在于蛋白质溶液中的内毒素去除。
[0177]
1)将旋转柱放置在管中,并且以500g的速度离心1分钟以排出其中所含的溶液,随后添加2m氯化钠(nacl)并缓慢地摇动柱,直至树脂悬浮在溶液中。将柱放置在管中,并且以500g的速度离心1分钟以排出其中所含的溶液。
[0178]
2)向树脂中添加不含内毒素的纯水,轻轻地摇动柱直至溶液悬浮,然后将柱放置在管中,并且以500g的速度离心1分钟以排出其中所含的溶液。
[0179]
3)此后,添加不含内毒素的缓冲液(25mm磷酸钠,ph 7.0),并且轻轻地摇动柱直至树脂悬浮在溶液中。将柱放置到管中,并且以500g的速度离心1分钟以排出其中所含的溶液。重复此过程两次。
[0180]
4)缓慢地倒入提取的蛋白质溶液,并且轻轻地摇动柱,直至树脂悬浮在溶液中,随后在4℃下孵育1小时,期间树脂徐缓地下降。
[0181]
5)将柱放置在管中,并且以500g的速度离心1分钟以获得该管中所含的溶液。
[0182]-使用lal显色内毒素定量试剂盒[thermo fisher scientific,88282]测量纯化蛋白质溶液的内毒素程度。
[0183]
1)为了在37℃下在96孔板中测量标准曲线,向孔中添加不含内毒素纯水(0eu/ml)和标准蛋白质溶液(0.1、0.25、0.5、1eu/ml)各50μl。
[0184]
2)向每样品两个孔中添加50μl的纯化蛋白质溶液。
[0185]
3)向每孔中添加50μl的鲎变形细胞溶解物(lal)试剂,然后轻轻地摇动板并混合,并且在37℃下孵育10分钟。10分钟后,向每孔中添加100μl的显色底物试剂,并且轻轻地摇动板以混合,并且在37℃下孵育6分钟。6分钟后,向每孔中添加100μl的停止试剂(25%乙酸),并且将板在室温下轻轻地混合。
[0186]
4)直接在波长为410nm的微型多读出器机器上测量光密度(od)值。
[0187]
5)用在标准蛋白质溶液中获得的od值绘制标准曲线之后,确定呈指数形式的拟合函数,然后将从纯化蛋白质溶液获得的od值拟合成拟合函数,以确定内毒素浓度。
[0188]-使用bca蛋白质测定试剂盒[thermo fisher scientific,23227]测量最终收获的纯化蛋白质溶液的浓度。
[0189]
1)对于96孔板,将纯化蛋白质溶液、pbs(0ug/ml)和标准蛋白质溶液在pbs中依次稀释,以制备标准蛋白质溶液(25、125、250、500、750、1000、1500和2000ug/ml),各自浓度为每孔10μl。
[0190]
2)将封装在试剂盒中的溶液a和溶液b以50:1的比率混合,向每孔中各添加200μl,并且将混合物在37℃孵育器中避光孵育30分钟。
[0191]
3)30分钟后,立即在波长为562nm的微型多读出器中测量od值。
[0192]
4)用在标准蛋白质溶液中获得的od值绘制标准曲线之后,确定呈指数形式的拟合函数,然后将在纯化蛋白质溶液中得到的od值代入到拟合函数中,从而确定蛋白质浓度。
[0193]
(2)实验结果
[0194]
根据上述实验方法分离和纯化后的每种蛋白质的浓度示出在表5中。
[0195]
表5
[0196][0197]
实施例3:融合蛋白二聚化的确认
[0198]
试图确定蛋白质表达已确认的各种菌株的fc-flagellin融合蛋白是否形成二聚体。
[0199]
(1)实验方法
[0200]-所使用的细胞系:hek293t
[0201]-在转染当天,将24孔板接种至细胞融合度为70%。
[0202]-在实验当天,将jettime转染试剂以每孔1ul的量与500ng每种dna(ev、#1、#2、tdtmt)混合,随后根据方案进行转染(对于转染,使用10%fbs dmem。转染体积为500ul)。
[0203]-转染后24小时,将其转到0.5%fbs培养基。
[0204]-48小时后收获400ul培养基。
[0205]-将培养基以12,300g离心1分钟以去除碎片,并且将上清液用作样品。
[0206]-每份样品除以200ul,添加两种5
×
样品缓冲液50ul。
[0207]
1)还原性5
×
样品缓冲液:一种常用的laemmli样品缓冲液组合物
[0208]
2)非还原性5
×
样品缓冲液:laemmli样品缓冲液组合物中未添加β-巯基乙醇。
[0209]-在99℃加热块中加热还原性样品5分钟。
[0210]-非还原性样品省略加热过程
[0211]-通过sds-page,按蛋白质大小分离。
[0212]-通过commasie染色检查大小。
[0213]
(2)实验结果
[0214]
结果示出在图3中。在非还原条件下,对于每个fc-鞭毛蛋白融合蛋白,观察到二聚体形成信号大小对应于还原条件下出现的信号大小的大约两倍。这确认了fc-鞭毛蛋白融合蛋白形成二聚体。
[0215]
实施例4:fc-flagellin融合蛋白的tlr5通路激活能力的评价
[0216]
为了确认所制备的fc-flagellin融合蛋白是否表现出作为tlr5激动剂的活性,对细胞内nf-κb活性进行了评价。至于细胞,使用hek-blue htlr5(invivogen,目录号hkb-htrl5),其是被构建成用于选择诱导对hek293t的tlr5活性的制剂的细胞系模型,并且通过过度表达htl r5和pnf-κb制备的fc-flagellin的tlr5活性可以被确认。
[0217]
(1)实验方法
[0218]
将hek-blu htlr5细胞保持在含有zeocin(100μg/ml)(invivogne,目录号ant-zn-1)、杀稻瘟素(blasticidin)(15μg或ml)(invivogen,目录号at-bl-1)和新霉素(normocin)(100μg/ml)(invivogen,目录号anti-nr-1)的培养基中。
[0219]-用于测量nf-kb活性的方法如下:
[0220]
①
将培养的hek-blue htlr5细胞分离,离心,将上清液去除,并且将细胞团块与1
×
pbs混合均匀。
[0221]
②
接种细胞前,预先向96孔板中添加预先制备的浓度分别为4nm、16nm和64nm的蛋白质样品(20ul)。
[0222]
③
在三板(tri-plates)条件下进行实验。
[0223]
④
对照组为添加有1
×
pbs(20ul)的组。
[0224]
⑤
将计算出的hek-blue htlr5细胞与hek-blue检测培养基(invivogen,目录号hb-det2)混合均匀,并且以大约2.5
×
104/96孔接种在96孔板中,细胞数目相等,体积为180ul。
[0225]
⑥
将添加有蛋白质的细胞在37℃孵育器中反应约16小时。
[0226]
⑦
约16小时后,通过在微型多读出器中测量620nm波长处的光密度(od)值来比较和计算nf-kb活性。
[0227]
(2)实验结果
[0228]
结果示出在图4中。
[0229]
如图4所示,发现每种fc-higg4-flagellin融合蛋白都以浓度依赖性方式增加tlr5依赖性nf-κb活性,特别是,确认了在所有浓度下fc-higg4-bsflagellin融合蛋白的活性都是最优异的。发现低浓度(4nm)的其他fc-higg4-flagellin融合蛋白不诱导tlr5的活性,然而只有fc-higg4-bsflagellin能够诱导显著的tlr5活性。
[0230]
实施例5:用于动物实验的fc-migg1-bsflagellin融合蛋白的制备
[0231]
为了在小鼠动物模型中验证在以上实施例1至4中被鉴定为示出了最优异活性的fc-higg4-bsflagellin,如下制备包含编码与衍生自小鼠igg1的fc区融合的蛋白质的多核苷酸的载体(图5)。为了比较接头大小是否影响fc融合鞭毛蛋白的功能,分别使用一个接头ggggs(seq id no:8)和三个接头gggs(seq.id no:9)。
[0232]
如下制备包含编码与bsflagellin融合的蛋白质的多核苷酸、接头和衍生自小鼠igg1的fc区的载体(图5)。
[0233]
具体而言,使用正向引物(5
′‑
ccggaattcatgagaattaaccacaatattgcagcacttaac-3)(seq id no:34)以及反向引物(5
′‑
gaccatggtagaccctccgccaccacgtaataattgaagtacgtttttgaggctg-3
′
(seq no:35)和5
′‑
gaccatggtagaccctccaccaccacgacctccgccaccacgtaataattgagtacgtttgaggctg-3
′‑
(seq id no:36)),在插入了枯草芽孢杆菌(b.subtilis)鞭毛蛋白(bsflagellin)基因的pet49b-bsflagellin载体(scientific reports,7,40878(2017))中进行pcr。使用pfu turbo dna聚合酶(invitrogen,2.5单位/ul,#600252)进行pcr,92℃下持续30秒、92℃下30持续秒、56℃下持续30秒、68℃下持续1分钟作为1个循环。30个循环后,通过在68℃下反应5分钟来终止反应。
[0234]
将由此获得的pcr产物用ecori/ncoi处理,然后使用t4 dna连接酶(takara,#2011a)将其连接到用ecor1/ncoi酶处理过的pfuse-migg1-fc1载体中,以通过测序确认“pfuse-migg1-fc1-bsflagellin”的表达载体(图6)。
[0235]
在用以上制备的载体转染细胞后,确认fc-bsflagellin融合蛋白的表达。
[0236]
结果示出在图7中。
[0237]
从图7可以看到,在ev中鉴定出未缀合的fc蛋白(26kda),在#1(fc-bsflagellin,即fc-linker-bsflagellin融合蛋白)和#2(fc-bslinker3,即fc-linker3 repeat-bsflagellin融合蛋白)中分别鉴定出bsflagellin缀合的fc蛋白,大小为55kda。在用于阴性对照的tdtmt泳道中未检测到信号。fc-bsflagellin融合蛋白是具有bsflagellin-linker(ggggs(seq id no:8))-fc结构的融合蛋白,并且fc-bsflagellin3是指具有bsflagellin-linker(ggggggs3repeat(seq id no:9))-fc结构的融合蛋白。
[0238]
实施例6:fc-migg1-bsflagellin融合蛋白二聚化的确认
[0239]
试图确定其表达已确认的fc-migg1-bsflagellin融合蛋白是否形成二聚体。
[0240]
如图8所示,在非还原条件下,观察到二聚体形成信号大小对应于还原条件下出现的信号大小的约两倍。这确认了fc-bsflagellin融合蛋白形成二聚体。
[0241]
实施例7:fc-flagellin和野生型鞭毛蛋白作为tlr5激动剂的活性的比较
[0242]
为了确认以上制备的fc-bsflagellin融合蛋白表现出作为tlr5激动剂的活性,以与实施例4中相同的方式评价细胞内nf-κb活性。
[0243]
结果示出在图9中。
[0244]
用在将fc-migg1-bsflagellin转染到hek293t细胞中之后48小时获得的细胞培养物来确认toll样受体(tlr)5依赖性nf-κb的活性。对于比较,使用来自枯草芽孢杆菌的纯化鞭毛蛋白(fla-bs)和来自鼠伤寒沙门氏菌的纯化鞭毛蛋白(fla-st),这两种纯化鞭毛蛋白由invivogen以99%纯度出售。当对每种测试物质进行处理时,确认了fc-bsflagellin的tlr5依赖性nf-κb活性显著高于用作标准蛋白的fla-bs或fla-st的此种活性。
[0245]
上述结果指示,与野生型鞭毛蛋白、野生型鞭毛蛋白的片段或野生型鞭毛蛋白的变体相比,与免疫球蛋白的fc区融合的鞭毛蛋白表现出显著提高的tlr5通路激活能力。
[0246]
上述实验中所使用的每种蛋白质的氨基酸序列以及编码其的多核苷酸的序列如下:
[0247]
bsflagellin氨基酸序列:seq id no:1
[0248]
sdflagellin氨基酸序列:seq id no:2
[0249]
paflagellin氨基酸序列:seq id no:3
[0250]
shflagellin氨基酸序列:seq id no:4
[0251]
ecflagellin氨基酸序列:seq id no:5
[0252]
人igg4 fc氨基酸序列:seq id no:6
[0253]
小鼠igg1 fc氨基酸序列:seq id no:7
[0254]
接头1氨基酸序列:seq id no:8
[0255]
接头2氨基酸序列:seq id no:9
[0256]
higg4-fc-bsflagellin融合蛋白氨基酸序列:seq id no:10
[0257]
migg1-fc-bsflagellin融合蛋白(接头1)氨基酸序列:seq id no:11
[0258]
migg1-fc-bsflagellin融合蛋白(接头2)氨基酸序列:seq id no:12
[0259]
higg4-fc-sdflagellin融合蛋白氨基酸序列:seq id no:13
[0260]
higg4-fc-paflagellin融合蛋白氨基酸序列:seq id no:14
[0261]
higg4-fc-shflagellin融合蛋白氨基酸序列:seq id no:15
[0262]
higg4-fc-ecflagellin融合蛋白氨基酸序列:seq id no:16
[0263]
higg4-fc-bsflagellin多核苷酸序列:seq id no:17
[0264]
migg1-fc-bsflagellin(接头1)多核苷酸序列:seq id no:18
[0265]
migg1-fc-bsflagellin(接头2)多核苷酸序列:seq id no:19
[0266]
higg4-fc-sdflagellin多核苷酸序列:seq id no:20
[0267]
higg4-fc-paflagellin多核苷酸序列:seq id no:21
[0268]
higg4-fc-shflagellin多核苷酸序列:seq id no:22
[0269]
higg4-fc-ecflagellin多核苷酸序列:seq id no:23
[0270]
工业适用性
[0271]
与野生型鞭毛蛋白、其片段或其突变体相比,本发明提供的融合蛋白具有显著优越的toll样受体5(tlr5)通路激活能力,并且其可以非常有效地用于开发用于可以通过激活tlr5通路来预防、改善或治疗的疾病的治疗剂和/或用于疫苗佐剂开发,因此具有很高的工业适用性。
