1.本发明涉及分析检测领域,特别涉及一种抗生素残留检测方法及其检测试剂盒。
背景技术:
2.卡那霉素(kan)是一种氨基糖苷类抗生素,广泛运用于微生物引发的感染。由于kan的滥用,食品中过量的kan残留已经成为对公众健康的威胁。
3.常规的kan检测方法有高效液相色谱(hplc)、高效毛细管电泳(hpce)和酶联免疫吸附法(elisa)。虽然这些方法灵敏度高、准确度高,但大多数都需要昂贵的设备、复杂的预处理和高技能的人员,这限制了这些方法在kan检测分析中的应用。
4.因此,迫切需要开发高灵敏度、高选择性的kan检测方法,使检测过程简单、快速,降低成本,易于推广。
技术实现要素:
5.本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一组检测抗生素的探针组以及基于其构建的检测试剂盒,其检测耗时短、操作简单,且灵敏度高,易于大规模推广使用。
6.本发明的第一个方面,提供一组检测抗生素的探针组,包括靶标抗生素的核酸适配体、dna1、探针h1、探针h2、enzyme strand和substrate strand;
7.所述dna1与所述靶标抗生素的核酸适配体的互补碱基数少于所述靶标抗生素与所述核酸适配体的互补碱基数;
8.所述dna1与所述探针h1的3'突出端互补;
9.所述dna1与所述探针h2的3'突出端互补;
10.所述enzyme strand为mg
2+
依赖性dnazyme的酶链;
11.所述enzyme strand从5'到3'依次包括:5*序列、8序列和7*序列;
12.所述substrate strand为mg
2+
依赖性dnazyme的底物链;
13.所述substrate strand从5'到3'依次包括:6*序列、mg
2+
依赖性dnazyme的识别位点ra和4*序列;
14.所述4*序列、5*序列与所述探针h1的5'端互补杂交形成y型dna双链结构;
15.所述6*序列、7*序列与所述探针h2的5'端互补杂交形成y型dna双链结构;
16.所述ra的两端分别修饰有荧光基团和淬灭基团。
17.在本发明的一些优选的实施方式中,所述dna1从5'到3'依次包括:3序列、2序列和1序列;所述3序列、2序列和1序列组成的序列与所述核酸适配体互补。
18.在本发明的一些优选的实施方式中,所述探针h1从5'到3'依次包括:4序列、5序列、5*序列、4*序列、1*序列和2*序列;所述4序列与所述4*序列互补;所述5序列与所述5*序列互补;所述1*序列与所述1序列互补;所述2*序列与所述2序列互补。
19.在本发明的一些优选的实施方式中,所述探针h2从5'到3'依次包括:7序列、6序
列、6*序列、7*序列、2*序列和3*序列;所述7序列与所述7*序列互补;所述6序列与所述6*序列互补;所述3*序列与所述3序列互补。
20.在本发明的一些优选的实施方式中,所述荧光基团及所述淬灭基团均在t碱基上修饰。
21.在本发明的一些实施方式中,所述荧光基团选自dabcyl、tamra、cy3和cy5中的任一种,所述淬灭基团选自fam、bhq1、bhq2和bhq3中的任一种。
22.在本发明的一些实施方式中,所述靶标抗生素包括卡那霉素、四环素、氯霉素、氨苄西林、土霉素、链霉素和红霉素。
23.在本发明的一些实施方式中,所述靶标抗生素为卡那霉素。
24.在本发明的一些实施方式中,所述核酸适配体的序列为:5'-tgggggttgaggctaagccga-3'(seq id no.1);
25.所述dna1的序列为:5'-agcctcaaccccctttttt-3'(seq id no.2);
26.所述探针h1的序列为:5'-gctcctacacctacgtctttttttagacgtaggtgtaggagcgggggttgag-3'(seq id no.3);
27.所述探针h2的序列为:5'-catcatattccctccatatttttttatggagggaatatgatgggttgaggct-3'(seq id no.4);
28.所述enzyme strand的序列为:5'-agacgtagggactccgagccggacgaagttaatatgatgtttttt-3'(seq id no.5);
29.所述substrate strand的序列为:5'-tatggagggaactraggtctgtaggagctttttt-3'(seq id no.6)。
30.在本发明的一些优选的实施方式中,所述ra两端分别修饰有荧光基团和淬灭基团。
31.在本发明的一些更优选的实施方式中,所述ra两端的荧光基团和淬灭基团均在t碱基上修饰。
32.在本发明的一些更优选的实施方式中,所述substrate strand的序列为:5'-tatggagggaact-dabcyl-raggt-fam-ctgtaggagctttttt-3'。
33.本发明的第二个方面,提供一种检测抗生素的试剂盒,包括本发明第一方面的探针组。
34.在本发明的一些实施方式中,所述试剂盒还包括mg
2+
缓冲液。
35.在本发明的一些优选的实施方式中,所述mg
2+
缓冲液选自含mg
2+
的pbs(磷酸盐缓冲液)、tris-hcl缓冲液和hepes(4-羟乙基哌嗪乙磺酸)缓冲液。
36.在本发明的一些更优选的实施方式中,所述mg
2+
缓冲液为含mg
2+
的tris-hcl缓冲液。
37.在本发明的一些实施方式中,mg
2+
缓冲液中的mg
2+
浓度为10-30mm。
38.在本发明的一些优选的实施方式中,mg
2+
缓冲液中的mg
2+
浓度为20mm。
39.本发明的第三个方面,提供一种本发明第一方面的探针组在制备抗生素检测产品中的应用,所述抗生素检测产品包括检测试剂盒和生物传感器。
40.在本发明的一些实施方式中,所述抗生素包括卡那霉素、四环素、氯霉素、氨苄西林、土霉素、链霉素和红霉素。
41.在本发明的一些优选的实施方式中,所述抗生素为卡那霉素。
42.本发明的第四个方面,提供一种定性和/或定量检测抗生素的方法,包括以下步骤:将本发明第一方面的核酸适配体和dna1混合,然后依次加入mg
2+
缓冲液、待测样品、发夹探针h1、发夹探针h2、exo iii、enzyme strand、xμl substrate strand,根据荧光强度定量卡那霉素浓度。
43.在本发明的一些优选的实施方式中,所述mg
2+
缓冲液选自含mg
2+
的pbs(磷酸盐缓冲液)、tris-hcl缓冲液和hepes(4-羟乙基哌嗪乙磺酸)缓冲液。
44.在本发明的一些更优选的实施方式中,所述mg
2+
缓冲液为含mg
2+
的tris-hcl缓冲液。
45.在本发明的一些实施方式中,mg
2+
缓冲液中的mg
2+
浓度为10-30mm。
46.在本发明的一些优选的实施方式中,mg
2+
缓冲液中的mg
2+
浓度为20mm。
47.在本发明的一些实施方式中,所述发夹探针h1和所述发夹探针h2的制备方法为:将直链探针h1、直链探针h2于90-100℃加热2-20min,使之形成发夹结构。
48.在本发明的一些优选的实施方式中,所述发夹探针h1和所述发夹探针h2的制备方法为:将直链探针h1、直链探针h2于93-98℃加热4-15min,使之形成发夹结构。
49.在本发明的一些更优选的实施方式中,所述发夹探针h1和所述发夹探针h2的制备方法为:将直链探针h1、直链探针h2于95℃加热5-8min,使之形成发夹结构。
50.在本发明的一些的实施方式中,所述待测样品需经过前处理。
51.在本发明的一些优选的实施方式中,所述前处理方法为过0.22μm滤膜。
52.当然,本领域技术人员也可以根据检测样品的具体类型,合理选择本领域中常规的前处理方法进行处理,以实现适用于本发明实施例中的检测方法检测的目的。
53.在本发明的一些实施方式中,检测体系如下:
54.组分终含量核酸适配体100-300nmdna150-150nmmg
2+
1-3mm待测样品10-30μl发夹探针h1300-500nm发夹探针h2300-500nmexo iii5-40uenzyme strand300-500nmsubstrate strand50-150nmddh2o补足至100μl
55.在本发明的一些优选的实施方式中,检测体系如下:
56.组分终含量核酸适配体150-250nmdna175-125nmmg
2+
1.5-2.5mm待测样品15-25μl
发夹探针h1350-450nm发夹探针h2350-450nmexo iii10-30uenzyme strand350-450nmsubstrate strand75-125nmddh2o补足至100μl
57.在本发明的一些更优选的实施方式中,检测体系如下:
58.组分终含量核酸适配体200nmdna1100nmmg
2+
2mm待测样品20μl发夹探针h1400nm发夹探针h2400nmexo iii20uenzyme strand400nmsubstrate strand100nmddh2o补足至100μl
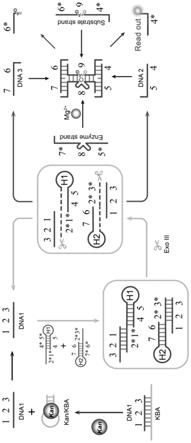
59.在本发明的一些实施方式中,孵育程序如下:
[0060][0061]
在本发明的一些优选的实施方式中,孵育程序如下:
[0062][0063][0064]
在本发明的一些更优选的实施方式中,孵育程序如下:
[0065][0066]
在本发明的一些实施方式中,所述待测样品包括卡那霉素。
[0067]
在本发明的一些实施方式中,所述核酸适配体和所述dna1的摩尔比为(1-10):1。
[0068]
在本发明的一些优选的实施方式中,所述核酸适配体和所述dna1的摩尔比为(1.2-7):1。
[0069]
在本发明的一些优选的实施方式中,所述核酸适配体和所述dna1的摩尔比为(1.5-5):1。
[0070]
在本发明的一些更优选的实施方式中,所述核酸适配体和所述dna1的摩尔比为2:1。
[0071]
本发明的第五个方面,提供一种本发明第一方面的探针组或本发明第二方面的试
剂盒在食品安全和环境检测中的应用。
[0072]
本发明的有益效果是:
[0073]
本发明提供了一组探针组,该探针组可以特异性识别靶标抗生素,利用抗生素的特异性核酸适配体作为特异性识别元件,基于发夹探针、外切酶iii(exo iii)、mg
2+
依赖性dnazyme实现对抗生素的高灵敏检测。该探针组具有灵敏度高,特异性好,准确度高,重复性好的特点。此外,该探针组对卡那霉素检测的线性范围为10fm-10nm,检出限为10fm。
[0074]
本发明提供了一种检测抗生素的试剂盒,包含上述探针,能够快速、灵敏、准确、特异性检测样品中的目标抗生素含量,易于大规模推广使用。
[0075]
本发明提供了一种定性和/或定量检测抗生素的方法,该方法步骤简单,检测快速,成本低廉,灵敏度高,特异性好,准确度高,重复性好,具有较好的应用前景。且整个检测过程响应迅速,无需专业训练即可掌握操作流程,便于快速推广使用。
附图说明
[0076]
下面结合附图和实施例对本发明做进一步的说明,其中:
[0077]
图1为本发明实施例中的检测方法的原理示意图。
[0078]
图2为本发明实施例中的检测方法的可行性验证结果。
[0079]
图3为本发明实施例中不同kba和dna1的摩尔比对卡那霉素检测效果的影响图。
[0080]
图4为本发明实施例中不同反应温度对卡那霉素检测效果的影响图。
[0081]
图5为本发明实施例中不同exo iii的孵育时间对卡那霉素检测效果的影响图。
[0082]
图6为本发明实施例中不同exo iii添加量对卡那霉素检测效果的影响图。
[0083]
图7为本发明实施例中的检测方法对不同浓度卡那霉素的检测结果。
[0084]
图8为本发明实施例中的检测方法的特异性检测结果。
具体实施方式
[0085]
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
[0086]
以下实施例中所使用的实验材料和试剂,如无特别说明,均为常规可从商业途径获得的耗材和试剂。下述实施例中荧光光谱测量仪器均为spectramax i3x多功能酶标仪。
[0087]
以下实施例中所使用的tris-hcl缓冲溶液含有150mm nacl、50mm kcl和20mm mgcl2,ph=8.0;kba、dna1、发夹探针h1、发夹探针h2均溶解于tris-hcl缓冲溶液。
[0088]
一种卡那霉素检测方法
[0089]
本实施例中利用卡那霉素核酸适配体(kba)作为特异性识别元件,结合发夹探针、外切酶iii(exo iii)、mg
2+
依赖性dnazyme实现对卡那霉素的高灵敏检测。
[0090]
上述检测卡那霉素的方法具体包括以下步骤:
[0091]
(1)在室温条件下,向ep管中加入kba和dna1,于95℃加热7min后冷却至室温,使之彻底形成kba和dna1复合物(kba和dna1的摩尔比会影响信噪比,信噪比越大,检测效果越好);随后向ep管中加入20μl待测溶液,于25℃孵育30min,使卡那霉素与kba充分结合,释放出原本与kba结合的dna1。
[0092]
kba的序列为:
[0093]
其中,kba序列中标粗部分为dna1的互补序列。
[0094]
dna1的序列为:
[0095]
其中,dna1序列中仅标粗部分为3序列,仅标有下划线部分为2序列,同时标有下划线的加粗部分为1序列;3序列、2序列和1序列组成的序列与kba互补。
[0096]
(2)继续向ep管中加入发夹探针h1、发夹探针h2和exo iii,于25℃孵育30min,使dna1与发夹探针h1、发夹探针h2充分结合,并被exo iii充分催化去除3'端的核苷酸,从而释放发夹探针h1的5'端序列dna2和发夹探针h2的5'端序列dna3。
[0097]
其中,发夹探针h1和发夹探针h2的制备方法为:将直链探针h1或直链探针h2溶解于tris-hcl缓冲溶液,于95℃加热5-10min。随后缓慢冷却至室温,以形成发夹探针h1和发夹探针h2。
[0098]
直链探针h1的序列为:直链探针h1的序列为:
[0099]
其中,直链探针h1序列中仅标粗部分为4序列,同时标有下划线的加粗部分为5序列,仅斜体部分为5*序列,同时标有下划线的斜体部分为4*序列,标粗的斜体部分为1*序列,同时标有下划线的标粗斜体部分为2*序列;4序列与4*序列互补,5序列与5*序列互补,1*序列与dna1的1序列互补,2*序列与dna1的2序列互补,4序列和5序列组成dna2。
[0100]
直链探针h2的序列为:直链探针h2的序列为:
[0101]
其中,直链探针h2序列中仅标粗部分为7序列,同时标有下划线的加粗部分为6序列,斜体部分为6*序列,同时标有下划线的斜体部分为7*序列,标粗的斜体部分为2*序列,同时标有下划线的标粗斜体部分为3*序列;7序列与7*序列互补,6序列与6*序列互补,3*序列与dna1的3序列互补,2*序列与dna1的2序列互补,7序列和6序列组成dna3。
[0102]
(3)继续向ep管中加入enzyme strand和substrate strand,25℃孵育45min,检测500-650nm范围内的荧光光谱(e
x
=488nm,em=520nm),并代入标准曲线方程后,从而计算出待测溶液中的卡那霉素的浓度。
[0103]
enzyme strand的序列为:strand的序列为:
[0104]
其中,enzyme strand序列中仅标粗部分为5*序列,标有下划线的部分为8序列,同时标有下划线的加粗部分为7*序列;5*序列与探针h1的5序列互补,7*序列与探针h2的7序列互补。
[0105]
substrate strand的序列为:strand的序列为:
[0106]
其中,substrate strand序列中仅标粗部分为6*序列,标有下划线的部分为9序
列,同时标有下划线的加粗部分为4*序列,6*序列与探针h2的6序列互补,4*序列与探针h1的4序列互补,9序列中含有enzyme strand的识别位点ra,荧光基团dabcyl及淬灭基团fam均在识别位点ra两侧的t碱基上修饰。
[0107]
上述实施例的检测体系中的各组分终含量如表1所示:
[0108]
表1:
[0109]
组分终含量kba200nmdna1100nmmg
2+
2mm待测样品20μl发夹探针h1400nm发夹探针h2400nmexo iii20uenzyme strand400nmsubstrate strand100nmddh2o补足至100μl
[0110]
上述实施例中的卡那霉素检测方法原理如图1所示,具体如下:
[0111]
(1)当体系中存在卡那霉素时:
[0112]
当体系中存在卡那霉素时,卡那霉素与kba特异性结合,从而释放出原本与kba结合的dna1,释放出的dna1可以分别与体系中的发夹探针h1的3'端和发夹探针h2的3'端互补结合,形成具有平末端的双链复合物dna1/h1和dna1/h2。在exo iii的催化下,dna1/h1和dna1/h2中的发夹探针h1和发夹探针h2的3'端的核苷酸逐步去除,释放出dna1、发夹探针h1的5'端序列dna2和发夹探针h2的5'端序列dna3,其中,释放出的dna1可以继续与体系中的发夹探针h1和发夹探针h2结合形成双链复合物dna1/h1和dna1/h2,随后,dna1/h1和dna1/h2继续被exo iii催化去除发夹探针h1和发夹探针h2的3'端的核苷酸并释放出dna1、dna2和dna3,循环往复,从而实现信号放大。而dna2的5'端序列可以依次与mg
2+
依赖性dnazyme的底物链(substrate strand)的3'端序列和酶链(enzyme strand)的5'端序列互补,dna3的5'端序列可以依次与enzyme strand的3'端序列和substrate strand的5'端序列互补,稳定协同杂交产生一个有活性的mg
2+
依赖性dnazyme。在体系中mg
2+
的作用下,substrate strand被切割为两段后从mg
2+
依赖性dnazyme中释放出来,随后,dna2、dna3和enzyme strand继续结合、切割完整的substrate strand,循环往复,从而实现信号放大。由于substrate strand的切割位点ra两端分别修饰有荧光基团和淬灭基团,substrate strand被切割后,荧光基团与淬灭基团分开而释放荧光信号,通过检测荧光信号强度可以实现对卡那霉素的高灵敏检测。
[0113]
(2)当体系中不存在卡那霉素时:
[0114]
当体系中不存在卡那霉素时,由于dna1与卡那霉素核酸适配体互补碱基相比发夹探针h1或发夹探针h2更多,因此,dna1会优先与卡那霉素核酸适配体互补杂交,从而无法与发夹探针h1或发夹探针h2互补杂交,故发夹探针h1和发夹探针h2无法形成平末端,dna2和dna3无法释放。此时enzyme strand和substrate strand之间互补碱基对不足以使其稳定
杂交,故substrate strand不能被mg
2+
依赖性dnazyme切割,而substrate strand切割位点ra两端修饰的荧光基团与淬灭基团由于靠近而发生荧光淬灭。
[0115]
上述实施例中的卡那霉素检测方法的可行性验证及测定条件优化
[0116]
(1)可行性验证
[0117]
在本实施例中使用浓度为500nm的卡那霉素标准品溶液作为检测对象,验证本方法的可行性。
[0118]
检测方法同上述实施例。
[0119]
设置对照组,分别为待测样品缺失组(反应体系中不加入待测样品)、发夹探针h1缺失组(反应体系中不加入发夹探针h1)、发夹探针h2缺失组(反应体系中不加入发夹探针h2)。
[0120]
检测结果如图2所示,其中,曲线a为待测样品缺失组的荧光光谱,曲线b为发夹探针h1缺失组的荧光光谱,曲线c为发夹探针h2缺失组的荧光光谱,曲线d为反应体系无缺失情况下的荧光光谱。
[0121]
由图2可知,在反应体系中缺少卡那霉素时,并无明显的荧光增强,这表明dna1与kba结合,无法触发后续反应。在反应体系中缺少发夹探针h1或发夹探针h2时,并无明显的荧光增强,这表明体系中缺少dna2或dna3片段时,会无法形成有活性的mg
2+
依赖性dnazyme以触发后续反应。当反应体系完整时,荧光信号显著增强,这表明该方法可以用于检测卡那霉素。
[0122]
(2)测定条件优化
[0123]
1)kba与dna1的摩尔比
[0124]
在本实施例中使用浓度为500nm的卡那霉素标准品溶液作为检测对象,以优化反应条件中的kba与dna1的摩尔比。
[0125]
检测方法同上述实施例,kba的终含量分别设置为100、200、300、400nm。
[0126]
检测结果如图3所示。
[0127]
由图3可知,kba与dna1的摩尔比,随着kba与dnal摩尔比从1:1增加到2:1,信噪比(s/n)增大,摩尔比进一步提高则导致信噪比降低。这可能是由于过量的kba会引起微弱的荧光信号,而kba不足则会由于dna1过量而引起空白背景信号过高。因此,kba与dnal摩尔比为2:1时,信噪比最大,可有效提高本发明检测方法的灵敏度。
[0128]
2)反应温度
[0129]
在本实施例中使用浓度为1μm的卡那霉素标准品溶液作为检测对象,以优化反应条件中的反应温度。
[0130]
检测方法同上述实施例,加入exo iii后的孵育温度分别设置为4℃、25℃、37℃和45℃。
[0131]
检测结果如图4所示。
[0132]
由图4可知,在体系中含有100nm卡那霉素的情况下,随着温度从4℃升高到37℃,荧光信号随之升高,然而,当温度进一步升高到45℃时,荧光信号降低。可能是因为exo iii的最适温度为37℃,在45℃时活性降低。在体系中不含有卡那霉素的情况下,随着温度从4℃升高到45℃,背景信号继续增加,这可能是因为在较高的温度下,kba/dna1双链和发夹探针的构象可能被破坏。因此,反应温度为25℃时,信噪比较高,可有效提高本发明检测方法
的灵敏度。
[0133]
3)exo iii的孵育时间
[0134]
在本实施例中使用浓度为500nm的卡那霉素标准品溶液作为检测对象,以优化反应条件中的exo iii的孵育时间。
[0135]
检测方法同上述实施例,加入exo iii后的孵育时间分别设置为0、10、20、30、40、50min。
[0136]
检测结果如图5所示。
[0137]
由图5可知,在体系中含有100nm卡那霉素的情况下,荧光信号随孵育时间的延长逐渐升高,在30min后趋于平稳。这说明在孵育30min后,双链复合物dna1/h1和dna1/h2已经被exo iii充分催化去除3'端的核苷酸。因此,本检测方法中,exo iii的最佳孵育时间为30min。
[0138]
4)exo iii浓度
[0139]
在本实施例中使用浓度为500nm的卡那霉素标准品溶液作为检测对象,优化反应条件中的exo iii浓度。
[0140]
检测方法同上述实施例,exo iii的终含量分别设置为5、10、20、30、40u。
[0141]
检测结果如图6所示。
[0142]
由图6可知,在体系中含有100nm卡那霉素的情况下,荧光信号随酶量增加而逐渐升高,在20u exo iii时趋于平稳。因此,20u exo iii为最适添加的酶量。
[0143]
上述实施例中的卡那霉素检测方法的检测性能评估
[0144]
(1)灵敏度、检出限和线性范围
[0145]
在本实施例中使用浓度为50fm、500fm、5pm、50pm、500pm、5nm、50nm和500nm的卡那霉素标准品溶液作为检测对象,以检测本发明检测方法的灵敏度、检出限和线性范围。
[0146]
检测方法同上述实施例。
[0147]
检测结果如图7(a:在e
x
=488nm条件下,不同浓度卡那霉素对应的发射光波普图;b:在e
x
=488nm条件下,em=520nm检测得到的荧光强度与对应的卡那霉素浓度的关系图;c:在e
x
=488nm条件下,em=520nm检测得到的荧光强度与对应的卡那霉素浓度的对数的关系图)所示。
[0148]
由图7可知,随着卡那霉素浓度升高,荧光信号随之增加。其中,线性回归图如图7c所示,在10fm-10nm范围内,荧光强度与卡那霉素浓度的对数呈线性关系,线性回归方程为f
520
=9.65
×
105+1.91
×
106×
lgc(r2=0.99),其中c为卡那霉素的浓度,f
520
为在e
x
=488nm条件下,em=520nm检测到的荧光强度。10fm卡那霉素的荧光强度明显高于空白样品,因此,本检测方法对卡那霉素的检测阈值为10fm,具有较好的灵敏度。
[0149]
(2)实际样品检测
[0150]
在本实施例中使用添加有卡那霉素标准品的牛奶(卡那霉素浓度分别为50fm、500fm、50pm、500pm和50nm)作为检测对象,其中,牛奶需经0.22μm滤膜过滤后用于检测,以去除牛奶中的不溶物。
[0151]
检测方法同上述实施例。
[0152]
此外,还采用液相色谱-质谱联用仪(lc-ms)对牛奶样品中添加的卡那霉素的浓度进行定量分析,以验证上述卡那霉素检测方法的检测精度。
[0153]
相对误差=[(本实施例方法检测量/lc-ms检测量)-1]
×
100%。
[0154]
检测结果如表1所示。
[0155]
表1:
[0156]
样品加标量本实施例方法检测量回收率(%)lc-ms检测量相对误差(reb)(%)牛奶110fm9.6fm969.8fm-2.0牛奶2100fm101.6fm101.697.4fm4.3牛奶310pm10.3pm1039.7pm6.2牛奶4100pm97.7pm97.799.2pm-1.5牛奶510nm10.5nm10510.2nm2.9
[0157]
由表1可知,应用本检测方法检测牛奶样品中的卡那霉素,回收率在96%-105%之间,相对误差在-2.0-6.2%之间,与lc-ms分析结果基本一致,这表明本检测方法重复性好,准确性高,可有效用于实际样品中抗生素的检测。并且本实施例提供的方法能够快速检测样品中卡那霉素含量,检测时长不到2h,成本低,灵敏度高,且准确度与常规检测方法相近。
[0158]
(3)特异性检测
[0159]
在本实施例中使用浓度为500nm的卡那霉素(kan)标准品溶液、四环素标准品(tet)溶液、氯霉素标准品(chl)溶液、氨苄西林标准品(amp)溶液、土霉素标准品(oxy)溶液、链霉素标准品(str)溶液和红霉素标准品(ery)溶液作为检测对象,以检测本检测方法的特异性。
[0160]
检测方法同上述实施例。
[0161]
检测结果如图8所示。
[0162]
由图8可知,与空白样品相比,卡那霉素可以产生高荧光信号,而tet、chl、amp、oxy、str和ery则显示与空白样品相似的低荧光信号。这表明本检测方法具有较高的特异性。
[0163]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。
