1.本发明属于生物材料领域,尤其涉及一种聚乳酸复合生物材料及其制备方法和应用。
背景技术:
2.大面积缺损区的骨再生是一个重大的临床挑战,因为骨折端之间的间隙超过临界距离,导致骨传导和骨诱导微环境较差。自体骨移植是目前治疗骨缺损的金标准。然而,由于移植物的大小和供区的并发症(如感染、持续疼痛等),这种治疗方法有一定的局限性。因此,寻找用于骨再生的人工骨修复生物材料具有重要意义。
3.聚乳酸(pla)是一种很好的支架材料,pla在骨组织工程中已被广泛用于各种形式或生物医学应用。这些pla支架被广泛认为有助于支持骨组织和支架结构的机械性能,但在没有生物活性因子的情况下无法直接引导骨再生,使得其在组织工程中的应用受到限制。
4.生物活性因子,如重组骨形态发生蛋白(rhbmp-2)、bfgf、vegf等可激活或促进成骨和血管化;通常与植入骨支架结合,可显著改善材料的成骨诱导或血管生成特性。但由于寿命短,易失活,有时会发生异位成骨的风险。
5.已有研究证实,无机材料中的mg
2+
、si
4+
等微量元素可诱导细胞过表达成骨或血管生成相关因子(如bmp-2、vegf),进而促进新骨或血管的形成。以硅酸盐为主体的生物材料,特别是含有钙、镁等微量元素的生物材料,被认为是一种很有前途的生物相容性良好的骨再生无机材料。mg
2+
诱导内皮细胞产生一氧化氮,其机制与vegf的血管化机制相同。si
4+
不仅可以通过上调enos导致vegf的表达来诱导血管生成,而且在成骨过程中起关键作用。
6.由于骨缺损形状多呈现不规则形状,体外预成型植骨修复材料难以适应骨缺损形状,与正常骨质间形成间隔,从而影响组织工程骨修复支架传导作用,随着3d打印技术的快速发展,利用3d打印技术能够简单方便地制备高分子支架,且能精确控制高分子支架孔的形状和大小、纤维尺寸、连通度和孔隙率等。定制设计的种植体也可以使修补材料更加契合缺损形状,植入更容易,外观更完美。
7.现有技术提供了一种可降解聚合物、可降解无机金属、活性添加物和可降解无机物的复合多孔支架,但无机金属、无机物溶液与聚合物溶液很难混合均匀,无机金属和无机物容易发生沉淀,很难保证均一性。而生物支架材料需要保证无机颗粒能均匀分散在有机基体中,并且无机材料中微量元素的含量也会影响成骨或成血管的成败。此外,生物材料植入后的免疫反应也会影响骨修复或血管形成的效果,免疫反应过于强烈,会导致植入失败。
技术实现要素:
8.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明第一个方面提出一种聚乳酸复合生物材料;本发明的第二个方面提供一种聚乳酸复合生物材料的制备方法;本发明的第三个方面提出一种3d生物打印支架;本发明的第四个方面提出一种聚乳酸复合材料或3d生物打印支架在制备组织工程支架中的应用。
9.根据本发明的第一个方面,提供了一种聚乳酸复合生物材料,包括硅酸镁(m2s)与聚乳酸(pla)复合物,所述硅酸镁表面涂覆有硅烷偶联剂。
10.硅烷偶联剂涂层能在各种疏水膜(pvdf、ptfe、pp等)表面形成粗糙的微纳结构,同时在膜表面引入大量的亲水性基团,该涂层还具有较好的普适性,可以实现多种材料的超亲水化改性。与传统的表面自由基聚合不同,该涂层衍生的表面引发的聚合不需要任何金属催化剂、光催化剂或光敏剂。利用这一技术,可以将多种化学功能基团接枝到各种底物上。本发明通过在硅酸镁颗粒上涂覆硅烷偶联剂涂层,提高其与有机基体的结合力,促进其均匀分散。pla是fda批准的具有良好生物相容性和低免疫源性的生物材料。硅酸镁中的mg
2+
、si
4+
等微量元素可诱导细胞过表达成骨或血管生成相关因子(如bmp-2、vegf),并有潜力调控免疫反应,进而共同促进新骨或血管的形成。
11.在本发明的一些优选的实施方式中,所述硅酸镁与聚乳酸的质量比为(0.001~50):100。
12.在本发明的一些优选的实施方式中,所述硅酸镁与聚乳酸的质量比为(1~30):100。
13.在本发明的一些更优选的实施方式中,所述硅酸镁与聚乳酸的质量比为(5~15):100。
14.在本发明的一些优选的实施方式中,所述硅酸镁表面涂覆硅烷偶联剂,所述硅烷偶联剂为3-氨丙基三乙氧基硅烷(aptes)、乙烯基三氯硅烷、3-异氰酸丙基三乙氧基硅烷中的至少一种。
15.根据本发明的第二个方面,提供了一种聚乳酸复合生物材料的制备方法,包括以下步骤:
16.s1:将硅酸镁分散在有机溶液中,加入硅烷偶联剂,混合反应,得涂覆硅烷偶联剂的硅酸镁;
17.s2:向聚乳酸溶液中加入s1中所述涂覆硅烷偶联剂的硅酸镁,共沉淀得到硅酸镁/聚乳酸复合物(m2s/pla)。
18.上述硅酸镁原料除可通过购买得到,还可通过以下方式制得:
19.配制表面活性剂溶液,随后同时加入硅酸四乙酯和六水硝酸镁溶液,调节溶液ph至强碱性,搅拌反应,洗涤,烘干后煅烧。
20.在本发明的一些优选的实施方式中,上述表面活性剂选自十六烷基三甲基溴化铵(ctab)、十二烷基硫酸钠、聚苯乙烯-b-2-乙烯基吡啶-b-环氧乙烷三嵌段聚合物中的至少一种。
21.在本发明的一些优选的实施方式中,所述ctab与水溶液的质量体积比为(0.1~6)g:40ml。
22.在本发明的一些优选的实施方式中,所述ctab溶于水后需50℃~65℃水浴,直至清澈均匀。
23.在本发明的一些更优选的实施方式中,所述ph值为11~12。
24.在本发明的一些优选的实施方式中,所述六水硝酸镁、硅酸四乙酯和ctab的摩尔比为(1~2):1:(0.1~10)。
25.在本发明的一些优选的实施方式中,所述搅拌反应的时间为2h~3h。
26.在本发明的一些优选的实施方式中,所述煅烧温度为700℃~1100℃,煅烧时间为3h~4h。
27.在本发明的一些优选的实施方式中,所述s1中分散硅酸镁的有机溶剂选自乙醇、甲醇、二氯甲烷中的至少一种。
28.在本发明的一些优选的实施方式中,所述s1中硅酸镁与有机溶剂的质量体积比为(0.1~10)g:50ml,分散的时间为30min~60min。
29.在本发明的一些优选的实施方式中,所述s1中硅烷偶联剂与硅酸镁的体积质量比为(0.001~5)ml:1g。
30.在本发明的一些更优选的实施方式中,所述s1中硅烷偶联剂与硅酸镁的体积质量比为(0.5~2)ml:1g。
31.在本发明的一些优选的实施方式中,所述s1中混合的温度为4℃~80℃,时间为2h~24h。
32.在本发明的一些优选的实施方式中,所述聚乳酸复合生物材料的制备方法中,s1:将硅酸镁分散在溶液中,加入硅烷偶联剂,混合,洗涤,得涂覆硅烷偶联剂的硅酸镁,所述洗涤的具体操作为:先用去离子水洗涤再用无水乙醇洗涤。
33.在本发明的一些优选的实施方式中,所述s2中聚乳酸在二氯甲烷、三氯甲烷、四氢呋喃中的至少一种有机溶剂中溶解。
34.根据本发明的第三个方面,提出了一种3d生物打印支架,包括上述聚乳酸复合生物材料。
35.在本发明的一些优选的实施方式中,上述聚乳酸复合生物材料中硅酸镁的质量分数为0.001%~50%。
36.在本发明的一些更优选的实施方式中,上述聚乳酸复合生物材料中硅酸镁的质量分数为5%~15%。
37.在本发明的一些优选的实施方式中,上述聚乳酸复合生物材料在打印前的保温温度为180℃~200℃,时间为1h~3h。
38.在本发明的一些优选的实施方式中,上述打印支架的参数为:直径或边长为4mm~20mm,层高100μm~1600μm。
39.在本发明的一些优选的实施方式中,上述打印支架的打印针头直径为100μm~2000μm,支架孔径为100μm~2000μm。
40.在本发明的一些优选的实施方式中,当上述打印支架的形状为圆柱体时,直径为6mm,高度为1mm,打印形状为长方体时,长和宽均为9cm,高度为2mm。
41.本发明的第四个方面提出了一种上述聚乳酸复合生物材料或上述3d生物打印支架在制备组织工程支架中的应用。
42.本发明的有益效果为:
43.1.本发明的聚乳酸复合生物材料,含有表面涂覆硅烷偶联剂的无机硅酸镁颗粒,硅酸镁分散均匀,与有机基体的结合力好。
44.2.本发明通过共沉淀析出无机/有机复合物制备聚乳酸复合生物材料,可以有效避免沉淀的发生,保证硅酸镁的均一性。
45.3.本发明制得的3d生物打印支架,操作简便,孔径分布可调,具有良好的生物降解
性和生物活性,可释放出mg
2+
、si
4+
,明显促进大鼠骨髓间充质干细胞(bmscs)的alp活性和成骨分化相关基因表达,有利于细胞成骨分化,有利于促进体内免疫成血管化和成骨。
46.4.本发明的聚乳酸复合生物材料可用于组织工程,还可结合骨缺损患者的临床影像学资料,经由3d打印机打印出生物仿生性、功能性、可生物降解的组织工程骨结构。
附图说明
47.下面结合附图和实施例对本发明做进一步的说明,其中:
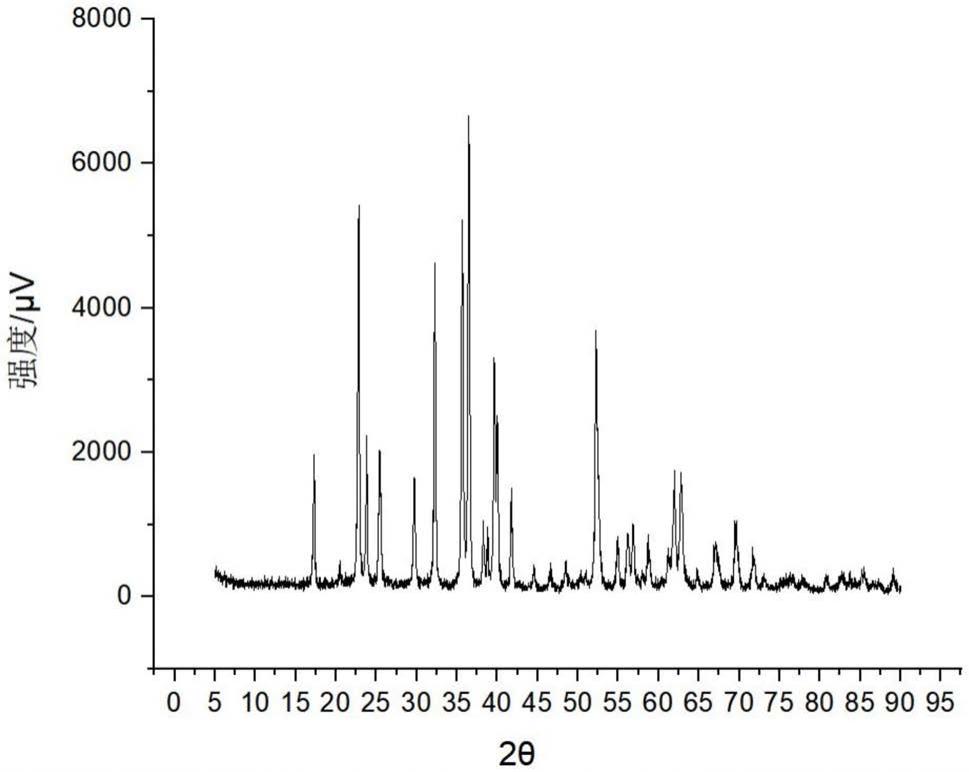
48.图1为本发明试验例1中mg2sio4经900℃煅烧后的纳米粉体的xrd结果。
49.图2为对比例1中的m2s(a1,a2)和实施例3中涂覆aptes的m2s(b1,b2)的扫描电子显微镜图,及实施例3(aptes-m2s/pla)和对比例1(pla)支架的大体形貌(c1,c2)与扫描电镜图(d1,d2),c1和d1为对比例1的支架,c2和d2为实施例3的支架。
50.图3为本发明实施例3(aptes-m2s/pla)、对比例1(pla)和对比例2(m2s/pla)支架压片的接触角。
51.图4为本发明试验例4中bmscs在不同实验组材料上的alp染色:(a)实施例3(aptes-m2s/pla);(b)对比例1(pla)。
52.图5是本发明试验例5中bmscs在不同复合材料共培养14天后的成骨基因表达。
具体实施方式
53.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
54.以下实施例1~5及对比例2中m2s制备步骤均为:
55.将10g的ctab溶解于400ml去离子水,搅拌至清澈均匀,然后快速氨水调节ph至12,于通风橱中搅拌5min,将68.33g六水硝酸镁溶解,在20min内将上述六水硝酸镁和30ml硅酸四乙酯滴加于ctab溶液中,然后继续调节溶液ph至11~12,连续搅拌2h~3h后过滤,去离子水洗涤4次,然后900℃煅烧3h,得到m2s。
56.以下实施例1~5中打印3d支架的条件与参数均为:打印3d支架的复合物材料在180℃保温1小时,再打印支架:边长9mm,4层;350μm针头,400μm孔径,层间距200μm。
57.实施例1
58.本实施例制备了一种含有2wt%aptes-m2s的3d打印pla支架,具体过程为:
59.s1:将2g的m2s超声分散在100ml的甲醇溶液中(30min),然后在搅拌情况下,滴加入2ml的aptes,65℃搅拌6小时,去离子水离心洗涤2次,醇洗2次,得到aptes-m2s;
60.s2:将10g的pla溶解在200ml三氯甲烷中;然后0.2g的aptes-m2s,得到2wt%aptes-m2s的aptes-m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物;
61.s3:3d打印支架。
62.实施例2
63.本实施例制备了一种含有5wt%aptes-m2s的3d打印pla支架,具体过程为:
64.s1:将2g的m2s超声分散在200ml的二氯甲烷溶液中(30min),然后在搅拌情况下,滴加入2ml的aptes,65℃搅拌6小时,去离子水离心洗涤2次,醇洗2次,得到aptes-m2s;
65.s2:将15g的pla溶解在200ml三氯甲烷中;然后加入0.75g的aptes-m2s,得到5wt%aptes-m2s的aptes-m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物;
66.s3:3d打印支架。
67.实施例3
68.本实施例制备了一种含有10wt%aptes-m2s的3d打印pla支架,具体过程为:
69.s1:将2g的m2s超声分散在400ml的二氯甲烷溶液中(30min),然后在搅拌情况下,滴加入2ml的aptes,65℃搅拌6小时,去离子水离心洗涤2次,醇洗2次,得到aptes-m2s;
70.s2:将5g的pla溶解在100ml二氯甲烷中;然后加入0.5g的aptes-m2s,得到10wt%aptes-m2s的aptes-m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物;
71.s3:3d打印支架。
72.实施例4
73.本实施例制备了一种含有20wt%的乙烯基三氯硅烷涂覆m2s的3d打印pla支架,具体过程为:
74.s1:将2g的m2s超声分散在500ml的90%乙醇溶液中(30min),然后在搅拌情况下,滴加入10ml的乙烯基三氯硅烷,65℃搅拌6小时,去离子水离心洗涤2次,醇洗2次,得到乙烯基三氯硅烷修饰m2s;
75.s2:将25g的pla溶解在300ml二氯甲烷中;然后加入5g乙烯基三氯硅烷涂覆m2s,得到纳米颗粒含量为20wt%的m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物;
76.s3:3d打印支架。
77.实施例5
78.本实施例制备了一种含有40wt%的3-异氰酸丙基三乙氧基硅烷涂覆m2s的3d打印pla支架,具体过程为:
79.s1:将6g的m2s超声分散在600ml的甲醇溶液中(30min),然后在搅拌情况下,滴加入12ml的3-异氰酸丙基三乙氧基硅烷,65℃搅拌6小时,去离子水离心洗涤2次,醇洗2次,得到3-异氰酸丙基三乙氧基硅烷涂覆m2s;
80.s2:将25g的pla溶解在500ml四氢呋喃中;然后取100ml溶液,加入3-异氰酸丙基三乙氧基硅烷涂覆m2s,得到纳米颗粒含量为40wt%的m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物;
81.s3:3d打印支架。
82.对比例1
83.本对比例制备了一种以pla为材料的3d打印支架,与实施例1~5的区别在于,未使用硅烷偶联剂涂覆m2s,具体过程为:
84.s1:将5g的pla溶解在100ml三氯甲烷中,之后在搅拌下缓慢加入乙醇析出pla沉淀;
85.s2:3d打印支架。
86.对比例2
87.本对比例制备了一种含有10wt%m2s的m2s/pla的3d打印支架,与实施例3的区别在于,所使用的m2s未涂覆aptes,与对比例1的区别在于,使用了m2s,具体过程为:
88.s1:将50g的pla溶解在1000ml三氯甲烷中;然后加入5g的m2s,得到10wt%的m2s/pla复合物;超声分散10min,搅拌5min,重复2次;之后在搅拌下缓慢加入乙醇析出复合物沉淀;
89.s2:3d打印支架。
90.试验例1
91.本试验例对900℃煅烧的mg2sio4纳米粉体进行了x射线衍射(xrd),具体过程为:
92.采用x射线衍射仪在5
°
~90
°
分析mg2sio4的微观结构及结晶状态。
93.结果分析:图1展示了mg2sio4纳米复合粉末的结构和形态特性相关的结果。值得注意的是,以900℃煅烧的mg2sio4纳米粉体为起始粉体构建aptes-m2s/pla支架,纳米材料的xrd图谱显示其物相与jcpds卡片00-004-0768(mg2sio4)一致,证明了mg2sio4纳米材料可在900℃成功合成和结晶。
94.试验例2
95.本试验例对实施例3和对比例2中制备的材料及3d打印支架进行性能表征,具体过程为:
96.扫描电子显微镜观察纤维支架形貌(sem):
97.(1)将制备好的复合支架粘于样品台上;
98.(2)样品抽真空,喷金90s;
99.(3)采用扫描电子显微镜,加速电压为10kv,观察支架的形态;
100.结果分析:如图2所示,从b1,b2中可以很容易地看出,aptes已成功地沉积在硅酸镁的表面并形成了完整的包覆层。与包覆前的a1,a2相比,硅酸镁颗粒的轮廓和边缘变模糊,且表面的凸起也已被aptes包覆层均匀覆盖。图c1,c2和d1,d2显示了3d打印支架的形态,两组支架外形和孔隙结构接近。
101.试验例3
102.本试验例对对比例1、对比例2和实施例3进行亲水性测定,具体过程为:
103.将去离子水分别滴到4种材料压片上,使用表面接触角分析仪测量复合支架的亲水性,并在5秒钟内进行拍照记录数据,对每个样品进行四次测量并取平均值。
104.合成聚合物表面的细胞粘附能力取决于其化学性质,如亲水性、粗糙度、电负性等。一般来说,细胞不能直接粘附在合成聚合物的表面,因为细胞膜表面的整合素只能与细胞外基质中蛋白质的特定氨基酸序列相互作用。良好的亲水性有利于吸收体液中的营养和蛋白质,从而显著促进细胞粘附。
105.结果分析:如图3所示,与对比例1相比,对比例2和实施例3的接触角明显降低,同时实施例3的水接触角明显小于对比例2,表明aptes-m2s明显增强了pla的亲水性。
106.试验例4
107.碱性磷酸酶(alp)是成熟成骨细胞的标志性酶,其含量的高低表示bmscs向成骨细胞分化的程度,通常采用bcip/nbt试剂盒对bmscs进行染色,通过材料上染色的深浅进一步
表征了不同实验组对bmscs分化的影响。alp存在时,会催化bcip水解产生中间加成产物,并与nbt反应形成蓝紫色晶体,颜色的深浅可以用来表征alp的活性,alp染色越深表示alp活性越高,说明成骨分化程度越高。
108.本试验例对实施例3和对比例1所制得的支架进行了alp染色,具体过程为:
109.将大鼠bmscs种植在实施例3和对比例1制得的两组灭菌支架上,使用商品化的成骨诱导液(含10mm养液甘油磷酸钠、10nm地塞米松、50mm维生素c)共培养细胞7天,采用bcip/nbt染色工作液对细胞进行染色,分析复合支架诱导bmscs的碱性磷酸酶表达,评估复合支架对细胞成骨的影响。
110.结果分析:如图4所示,两组均有紫色显色。与对比例1相比,实施例3的染色的细胞颜色更深,说明早期bmscs的碱性磷酸酶表达量在实施例3支架上要高于对比例。结果表明,含aptes-m2s的支架能诱导bmscs中碱性磷酸酶活性的上调,具有较好的成骨诱导能力。
111.试验例5
112.成骨特异性基质蛋白主要包括碱性磷酸酶(alp)、骨唾液蛋白(bsp)、骨钙素(ocn)、骨桥蛋白(opn)、i型胶原(col-1)。成骨细胞表型是分两个阶段特异性获得的。在第一阶段,细胞增殖并且基质成熟。与骨细胞表型有关的特定蛋白质,例如在第10到15天的细胞增殖和基质成熟过程中检测到碱性磷酸酶(alp);在第二阶段基质矿化并表达成骨后期标志物,比如10
–
15天至25
–
30天表达骨钙蛋白(ocn)最后,多种合成代谢信号通路积极参与控制骨形成,例如bmp,wnt和runx2通路。
113.碱性磷酸酶(alp)活性是最广泛认可的成骨细胞活性标记。它是成骨细胞表型和成骨细胞分化的典型蛋白质产物。alp由在活性位点含锌的同型二聚金属酶组成,alp水解多种磷酸盐化合物(例如atp),将产物(特别是无机磷酸盐)释放到细胞外基质中,影响pi稳态。细胞外基质中还含有其他钙依赖性蛋白,基质囊泡利用pi引发细胞外基质钙沉积物的晶体成核,从而导致羟基磷灰石的形成。通常,alp活性的出现代表成骨细胞生成的早期表型标记。
114.骨唾液蛋白(bsp)在alp表达后出现,位于矿化基质中,可以在体外促进羟磷灰石矿化的成核作用,并增加钙的结合及钙结节的形成。骨钙素(ocn)出现在成骨细胞分化的末期,可以与ca
2+
结合以调节钙离子稳态和骨骼矿化。ocn缺陷小鼠的骨形成甚至增加,暗示ocn是晚期成骨细胞标志物,但并不代表骨矿化程度。bsp和ocn的表达分别代表成骨细胞分化的中晚期。骨桥蛋白(opn)是成骨细胞和破骨细胞产生的骨基质中较丰富的非胶原蛋白之一,可以有效刺激成熟破骨细胞的破骨细胞生成和吸收活性。此外,i型胶原(col-1)是一种细胞外基质蛋白,可刺激成骨细胞粘附和分化。
115.间充质干细胞的成骨分化受多种转录因子的调节,例如runt相关转录因子2/核心结合因子α1(runx2/cbfa1)和osterix(osx)。runx2/cbfa1和osx对于调节负责成骨特异性基质蛋白(包括alp,col-1,bsp,ocn,opn)基因的表达至关重要,并最终刺激骨骼结节矿化。
116.转录因子核心结合因子α1(cbfa1)对胚胎形成过程中的骨形成至关重要,并且是骨分化的关键介体。最近的研究表明,cbfa1的表达与成骨细胞从增生表型向分化表型的转变有关。然而,成骨细胞谱系细胞中cbfa1的过度表达并不一定会导致成年骨骼中骨形成的实质性增加,但在体外可以促进破骨细胞的分化,并且在体内可以通过增加rankl表达促进骨吸收。
117.与runt相关的转录因子2(runx2)是成骨细胞表型的中央控制基因。runx2是一种重要的成骨转录因子,可以与成骨基因启动子区域的成骨细胞特异性顺式作用元件(ose)2结合。有证据表明runx2在成骨细胞分化中的重要性已得到证明,runx2基因的一个拷贝被破坏会导致颅骨发育不良,而小鼠内runx2基因的敲除会阻止成骨细胞的发育。
118.将大鼠bmscs种植在实施例3和对比例1的灭菌支架(n=3)上,将bmscs与复合材料共培养14天后,使用quantitect sybr green pcr试剂盒,根据试剂盒的说明,通过实时rt-qpcr,检测col-1、ocn、opn、runx-2和alp这5种比较有代表性的成骨分化标志基因的表达,评估复合支架对细胞成骨的影响。
119.结果分析:由图5可见,14天时,细胞在实施例3支架上的成骨基因表达量明显高于对比例1的,这说明实施例3支架中含有的aptes-m2s可以明显的促进干细胞成骨分化。
120.上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
