用于在肿瘤治疗中使用的pd-l1反义寡核苷酸
技术领域
1.本发明涉及由与编码pd-l1的seq id no.1杂交的10至20个核苷酸组成的寡核苷酸,其中寡核苷酸与seq id no.1的特异性区域杂交并且寡核苷酸具有本质上减少的潜在脱靶结合位点数,从而导致脱靶效应风险显著降低。此外,本发明涉及包含该寡核苷酸和药物可用的赋形剂的药物组合物。
背景技术:
2.在最近数十年的癌症研究期间,显而易见的是免疫系统对于引起和释放有效抗肿瘤反应是必需的。因此,需要将它整合到常见癌症疗法中。然而,癌细胞发展出了绕过抗肿瘤免疫应答的机制,例如,通过下调hla分子,从而导致抗原递呈受损,通过分泌抑制性可溶性介体,如il-10或腺苷酸,或者通过表达t细胞抑制配体。
3.在抗原递呈细胞和癌细胞表面上表达的最显著的抑制性配体是程序化细胞死亡-配体1和2(pd-l1/pd-l2)。程序化细胞死亡-配体1(pd-l1),也称为分化簇274(cd274)或者b7同源物1(b7-h1),是在人中通过cd274基因编码的蛋白。尽管pd-l2(b7-dc或cd273)主要在专职性抗原递呈细胞(如b细胞和树突状细胞)上表达,pd-l1在非淋巴样细胞,如实质细胞、病毒感染的细胞和肿瘤细胞以及在其他免疫细胞上表达。两种配体与外周中的一些免疫细胞,如激活的t细胞、b细胞、自然杀伤细胞和骨髓细胞上表达的它们的受体程序化细胞死亡-1(pd-1)相互作用。
4.在人中,pd-1编码基因(pdcd1)的遗传改变与对一些自体免疫性疾病,如全身性红斑狼疮、1型糖尿病、多发性硬化、类风湿性关节炎、格拉夫病和关节强硬性脊椎炎的敏感性提高有关。然而,不同于其他负免疫调节因子,pd-1缺陷特异性并且仅影响抗原特异性自体免疫反应,而其他负调节因子的缺陷导致全身性、非抗原特异性自体免疫表型。
5.直到目前,通过单克隆抗体或通过pd-1表达的遗传操纵对pd-1/pd-l1相互作用的阻断导致了提高的肿瘤根除。此外,临床数据表明肿瘤中提高的pd-l1表达与不同癌症患者的不良存活预后相关。这些结果导致靶向pd-1或pd-l1的一些不同的完全人源化单克隆抗体的开发。那些抗体的应用显示了在(例如)非小细胞肺癌、黑素瘤、肾细胞癌和霍奇金淋巴瘤的临床试验中的在人中的阳性反应率,以及患者亚组中的药物相关不良事件。尽管如此,pd-1通路的治疗性阻断是目前临床中用于免疫抗肿瘤疗法的最强大的靶标。
6.然而,大部分癌症患者(》70%)对使用单克隆抗体疗法的pd-1或pd-l1的治疗性阻断反应不良。这些数据表明了为了改善抗肿瘤免疫疗法,使用可能具有加和和/或协同作用的阻断其他负调节因子或激活正调节因子的试剂的获得组合疗法的重要性。在mrna水平上靶向pd-l1表达的反义寡核苷酸的应用与靶向其他已知的负(例如,lag-3;tim-3;2b4;cd160)或正(例如,cd137;cd40)免疫调控通路的疗法组合可以比单独靶向pd-1/pd-l1通路提供更好的治疗效力。一些研究表明了癌症患者血清中pd-l1的免疫抑制性可溶性形式(spd-l1)的存在,这与疾病严重性以及不利的患者存活结局相关。因此,很可能的是不可以在全身水平上通过常规抗pd-l1单克隆抗体完全捕获pd-l1的可溶性形式。
7.此外,抗体的分子尺寸巨大,并因此可能不能触及在致密且包装的组织上表达的靶标,如对于多种不同肿瘤的情况。因此,尽管靶向pd-l1似乎是开发和改善新型抗不同癌症的免疫疗法的有前景的方法,但是尚未发现实现它的令人满意的解决方案。因此,在科学和医学上,仍对于降低或抑制pd-l1表达和/或活性的治疗剂存在高度需要。因此,对于不同癌症的新型免疫疗法的开发和改善,靶标表达的抑制可以是比常规抗体疗法更有前景的方法。目前,两种竞争性技术主要用于mrna表达的特异性抑制:反义寡核苷酸和sirna。
8.由于其双链性质,sirna不会单独跨过细胞膜并且对于其体外和体内活性需要递送系统。尽管存在将sirna有效体内递送至肝细胞的sirna递送系统,但是目前尚无可以将sirna以足够效力体内递送至肝外组织,如肿瘤的系统。因此,目前靶向pd-l1的sirna方法限制于离体方法,例如,用于树突状细胞-基肿瘤疫苗的产生。对于反义寡核苷酸,通常在使用转染试剂或电穿孔转染后确定细胞培养物中的效力。针对pd-l1的反义方法描述于,例如,wo 2006/042237或wo 2016/057933,或者描述于mazanet等人,j.immunol.169(2002)3581-3588中。此外,最近发现通过所谓的第三代化学,如2',4'-lna(参见,例如,wo 2014/154843 a1)或者约束的乙基桥核酸(c-et)修饰的反义寡核苷酸可以在无递送系统的情况下体外和体内进入细胞以实现靶向下调。另外,已作为pd-l1抑制剂测试了双-链rna分子(参见wo 2011/127180)和包含通过它们的5'端连接的两种反义构建体的所谓的“第三代反义化合物”(参见wo 2016/138278)。
9.然而,在现有技术中描述的一些方法中,仅实现了中等靶向抑制水平,并且对于有效靶向抑制需要相对高浓度的寡核苷酸。例如,在us 8,563,528中,10μm的浓度导致产生了仅70%的靶向抑制。在无转染试剂的情况下,第三代寡核苷酸的ic
50
值通常在300至600nm的范围内(zhang等人gene therapy(2011)18,326-333)。在体内全身施用后,仅可以在相关靶组织中实现相对低的寡核苷酸浓度。因此,在低浓度实现高最大靶向抑制的反义寡核苷酸将明显导致产生提高的治疗效果。wo 2018/065589 a1和wo 2017/157899 a1描述了第三代反义寡核苷酸,其显示将pd-l1表达的抑制作为开发和改善对于不同癌症的新型免疫疗法的方法。
10.然而,仍需要改善的寡核苷酸,具体地在与靶标区的结合中具有提高的特异性并因此具有显著降低的副作用的反义寡核苷酸,从而尤其对于肿瘤疾病的有效预防和/或治疗中的使用,导致了降低的毒性。
技术实现要素:
11.本发明涉及包含与编码pd-l1的seq id no.1(grch38_9_5447492_5473576)杂交的10至20个核苷酸或者由所述核苷酸组成的寡核苷酸,其中寡核苷酸在seq id no.1的位置15400至位置22850的区域内或者在seq id no.1的位置3100至位置19500的区域内杂交。不进行进一步选择,存在以下可能:寡核苷酸不仅结合至预期靶标序列,而且还结合至显示出特定序列互补性的其他序列,从而导致脱靶效应风险提高。选择本发明的寡核苷酸以强烈降低该风险。
12.可选地,本发明的寡核苷酸的确以零错配仅结合至靶标rna。不存在其中寡核苷酸可以以零错配或一个错配结合的脱靶rna,并且存在其中寡核苷酸可以以两个错配结合的最多20个脱靶。
13.本发明的寡核苷酸包含(例如)一个或多个修饰的核苷酸。寡核苷酸包括例如lna、c-et、ena、聚环氧烷-、2'-氟-、2'-o-甲氧基-、fana和/或2'-o-甲基修饰的核苷酸。所述修饰的核苷酸位于(例如)寡核苷酸的5'-或3'-末端或者5'-和3'-末端。
14.本发明的寡核苷酸包括例如选自下列的序列:seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6、seq id no.7、seq id no.8、seq id no.9、seq id no.10、seq id no.11、seq id no.12以及它们的组合,或者本发明的寡核苷酸包括例如选自下列的序列:seq id no.13、seq id no.14、seq id no.15、seq id no.16、seq id no.17、seq id no.18、seq id no.19、seq id no.20、seq id no.21、seq id no.22、seq id no.23、seq id no.24、seq id no.25、seq id no.26、seq id no.27、seq id no.28、seq id no.29、seq id no.30、seq id no.31、seq id no.32、seq id no.33、seq id no.34、seq id no.35、seq id no.36、seq id no.37、seq id no.38、seq id no.39、seq id no.40、seq id no.41、seq id no.42、seq id no.43、seq id no.44、seq id no.45、seq id no.46、seq id no.47、seq id no.48、seq id no.49、seq id no.50、seq id no.51、seq id no.52、seq id no.53、seq id no.54、seq id no.55、seq id no.56、seq id no.57、seq id no.58、seq id no.59、seq id no.60、seq id no.61、seq id no.62、seq id no.63、seq id no.64、seq id no.65、seq id no.66、seq id no.67、seq id no.68、seq id no.69、seq id no.70、seq id no.71、seq id no.72、seq id no.73、seq id no.74、seq id no.75、seq id no.76以及它们的组合。
15.作为另外一种选择,本发明的寡核苷酸包括选自下列的序列:seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6、seq id no.7、seq id no.8、seq id no.9、seq id no.10、seq id no.11、seq id no.12、seq id no.13、seq id no.14、seq id no.15、seq id no.16、seq id no.17、seq id no.18、seq id no.19、seq id no.20、seq id no.21、seq id no.22、seq id no.23、seq id no.24、seq id no.25、seq id no.26、seq id no.27、seq id no.28、seq id no.29、seq id no.30、seq id no.31、seq id no.32、seq id no.33、seq id no.34、seq id no.35、seq id no.36、seq id no.37、seq id no.38、seq id no.39、seq id no.40、seq id no.41、seq id no.42、seq id no.43、seq id no.44、seq id no.45、seq id no.46、seq id no.47、seq id no.48、seq id no.49、seq id no.50、seq id no.51、seq id no.52、seq id no.53、seq id no.54、seq id no.55、seq id no.56、seq id no.57、seq id no.58、seq id no.59、seq id no.60、seq id no.61、seq id no.62、seq id no.63、seq id no.64、seq id no.65、seq id no.66、seq id no.67、seq id no.68、seq id no.69、seq id no.70、seq id no.71、seq id no.72、seq id no.73、seq id no.74、seq id no.75、seq id no.76以及它们的组合。
16.本发明的寡核苷酸例如选自表1或表2的寡核苷酸以及它们的组合。本发明还涉及包含本发明的寡核苷酸和药物可用的赋形剂的药物组合物。
17.例如,在选自恶性肿瘤和良性肿瘤的列表的疾病或病症的预防和/或治疗方法中使用了本发明的寡核苷酸、本发明的药物组合物或它们的组合。例如,所述肿瘤选自:实体瘤、血源肿瘤、白血病、肿瘤转移、血管瘤、听神经瘤、纤维神经瘤、沙眼、脓性肉芽肿、银屑病、星形细胞瘤、胚细胞瘤、尤因氏瘤、颅咽管瘤、室管膜瘤、成神经管细胞瘤、神经胶质瘤、成血管细胞瘤、霍奇金淋巴瘤、间皮瘤、成神经细胞瘤、非霍奇金淋巴瘤、松果体瘤、成视网
id no.1所示的pd-l1(grch38_9_5447492_5473576)的前体mrna序列杂交并且分别抑制pd-l1的表达和活性的反义寡核苷酸。seq id no.1的前体mrna包含pd-l1的外显子和内含子。本发明的寡核苷酸与seq id no.1的外显子区或内含子区杂交并且以非常靶向特异性的方式杂交。因此,本发明的寡核苷酸代表了用于在预防和/或治疗病症的方法中使用的所关心且高效的工具,其中由于寡核苷酸具有极低脱靶效应,并因此具有显著降低的副作用和显著降低的毒性,因此分别提高了所述pd-l1的表达和活性。
27.本发明的寡核苷酸在seq id no.1的位置15400至位置22850的区域内或者在seq id no.1的位置3100至位置19500的区域内杂交,其中所述区域包含了所述区域的起点和终点,即位置3100、15400、19500和22850。
28.本发明的寡核苷酸具有抑制剂功能,即它分别抑制pd-l1的转录和表达。根据本发明的抑制包含与未施用寡核苷酸,如与pd-l1杂交的反义核苷酸的细胞相比,pd-l1的转录和表达分别的任何水平的减小。
29.本发明的具有n个核苷酸长度的寡核苷酸不以100%序列互补性结合至任何脱靶核苷酸序列(即寡核苷酸与任何脱靶核苷酸序列具有零错配),它也不以((n-1)/n*100)%序列互补性结合至任何脱靶核苷酸序列(即寡核苷酸与任何脱靶核苷酸序列具有一个错配)。本发明的寡核苷酸仅以((n-2)/n*100)%序列互补性结合至非常有限数目的脱靶核苷酸序列(即寡核苷酸与各自脱靶核苷酸序列具有两个错配)。因此,与和seq id no.1的pd-l1前体mrna杂交,但是不满足这些条件的寡核苷酸相比,满足这些条件的本发明的寡核苷酸具有显著降低的诱导脱靶效应的风险。本发明的寡核苷酸(例如)与seq id no.1的位置15400至位置22850的区域或者与seq id no.1的位置3100至位置19500的区域杂交。与这些区域之一杂交,但不满足上述与根据本发明的错配有关的严格性条件的寡核苷酸不存在与本发明的寡核苷酸相同的显著降低的诱导脱靶效应的风险。以((n-2)/n*100)%的序列互补性结合至脱靶核苷酸序列的本发明的寡核苷酸的脱靶位点数限制在分别最多5、最多10、最多15、最多20、最多25、最多30、最多35或最多40个脱靶结合和效应。
30.脱靶效应是不同于且不位于其预期位置和/或生物靶标的寡核苷酸的生物活性。脱靶效应包含(例如)寡核苷酸,如反义寡核苷酸(aso)与所述核酸序列的不同位置或者不同靶标核酸序列的结合。脱靶效应是故意或非故意的并且具有(例如)生理学woqu和/或生物化学影响,或者是沉默的,即对细胞、组织、器官和/或生物不具有任何或具有至少不可测量的影响。例如,它有助于副作用,如毒性。
31.与sirna相比,反义寡核苷酸具有显著优势。可以在不使用转染试剂的情况下体外转染反义寡核苷酸,并因此所述转染比使用对于sirna的转染所必须的转染试剂的转染相比,所述转染更接近于体内状况。反义寡核苷酸的体内全身施用在不同组织中是可能的,然而sirna的体内施用取决于在肝脏中的递送系统,如galnac。此外,反义寡核苷酸比sirna更短,并因此在合成和在向细胞中的吸收中不太复杂。sirna经常显示出同样可以起始sirna的随从链的脱靶效应。随从链risc负荷是rnai药物特别关心的,因为随从链可以将rnai的活性导向至非故意靶标,从而导致毒副作用(参见chackalamannil,rotella,ward,comprehensive medicinal chemistry iii elsevier,03.06.2017)。反义寡核苷酸不包含随从链。
32.以下,将更详细地描述本发明的要素。通过具体实施方式列出了这些元素,然而,
应理解它们可以以任何方式并以任何数目组合以产生其他实施方式。不应将多种所述的实例和实施方式视为将本发明仅限制在明确描述的实施方式。应理解这种描述支持并涵盖了将明确描述的实施方式与任何数目的所公开的元素组合的实施方式。此外,应认为除非上下文另外说明,否则通过本发明申请的描述公开了在本发明申请中所有所述元素的任何排列与组合。
33.在整个说明书和权利要求中,除非上下文另外要求,否则单词“包含”和变化形式将被理解为表示对所述成员、整数或步骤或成员、整数或步骤的组的包含,但不排除任何其他成员、整数或步骤或成员、整数或步骤的组。除非在本文中另外说明或明显与上下文矛盾,否则在描述本发明的上下文中(特别是在权利要求的上下文中)使用的术语“一个”和“所述”及类似参考将被视为涵盖了单数和复数两种形式。本文中数值范围的列举仅旨在用作分别表示属于该范围内的每个单独数值的简写方法。除非本文另外说明,否则每个单独的值都被并入说明书中,就好像将其在本文中单独引用一样。除非本文另外指出或明显与上下文矛盾,否则本文描述的所有方法可以以任何适合的顺序执行。除非另外主张,否则本文所提供的任何和全部实施例或示例性语言(例如,“如”,“例如”)的使用仅旨在更好地描述本发明并且不对本发明的范围造成限制。本说明书中的语言不应视为表示对本发明的实践所必需的任何未主张的元素。
34.例如,本发明的寡核苷酸是反义寡核苷酸(aso),其由10至25个核苷酸、12至22个核苷酸、15至20个核苷酸、16至18个核苷酸或者15至17核苷酸组成或包含它们。例如,寡核苷酸由10、11、12、13、14、15、16、17、18、19、20或25个核苷酸组成或者包含它们。本发明的寡核苷酸包含至少一种修饰的核苷酸。例如,所述修饰的核苷酸是桥核苷酸,如锁核酸(lna,例如,2',4'-lna)、cet、ena、聚环氧烷-、2'-氟-、2'-o-甲氧基-、fana和/或2'-o-甲基修饰的核苷酸以及它们的组合。在一些实施方式中,本发明的寡核苷酸包含具有相同或不同修饰的核苷酸。在一些实施方式中,本发明的寡核苷酸包含修饰的磷酸酯主链,其中所述磷酸酯是(例如)硫代磷酸酯。
35.本发明的寡核苷酸在寡核苷酸的3'-和/或5'-端和/或在寡核苷酸内的任意位置包含一个或多个修饰的核苷酸,其中修饰的核苷酸以1、2、3、4、5或6个修饰的核苷酸行排列,或者修饰的核苷酸与一个或多个未修饰的核苷酸组合。下表1和2提供了本发明的寡核苷酸的实施方式,其包含通过(+)表示的修饰的核苷酸,例如lna和通过(*)表示的硫代磷酸酯(pto)并且以第一核苷酸结合至通过(
§
)表示的grch38_9:5447492-5473576中的给定位置结合。分别由表1和2所示的序列组成或包含它们的寡核苷酸可以包含任何其他修饰的核苷酸和任何其他修饰和未修饰的核苷酸的组合。表1的寡核苷酸与人pd-l1的前体mrna的外显子区杂交:
36.[0037][0038]
表1:与(例如)seq id no.1所示的人pd-l1前体mrna的外显子区杂交的反义寡核苷酸的列表;neg1是代表不与seq id no.1所示的pd-l1杂交的阴性对照的寡核苷酸。“h”表示“人外显子区”并且表示主要与人pd-l1的前体mrna的外显子区杂交的寡核苷酸。
[0039]
表2的寡核苷酸与人pd-l1的前体mrna的内含子区杂交:
[0040]
[0041]
[0042]
[0043][0044]
表2:与人pd-l1前体mrna的内含子区杂交的反义寡核苷酸的列表;neg1(seq id no.77)和r01011(seq id no.78)分别是代表不与seq id no.1所示的pd-l1杂交的阴性对照的寡核苷酸。“hi”表示与内含子杂交的寡核苷酸。
[0045]
表1和表2提供了本发明的寡核苷酸的反义序列5'-3',其包含核苷酸的不同修饰,如lna修饰。在这些表中,通过“+”表示lna修饰的核苷酸并且通过“*”表示硫代磷酸酯。
[0046]
本发明的寡核苷酸抑制了(例如)至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、92%、94%、95%、96%、97%、98%、99%或100%的pd-l1的表达,如(例如)人、大鼠或鼠科pd-l1的表达。
[0047]
本发明的寡核苷酸以纳摩尔或微摩尔浓度抑制pd-l1的表达,例如,以0.1、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900或950nm或者1、10或100μm的浓度。
[0048]
例如,以1、3、5、9、10、15、27、30、40、50、75、82、100、250、300、500或740nm或者1、2.2、3、5、6.6或10μm的浓度使用本发明的寡核苷酸。
[0049]
例如,本发明的pd-l1寡核苷酸施用一次或反复施用,例如,每12h,每24h,每48h施用数周,数月或数年,或者将其每周、每两周、每3周或每月施用。
[0050]
本发明还涉及包含本发明的寡核苷酸和(例如)药物可用的载体、赋形剂和/或稀释剂的药物组合物。在一些实施方式中,所述药物组合物还包含化疗剂、另一种寡核苷酸、抗体、小分子或其组合。
[0051]
例如,本发明的寡核苷酸或药物组合物用于在预防和/或治疗病症的方法中使用。在一些实施方式中,将本发明的寡核苷酸或药物组合物在预防和/或治疗病症的方法中的使用与放射疗法结合。放射疗法还可以与化疗(例如,铂、吉西他滨)组合。例如,病症的特征在于pd-l1失衡,即与正常、健康细胞、组织、器官或受试者中的水平相比,pd-l1水平升高。例如,分别通过提高pd-l1的表达和活性来提高pd-l1水平。可以通过本领域技术人员已知的任何标准方法,如免疫组织化学、免疫印迹、定量实时pcr或quantigene测定来测量pd-l1水平。
[0052]
局部或全身,例如,口服、舌下、鼻部、皮下、静脉内、腹膜内、肌内、肿瘤内、鞘内、透皮和/或直肠施用本发明的寡核苷酸或药物组合物。其他施用途径包括但不限于电穿孔、表
皮、压印至皮肤(impression into skin)、动脉内、关节内、颅内、皮内、病灶内、肌内、鼻内、眼内、鞘内、房内、腹膜内、前列腺内、肺内、脊柱内、膀胱内、放置于体腔内、鼻肺吸入(例如,通过吸入或吹入粉末或气溶胶,包括通过喷雾器)、皮下、局部(包括眼科和至粘膜,包括阴道和直肠递送)或透皮施用。作为另外一种选择或组合,施用离体处理的免疫细胞。单独或与本发明的另一种寡核苷酸组合并且可选地与另一种化合物,如非本发明的另一种寡核苷酸、抗体或其片段,如fab片段、hera融合蛋白、配体阱、纳米抗体、bite、小分子和/或化学治疗剂(例如,铂、吉西他滨)组合施用寡核苷酸。在一些实施方式中,另一种寡核苷酸(即不是本发明的一部分)、抗体和/或小分子在预防和/或治疗自体免疫病中有效,例如,自体免疫性关节炎或胃肠性自体免疫疾病,如炎症性肠病(ibd)或结肠炎、免疫病症,例如,由于慢性病毒感染,如hiv感染所造成的免疫衰竭、心血管病症、炎性病症,例如,慢性气道炎症、细菌、病毒和/或真菌感染,例如,败血病或牛型结核分枝杆菌(mycobacterium bovis)感染、肝脏病症、慢性肾病、精神病症(例如,精神分裂症、躁郁症、阿尔茨海默病)和/或癌症。例如,在预防和/或治疗实体瘤或血液学肿瘤的方法中使用本发明的寡核苷酸或药物组合物。通过使用本发明的寡核苷酸或药物组合物可预防和/或可治疗的癌症的实例为实体瘤、血源肿瘤、白血病、肿瘤转移、血管瘤、听神经瘤、纤维神经瘤、沙眼、脓性肉芽肿、银屑病、星形细胞瘤、胚细胞瘤、尤因氏瘤、颅咽管瘤、室管膜瘤、成神经管细胞瘤、神经胶质瘤、成血管细胞瘤、霍奇金淋巴瘤、间皮瘤、成神经细胞瘤、非霍奇金氏淋巴瘤、松果体瘤、成视网膜细胞瘤、肉瘤、精原细胞瘤和韦尔姆斯氏瘤、胆管癌、膀胱癌、脑肿瘤、乳腺癌、支气管癌、肾癌、宫颈癌、绒毛膜癌、脉络膜癌、囊腺癌、胚胎癌、上皮癌、食道癌、宫颈癌、结肠癌、结肠直肠癌、子宫内膜癌、胆囊癌、胃癌、头癌、肝癌、肺癌、髓样癌、颈癌、非小细胞支气管/肺癌、卵巢癌、胰癌、乳头状癌、乳头状腺癌、前列腺癌、小肠癌、前列腺癌、直肠癌、肾细胞癌、皮肤癌、小细胞支气管/肺癌、鳞状细胞癌、皮脂腺癌、睾丸癌和子宫癌。
[0053]
本发明的重大优势在于即使全身施用寡核苷酸,本发明的寡核苷酸在肿瘤中是可检测且有效的。
[0054]
在一些实施方式中,共同,在相同时间点,例如,在药物组合物中施用或者分开或以交错间隔施用本发明的两种或更多种寡核苷酸。在其他实施方式中,将本发明的一个或多个寡核苷酸与另一种化合物,如另一种寡核苷酸(即不是本发明的一部分)、抗体、小分子和/或化学治疗剂在相同时间点,例如,在药物组合物中或者分开或以交错间隔施用本发明的一种或多种寡核苷酸。在这些组合的一些实施方式中,免疫抑制-恢复寡核苷酸分别抑制免疫抑制因子的表达和活性,并且另一种寡核苷酸(即不是本发明的一部分)、抗体或其片段,如fab片段、hera融合蛋白、配体阱、纳米抗体、bite和/或小分子抑制(拮抗)或刺激(激动)相同和/或另一种免疫抑制因子。免疫抑制因子和/或免疫刺激因子和/或免疫刺激因子。例如,免疫抑制因子选自:ido1、ido2、ctla-4、pd-1、pd-l1、lag-3、vista、a2ar、cd39、cd73、stat3、tdo2、tim-3、tigit、tgf-beta、btla、mica、nkg2a、kir、cd160、chop、xbp1以及它们的组合。例如,免疫刺激因子选自4-1bb、ox40、kir、gitr、cd27、2b4以及它们的组合。
[0055]
例如,分别将寡核苷酸和药物组合物配制为分别处于胶囊、片剂和丸剂等形式的剂量单位,其含有例如选自下列的化合物:微晶纤维素、胶、明胶、淀粉、乳糖、硬脂酸酯、甜味剂、调味剂以及它们的组合。对于胶囊,剂量单位含有(例如)液体载体,如脂肪油剂。可选地,糖或肠溶剂的涂层是剂量单位的一部分。
[0056]
对于肠胃外、皮下、皮内或局部施用,寡核苷酸和/或药物组合物包括例如无菌稀释剂、缓冲剂、毒性调节剂和抗菌剂。在优选的实施方式中,与保护抵抗降解和从身体直接消除的载体,包括具有控释性质的植入物或微胶囊一起制备寡核苷酸或药物组合物。对于静脉内施用,载体是(例如)生理盐水或磷酸盐缓冲盐水。用于口服施用的寡核苷酸和/或包含该寡核苷酸的药物组合物包括例如粉末剂或颗粒剂、微粒剂、纳米颗粒、水或非水媒介中的混悬液或溶液、胶囊剂、凝胶胶囊剂、囊剂、片剂或微片剂。用于肠胃外、鞘内、房内或心室内施用的寡核苷酸和/或包含该寡核苷酸的药物组合物包括例如可选地含有缓冲液、稀释剂和/或其他适合的添加剂,如渗透增强剂、载体化合物和/或其他药物可用的载体或赋形剂的无菌水溶液。
[0057]
药物可用的载体是(例如)液体或固体,并且例如,当与核酸和给定药物组合物的另一种组分混合时,以考虑计划施用方式选择,以提供所期望的整体性、一致性等。典型的药物可用的载体包括但不限于结合剂(例如,预胶凝玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素等);填充剂(例如,乳糖及其他糖、微晶纤维素、果胶、明胶、硫酸钙、乙基纤维素、聚丙烯酸盐或磷酸氢钙等);润滑剂(例如,硬脂酸镁、滑石、二氧化硅、胶体二氧化硅、硬脂酸、金属硬脂酸盐、氢化植物油、玉米淀粉、聚乙二醇、苯甲酸钠、乙酸钠等);崩解剂(例如,淀粉、淀粉羟基乙酸钠等);或者润湿剂(例如,月桂基硫酸钠等)。在美国专利号4,704,295;4,556,552;4,309,406;和4,309,404中描述了用于口服施用的剂量形式的缓释口服递送系统和/或肠溶衣。佐剂包含在这些短语之下。
[0058]
免疫抑制因子是其表达和/或活性(例如)在细胞、组织、器官或受试者中升高的因子。免疫刺激因子是基于细胞、组织、器官或受试者及其个体状况,其水平在细胞、组织、器官或受试者中升高或降低的因子。
[0059]
与本发明的寡核苷酸或药物组合物组合的抗体是(例如)抗pd-1抗体、抗pd-l1抗体或双重特异性抗体。与本发明的寡核苷酸或药物组合物组合的小分子是(例如)arl67156(oncoimmunology 1:3;2012)或者pom-1(gastroenterology;2010;139(3):1030-1040)。
[0060]
本发明的受试者是(例如)哺乳动物、鸟或鱼。哺乳动物包括例如马、狗、猪、猫或灵长类(例如,猴、黑猩猩或狐猴)。啮齿类包括例如大鼠、兔、小鼠、松鼠或豚鼠。
[0061]
实施例
[0062]
以下实施例将用于进一步说明本发明,然而,同时不构成对其的任何限制。相反,将清楚地理解本发明的范围是指在阅读本文中的描述后,在不背离本发明的精神的情况下,多种其他实施方式、其修改和等价形式可以将它们呈现给本领域技术人员。
[0063]
实施例1:pd-l1反义寡核苷酸在人癌细胞系中的单一剂量效力筛选
[0064]
对于对人pd-l1具有特异性的反义寡核苷酸的设计,使用了序列grch38_9_5447492_5473576(seq id no:1)。根据内部标准,设计了15、16和17聚体,其将注意力主要集中在对于靶标基因的特异性。将neg1(例如,wo2014154843 a1中所描述的)用作对照寡核苷酸。
[0065]
为了研究计算机设计的pd-l1反义寡核苷酸的敲低效力,在人癌细胞系hdlm-2和mda-mb-231中进行了效力筛选。因此,在不使用转染试剂的情况下,以2μm(hdlm-2)或10μm(mda-mb-231)浓度,用各自的反义寡核苷酸或对照寡核苷酸处理细胞3天。在3天处理期后裂解细胞,使用quantigene singleplex测定(thermofisher)分析pd-l1和hprt1mrna表达。
将pd-l1表达值归一化至hprt1表达值并且相对于空对照治疗的细胞设置。图1和表1中显示了结果。8个所测试的反义寡核苷酸在hdlm-2细胞中具有》80%的敲低效力(通过《0.2的相对pd-l1 mrna表达表示)(图1a)。4个所测试的反义寡核苷酸在mda-mb-231细胞中具有》70%的敲低效力(通过《0.3的相对pd-l1 mrna表达表示)(图1b)。
[0066]
下表3和表4显示了这些寡核苷酸的抑制作用:
[0067]
[0068][0069]
表3:与空对照处理的细胞相比,hdlm-2细胞中平均pd-l1表达值的列表。将表达值归一化至hprt1。
[0070]
[0071][0072]
表4:与空对照处理的细胞相比,mda-mb-231细胞中平均pd-l1表达值的列表。将表达值归一化至hprt1。
[0073]
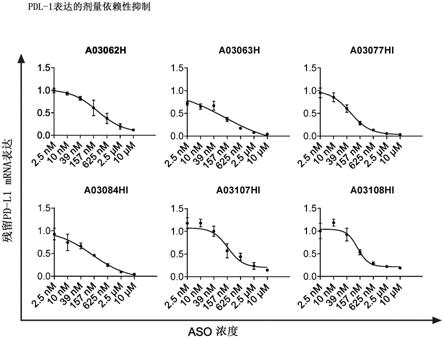
实施例2:剂量反应关系的研究和所选的pd-l1反义寡核苷酸的ic
50
值的确定
[0074]
在hdlm-2细胞中研究了通过pd-l1反义寡核苷酸的pd-l1 mrna表达的剂量依赖性
敲低并且计算了各自的id
50
值。因此,在不使用转染试剂的情况下,在以下浓度:10μm、2.5μm、625nm、157nm、39nm、10nm、2.5nm的各自反义寡核苷酸处理hdlm-2细胞3天。在3天处理期后裂解细胞,使用quantigene singleplex测定(thermofisher)分析pd-l1和hprt1 mrna表达。将pd-l1表达值归一化至hprt1表达值并且相对于空对照治疗的细胞设置。观察了使用所有所测试的pd-l1反义寡核苷酸对pd-l1 mrna的剂量依赖性敲低(图2,表5),其中ic
50
值在下表5中所示的纳摩尔范围内:
[0075][0076]
表5:所选的pd-l1反义寡核苷酸的ic
50
值和敲低效力
[0077]
实施例3:所选的反义寡核苷酸的肝脏毒性的体内评价
[0078]
为了确定反义寡核苷酸a03008h和a03028(wo 2018/065589 a1中所描述)以及本发明的反义寡核苷酸a03063h(seq id no.7)和a03108hi(seq id no.50)的肝脏毒性能力,通过反复注射(20mg/kg)各自反义寡核苷酸处理小鼠。在不同时间点确定丙氨酸转氨酶的血清水平。如图3所示,使用wo 2018/065589 a1的两个所测试的反义寡核苷酸的处理导致alt升高,并且必须处死一些处理小鼠。相反,不使用所述两个所测试的反义寡核苷酸的处理导致与媒介物对照相比alt升高。
[0079]
实施例4:潜在脱靶结合位点的研究
[0080]
计算机筛选两个不同的数据库以测试本发明的寡核苷酸的脱靶效应。这些数据库是包含剪接rna序列的refsecrna和包含非剪接rna序列的ensembl。表6和7中所示的寡核苷酸不具有包含零错配,即与脱靶序列100%序列互补(0mm)或者一个错配,即与脱靶序列((n-1)/n*100)%序列互补(1mm)的潜在脱靶结合位点。具有两个错配(即((n-2)/n*100)%序列互补性(2mm))的本发明的寡核苷酸的潜在脱靶位点数限制在最多20(参见表6和7,refseq(基因id),2mm)。图4显示了错配测试的原理。
[0081]
表6和表7显示了本发明的寡核苷酸的错配测试的结果。
[0082][0083]
表6:除靶标基因外,允许0、1或2个错配,对各自pd-l1外显子-结合反义寡核苷酸显示出序列互补性的基因数。
[0084]
[0085][0086]
表7:除靶标基因外,允许0、1或2个错配,对各自pd-l1内含子-结合反义寡核苷酸显示出序列互补性的基因数。
[0087]
实施例5:两种不同细胞系中的剂量依赖性pd-l1蛋白敲低和ic
50
值
[0088]
将两种不540c的癌细胞系用于研究aso a03063h(seq id no.7)和a03108hi(seq id no.50)的pd-l1蛋白敲低效力。因此,在不使用转染试剂(自主转染(gymnotic transfection))的情况下,用不同浓度的所指明的aso处理hdlm-2细胞(人霍奇金淋巴瘤细胞)或者miapaca-2细胞(人胰癌细胞)3天。为了在miapaca-2细胞中诱导pd-l1的表达,在使用aso处理开始后2天,将ifnγ加入至所述细胞。在aso治疗开始后第3天,使用pd-l1特异性抗体通过流式细胞术评价pd-l1蛋白表达。在用处于各自浓度的各自aso处理细胞后,对于hdlm-2(图5a)和miapaca-2细胞(图5b)显示了作为蛋白表达的量度的pd-l1的中值荧光强度(mfi)。表8(hdlm-2细胞)和表9(miapaca-2细胞)显示了各自浓度下的ic
50
值和敲低效力。
[0089][0090]
表8:aso a03063h(seq id no.7)和a03108hi(seq id no.50)在hdlm-2细胞中的ic
50
值。
[0091][0092]
表9:aso a03063h(seq id no.7)和a03108hi(seq id no.50)在miapaca-2细胞中的ic
50
值。
[0093]
实施例6:树突状细胞中的pd-l1蛋白敲低
[0094]
在本文中,研究了pd-l1 aso a03063h(seq id no.7)和a03108hi(seq id no.50)在人树突状细胞(dc)中的敲低效力。因此,在3天规程中产生dc:从周围血单核细胞(pbmc)中纯化出人单核细胞,通过添加白介素-4(il-4)和粒性白细胞-巨噬细胞集落刺激因子(gm-csf)分化成未成熟的dc并且通过添加细胞因子混合物和toll-样受体配体成熟为dc。在dc产生期间,未用aso(空对照)处理、以5μm的最终浓度用对照寡核苷酸(r01011,seq id no.78)或者pd-l1特异性aso a03063h(seq id no.7)或a03108hi(seq id no.50)之一处理细胞。如图6所示,与空对照处理的细胞相比,r01011仅对残留pd-l1蛋白表达具有很小的影响。在强烈对比中,用a03063h或a03108hi处理导致pd-l1蛋白表达减小》90%(由《0.1的残留pd-l1蛋白表达表示)。
[0095]
实施例7:高增殖细胞中pd-l1蛋白敲低的持久性
[0096]
此外,研究了pd-l1 aso处理的高增殖hdlm-2细胞中pd-l1蛋白敲低的持久性。因此,hdlm-2细胞(人霍奇金淋巴瘤细胞)是未处理的(空对照处理的细胞),用最终浓度5μm的对照寡聚neg1(seq id no.77)或者pd-l1特异性aso a03063h(seq id no.7)或a03108hi(seq id no.50)处理的。3天后,严格清洗细胞以除去aso并用细胞增殖染料染色。在清洗掉aso后的第0、3、5、7、10和12天,对于增殖(图7a)和pd-l1表达(图7b,显示为与来自同一天的空对照处理的细胞相比的残留的pd-l1蛋白表达),通过流式细胞术分析细胞。如通过图7a中增殖染料随时间的均匀稀释所示,在清洗掉aso后的第3、5、7、10和12天观察到了hdlm-2细胞的均一、强烈的增殖。未观察到neg1对pd-l1蛋白表达的不利影响。在强烈对比中,用pd-l1特异性aso a03063h或a03108hi的细胞处理导致pd-l1蛋白表达的强烈且持久的减少,其效力在清洗掉aso后长达第7天》50%。
[0097]
结果意外地显示尽管细胞强烈增殖并因此aso快速稀释,但是pd-l1蛋白表达的强抑制对于很多天,即多至7天是可检测的。
