1.本发明涉及海洋生物蛋白肽领域,特别是来源于鲐鱼的高活性抗氧化肽及其制备方法和应用。
背景技术:
2.生物蛋白肽是一类由2~20个氨基酸经过脱水缩合,相对分子质量低于6kda的蛋白酶解中间产物,其具有增强人体免疫力、抗氧化、降血压和抑菌等生物功能。生物蛋白肽的来源广泛,大体可以分为植物蛋白肽和动物蛋白肽。动物源蛋白肽由天然肌肽、海洋生物蛋白肽、乳制品蛋白肽等组成,与陆地生物相比,海洋生物具有多样性、复杂性和特殊性,这就使得海洋生物蛋白肽产生不同于其他蛋白肽的功能特性。海洋生物中鱼类的数量占到相当大的比例,鱼类资源丰富易捕捞,是制备蛋白肽常见的原料,目前海洋生物蛋白肽的制备多来源于低值鱼及其下脚料。
3.鲐鱼系鲭科鲐属,形体较粗壮,在我国主要分布在东海和黄海海域。鲐鱼具有生长迅速、年产量稳定、鱼汛期集中、捕捞难度较小的特点,为我国重要的经济鱼类之一。目前,鲐鱼主要被加工成鱼干、鱼露、鱼粉等低值产品,在深加工利用方面未得到很好的开发。鲐鱼营养较为丰富,主要营养成分为蛋白质和多不饱和脂肪酸,是新型功能食品的优质蛋白原料,具有较大的开发潜力。
技术实现要素:
4.本发明所要解决的第一个技术问题是针对现有技术的现状而提供一种鲐鱼抗氧化肽。
5.本发明所要解决的第二个技术问题是针对现有技术的现状而提供一种上述鲐鱼抗氧化肽的制备方法。
6.本发明所要解决的第三个技术问题是针对现有技术的现状而提供一种上述鲐鱼抗氧化肽的应用。
7.为解决上述第一个技术问题,本发明采用的技术方案为:一种鲐鱼抗氧化肽,其特征在于:该鲐鱼抗氧化肽的氨基酸序列为gln-cys-cys-cys-phe-thr。
8.进一步地,该鲐鱼抗氧化肽具有抗氧化性活性,dpph
·
自由基的清除能力ic
50
为33
±
0.1μg/ml。
9.为解决上述第二个技术问题,本发明还提供一种上述鲐鱼抗氧化肽的制备方法,包括以下步骤:
10.(1)鲐鱼的前处理
11.将洗净的鲐鱼进行去皮、去骨和搅碎处理后吸净血水以获得鲐鱼鱼糜;
12.(2)酶解产物的制备
13.将步骤(1)所得鲐鱼鱼糜用缓冲液配置为悬浊液,加入酸性蛋白酶进行酶解,酶解完毕后收集上清液,即为酶解产物;
14.(3)酶解产物的分离纯化
15.对步骤(2)所得酶解产物通过凝胶柱进行分离纯化。
16.优选地,步骤(2)中所述的缓冲液的ph为2.0~5.0,并使用该缓冲液将步骤(1)所得鲐鱼鱼糜配置成质量浓度为5~15%的悬浊液,加入按底物质量比为0.1~0.3%的酸性蛋白酶,然后在45~55℃下酶解4~6h得到酶解液,最后将酶解液在95-100℃的温度下保温15-25min,冷却后在8000-10000r/min的条件下离心并收集上清液。
17.优选地,步骤(2)中所述的缓冲液的ph为3.0,并使用该缓冲液将步骤(1)所得鲐鱼鱼糜配置成质量浓度为10.65%的悬浊液,再加入按底物质量比为0.21%的酸性蛋白酶,然后于53℃下酶解5h,得到酶解液,最后将酶解液在95℃的温度下保温15min,冷却后在10000r/min的条件下离心并收集上清液。本发明采用旋转正交实验优化酶解条件,确定在底物质量浓度为10.65%、酶浓度为0.21%(相对底物质量)、酶解时间为5h和酶解温度为53℃时,产品抗氧化效果最好且水解度高。
18.优选地,步骤(3)中所述的凝胶柱为sephadex g-15,对所述酶解产物进行分离纯化的具体条件为:洗脱液为纯水,检测波长为220nm,流速为0.2~0.8ml/min。
19.为解决上述第三个技术问题,本发明提供一种鲐鱼抗氧化肽在制备营养强化剂、食品添加剂中的应用。
20.同样为解决上述第三个技术问题,本发明还提供一种鲐鱼抗氧化肽在制备化妆品和日化用品中的应用。
21.与现有技术相比,本发明的优点在于:
22.(1)本发明提供的鲐鱼抗氧化肽的抗氧化活性约为谷胱甘肽的40倍,且有较高的酸、热和消化稳定性;并且该抗氧化肽在中酸性环境抗氧化活性均保持在96%以上;在4、20、40、60、80、100℃下分别保温2h后,抗氧化活性均保持在80%以上;经胃肠模拟消化后仍能保持57.17%的抗氧化活性;
23.(2)本发明采用旋转正交实验优化酶解条件,在多因素控制的酶解反应中,找到最适酶解条件;本发明还采用可控酶解技术与凝胶柱层析技术联用,整个制备过程简单易控、制备效率高,抗氧化肽酶解物得率为93.25%,最高活性分离级分得率为29.01%;
24.(3)该抗氧化肽可以广泛用于食品、保健品、化妆品中。
附图说明
25.图1为本发明中鲐鱼抗氧化肽的ms图谱(ms质谱);
26.图2为本发明中酶解产物凝胶柱分离的色谱图(不同的数字代表不同分离级分);
27.图3为本发明中不同分离级分对羟基自由基清除能力的结果图;
28.图4为本发明中不同分离级分对abts自由基清除能力的结果图;
29.图5为本发明中不同分离级分对dpph自由基清除能力的结果图;
30.图6为本发明中f4分离级分在不同浓度下对dpph自由基清除能力的结果图;
31.图7为本发明中ph对f4分离级分抗氧化能力的影响图;
32.图8为本发明中温度对f4分离级分抗氧化能力的影响图;
33.图9为本发明中胃肠模拟消化处理对f4分离级分抗氧化能力的影响图;
34.图10为本发明中抗氧化肽qcccft在不同浓度下对dpph自由基清除能力的结果图;
35.图11为本发明中酶添加量对dpph自由基清除率和水解度影响的结果图;
36.图12为本发明中酶解时间对dpph自由基清除率和水解度影响的结果图;
37.图13为本发明中酶解温度对dpph自由基清除率和水解度影响的结果图;
38.图14为本发明中底物浓度对dpph自由基清除率和水解度影响的结果图;
39.图15-a为本发明中酶添加量和时间对dpph自由基清除率影响的三维结果图;
40.图15-b为本发明中酶添加量和时间对dpph自由基清除率影响的二维结果图;
41.图16-a为本发明中酶添加量和温度对dpph自由基清除率影响的三维结果图;
42.图16-b为本发明中酶添加量和温度对dpph自由基清除率影响的二维结果图;
43.图17-a为本发明中酶添加量和底物浓度对dpph自由基清除率影响的三维结果图;
44.图17-b为本发明中酶添加量和底物浓度对dpph自由基清除率影响的二维结果图;
45.图18-a为本发明中时间和温度对dpph自由基清除率影响的三维结果图;
46.图18-b为本发明中时间和温度对dpph自由基清除率影响的二维结果图;
47.图19-a为本发明中时间和底物浓度对dpph自由基清除率影响的三维结果图;
48.图19-b为本发明中时间和底物浓度对dpph自由基清除率影响的二维结果图;
49.图20-a为本发明中温度和底物浓度对dpph自由基清除率影响的三维结果图;
50.图20-b为本发明中温度和底物浓度对dpph自由基清除率影响的二维结果图。
具体实施方式
51.以下结合附图实施例对本发明作进一步详细描述。
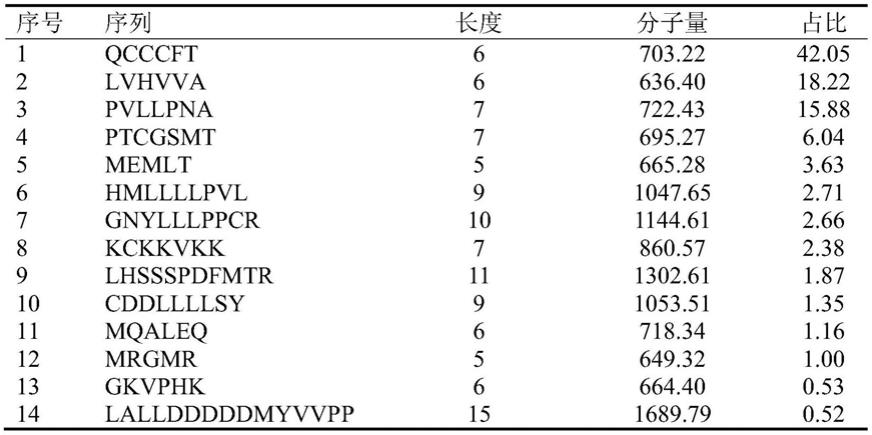
52.实施例1
53.本实施例中鲐鱼抗氧化肽的制备方法包括以下步骤:
54.(1)鲐鱼的前处理
55.将洗净的鲐鱼进行去皮、去骨和搅碎处理后用纱布吸净血水以获得鲐鱼鱼糜;
56.(2)酶解产物的制备
57.将步骤(1)所得鲐鱼鱼糜用ph为2.0的缓冲液配置成质量浓度为5%的悬浊液,再加入0.3%酸性蛋白酶(相对底物质量),于45℃酶解6h,然后将酶解液100℃保温15min灭酶,冷却后在10000r/min的条件下离心15min处理并收集上清,经浓缩冻干即得抗氧化肽酶解产物;
58.(3)酶解产物的分离和抗氧化活性鉴定
59.对步骤(2)所得抗氧化肽酶解产物通过sephadex g-15凝胶柱进行分离,用纯水作为洗脱液,在流速0.2ml/min,检测波长220nm条件下,收集各峰洗脱液,经浓缩冻干制得不同分离级分冻干粉,分别命名为f1~f8,并对其抗氧化活性进行分析比较,得高抗氧化活性分离级分f4;
60.(4)高抗氧化活性分离级分f4序列分析
61.通过lc-ms/ms对步骤(3)所制备的高抗氧化活性分离级分f4进行测定,采用de novo的方法进行序列解析。结果如表1所示,发现高活性分离级分f4中共有14条肽序列,其中含量最丰富的氨基酸序列为qcccft(gln-cys-cys-cys-phe-thr)。
62.表1高活性分离级分f4测序结果
[0063][0064]
实施例2
[0065]
本实施例中鲐鱼抗氧化肽的制备方法包括以下步骤:
[0066]
(1)鲐鱼的前处理
[0067]
将洗净的鲐鱼进行去皮、去骨和搅碎处理后用纱布吸净血水以获得鲐鱼鱼糜;
[0068]
(2)酶解产物的制备
[0069]
将步骤(1)所得鲐鱼鱼糜用ph为3.0的缓冲液配置成质量浓度为10%的悬浊液,再加入0.2%酸性蛋白酶(相对底物质量),于50℃酶解5h,然后将酶解液95℃保温20min灭酶,冷却后在8000r/min的条件下离心15min处理并收集上清,经浓缩冻干即得抗氧化肽酶解产物;
[0070]
(3)酶解产物的分离和抗氧化活性鉴定
[0071]
对步骤(2)所得抗氧化肽酶解产物通过sephadex g-15凝胶柱进行分离,用纯水作为洗脱液,在流速0.8ml/min,检测波长220nm条件下,收集各峰洗脱液,经浓缩冻干制得不同分离级分冻干粉,分别命名为f1~f8,并对其抗氧化活性进行分析比较,得高抗氧化活性分离级分f4;
[0072]
(4)高抗氧化活性分离级分f4序列分析
[0073]
通过lc-ms/ms对步骤(3)所制备的高抗氧化活性分离级分f4进行测定,采用de novo的方法进行序列解析,发现高活性分离级分f4中共有14条肽序列,其中含量最丰富的氨基酸序列为qcccft(gln-cys-cys-cys-phe-thr)。
[0074]
实施例3
[0075]
本实施例中鲐鱼抗氧化肽的制备方法包括以下步骤:
[0076]
(1)鲐鱼的前处理
[0077]
将洗净的鲐鱼进行去皮、去骨和搅碎处理后用纱布吸净血水以获得鲐鱼鱼糜;
[0078]
(2)酶解产物的制备
[0079]
将步骤(1)所得鲐鱼鱼糜用ph3.0的缓冲液配置成质量浓度为15%的悬浊液,再加入0.1%酸性蛋白酶(相对底物质量),于55℃酶解4h,然后将酶解液100℃保温20min灭酶,冷却后在10000r/min的条件下离心15min处理并收集上清,经浓缩冻干即得抗氧化肽酶解产物;
[0080]
(3)酶解产物的分离和抗氧化活性鉴定
[0081]
对步骤(2)所得抗氧化肽酶解产物通过sephadex g-15凝胶柱进行分离,流速0.8ml/min,检测波长220nm,收集各峰洗脱液,经浓缩冻干得不同分离级分冻干粉,分别命名为f1~f8,对其抗氧化活性进行测定,得高抗氧化活性分离级分f4;
[0082]
(4)高抗氧化活性分离级分f4序列分析
[0083]
对步骤(2)所得抗氧化肽酶解产物通过sephadex g-15凝胶柱进行分离,用纯水作为洗脱液,在流速0.8ml/min,检测波长220nm条件下,收集各峰洗脱液,经浓缩冻干制得不同分离级分冻干粉,分别命名为f1~f8,并对其抗氧化活性进行分析比较,得高抗氧化活性分离级分f4。
[0084]
如图1所示,本发明实施例1-3制备的鲐鱼抗氧化肽gln-cys-cys-cys-phe-thr的分子离子峰为[m]
+
703.22m/z,其中438.14为gln-cys-cys-cys-phe-thr带两个电子的质谱碎片,分子质量的计算为703=438*2-57*3-1*2(57为烷基的质量,1为氢的质量)。
[0085]
本发明实施例1-3凝胶柱分离洗脱后的曲线见图2,共8个峰,其中峰4为目标峰f4。
[0086]
如图3-5所示,对不同分离级分进行
·
oh、abts+
·
、dpph
·
抗氧化能力测定,综合比较,分离级分f4的抗氧化活性最高。
[0087]
如图6所示,本发明所得分离级分f4对dpph
·
的ic
50
值为7
±
0.1mg/ml,具有较好的dpph
·
清除效果,显示了较高的抗氧化活性。
[0088]
如图7-9所示,对本发明分离制备的分离级分f4在不同ph(2、4、6、7、8、10、12)值的抗氧化活性稳定性进行分析,结果表明,分离级分f4的抗氧化活性在中、酸性环境中均保持在96%以上,显示出较好的酸稳定性;对本发明分离制备的分离级分f4在不同温度(4、20、40、60、80、100℃)下的抗氧化活性稳定性进行分析,发现分离级分f4的抗氧化活性在不同温度均保持在80%以上,具有较好的热稳定性;本发明分离制备的分离级分f4经胃肠模拟消化,仍能保持57.17%的抗氧化活性,具有较好的消化稳定性。
[0089]
如图10所示,本发明所得抗氧化肽qcccft对dpph
·
的ic
50
值为33.0
±
0.1μg/ml,其活性约为谷胱甘肽的40倍,是凝胶柱分离前酶解产物抗氧化活性的270余倍。显示了高抗氧化活性。
[0090]
实施例4
[0091]
蛋白酶的筛选
[0092]
选用表2所示五种蛋白酶作为酶解用酶,按表2所示固定酶添加量(5000u/g)、底物浓度(10%,1:10=物料:水)和时间(6h),在各酶最适温度和ph条件下进行酶解。酶解结束后,在100℃灭酶15min,冷却后,于4℃和10000r/min离心15min,取上清液,测定各酶水解的上清液对dpph
·
自由基清除率,以及各酶对底物的水解度。
[0093]
表2蛋白酶种类及其最适ph和温度
[0094]
[0095]
如表3所示,酸性蛋白酶酶解产物对dpph
·
自由基的清除率最高,对底物的水解度也最高。
[0096]
表3各酶解产物对dpph
·
的清除率和蛋白水解度
[0097][0098][0099]
注:不同字母表示差异显著(p《0.05)。
[0100]
实施例5
[0101]
酶解条件的优化
[0102]
(1)单因素试验分析
[0103]
分别探究酶添加量(相对底物质量0.05、0.1、0.2、0.3、0.4、0.5、1.0%)、时间(3、4、5、6、7、10h)、温度(30、40、45、50、55、60℃)和底物浓度(质量浓度2、5、10、15、20、30%)对鲐鱼酶解效果的影响。选取各因素最佳水平,进行4因素3水平旋转正交试验。
[0104]
由图11、14可知,在其他条件相同情况下,随着酶添加量或底物浓度的增加,水解度逐渐增加,但其dpph自由基清除率呈先上升后下降的趋势,最终以0.2%酶添加量和10%底物浓度最佳;由图12、13可知,随着水解时间的延长或温度的上升,产物的dpph自由基清除率和水解度均先上升后下降,这可能是由于水解时间过长、温度过高,具有抗氧化活性的多肽进一步降解成小分子氨基酸,使其清除dpph自由基的效果下降,最终酶解时间5h、温度45℃为最佳。
[0105]
(2)旋转正交试验
[0106]
综合单因素试验结果,确定酶添加量(a)、时间(b)、温度(c)和底物浓度(d)自变量水平,dpph自由基清除率为响应值,采用box-behken模型进行旋转正交试验,得出最佳酶解工艺条件,各因素水平见表4。
[0107]
表4 box-behnken因素水平设计
[0108][0109]
响应面实验结果如表5所示,通过design expert10.0.7对表5进行分析,得到回归方程:dpph自由基清除率(%)=-4.16a
2-7.47b
2-4.01c
2-5.30d2+2.63ab-4.30ac-1.46ad+1.06bc-2.88bd-0.65cd+2.50a+2.21b+2.89c+1.94d+60.23。
[0110]
表5 box-behnken试验设计及结果
[0111][0112]
表6回归方程方差分析
[0113]
[0114][0115]
注:“*”表示差异显著(p<0.05);“**”表示差异极显著(p<0.01)
[0116]
回归方程的方差分析见表6,回归模型极显著(p《0.01),失拟值不显著(p=0.4296>0.05),相关系数r2=0.9727,矫正系数r2adj=0.9454,表明模型可靠,能较好预测酶解工艺条件对鲐鱼抗氧化肽活性的影响。此外,f(a)》f(c)》f(b)》f(d),酶添加量对其影响最大,其次为温度、时间和底物浓度。
[0117]
(3)响应面分析与条件优化
[0118]
由图15-20可知,响应值随着酶添加量、时间、温度和底物浓度的增大均呈现先上升后下降的的趋势,酶添加量与温度的交互作用最强,温度和底物浓度的交互作用最弱。根据box-behken模型得到鲐鱼抗氧化肽酶解工艺的最佳参数为:酶添加量0.2116%、时间5.14h、温度53.09℃和底物浓度10.65%。在此条件下,酶解产物对dpph自由基清除率为61.14%。
[0119]
(4)模型验证试验
[0120]
为了实际操作方便,本试验对鲐鱼抗氧化肽最优工艺参数进行微调,即酶添加量0.21%(相对底物质量)、酶解时间5h、酶解温度53℃和底物浓度10.65%。经3次平行验证试验,得到dpph自由基清除率为62.23
±
0.15%,与理论值相符,表明该模型对鲐鱼抗氧化肽最优参数的预测有较高的准确度,具有一定的实用价值,该条件酶解得率为93.25%。
[0121]
上述各实施例中的酸性蛋白酶生产厂家为北京索莱宝公司,sephadex g-15生产厂家为美国ge公司。
