一种small rna文库的制备方法
技术领域
1.本发明属于生物技术领域,具体涉及small rna文库的制备方法。
背景技术:
2.small rna(小rna)几乎存在于所有的生物体中,是一大类调控分子,长约18-40nt。small rna通过翻译抑制、mrna降解、异染色质形成等途径,在基因表达调控、个体发育、代谢及癌症等疾病的发生发展过程中发挥功能,主要包括mirna、sirna、pirna等。由于高通量测序技术的快速发展和测序成本的不断降低,因此使用高通量测序技术对small rna进行分析是研究small rna的重要手段之一。
3.将样本中微量的small rna转化成能够用于进行二代测序的dna文库,首先需要使用t4rnaligase在small rna分子的3’和5’端分别加上一段通用接头序列,然后再使用特异性引物进行逆转录,将两端带有通用序列的small rna分子逆转录成cdna,最后再经过pcr扩增使cdna带上可用于上机测序的完整接头序列。目前small rna文库构建中最大的技术缺陷就是由于small rna分子短(18-24nt)很难与样本中降解成短片段的rrna或者全长的5.8s rrna分开,使得最终文库中rrna的含量非常高,且难以有效全部去除,在最终上机测序时造成数据量的浪费。
4.目前公开的文献或者已有的商业化成品试剂盒用于去除rrna主要是通过双轮磁珠分选或者通过page胶分离再进行胶回收来去除比small rna分子量大于100nt以上的rrna分子,而与small rna分子相近或者差别在50-100nt以内的rrna分子很难有效去除。其次使用双轮磁珠分选或者page胶分离纯化时间成本较高,尤其后者,通常单个样本需要4h以上,这极大的限制了small rna文库分离纯化的通量。另外不论是磁珠纯化还是page胶纯化回收效率均非常的低,尤其是page胶纯化,回收效率不到10%。
5.近年来由于small rna(比如mirna和pirna)作为癌症(比如胰腺癌、结肠癌、前列腺癌)的生物标记物,在肿瘤检测中发挥着重要作用。由于临床活检样本的珍贵和微量,超低起始量模板投入small rna建库需求非常迫切。肿瘤活检样本中的rna样本,通常包含有用于细胞间通讯的mirna以及细胞凋亡产生的降解小片段rna,其中以rrna的占比最高。因此对这类样本的small rna文库进行rrna移除,对于提高超低起始量模板投入文库构建的成功率、降低测序成本以及提高建库通量都具有重要的意义。
技术实现要素:
6.本发明目的在于提供一种制备small rna文库的方法和试剂盒,其可降低非目标rna对文库及其后续文库使用的干扰。
7.在第一方面,本发明提供一种3’端封闭的rrna特异性寡核苷酸,其具有3’端封闭模块和5’端rrna特异性序列(有或无别的序列),所述rrna特异性序列与rrna靶序列至少约50%、60%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%反向互补。
8.在一些实施方案中,所述rrna特异性序列的3’端与rrna靶序列有至少4nt完全互补。
9.在一些实施方案中,所述3’端封闭模块是对3’末端核苷(酸)的3
’‑
羟基基团的修饰。
10.在一些实施方案中,所述修饰是在3
’‑
羟基基团上连接氨基或胞苷。
11.在一些实施方案中,所述5’端rrna特异性序列和/或所述rrna靶序列具有例如4nt至120nt、6nt至75nt、10nt至60nt、20nt至50nt或30nt至40nt的长度,包括所述范围内的任一整数的长度,例如4nt、5nt、6nt、7nt、8nt、9nt、10nt、11nt、12nt、13nt、14nt、15nt、20nt、25nt、30nt、35nt、40nt、45nt、50nt、55nt、60nt、65nt、70nt或75nt的长度。
12.在一些实施方案中,rrna特异性序列为脱氧核糖核苷酸序列、核糖核苷酸序列、或脱氧核糖核苷酸和核糖核苷酸杂合链序列。
13.在一些实施方案中,所述rrna特异性序列对5.8s或5s真核细胞质rrna有特异性。
14.在一些实施方案中,所述rrna靶序列是rrna的保守序列或共有序列。
15.在一些实施方案中,所述寡核苷酸含修饰碱基,例如lna(锁核酸)修饰和/或ome(甲氧基)修饰。
16.在一些实施方案中,所述修饰碱基具有例如1个至120个、6个至75个、10个至60个、20个至50个或30个至40个,包括所述范围内的任一个修饰,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、20个、25个、30个、35个、40个、45个、50个、55个、60个、65个、70个或75个。
17.在一些实施方案中,所述rrna来自感兴趣的物种,包括但不限于哺乳动物,例如灵长动物或啮齿动物,又例如人、食蟹猴、小鼠、大鼠、兔、犬、猫、牛、马、羊、猪。
18.在一些实施方案中,所述rrna来自感兴趣的微生物,例如细菌或真菌,包括但不限于大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、酿酒酵母、巴斯德毕赤酵母。
19.在一些实施案例中,所述rrna来自感兴趣的植物,例如水稻或大豆、拟南芥。
20.在一些实施方案中,所述rrna来自小鼠或人源hela细胞。
21.在一些实施方案中,所述rrna特异性序列选自seq id no.1至seq id no.6的任意一种或多种。
22.在一些实施方案中,所述寡核苷酸包含碱基位点的锁核酸修饰,所述锁核酸修饰位点如下:
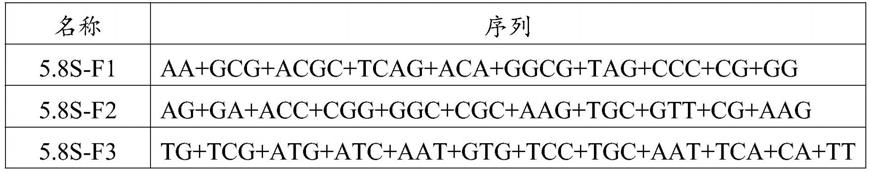
23.对应的seq id no.序列1aa+gcg+acgc+tcag+aca+ggcg+tag+ccc+cg+gg2ag+ga+acc+cgg+ggc+cgc+aag+tgc+gtt+cg+aag3tg+tcg+atg+atc+aat+gtg+tcc+tgc+aat+tca+ca+tt4aa+ttc+tcgc+agc+tagc+tgcg+ttc+tt+ca+tcg+acg5ca+cga+gccg+ag+tg+atc+cac+cgc+ta+ag+ag+tcg6gc+aag+tg+cg+tt+cgaa+gtg+tcg+atg+at+ca+at
24.其中“+”表示其后面的一个碱基包含锁核酸修饰,例如序列1的第三个碱基g包含锁核酸修饰。
25.在第二个方面,本发明提供一种寡核苷酸混合物,其包含多种本发明第一方面所
述的寡核苷酸。
26.在一些实施方案中,所述寡核苷酸混合物包含选自seq id no.1至seq id no.6所示序列的寡核苷酸的至少两种、至少三种、至少四种、至少五种或至少六种,其中所述序列对应的寡核苷酸包含前述的碱基修饰且3’端羟基基团上连接氨基。
27.在一些实施方案中,所述寡核苷酸混合物包含选自由seq id no.1至seq id no.5组成的组,由seq id no.2至seq id no.6组成的组,或由seq id no.1至seq id no.6组成的组所示序列的寡核苷酸的任意一组。
28.在任何上述方面的一些实施方案中,所述寡核苷酸、寡核苷酸混合物作为探针与靶序列进行杂交的用途。
29.在第三个方面,本发明提供一种small rna文库的制备方法,其包括以下一个或多个步骤:
30.(1)提取样本中的总rna;
31.(2)总rna与3’接头混合并变性;
32.(3)在连接酶的作用下,连接3’接头和总rna;
33.(4)用与3’接头反向互补的引物封闭3’接头;
34.(5)连接5’接头;
35.(6)以rna为模板,用与3’接头反向互补的引物为引物进行逆转录合成cdna,获得cdna与rna的杂交链;
36.(7)根据3’接头和5’接头设计引物,以cdna杂交链为模板进行pcr扩增获得富集的文库;
37.其中,在选自步骤(2)、(4)和/或(5)加入上述任一方面或实施方案中的寡核苷酸或寡核苷酸混合物。
38.在一些实施方案中,在步骤(2)前、中、后至少一个阶段加入寡核苷酸或寡核苷酸混合物。
39.在一些实施方案中,在步骤(4)前、中、后至少一个阶段加入寡核苷酸或寡核苷酸混合物。
40.在一些实施方案中,在步骤(5)前、中、后至少一个阶段加入寡核苷酸或寡核苷酸混合物。
41.所述的在步骤前或步骤中加入寡核苷酸或寡核苷酸混合物,只要是在相应的步骤(2)或(4)或(5)完成后使所述寡核苷酸或寡核苷酸混合物实现与目标序列的杂交即可。
42.在一些实施方案中,在步骤(2)中加入寡核苷酸或寡核苷酸混合物。
43.在一些实施方案中,在步骤(4)中加入寡核苷酸或寡核苷酸混合物。
44.在一些实施方案中,在步骤(5)后加入寡核苷酸或寡核苷酸混合物。
45.在一些实施方案中,当在步骤(5)后加入寡核苷酸或寡核苷酸混合物时,需要执行退火,以使寡核苷酸或寡核苷酸混合物与目标rrna杂交。
46.在一些实施方案中,所述退火在如下条件下进行:
47.75℃2min70℃2min65℃2min60℃2min55℃2min37℃5min25℃5min。
48.本发明的封闭模块一方面是为了防止寡核苷酸与接头进行连接反应,另一方面是防止寡核苷酸在后面的文库扩增步骤被当成引物进行扩增。在一些实施方案中,包含对所
述富集的文库进行分选的步骤。
49.在一些实施方案中,所述small rna文库可用于进行二代测序。
50.在一些实施方案中,所述接头是测序接头。在一个实施方案中,所述测序接头是y型测序接头。在一个实施方案中,所述测序接头是illumina平台的测序接头、ion torrent平台的测序接头或华大智造mgi平台的测序接头。
51.在一些实施方案中,每1μg总rna所需寡核苷酸的用量具有例如0.1pmol至50pmol、0.1pmol至30pmol、0.1pmol至20pmol、0.1pmol至10pmol、0.1pmol至5pmol、0.1pmol至1pmol、0.1pmol至0.5pmol、0.5pmol至50pmol、0.5pmol至20pmol或0.5pmol至10pmol,包括所述范围内的任意用量例如0.1pmol、0.2pmol、0.3pmol、0.4pmol、5pmol、6pmol、7pmol、8pmol、9pmol、10pmol、15pmol、20pmol、30pmol、40pmol或50pmol。
52.在一些实施方案中,每1μg总rna所需寡核苷酸混合物中每种寡核苷酸的用量具有例如0.1pmol至50pmol、0.1pmol至30pmol、0.1pmol至20pmol、0.1pmol至10pmol、0.1pmol至5pmol、0.1pmol至1pmol、0.1pmol至0.5pmol、0.5pmol至50pmol、0.5pmol至20pmol或0.5pmol至10pmol,包括所述范围内的任意用量例如0.1pmol、0.2pmol、0.3pmol、0.4pmol、5pmol、6pmol、7pmol、8pmol、9pmol、10pmol、15pmol、20pmol、30pmol、40pmol或50pmol。
53.第四个方面,本发明提供一种试剂盒,其包含本发明的一些方面和一些实施方案所述的3’端封闭的rrna特异性寡核苷酸或寡核苷酸混合物。
54.在一些实施方案中,所述试剂盒还包含用于实施本发明的方法需要的其它试剂。在另一些实施方案中,所述试剂盒用于实施本发明的方法,例如用于制备small rna测序文库。
55.在一些实施方案中,所述寡核苷酸与选自rrna、snorna、mrna、sirna和linker rna的任意一种或多种反向互补。
56.在另一个方面,本发明提供一种用于制备small rna文库的试剂盒,其特征在于,包括以下一种或多种试剂:接头、连接酶、连接酶缓冲液、逆转录引物、pcr反应缓冲液、聚合酶。
57.本发明的small rna包括mirna、pirna、sno rna、sirna、ncrna和/或rasirna的一种或多种。
58.降解的rna样品也可用本试剂盒进行文库构建。
59.本发明适用起始量为0.1ng-2μg的总rna样本;在一些实施方案中,所述总rna样本起始量为1μg。
60.附图简述
61.图1显示small rna文库构建流程
具体实施方式
62.实施例小鼠肝脏rna样本small rna文库构建同时去除5.8s rrna
63.1、以小鼠肝脏提取的总rna作为模板,起始投入量为1μg,采用small rna测序文库构建试剂盒vazyme#nr801 vahts small rna library prep kit for illumina构建small rna测序文库。
64.文库制备流程(附图1)及质控标准按照试剂盒说明书进行,文库制备流程依次为
样本收集和rna提取、3’接头连接、多余3’接头封闭、5’接头连接、cdna合成、pcr扩增文库富集、pcr产物纯化和文库分选,最后根据接头序列进行文库上机测序。分别在表2的不同步骤中加入探针组合以捕获并去除5.8s rrna,其中方案1中不加入探针组合,方案2-4在3’接头与底物变性步骤加入探针,方案5-7在多余3’接头封闭步骤加入探针,方案8-10在5’接头连接完成后加入探针组合并执行表1中程序后进行后续步骤,同时调整各个步骤加入探针的量,进而考察不同方案对结果的影响。
65.5.8srrna封闭探针组合的核苷酸序列如下,以下各探针以摩尔数1:1混合配成探针组合,后投入到不同的反应步骤进行反应,+代表lna修饰。
66.表1 探针序列
[0067][0068][0069]
注:(1)其中“+”代表其后的一个碱基包含锁核酸修饰。(2)上述序列3’端羟基被氨基修饰。
[0070]
表2 5.8s rrna封闭探针组合加入步骤及加入量
[0071][0072]
注:加入探针组合的体积为1μl,浓度分别为0.5μm、10μm、20μm。
[0073]
2、实验结果
[0074]
构建好的small rna文库在illumina平台上进行测序,统计下机数据的rrna占比。
[0075]
表3 在文库构建的不同阶段加入探针组合物对结果的影响
[0076]
方案号rrna占比方案14078760(36.6599%)方案22525589(22.7000%)方案3304788(5.8901%)方案4615441(5.5316%)方案52754621(24.7585%)方案6728678(6.5494%)方案7719507(6.4669%)方案82525589(22.7000%)
方案9988688(8.8863%)方案10985936(8.8616%)
[0077]
从以上结果看,加入探针的方案rrna占比明显降低;其中在3’接头与底物变性步骤加入探针时,rrna的占比最低,去除效果最好;当探针投入量达到10pmol时去除效果较好。实验证明上述探针组合也可用于人源hela细胞的rrna的去除。
