1.本发明涉及肠癌早期筛查技术领域,尤其涉及一种多基因甲基化突变的检测方法和试剂盒及其应用。
背景技术:
2.结直肠癌(crc)发病率位居全球恶性肿瘤第三位,已成为新发肿瘤病例和死亡的第三大原因。定期筛查可以早期发现结直肠癌,从而进行早期干预,以防止疾病进展甚至治愈疾病。然而,60%~70%患者在首次确诊时即为中、晚期crc。美国预防服务工作小组(united states preventive services task force,uspstf)的统计数据显示,如果健康人每年进行常规定期检查,实现crc的早期诊治,可避免约60%crc患者病死,平均五年生存率可以从46%提高到73%。因此,有效的早期筛查方法,可提高crc患者的五年生存率,降低病死率。
3.目前临床主要运用两种方法进行crc筛查:粪便潜血试验(fecal occult blood teats,fobt)和结肠镜检查。fobt主要包括gfobt(愈创木脂粪便潜血试验)、ifobt(免疫粪便潜血试验)和fit(人体血红蛋白特异性粪便免疫化学试验)。作为常规使用的筛查方法,gfobt易受食物、药物和其他因素的影响,易导致假阳性结果,且稳定性较差;ifobt的敏感度和特异性明显优于gfobt,但此检测仍然是定性试验,如果样品采集后放置过久(超过5d),其检出率明显下降;fit其敏感度较高,但价格昂贵。相比之下,结肠镜检查是侵入性的,需要肠道准备,以确保大肠管腔视野良好。另外,肠镜检查有一系列并发症,如肠活检部位出血、肠穿孔和感染;该检查有多种禁忌证,如严重的心脏疾病、心肺功能不全、急性腹泻、严重溃疡性结肠炎、结肠克罗恩病、腹膜炎和妊娠等。因此,无论是fobt还是结肠镜检查,患者依从性均较差。
4.研究表明,散发性的结直肠癌往往由于遗传及表观遗传突变的积累导致正常的肠上皮细胞病变形成腺瘤进而癌变的。表观遗传的突变导致基因表达的改变,包括微卫星不稳定、组蛋白修饰及dna甲基化。其中dna甲基化与肿瘤的发生发展联系密切,其具有很好的技术优势及应用前景。
5.dna甲基化是指生物体以s-腺苷甲硫氨酸(sam)为供体,在dna甲基转移酶(dna methyltransferase,dnmt)的催化作用下,甲基转移到5
’‑
cpg-3’的c上生成5-甲基胞嘧啶(5mc)的过程。该过程不改变蛋白质的一级结构和核苷酸的密码子,是一个可逆的过程,可在基因转录的过程中发挥至关重要的作用,可作为表观遗传学中调控基因最重要的机制,被认为是基因调控的表观遗传机制之一。在大多数研究中,有学者认为cpg岛基因与dna启动子区基因存在重叠,其重叠率高达60%~70%,在正常黏膜中cpg岛并未发生甲基化,该过程不需要基因的调控。而认为cpg岛作为一种肿瘤的抑制基因,其表观遗传修饰与结直肠癌的发生密切有关。
6.因此,研究开发一种多基因靶点的甲基化突变检测试剂盒具有巨大意义,能够快速、准确、无创地检测甲基化突变,进而有效筛查肠癌。
技术实现要素:
7.为解决上述的技术问题,本发明的目的是提供一种多基因甲基化突变的检测方法和试剂盒及其应用,通过检测sdc2、bmp3、sfrp2、ndrg4及sept9五个抑癌基因启动子区域甲基化突变情况,可对肠癌病变进行早期筛查,本发明的检测方法具有灵敏、可靠等优势。
8.本发明目的是通过以下方式实现:
9.本发明提供一种多基因甲基化突变的检测方法,主要包括以下步骤:
10.(1)通过试剂盒提取粪便中的基因组dna;
11.(2)将步骤(1)得到的基因组dna经重亚硫酸盐处理后,纯化回收得到产物片段;
12.(3)根据步骤(2)得到的产物片段的待检测的多基因区设计两组以上的引物和探针,通过多重荧光pcr同时检测多基因甲基化的突变情况。
13.进一步地,步骤(1)中所述的基因组dna通过粪便基因组提取试剂盒提取获得。
14.进一步地,步骤(2)中所述的重亚硫酸盐处理通过qiagen epitect fast bisulfite kit试剂盒完成。
15.进一步地,步骤(2)中所述的重亚硫酸盐处理的具体过程为95℃5min,60℃10min,95℃5min,60℃10min,20℃保温。
16.进一步地,步骤(3)中所述的多基因区包括sdc2、bmp3、sfrp2、ndrg4和sept9五个抑癌基因启动子区域。
17.进一步地,步骤(3)中所述的多重荧光pcr的反应体系包含taq pro hs master mix预混液,内参基因为actb。
18.本发明一方面提供了一种用于上述的多基因甲基化突变的检测方法的试剂盒,所述的试剂盒包括以下成分:特异性扩增sdc2、bmp3、sfrp2、ndrg4及sept9五个抑癌基因启动子区域的甲基化片段的上游引物、下游引物及探针,其中,所述的sdc2基因上游引物核苷酸序列如seq id no.1所示,所述的sdc2基因下游引物核苷酸序列如seq id no.2所示,所述的sdc2基因探针核苷酸序列如seq id no.3所示;所述的sfrp2基因上游引物核苷酸序列如seq id no.4所示,所述的sfrp2基因下游引物核苷酸序列如seq id no.5所示,所述的sfrp2基因探针核苷酸序列如seq id no.6所示;所述的bmp3基因上游引物核苷酸序列如seq id no.7所示,所述的bmp3基因下游引物核苷酸序列如seq id no.8所示,所述的bmp3基因探针核苷酸序列如seq id no.9所示;所述的ndrg4基因上游引物核苷酸序列如seq id no.10所示,所述的ndrg4基因下游引物核苷酸序列如seq id no.11所示,所述的ndrg4基因探针核苷酸序列如seq id no.12所示;所述的sept9基因上游引物核苷酸序列如seq id no.13所示,所述的sept9基因下游引物核苷酸序列如seq id no.14所示,所述的sept9基因探针核苷酸序列如seq id no.15所示。
19.进一步地,所述的试剂盒还包括内参基因actb的上游引物、下游引物及探针,所述的actb上游引物核苷酸序列如seq id no.16所示,所述的actb基因下游引物核苷酸序列如seq id no.17所示,所述的actb基因探针核苷酸序列如seq id no.18所示。
20.进一步地,所述的试剂盒应用的pcr扩增体系中,上游/下游引物和对应的探针的质量比为2:1。
21.进一步地,pcr扩增体系中引物终浓度为0.2μm,探针终浓度为0.1μm。
22.进一步地,所述的试剂盒中还包括但不限于:dna聚合酶(如taq酶)、dntps、mg
2+
及
taq酶缓冲液。
23.进一步地,所述的试剂盒应用的pcr扩增体系中,所述的mg
2+
浓度为3.5mm;所述的dntps浓度为0.25mm;所述的dna聚合酶为1.5u。
24.进一步地,所述试剂盒还包括重亚硫酸盐转化及纯化回收试剂。
25.进一步地,所述试剂盒还包括粪便基因组提取试剂。
26.本发明还提供了上述试剂盒在肠癌早期筛查中的应用。
27.本发明的有益效果:
28.本发明提供的多基因甲基化突变的检测方法和试剂盒通过检测sdc2、bmp3、sfrp2、ndrg4及sept9五个抑癌基因启动子区域甲基化突变情况,可对肠癌病变进行早期筛查,本发明的检测方法操作简单、检测灵敏度高、实验成本低、结果更加可靠。
具体实施方式
29.以下结合具体实施例对本发明作进一步说明,但不以任何方式限制本发明。
30.下面将结合实施例对本发明的实施方案进行详细的描述,但是本领域技术人员将会理解,在本发明各实施方式中,为了使读者更好地理解本技术而提出了许多技术细节。但是,即使没有这些技术细节,也可以实现本技术各权利要求保护的技术方案。
31.以下实施例中所使用的设备和试剂如下:粪便基因组提取试剂盒(百泰克生物技术有限公司),高速离心机sigma 3-30k,重亚硫酸盐转化回收试剂盒购自qiagen公司,荧光pcr所需酶及缓冲液试剂购自takara公司,荧光pcr仪为宏石slan。
32.实施例1
33.利用本发明所述检测方法及试剂盒完成8例临床人粪便标本的甲基化突变检测,具体操作方法及结果如下所示。
34.1.样本采集、运送保存
35.本发明样本采集选取人粪便样本,采集2g粪便样本于装有保存液的离心管中。样本在常温环境中运输尽快送达实验室。采集的样本在2-8℃条件下保存不超过1周;-20℃条件保存不超过1个月;需长期保存的样本需放于-80℃条件下保存。从样品采集之日起一周之内完成基因组dna的提取。
36.2.粪便样本基因组dna提取
37.粪便基因组dna的提取方法参照百泰克生物技术有限公司的粪便基因组提取试剂盒,分别提取了编号为1-8的8例临床人粪便样本。具体操作如下:
38.(1)在采集好样本的离心管中加上1ml溶液a上下颠倒混匀,65℃下消化》24h。
39.(2)把离心管放置到离心机上,10000转离心10分钟。离心后取下离心管,抽取7ml的上清液到一个新的离心管中,在其中加上2ml结合辅助液、60ul的磁珠和6ml的无水乙醇,涡旋混匀65℃下结合20分钟,期间取出上下颠倒混匀3-4次。
40.(3)结合完后取出离心管放置到磁力架上磁吸2min,小心倒弃上清。
41.(4)在离心管中加上10ml的漂洗液ir,涡旋混匀2分钟,然后再次放置到磁力架上磁吸2分钟,小心倒弃上清液。重复步骤(4)。
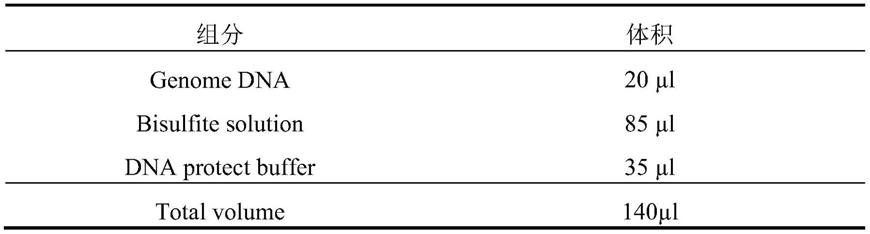
42.(5)在离心管中加上5ml的漂洗液wb,涡旋混匀后放置到磁力架上,磁吸2分钟,小心倒弃上清。
43.(6)在离心管中加上1ml的漂洗液wb,重悬磁珠,转移磁珠到一个1.5ml的离心管中,把1.5ml的离心管放置到磁力架上,磁吸1-2分钟,小心抽弃上清,尽可能的抽弃干净,室温下晾干5分钟。
44.(7)从磁力架上取下离心管,在其中加上300ul的洗脱液eb,涡旋混匀1-2分钟,65℃下孵育5min,期间取出涡旋混匀1-2次.等孵育后取出离心管放置到磁力架上,小心转移上清液到一个新的1.5ml的离心管中(注意不要抽到管壁上的磁珠)。管中的核酸可以先测试一下浓度。
45.(8)在离心管中加上450ul的结合液cb和500ul的异丙醇。上下颠倒混匀,分两次加到吸附柱ac中,12000转离心1分钟,弃滤液。
46.(9)在吸附柱中加上600ul漂洗液ir,12000转离心1分钟,弃滤液。
47.(10)在吸附柱中加上600ul的漂洗液wb,12000转离心弃上清。
48.(11)把装有吸附柱的离心管放置到离心机中12000转空甩2分钟,离心完后取下离心柱,丢弃套管,把离心柱放置到1.5ml的离心管中,在其中加上120ul的洗脱液eb,12000转离心1分钟,离心后取出离心柱,抽取管底的溶液重新加到离心柱中,12000转离心1分钟,丢弃离心柱,提取完的核酸可用于下游实验检测。
49.3.粪便基因组dna重亚硫酸盐处理转化并纯化回收
50.基因组dna重亚硫酸盐处理及纯化回收:将提取好的基因组dna使用qiagen epitect fast bisulfite kit进行重亚硫酸盐处理及纯化回收:
51.(1)准备200μlpcr管,按照如表1所示的体系加入反应各组分:
52.表1.重亚硫酸盐处理反应体系组分
[0053][0054]
(2)盖上pcr管盖后,混匀重亚硫酸盐反应体系(颜色指示剂为蓝色确保重亚硫酸盐效果),使用pcr仪进行重亚硫酸盐甲基化处理反应:
[0055]
表2.重亚硫酸盐处理过程
[0056][0057]
(3)重亚硫酸盐反应产物纯化:
[0058]
①
将200μl反应产物转移到新的1.5ml ep管中,向ep管中加入310μl buffer bl与
250μl无水乙醇,涡旋震荡15s,瞬时离心后将混合液转移至吸附柱minelute dna spin column(耗材需2-8℃保存),12000rpm离心1min。
[0059]
②
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bw(使用前确认添加乙醇),12000rpm离心1min。
[0060]
③
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bd(使用前确认添加乙醇,需2-8℃保存),室温静置15min,12000rpm离心1min。
[0061]
④
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bw(使用前确认添加乙醇),12000rpm离心1min。
[0062]
⑤
重复
④
步骤1次,共洗涤2次。
[0063]
⑥
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入250μl无水乙醇,12000rpm离心1min。
[0064]
⑦
离心后倒掉废液将吸附柱转移至新的收集管中,12000rpm离心1min,保证去除乙醇以免影响后续实验。
[0065]
⑧
将吸附柱转移至新的1.5ml ep管中,向吸附柱膜中央加入15μl buffer eb,室温静置1min,12000rpm离心1min回收纯化产物(产物2-8℃可保存24h,尽量避免反复冻融,长期保存至于-20℃)。
[0066]
4.引物设计
[0067]
确定与结直肠癌发生发展密切相关的抑癌基因启动子cpg岛区域,针对目标区域进行甲基化特异性荧光pcr引物设计,pcr产物长度选取100-300bp;引物长度选取20-30bp;
[0068]
设计引物序列遵循以下原则:(1)通用序列本身的gc含量在40.0%-60.0%,(2)减少通用序列添加在pcr引物上后,对pcr引物造成的严重发卡(haripin)、二聚体(dimer)情况的出现,(3)通用序列不会和模板进行非特异扩增。设计的引物如下:
[0069]
sdc2基因上游引物核苷酸序列如seq id no.1所示:
[0070]5’‑
aattaataagtagagggcgtcgc-3’[0071]
sdc2基因下游引物核苷酸序列如seq id no.2所示:
[0072]5’‑
cgactcaaactcgaaaactcg-3’[0073]
sdc2基因探针核苷酸序列如seq id no.3所示:
[0074]5’‑
fam-agtaggcgtaggaggaggaagcga-bhq1-3’[0075]
sfrp2基因上游引物核苷酸序列如seq id no.4所示:
[0076]5’‑
cgttttagtcgtcggttgttagttt-3’[0077]
sfrp2基因下游引物核苷酸序列如seq id no.5所示:
[0078]5’‑
tcccgaacccgctctctt-3’[0079]
sfrp2基因探针核苷酸序列如seq id no.6所示:
[0080]5’‑
vic-acgtaaatacgactcgaaaccccgaa-bhq1-3’[0081]
bmp3基因上游引物核苷酸序列如seq id no.7所示:
[0082]5’‑
tttgaaaatattcgggttatatacgtcgc-3’[0083]
bmp3基因下游引物核苷酸序列如seq id no.8所示:
[0084]5’‑
tcttccccaacaactacgcg-3’[0085]
bmp3基因探针核苷酸序列如seq id no.9所示:
[0086]5’‑
rox-agcgttggagtggagacggcgttcgtagcgt-bhq2-3’[0087]
ndrg4基因上游引物核苷酸序列如seq id no.10所示:
[0088]5’‑
tagtcgcgtagaaggcggaa-3’[0089]
ndrg4基因下游引物核苷酸序列如seq id no.11所示:
[0090]5’‑
cgcgaaacgataccgaaccta-3’[0091]
ndrg4基因探针核苷酸序列如seq id no.12所示:
[0092]5’‑
vic-cgaaccgcgatccctcgcgcg-bhq2-3’[0093]
sept9基因上游引物核苷酸序列如seq id no.13所示:
[0094]5’‑
tattagttattatgtcggatttcgc-3’[0095]
sept9基因下游引物核苷酸序列如seq id no.14所示:
[0096]5’‑
tccaacacgtccgcgaccgca-3’[0097]
sept9基因探针核苷酸序列如seq id no.15所示:
[0098]5’‑
rox-aacgcgtagttggatgggattatttcgga-bhq2-3’[0099]
其中,内参基因actb上游引物核苷酸序列如seq id no.16所示:
[0100]5’‑
gaaagggtgtagttttgggaggttag-3’[0101]
所述的actb基因下游引物核苷酸序列如seq id no.17所示:
[0102]5’‑
aataacccaaataaataacccactacctc-3’[0103]
所述的actb基因探针核苷酸序列如seq id no.18所示:
[0104]5’‑
cy5-cctcttctaataaccacctccctccttcctaac-bhq2-3’[0105]
5.甲基化特异性荧光pcr检测
[0106]
利用上述的肠癌早筛相关多基因甲基化突变检测的试剂盒,分两个多重荧光pcr体系进行五个目标基因甲基化突变情况检测。反应体系如下:
[0107]
表3.多重荧光pcr体系1
[0108][0109]
表4.多重荧光pcr体系2
[0110][0111]
上述的pcr反应条件如下:
[0112]
表5.多重荧光pcr反应条件
[0113][0114]
检测结果如表6所示,8例临床标本中有5例为肠癌患者术前粪便样本,根据检测结果显示s1、s3、s4、s5、s6这5例肠癌患者术前粪便样本甲基化检测结果均呈阳性;1例肠癌患者术后采集粪便样本,其中s1、s2为同一患者样本,s2为患者术后采集粪便样本,甲基化检测结果呈阴性;2例健康人群粪便样本,甲基化检测结果均呈阴性。以上8例临床标本甲基化突变检测结果符合临床数据特征,证实本发明提供的检测方法及试剂盒有效可靠、性能优越。
[0115]
表6. 8例临床粪便样本甲基化突变检测结果
[0116][0117]
实施例2
[0118]
利用本发明所述检测方法及试剂盒完成8例模拟甲基化率为0%、0.5%、1%、5%、10%、25%、50%、100%的标准品检测,具体操作方法及结果如下所示。
[0119]
1.标准品基因组dna重亚硫酸盐处理转化并纯化回收
[0120]
标准品基因组dna重亚硫酸盐处理及纯化回收:将标准品基因组dna使用qiagen epitect fast bisulfite kit进行重亚硫酸盐处理及纯化回收:
[0121]
(1)准备200μlpcr管,按照如下体系加入反应各组分:
[0122]
表7.重亚硫酸盐处理反应体系组分
[0123][0124]
(2)盖上pcr管盖后,混匀重亚硫酸盐反应体系(颜色指示剂为蓝色确保重亚硫酸盐效果),使用pcr仪进行重亚硫酸盐甲基化处理反应:
[0125]
表8.重亚硫酸盐处理反应过程
[0126][0127]
(3)重亚硫酸盐反应产物纯化:
[0128]
①
将200μl反应产物转移到新的1.5ml ep管中,向ep管中加入310μl buffer bl与250μl无水乙醇,涡旋震荡15s,瞬时离心后将混合液转移至吸附柱minelute dna spin column(耗材需2-8℃保存),12000rpm离心1min。
[0129]
②
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bw(使用前确认添加乙醇),12000rpm离心1min。
[0130]
③
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bd(使用前确认添加乙醇,需2-8℃保存),室温静置15min,12000rpm离心1min。
[0131]
④
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入500μl buffer bw(使用前确认添加乙醇),12000rpm离心1min。
[0132]
⑤
重复
④
步骤1次,共洗涤2次。
[0133]
⑥
离心后倒掉收集管中废液,向吸附柱minelute dna spin column加入250μl无水乙醇,12000rpm离心1min。
[0134]
⑦
离心后倒掉废液将吸附柱转移至新的收集管中,12000rpm离心1min,保证去除乙醇以免影响后续实验。
[0135]
⑧
将吸附柱转移至新的1.5ml ep管中,向吸附柱膜中央加入15μl buffer eb,室温静置1min,12000rpm离心1min回收纯化产物(产物2-8℃可保存24h,尽量避免反复冻融,
[0171]
所述的actb基因下游引物核苷酸序列如seq id no.17所示:
[0172]5’‑
aataacccaaataaataacccactacctc-3’[0173]
所述的actb基因探针核苷酸序列如seq id no.18所示:
[0174]5’‑
cy5-cctcttctaataaccacctccctccttcctaac-bhq2-3’[0175]
3.甲基化特异性荧光pcr检测
[0176]
利用上述的肠癌早筛相关多基因甲基化突变检测的试剂盒,分两个多重荧光pcr体系进行五个目标基因甲基化突变情况检测。反应体系如下:
[0177]
表9.多重荧光pcr体系1
[0178][0179]
表10.多重荧光pcr体系2
[0180][0181][0182]
所述的pcr反应条件如下:
[0183]
表11.多重荧光pcr反应条件
[0184][0185]
检测结果如表12所示,8例模拟甲基化突变频率标准品检测,根据检测结果显示甲基化率为0%的阴性标准品5个目标基因检测结果均为阴性;甲基化率为0.5%的标准品基因sfrp2、bmp3、ndrg4检测结果为阳性,基因sdc2、sept9检测结果为阴性;甲基化率为1%的标准品5个目标基因检测结果均为阳性;甲基化率为5%的标准品5个目标基因检测结果均
为阳性;甲基化率为10%的标准品5个目标基因检测结果均为阳性;甲基化率为25%的标准品5个目标基因检测结果均为阳性;甲基化率为50%的标准品5个目标基因检测结果均为阳性;甲基化率为100%的标准品5个目标基因检测结果均为阳性。结果显示甲基化率1%以上的标准品5个目标基因可保证稳定准确检出,体现检测体系稳定可靠,检测灵敏度较高。
[0186]
表12.模拟甲基化率标准品检测结果
[0187][0188]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
