1.本发明属于动物传染病病原体分子检测技术领域,具体涉及一种能够检测并鉴别不同猪繁殖与呼吸综合征病毒毒株包括欧洲型、美洲型、美洲型高致病株、美洲型类nadc30株、美洲型类nadc34株的鉴别检测试剂盒及其应用。
背景技术:
2.猪繁殖与呼吸综合征俗称猪蓝耳病,是我国《一、二、三类动物疫病病种名录》中规定的二类动物疫病,其是由猪繁殖与呼吸综合征病毒(porcinereproductive and respiratory syndrome virus, prrsv)引起的一种高度接触性传染病,主要怀孕母猪早产、流产、死胎以及仔猪的呼吸道系统症状。
3.近年来,prrsv在流行过程中不断演化重组,出现了多种新的流行毒株,例如欧洲型、美洲型经典株、美洲型高致病株、美洲型类nadc30株、美洲型类nadc34株等,不同类型的prrsv的鉴别检测对于动物疫病流行病学调查及防控手段的选择有重要意义。
4.prrsv是一种rna病毒,通常,技术人员会采用荧光rt-pcr法或pcr-电泳法来检测prrsv病毒的核酸,并通过设计针对不同毒株的特异性引物、探针来对各种类型的毒株进行鉴别。
5.但是,荧光rt-pcr法通常需要使用特异性taqman水解探针,需要鉴别的毒株类型越多,所使用的特异性taqman水解探针就越多,势必增加探针之间的相互干扰,影响检测的灵敏度。而且,不同探针需要用不同颜色的荧光信号加以识别,探针种类的增加要求荧光pcr仪具有更多的荧光检测通道,而实际上在广大基层检测实验室普遍配置的荧光pcr仪中双通道荧光pcr仪占绝大多数,四通道以上的荧光pcr仪价格昂贵,并不适合在基层推广。电泳法虽然不需要使用荧光探针,但是其只能通过分析片段大小区分来自不同毒株的扩增产物,当这些扩增产物大小接近时则无法加以区分,因而分辨率低。而且,电泳法还存在下述问题:容易受非特异性扩增产物的干扰、特异性差;荧光染料的背景强导致信噪比低、检测灵敏度低。
6.此外,基因芯片已经应用于分子生物学检测领域。所述基因芯片是将目标序列特异性的核酸探针固定在固相基质反应孔中的特定位置以形成微阵列,在对生物样品进行核酸提取和核酸扩增后,将核酸扩增产物与基因芯片共同温育,使得目标序列的扩增产物与基因芯片的特定位置上的特异性核酸探针杂交形成核酸杂交产物,然后清洗去除未杂交的扩增产物,并使所述基因芯片的特定位置上的核酸杂交产物产生可识读的信号(化学显色、化学发光等),从而能够判定是否存在与所述特异性核酸探针杂交的核酸扩增产物。与荧光rt-pcr法相比,基因芯片法通过特定位置来区分不同核酸探针,无需对不同核酸探针进行不同颜色的荧光标记,甚至无需使用荧光pcr仪器,因此不存在荧光探针之间相互干扰的问题,也不存在需要匹配昂贵的检测仪器的问题。与电泳法相比,基因芯片法的分辨率和检测灵敏度都明显更高。
7.但是,即使采用基因芯片法,对于上述这么多种类型的prrsv毒株的鉴别检测而
8所示。
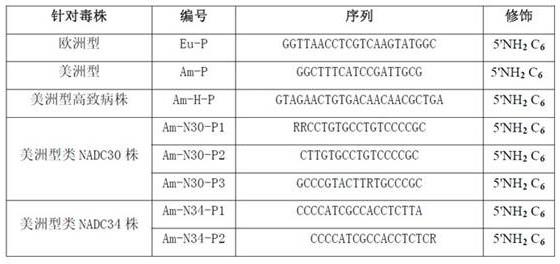
13.eu-p,seqidno:1:ggttaacctcgtcaagtatggcam-p,seqidno:2:ggctttcatccgattgcgam-h-p,seqidno:3:gtagaactgtgacaacaacgctgaam-n30-p1,seqidno:4:rrcctgtgcctgtccccgcam-n30-p2,seqidno:5:cttgtgcctgtccccgcam-n30-p3,seqidno:6:gcccgtacttrtgcccgcam-n34-p1,seqidno:7:ccccatcgccacctcttaam-n34-p2,seqidno:8:ccccatcgccacctctcr。
14.本发明的另一方面提供一种用于猪繁殖与呼吸综合征病毒prrsv鉴别检测的核酸杂交组件,其包含上述的基因芯片和用于核酸杂交的试剂。
15.本发明的第三方面提供一种猪繁殖与呼吸综合征病毒prrsv鉴别检测试剂盒,其包含上述的基因芯片。
16.较佳的,上述试剂盒还包含下述用于扩增目标基因片段的引物组:用于扩增prrsv欧洲型的目标基因片段的引物组1:上游引物的核苷酸序列如seqidno:9所示,下游引物的核苷酸序列如seqidno:10所示;用于扩增prrsv美洲型的目标基因片段的引物组2:上游引物的核苷酸序列如seqidno:11所示,下游引物的核苷酸序列如seqidno:12所示;用于扩增prrsv美洲型高致病株的目标基因片段的引物组3:上游引物的核苷酸序列如seqidno:13所示,下游引物的核苷酸序列如seqidno:14所示;用于扩增prrsv类nadc30株的目标基因片段的引物组4:上游引物的核苷酸序列如seqidno:15所示,下游引物的核苷酸序列如seqidno:16所示;以及用于扩增prrsv类nadc34株的目标基因片段的引物组5:上游引物的核苷酸序列如seqidno:17所示,下游引物的核苷酸序列如seqidno:18所示。
17.欧洲型eu-f,seqidno:9:ggcaaacgagctgttaaacgaeu-r,seqidno:10:gccattccccattggagctg美洲型am-f,seqidno:11:gatgccgtttgtgcttgctam-r,seqidno:12:tgtgccgttgaccgtagtg美洲型高致病株am-h-f,seqidno:13:tgacacctatgagtgagcccgam-h-r,seqidno:14:cagacaaatccagaggctcatcc美洲型类nadc30株am-n30-f,seqidno:15:ctgtcaggagccttccagagaam-n30-r,seqidno:16:hagcttcagtcgggacacagt美洲型类nadc34株am-n34-f,seqidno:17:atgttgtgttccctggagtggam-n34-r,seqidno:18:cttctaacggaccttgtttttcg。
18.较佳的,上述试剂盒中,上述引物组1-5被预混装于一个容器中。
19.较佳的,上述试剂盒中,上述引物组1-5中的各个下游引物的5'端经生物素标记。
20.较佳的,上述试剂盒中,包含核酸提取组件、核酸扩增组件和核酸杂交组件;其中,所述核酸提取组件包含用于核酸提取的试剂;所述核酸扩增组件包含用于核酸扩增的试剂,所述用于核酸扩增的试剂包含所述引物组1-5的预混液;所述核酸杂交组件包含所述基因芯片和用于核酸杂交的试剂。
21.本发明的还公开了上述猪繁殖与呼吸综合征病毒(prrsv)鉴别检测试剂盒的使用方法,主要包括:(1)使用所述核酸提取组件提取待测样本的核酸;(2)使用所述核酸扩增组件(可以包含例如引物组1-5的预混液和rt-pcr扩增用酶预混液)对样本核酸进行rt-pcr扩增;(3)使用所述核酸杂交组件对rt-pcr扩增产物进行核酸杂交检测;(4)观察基因芯片上的各个探针位点是否显色,判定检测结果。
附图说明
22.图1为检测prrsv欧洲型样本的实验结果照片;图2为检测prrsv美洲型经典株的实验结果照片;图3为检测prrsv美洲型高致病株的实验结果照片;图4为检测第一种类型的prrsv美洲型类nadc30株的实验结果照片;图5为检测第二种类型的prrsv美洲型类nadc30株的实验结果照片;图6为检测第三种类型的prrsv美洲型类nadc30株的实验结果照片;图7为检测第一种类型的prrsv美洲型类nadc34株的实验结果照片;图8为检测第二种类型的prrsv美洲型类nadc34株的实验结果照片。
具体实施方式
23.以下结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例是用于解释本发明,并非对本发明的限定。
24.实施例1. 试剂盒的制备1. 基因芯片的制备(见表1 探针序列表和表2基因芯片布局图)表1 探针序列表
rt-pcr kit中的one step enzyme mix。
27.4. sa-hrpsa-hrp为20-80u/ml(优选为40-50u/ml) streptavidin-pod,streptavidin-pod购买自罗氏公司,货号11089153001。
28.5. 杂交液a杂交液a配方为:17.53g/l氯化钠,8.82g/l柠檬酸钠,0.2g/l十二烷基硫酸钠,ph7.0。
29.6. 洗涤液b洗涤液b配方为:4.383g/l氯化钠,2.205g/l柠檬酸钠,0.2g/l十二烷基硫酸钠,ph7.0。
30.7. 洗涤液c洗涤液c配方为:29.41g/l柠檬酸钠,ph4.0。
31.8. tmb显色剂tmb显色剂购买自赛默飞世尔科技(中国)有限公司,货号37574。
32.实施例2. 检测步骤(1)核酸提取使用广州美基生物科技有限公司生产的“磁珠法病毒总核酸提取试剂盒”,按照产品说明书进行操作,提取待检样本中的总核酸。
33.(2)核酸扩增
①
根据检测数量(n),分别吸取n
×
14μl pcr 反应液和n
×
1μl酶混合液,混匀,瞬时离心。按15μl/管分装上述配制好的混合液。
34.②
往上述分装好的混合液中,分别加入5μl核酸提取产物。轻弹管壁混匀,应避免气泡产生,瞬时离心。
35.③
将加完核酸模板后的核酸扩增体系放入pcr仪,按下列循环参数进行扩增反应(表4):表4 扩增反应相关参数(3)基因芯片检测
①
将基因芯片置于47℃的孵育器中,200rpm孵育5min-10min;
②
将洗涤液b置于47℃水浴预热;
③
配制sa-hrp工作液(现配现用):按每4ml杂交液a加入2μl sa-hrp,混匀;
④
按100μl/孔,将杂交液a分装至各芯片孔中,再分别加入20μl各变性产物。然后将芯片置于47℃的孵育器中,200rpm孵育20min;
⑤
吸弃芯片孔中的液体,按150μl/孔,加入预热的洗涤液b,随后吸弃芯片孔中的液体。重复此步骤两次;
⑥
按150μl/孔,加入预热的洗涤液b,将芯片置于47℃的孵育器中,200rpm孵育10min。吸弃芯片孔中的液体(尽量吸干);
⑦
按150μl/孔,加入sa-hrp工作液,将芯片置于47℃的孵育器中,200rpm孵育10min。吸弃芯片孔中的液体(尽量吸干);
⑧
按150μl/孔,加入杂交液a,随后吸弃芯片孔中的液体。重复此步骤三次;
⑨
按150μl/孔,加入洗涤液c,随后吸弃芯片孔中的液体。重复此步骤三次;
⑩
按85μl/孔,加入tmb显色剂,室温,避光,静置5-10min。吸弃芯片孔中的液体;
⑪
按150μl/孔,加入纯化水,随后吸弃芯片孔中的液体。重复此步骤三次;
⑫
使用吸水纸吸去膜表面水分,可肉眼观察各探针点的显色情况,或尽快放入芯片阅读仪中进行扫描分析。
36.(4)结果判定
①
每个待检样本的检测结果应先满足以下质控要求:buffer质控点不显色,表示芯片制备正常;否则表示芯片制备异常。
37.biotin质控点显色(蓝色或淡蓝色),表示偶联和显色反应正常;否则表示偶联和显色反应异常。
38.②
参照芯片布局图,根据检测结果中各个探针是否显色进行判定:检测信号值可用图像自动采集装置读取。
39.显色(或检测信号值≥10)则判为此探针对应的基因型或毒株阳性;不显色(或检测值<10)则判为此探针对应的基因型或毒株阴性。
40.具体判定方法如下(见表5):表5判定方法 实施例3. 试剂盒性能测试1. 敏感性
分别检测prrsv欧洲型、prrsv美洲型经典株、prrsv美洲型高致病株、prrsv美洲型类nadc30株、prrsv美洲型类nadc34株的阳性样本,敏感性为100%,且不同型别、不同毒株之间无交叉反应。对于不同型别、不同毒株典型实验结果照片如图1-8所示。
41.2. 特异性检测猪瘟病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪冠状病毒、猪轮状病毒、伪狂犬病毒、非洲猪瘟病毒、猪圆环病毒2型、猪圆环病毒3型、猪细小病毒,结果均为阴性,与上述病原体无交叉反应。
42.上述说明示出并描述了本发明的优选实施例,如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域技术人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
43.本发明公开的猪繁殖与呼吸综合征病毒鉴别检测试剂盒能够检测并鉴别不同猪繁殖与呼吸综合征病毒毒株包括欧洲型、美洲型、美洲型高致病株、美洲型类nadc30株、美洲型类nadc34株,可用于猪繁殖与呼吸综合征疫情防控。
