一种酶催化制备2-羟基四氢呋喃、1, 4-丁内酯与
γ-羟基丁酸钠的方法
技术领域
1.本发明属于生物催化技术领域,具体涉及一种由过氧化物酶催化制备2-羟基四氢呋喃、1, 4-丁内酯与或γ-羟基丁酸钠的方法。
背景技术:
2.随着有机合成的发展,杂环化合物的重要性日益凸显,其中环氧化合物占据着重要的地位。环氧化合物是指含三元环及其以上的醚及其衍生物,是一类重要的医药中间体,在医学药学等领域起着重要的作用。四氢呋喃是其中重要的结构单元,广泛存在于各类天然产物与药物中。比如抗癌药物吉西他滨含有一个多取代的手性四氢呋喃;抗癫痫药物托吡酯含有一个多取代的手性四氢吡喃;泊沙康唑含有一个2,4位取代的四氢呋喃环,是伊曲康唑的衍生物;安普那韦是由英国glaxo-smith公司开发的第5代抗逆转病毒蛋白酶抑制剂,是一个3位取代的四氢呋喃类化合物。目前,直接以四氢呋喃为原料合成四氢呋喃结构单元化合物的报道很少,像2-羟基四氢呋喃、1, 4-丁内酯大多以更复杂的化合物作为原料,同时需要复杂的催化剂与实验条件,使得此类化合物大规模的生产与应用受到一定的局限。
3.γ-羟基丁酸(gamma-hydroxybutyric acid, ghb)在医药领域里被认为是一种神经递质,对于自我平衡的调整和产生有规律的睡眠等方面起着非常重要的作用,ghb 通常用其钠盐,其钠盐为白色粉末,易溶于水。早在1874年,ghb由亚历山大
·
扎伊采夫(alexander mikhaylovich zaytsev)首次合成。20世纪60年代初,henri laborit博士在研究神经递质γ-氨基丁酸(gaba)时对ghb对人体的作用进行了全面研究,在那时临床上就已经将其用作麻醉剂和催眠剂。在法国、意大利等欧洲国家,γ-羟基丁酸作为一个安眠药和分娩时的麻醉剂几十年来一直被大量使用。但随后发现其有极大的毒副作用,如长期服用会产生依赖综合症,引起头痛、恶心、呕吐、甚至呼吸抑制和昏迷。当与其它药物、酒精混合使用时,毒副作用更加明显,因此 ghb 逐渐被其它药物取代。因其被滥用产生的问题和新药的开发导致ghb的使用日益减少。然而目前ghb 仍被作为附加麻醉剂和催眠剂使用,除此以外,ghb也应用于酒精依赖、鸦片戒断综合征和嗜睡病人的治疗等。ghb的传统合成方法主要是以1, 4-丁二醇为原料,在氧气条件下加热加压可以直接得到产物;或者以环丁酮为原料,在锡催化剂的条件下,加入过氧化氢和有机溶剂得到产物。此类方法缺陷是目标产物的产率较低且副产物较多。目前,大多数合成γ-羟基丁酸钠的方法主要是先得到1, 4-丁内酯作为中间体,进而合成ghb。1, 4-丁内酯的合成方法主要有:顺酐加氢法、1, 4-丁二醇脱氢法、1, 4-丁二醇催化、丁二酸酐加氢脱水和烯丙醇法。这些方法大多通过高温高压等苛刻条件,同时还伴随着大量副产物的生成,不符合绿色化学的要求。
4.目前为止,直接合成γ-羟基丁酸钠的报道很少,也没有从四氢呋喃出发采用“一锅法”合成γ-羟基丁酸钠的相关报道。
技术实现要素:
5.本发明的目的是提供一种酶催化氧化四氢呋喃制备2-羟基四氢呋喃、1, 4-丁内酯与γ-羟基丁酸钠的方法。
6.本发明以廉价易得的四氢呋喃为原料,以磷酸盐或柠檬酸缓冲液为溶剂、过氧合酶为催化剂,合成2-羟基四氢呋喃、1, 4-丁内酯与γ-羟基丁酸钠。本发明是以过氧合酶作为催化剂的环境友好、条件温和、co2排放量大幅减少、操作简便的绿色合成方法,使用的过氧合酶稳定性好,可扩大反应进行工业化生产。
7.本发明提供的一种由过氧合酶催化制备环氧化合物与γ-羟基丁酸钠方法,包括如下步骤:在缓冲液中加入四氢呋喃、过氧合酶,最后用输液泵加入过氧化物,当该反应体系的过氧化物的用量与原料的物质的量之比控制在1.5:1以内时,即得到式(a)所示的2-羟基四氢呋喃。
8.当上述反应体系提高过氧化物的用量与原料的物质的量之比控制在1.5-4.0:1时,则得到式(b)所示的1, 4-丁内酯;当反应体系加入氢氧化钠时,即得到式(c)所示的γ-羟基丁酸钠。
9.本发明中,所述产物具体可选2-羟基四氢呋喃、1, 4-丁内酯和γ-羟基丁酸钠中的至少一种。
10.上述的方法中,所述过氧化物酶或过氧合酶具有血红素活性,酶国际分类为ec 1.11.2.1,其不需要提供辅因子参与催化,而是直接利用过氧化物与血红素作用生成反应活性物种(compound i),进而以单加氧酶的方式催化单氧原子从过氧化物选择性转移到不同的目标分子的碳氢键上。优选地,可选自以下(1)-(11)中至少一种,也可以直接购买现有相关过氧合酶,这些 upo 是典型的不需要提供辅因子参与催化,而是利用单加氧酶的方式催化单氧原子从过氧化物(h2o2,rooh)选择性转移到不同的目标分子。
11.(1)来源于leptoxyphium fumago的卤代过氧化物酶lfucpo(uniprotkb: p04963);(2)来源于caldariomyces fumago的卤代过氧化物酶cfcpo( genbank:gca001660795.1);(3)来源于agrocybe aegerita的过氧化酶aaeupo(genbank: cbj94532.1);(4)来源于chaetomium globosum的过氧化酶cglupo(genbank: xm 001219539.1);(5)来源于marasmius rotula的过氧化酶mroupo(genbank: jq654436.1);(6)来源于marasmius wettsteinii 的过氧化酶mweupo(seq id no.2);(7)来源于coprinopsis cinerea的过氧化酶cciupo(seq id no.3);(8)来源于myceliophthora thermophila的过氧化酶mthupo(seq id no.1);(9)来源于thielavia terrestris的过氧化酶tteupo(seq id no.4);(10)来源于coprinellus radians的过氧化酶craupo(genbank: fm872459.1);
s.; mate, d. m.; ludwig, r.; alcalde, m., tandem-yeast expression system for engineering and producing unspecific peroxygenase. enzyme and microbial technology 2015,73
–
74, 29-33.)培养液通过在4℃下以8000 rpm离心2小时澄清。上清液通过20
ꢀµ
m过滤器过滤并保持在-80℃。raaeupo 活性通过在ph 5.0的 napi 缓冲液中使用 abts 测定法测定。
28.蛋白质纯化:将上清液浓缩并用100 mm磷酸钠,ph 7进行透析。使用ngc色谱系统(biorad)一步纯化aaeupo。分离在q sepharose ff 30-ml小柱上进行,流速为 5 ml/min。90 ml后,保留的蛋白质用450 ml中的 0-50% nacl梯度洗脱,然后是50 ml中的50-100%梯度和75 ml中的100% nacl过氧化物酶活性之后是在 h2o2存在下的abts氧化,将合适的部分合并、浓缩并用100 mm磷酸钠缓冲液 (ph 7)进行透析。raaeupo的纯化通过十二烷基硫酸钠 (sds)-page在12%凝胶中用考马斯亮蓝 r-250 (sigma) 染色证实。
29.在100 ml反应瓶中,加入 50 ml磷酸盐缓冲溶液(ph = 8,磷酸二氢钠100mm),再加入50μl四氢呋喃于缓冲溶液中,然后加入2 mlupo酶(与上述酶浓度相同为2 mg/ml,反应体系中酶浓度为2 μm)。使用输液泵以3.0mm/h 速率通入h2o2。
30.上述反应体系于30℃水浴锅中,磁子搅拌反应3 h后,结束反应,加入100 ml乙酸乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂即得到2-羟基四氢呋喃(产率30%,纯度98%)。
31.图4为本实施例制备2-羟基四氢呋喃的气相谱图,保留时间与市售2-羟基四氢呋喃标准品一致。
32.实施例2、1, 4-丁内酯的制备:1, 4-丁内酯的结构式为:。
33.在100 ml反应瓶中,加入 50 ml磷酸盐缓冲溶液(ph = 8,磷酸二氢钠100 mm),再加入50 μl四氢呋喃于缓冲溶液中,然后加入2 mlraaeupo酶(与上述酶浓度相同为2 mg/ml,反应体系中酶浓度为2 μm)。使用输液泵以3.0mm/h 速率通入h2o2。
34.上述反应体系于30℃水浴锅中,磁子搅拌反应12 h后,结束反应,加入100 ml乙酸乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂即得到1, 4-丁内酯(产率22%,纯度98%)。
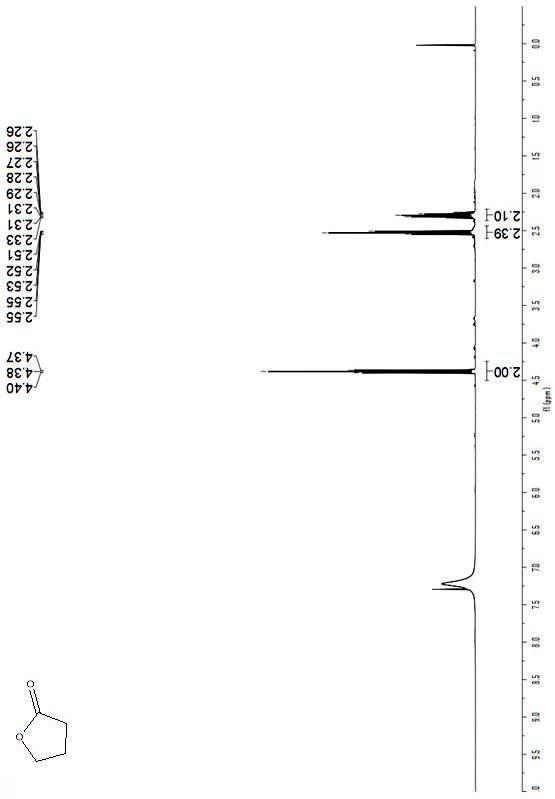
35.图2是本实施例制备1,4-丁内酯核磁共振氢谱,其中以氘代氯仿为溶剂,使用仪器为中科牛津400mhz核磁共振波谱仪。
36.图5为本实施例制备1,4-丁内酯的气相谱图,与核磁共振氢谱所测试1,4-丁内酯标准品保留时间一致。
37.实施例3、γ
‑ꢀ
羟基丁酸钠的制备:γ-羟基丁酸钠的结构式为:。
38.在100 ml反应瓶中,加入 50 ml磷酸盐缓冲溶液(ph=8,磷酸二氢钠100 mm),再加入50 μl四氢呋喃于缓冲溶液中,然后加入2 mlraaeupo酶(与上述酶浓度相同为2 mg/ml,反应体系中酶浓度为2 μm)。使用输液泵以3.0mm/h 速率通入h2o2。
39.上述反应体系于30℃水浴锅中,磁子搅拌反应12 h后,结束反应,加入100 ml乙酸
乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂,然后加入30 ml乙醇与过量氢氧化钠2 g,搅拌2 h后即可得到目标产物γ-羟基丁酸钠(产率18%,纯度98%)。
40.图3为是本实施例制备γ-羟基丁酸钠的核磁共振氢谱,以重水为溶剂,使用仪器为中科牛津400 mhz核磁共振波谱仪。
41.实施例4、1, 4-丁内酯的制备:1, 4-丁内酯的结构式为:。
42.在100 ml反应瓶中,加入 50 ml磷酸盐缓冲溶液(ph = 8,磷酸二氢钠100 mm),再加入50 μl四氢呋喃于缓冲溶液中,然后加入3μm的lfucpo酶(终浓度)。使用输液泵以2.0 mm/h 速率通入h2o2。
43.上述反应体系于30℃水浴锅中,磁子搅拌反应20 h后,结束反应,加入100 ml乙酸乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂即得到1, 4-丁内酯(产率69%)。产物的气相色谱图如图5所示。
44.实施例5、 2-羟基四氢呋喃的制备:2-羟基四氢呋喃的结构为:。
45.在100 ml反应瓶中,加入 50 ml磷酸盐缓冲溶液(ph = 8,磷酸二氢钠100mm),再加入50μl四氢呋喃于缓冲溶液中,然后加入2.5μm的cciupo酶(终浓度),使用输液泵以1.5 mm/h 速率通入h2o2。
46.上述反应体系于30℃水浴锅中,磁子搅拌反应3.5 h后,结束反应,加入100 ml乙酸乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂即得到2-羟基四氢呋喃(产率44%,纯度94%)。产物的气相色谱图如图4所示。
47.实施例6、γ-羟基丁酸钠的制备:γ-羟基丁酸钠的结构式为:。
48.在100 ml反应瓶中,加入50 ml磷酸盐缓冲溶液(ph=8,磷酸二氢钠100 mm),再加入50 μl四氢呋喃于缓冲溶液中,然后加入3.5μm的mthupo酶(终浓度),使用输液泵以3.0mm/h 速率通入h2o2。
49.上述反应体系于30℃水浴锅中,磁子搅拌反应15 h后,结束反应,加入100 ml乙酸乙酯萃取,共两次,合并有机相,有机相于30-40℃下减压蒸馏除去有机溶剂,然后加入30 ml乙醇与过量氢氧化钠2 g,搅拌2 h后即可得到目标产物γ
‑ꢀ
羟基丁酸钠(产率45%,纯度92%)。产物的核磁共振波谱图与图3一致。
50.以上所述,实施案例仅为本发明较好的实施方式,本领域的技术人员应当理解的是,实施示例并不是范例性的,不对本发明的保护范围构成任何限制。任何熟悉本技术领域的技术人员在本发明所提出的技术范围内,根据本发明的技术方案及其发明构思,在其细节或者形式的做出等同替换或改变,都应涵盖在本发明的保护范围之内。
