一种氧化型tmb纳米材料及其在检测谷胱甘肽中的应用
技术领域
1.本技术涉及分析检测技术领域,具体涉及一种氧化型tmb纳米材料及其在检测谷胱甘肽中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本技术的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.普鲁士蓝(pb),即亚铁氰化铁,又称柏林蓝、铁蓝等,是一种深蓝色颜料,分子式为fe4[fe(cn)6]3·
nh2o,是一种混合价态过渡金属铁氰化物。普鲁士蓝是立方结构,和沸石结构相似,fe
3+
和fe
2+
分别交替在立方体的小晶格结点上,而且fe
3+
和fe
2+
之间以cn-桥联,fe
2+
与cn
-
配位后再与fe
3+
结合,形成立方体的网状聚合骨架,骨架内被水分子或k
+
离子占据。普鲁士蓝具有催化、光吸收和光热转化、电导性等优良性能,因此被广泛关注。
[0004]
具体地,普鲁士蓝具有过氧化氢酶、过氧化物酶、超氧化物歧化酶等酶的活性,比如可以催化过氧化氢生成氧气和水。普鲁士蓝具有光热转化性能,可将其用于癌症治疗,比如使用近红外光照射普鲁士蓝,提高肿瘤细胞温度,从而杀死肿瘤细胞。此外,利用光热转化性能,普鲁士蓝还可用于us成像、mri成像等多模态成像。利用普鲁士蓝的电化学性能,可将其制备成传感器,比如分子类传感器(包括无酶传感器和生物传感器)、非活性阳离子传感器和阴离子传感器。无酶传感器的检测机理是基于电极与被测物发生氧化还原反应产生电流从而实现检测目的。如可用普鲁士蓝检测过氧化氢、半胱氨酸等。非活性阳离子传感器是利用普鲁士蓝的多孔结构,使k
+
、nh
4+
、cs
+
、rb
+
可以通过普鲁士蓝的晶格间隙,在溶液中选择性的进行离子交换。基于普鲁士蓝还可以制成检测cl-等离子的阴离子检测器。
[0005]
谷胱甘肽(gsh)是一种含γ-酰胺键和巯基的三肽,由半胱氨酸、谷氨酸及甘氨酸组成,分子式为c
10h17
o6n3s,广泛存在于人体内,是机体中含量最高的巯基化合物。gsh作为抗氧化剂,可清除体内自由基并参与细胞内重要生理生化反应的调控,谷胱甘肽还有保护体内免疫系统的功能。
[0006][0007]
目前,发展了多种测定gsh的检测技术,包括化学的、仪器的,诸如紫外/可见分光光度法、荧光法、酶循环法、电化学法、化学发光法、电致化学发光法、高效液相色谱法、气相色谱法、毛细管电泳法等多种方法,每种方法在灵敏度、选择性、稳定性、检测时间、成本、仪器等方面都各有其优缺点,目前还没有一种既快速、稳定、特异,又十分灵敏、经济的测定方法,影响了他们在高通量的常规临床检测及生物研究中的应用。
[0008]
酶的催化效率高且专一性强,以过氧化物酶为代表的生物催化剂,在食品、化学、环境等领域应用十分广泛。但天然酶价格昂贵,在强酸强碱及高温等极端条件下很容易失活,且较难储存。根据gsh检测技术的发展趋势来看,迫切需要提高检测灵敏度以实现微量样品的高灵敏、高特异性的检测要求。
技术实现要素:
[0009]
为了改善现有技术的不足,本发明提供了一种氧化型tmb纳米材料及其在检测谷胱甘肽中的应用。本发明提供的通过普鲁士蓝催化过氧化氢和tmb反应产生蓝绿色的氧化型tmb,而谷胱甘肽对该蓝绿色氧化型tmb进行还原,使颜色褪去,一方面通过颜色变化,利用吸光度实现定量检测,同时利用pb和氧化型tmb的光热转化性能,进一步降低谷胱甘肽的检测限,实现了谷胱甘肽的多模式检测,并保证了检测结果的准确性、灵敏性,该检测方法线性范围广、检测限低,同时具有良好的特异性和回收率,可广泛用于苹果、梨、黄瓜等实际样品的检测。
[0010]
具体地,本发明提供了下述的技术特征,以下技术特征的一个或多个的结合构成本发明的技术方案。
[0011]
在本发明的第一方面,本发明提供了一种氧化型tmb纳米材料,其为基于普鲁士蓝纳米材料,以普鲁士蓝、3,3',5,5'-四甲基联苯胺和过氧化氢为原料,由普鲁士蓝(pb)催化3,3',5,5'-四甲基联苯胺(tmb)与过氧化氢反应生成。
[0012]
在本发明的实施方式中,所述氧化型tmb纳米材料呈蓝绿色,该颜色具有很明显的识别性。
[0013]
在本发明的第二方面,本发明提供了一种氧化型tmb纳米体系,其包含上述第一方面中所述的氧化型tmb纳米材料,或者,其包含pb和tmb显色液的混合溶液,其中,tmb显色液包含或由tmb、tmb缓冲液和过氧化氢组成。
[0014]
在本发明的一些实施方式中,tmb显色液中,所述tmb缓冲液的ph为3-5,更优选为3-3.5;该缓冲液优选由磷酸氢二钠溶液和柠檬酸溶液组成。缓冲液ph不同,pb催化tmb显现的颜色不同。随着ph增加,吸光度降低,在较酸性环境下,吸光度值较大,尤其是,ph=3时,吸光度值达到最大,但此时颜色并非理想的蓝绿色,而为黄绿色可以理解为酸性过强时反应提前终止而产生的颜色,使得吸光度值增大,而非氧化型tmb产生的吸光度,当ph=3.5时为理想的蓝绿色,因此ph=3.5为反应最优ph,比如在本技术的一些实施方式中,相应的反应条件可以为:反应时间为5min,pb浓度为1mg/ml,过氧化氢体积为2.5μl/ml,tmb浓度为15mg/ml。
[0015]
在本发明的第三方面,本发明提供了一种检测探针,其包含上述第一方面中所述的氧化型tmb纳米材料,或者包含上述第二方面中所述的氧化型tmb纳米体系。
[0016]
在本发明的第四方面,本发明提供了上述第一方面中所述的氧化型tmb纳米材料或上述第二方面中所述的氧化型tmb纳米体系或上述第三方面中所述的检测探针在谷胱甘肽识别和/或检测中应用。
[0017]
在本发明的一些实施方式中,所述谷胱甘肽的识别和/或检测通过谷胱甘肽与氧化型tmb纳米材料接触发生还原反应实现。
[0018]
在本发明的一些实施方式中,所述谷胱甘肽的识别指标为颜色的变化,包括存在
谷胱甘肽时,谷胱甘肽把氧化型tmb纳米材料由蓝绿色还原为无色。
[0019]
在本发明的一些实施方式中,所述谷胱甘肽的检测方法包括存在谷胱甘肽时,谷胱甘肽与氧化型tmb纳米材料接触发生还原反应,利用吸光度和光热转化能力的变化构建线性关系。本发明中所述线性关系的构建可以采用比色法,也可以采用光热法,可实现比色法和光热法多模式检测谷胱甘肽。
[0020]
在本发明的实施方式中,对于谷胱甘肽的检测,其线性检测范围为0.0008mg/ml-0.02mg/ml,比色法检测时的线性回归方程为y=15.139x-0.07295,相关系数r2=0.99,检测限为0.0148mg/ml,光热法检测时的线性回归方程为y=3.0838x+22.976,相关系数r2=0.9825,检测限为0.0011mg/ml。
[0021]
在本发明的第五方面,本发明提供了一种识别和/或检测谷胱甘肽的方法,其包括将上述第一方面中所述的氧化型tmb纳米材料或上述第二方面中所述的氧化型tmb纳米体系或上述第三方面中所述的检测探针与待测溶液接触;观察颜色变化或者利用吸光度或者光热性质变化构建线性关系,识别和/或定量谷胱甘肽。
[0022]
其中,线性关系的构建既可以采用比色法,也可以采用光热法,能够在多模式下实现对谷胱甘肽的检测。
[0023]
在本发明的实施方式中,对于谷胱甘肽的检测,其线性检测范围为0.0008mg/ml-0.02mg/ml,比色法检测时的线性回归方程为y=15.139x-0.07295,相关系数r2=0.99,检测限为0.0148mg/ml,光热法检测时的线性回归方程为y=3.0838x+22.976,相关系数r2=0.9825,检测限为0.0011mg/ml。
[0024]
相较于现有技术,本发明的优势在于:
[0025]
本发明利用pb的催化性能,提供了pb催化3,3-二氨基联苯胺(dab)与过氧化氢(h2o2)反应生成红棕色的氧化型dab(ox-dab)体系,和pb催化3,3',5,5'-四甲基联苯胺(tmb)与过氧化氢(h2o2)反应生成蓝绿色的氧化型tmb(ox-tmb)体系,在研究过程中发现,氧化型tmb纳米体系中的纳米材料具有更为优良的光热转化性能,谷胱甘肽(gsh)可将其由蓝绿色还原为无色的tmb而使得溶液颜色变浅,该过程中伴随吸光度和光热转化能力的降低,体系的吸光度和光热转化能力的变化与谷胱甘肽含量呈线性关系。
[0026]
本发明基于该原理,构建得到了检测谷胱甘肽的标准曲线,从而实现了比色法和光热法多模式下对谷胱甘肽的检测,并且两种检测方法的线性范围较宽,检测限较低,比色法检测限为0.0148mg/ml,光热法检测限更是低至0.0011mg/ml,表现出良好的准确性和灵敏度,同时,该方法具有良好的回收率和特异性,在特异性实验中,本发明以抗坏血酸、葡萄糖、l-组氨酸、l-半胱氨酸、l-丝氨酸、蔗糖作为干扰物质进行选择性实验,结果在吸光度特异性评价和光热特异性评价结果中均表现出极强的选择性。
附图说明
[0027]
构成本技术的一部分的说明书附图用来提供对本技术的进一步理解,本技术的示意性实施例及其说明用于解释本技术,并不构成对本技术的不当限定。以下,结合附图来详细说明本技术的实施方案,其中:
[0028]
图1:a是pb的电镜图;b是pb纳米材料和tmb催化体系的光热转化效率;c是不同tmb浓度下的催化速率曲线;d是tmb酶活的双倒数曲线。
[0029]
图2:a是dab为底物时ph对pb催化活性影响的结果;b是dab为底物时反应时间对pb催化活性影响的结果;c是dab为底物时pb浓度对催化反应影响的结果;d是dab为底物时h2o2体积对pb催化活性影响的结果;e是不同dab浓度对催化活性影响的结果。
[0030]
图3:a是tmb为底物时ph对pb催化活性影响的结果和不同ph下的实物图;b是tmb为底物时反应时间对pb催化活性影响的结果;c是tmb为底物时h2o2体积对pb催化活性影响的结果;d是tmb为底物时pb浓度对催化反应影响的结果;e是不同tmb浓度对催化活性影响的结果。
[0031]
图4:a是dab体系光热照射时间优化结果;b是dab体系光热功率优化结果;c是tmb体系光热照射时间优化结果;d是tmb体系光热功率优化结果。
[0032]
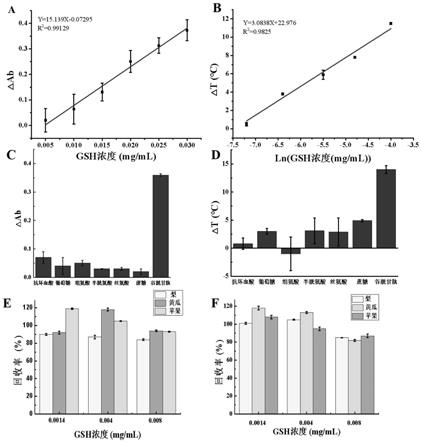
图5:a是吸光度检测gsh标准曲线;b是光热检测gsh标准曲线;c是吸光度特异性评价结果;d是光热特异性评价结果;e是吸光度回收率评价结果;f是光热回收率评价结果。
具体实施方式
[0033]
下面结合具体实施例,进一步阐述本技术。应理解,这些实施例仅用于说明本技术而不用于限制本技术的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
[0034]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本技术所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本技术所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本技术方法中。文中所述的较佳实施方法与材料仅作示范之用。
[0035]
实施例
[0036]
1.材料与方法
[0037]
1.1主要仪器和试剂
[0038]
试剂及仪器
[0039][0040]
1.2主要溶液的配置
[0041]
(1)普鲁士蓝溶液:称取实验室自制的普鲁士蓝1mg溶解于1ml超纯水中,超声30s,使其充分溶解,得到1mg/ml的pb溶液。
[0042]
(2)tmb溶液:取tmb固体10mg溶于1ml n-n-二甲基-甲酰胺中,得到10mg/ml的tmb溶液。
[0043]
(3)不同ph值的tmb缓冲液:称取7.163g十二水合磷酸氢二钠(na2hpo4·
12h2o)和2.101g一水合柠檬酸(c6h8o7·
h2o)分别溶于去离子水中,于100ml的容量瓶中定容,配制成0.2mol/l的磷酸氢二钠溶液和0.1mol/l的柠檬酸溶液,按不同比例加入两种溶液配制成ph为3、3.5、4、4.5、5的tmb缓冲液。
[0044]
(4)不同ph值的pbs缓冲液:称取156.01mg二水合磷酸二氢钠(nah2po4·
2h2o)和358.14mg十二水合磷酸氢二钠(na2hpo4·
12h2o)分别用去离子水定容至100ml,分别配制成0.01mol/l的磷酸二氢钠溶液(a液)和0.01mol/l的磷酸氢二钠溶液(b液),按不同比例混合a液和b液配制成ph为5、6、6.5、7、8的pbs缓冲液。
[0045]
(5)tmb显色液:10μltmb溶液+985μltmb缓冲液+5μl30%h2o2。
[0046]
(6)dab溶液:称取4mg的dab固体溶于1ml的pbs溶液,配制成4mg/ml的dab溶液。
[0047]
(7)dab显色液:1mldab溶液+0.4μl30%h2o2。
[0048]
1.3普鲁士蓝催化h2o2和dab(或tmb)反应体系的设置
[0049]
在ep管中加入20μl一定浓度的pb溶液,然后加入100μl的dab显色液(或tmb显色液),显色液现用现配,震荡混匀后进行反应7min(tmb反应5min)后将待测液分别移入酶标板和ep管中,每孔加样品100μl,每个ep管加样品40μl,每个样品设置3组平行,用酶标仪测定一定波长下的吸光度值,用热像仪测定红外光照射后样品的温升。
[0050]
1.4普鲁士蓝催化h2o2和dab反应条件的优化
[0051]
1.4.1反应体系ph优化
[0052]
称取1mg dab固体分别溶于1ml的ph为5、6、6.5、7、8的pbs缓冲液中,加入0.3μl的
h2o2溶液,混匀后分别取100μl立即加入到20μl1 mg/ml的pb溶液中,振荡均匀,反应10min后加入酶标板中,每孔加100μl,测量460nm波长下不同ph样品的吸光度值,样品设置3组平行。
[0053]
1.4.2反应时间优化
[0054]
各取20μl1 mg/ml的普鲁士蓝于ep管中,加入100μldab显色液,显色液现用现配,设置不同的反应时间,分别反应2、3、5、7、10、13、15min后加入酶标板中,每孔加100μl,于460nm波长测量不同反应时间的样品吸光度值,反应设置3组平行。
[0055]
1.4.3普鲁士蓝浓度优化
[0056]
分别取0.025、0.125、0.25、0.5、1.0、2.0mg/ml的普鲁士蓝20μl和超纯水20μl于ep管中,分别加入100μldab显色液后混匀,反应7min后,加入酶标板中,每孔加100μl,测量460nm波长下的吸光度值,设置3组平行。
[0057]
1.4.4h2o2体积优化
[0058]
在ep管中加入20μl的0.25mg/ml的pb溶液,分别加入用0.1、0.2、0.4、0.8μlh2o2配制成的dab显色液100μl,混匀,反应7min后,加入酶标板中,每孔加100μl,测量460nm波长下的吸光度值,设置3组平行及空白试验。
[0059]
1.4.5dab浓度优化
[0060]
取20μl0.25 mg/ml的pb溶液于ep管中;分别配制0.05、0.1、0.2、0.5、1、2、4、8mg/ml的dab溶液,分别取以上浓度的dab溶液1ml,加入0.4μl的30%h2o2,混匀后加入ep管中,混匀,反应7min后,加入酶标板中,每孔加100μl,测量460nm波长下的吸光度值,设置3组平行。
[0061]
1.5普鲁士蓝催化h2o2和dab反应光热性能优化
[0062]
1.5.1照射时间优化
[0063]
取20μl的0.25mg/ml的pb溶液于ep管中,加入现配的dab显色液100μl,混匀,使其反应7min,将反应后的产物取40μl移到ep管中,在某一特定功率的红光下照射,记录样品的起始温度,每隔10s记录下样品的平均温度和最高温度,计算温升[温升=(平均温度+最高温度)/2-起始温度],设置3组平行。
[0064]
1.5.2照射功率优化
[0065]
取20μl的0.25mg/ml的pb溶液于ep管中,加入现配的dab显色液100μl,混匀,使其反应7min,将反应后的产物取40μl移到ep管中,将其在1、2、2.5、3、3.5、4w的红光下照射,记录起始温度,照射2min,记录平均温度和最高温度,计算温升[温升=(平均温度+最高温度)/2-起始温度],设置3组平行。
[0066]
1.6普鲁士蓝催化h2o2和tmb反应条件的优化
[0067]
1.6.1反应体系ph优化
[0068]
取20μl的0.25mg/ml的普鲁士蓝溶液于ep管中,分别在985μl的ph为3、3.5、4、4.5、5的tmb缓冲液中加入10μltmb溶液和5μl 30%的h2o2溶液,混匀后各取100μl,立即加入到20μl0.25 mg/ml的pb溶液中,振荡均匀,反应20min后加入酶标板中,每孔加100μl,测量450nm波长下的反应产物吸光度值,设置3组平行。
[0069]
1.6.2反应体系时间优化
[0070]
各取20μl 0.25mg/ml的普鲁士蓝于ep管中,加入100μltmb显色液,显色液现用现配,设置不同的反应时间,分别反应1、5、10、20、30、40min后加入酶标板中,每孔加100μl,于450nm波长测量不同反应时间的样品吸光度值,反应设置3组平行及空白试验。
[0071]
1.6.3反应体系pb浓度优化
[0072]
分别取0.025、0.125、0.25、0.5、1.0、2.0mg/ml的普鲁士蓝20μl和超纯水20μl于ep管中,分别加入100μltmb显色液后混匀,反应5min后,加入酶标板中,每孔加100μl,测量450nm波长下的吸光度值,设置3组平行及空白试验。
[0073]
1.6.4反应体系h2o2体积优化
[0074]
在ep管中加入20μl的1.0mg/ml的pb溶液,分别加入用1μl、2.5μl、5μl、7.5μl、10μlh2o2配制成的tmb显色液100μl,混匀,反应5min后,加入酶标板中,每孔加100μl,测量450nm波长下的吸光度值,设置3组平行及空白试验。
[0075]
1.6.5反应体系tmb浓度优化
[0076]
取20μl1.0 mg/ml的pb溶液于ep管中;分别配制1mg/ml、5mg/ml、10mg/ml、15mg/ml、20mg/ml的tmb溶液,分别取以上浓度的tmb溶液10μl,加入984μl的tmb缓冲液和6μl30%h2o2混匀后取100μl显色液加入ep管中,混匀,反应7min后,加入酶标板中,每孔加100μl,测量450nm波长下的吸光度值,设置3组平行。
[0077]
1.7普鲁士蓝催化h2o2和tmb反应光热性能的优化
[0078]
1.7.1照射时间优化
[0079]
取20μl的0.25mg/ml的pb溶液于ep管中,加入现配的tmb显色液100μl,混匀,使其反应20min,将反应后的产物取40μl移到ep管中,在功率为3w的红外激光下照射,记录样品的起始温度,每隔10s记录下样品的平均温度和最高温度,计算温升[温升=(平均温度+最高温度)/2-起始温度],设置3组平行。
[0080]
1.8谷胱甘肽和普鲁士蓝反应
[0081]
1.8.1dab体系下谷胱甘肽与普鲁士蓝反应
[0082]
在ep管中加入20μl一定浓度的pb溶液,分别加入120μl的不同浓度gsh,再加入100μl的dab显色液,显色液现用现配,混匀后反应7min。将待测液移入酶标板中,每孔加样品100μl,每个样品设3组平行,用酶标仪测定460nm波长下的吸光度值;将待测液40μl移入ep管中,用热像仪测定3w红外激光照射120s的温升。
[0083]
1.8.2tmb体系下谷胱甘肽与普鲁士蓝反应
[0084]
在ep管中加入20μl一定浓度的pb溶液,分别加入120μl的不同浓度gsh,再加入100μl的tmb显色液,显色液现用现配,混匀后反应20min。将待测液移入酶标板中,每孔加样品100μl,每个样品设3组平行,用酶标仪测定450nm波长下的吸光度值;将待测液40μl移入ep管中,用热像仪测定3w红外激光照射70s的温升。
[0085]
1.9检测限探究
[0086]
将三倍空白标准偏差代入标曲,计算得出检测限。
[0087]
1.10检测性能评价
[0088]
1.10.1重复性评价
[0089]
为了证明实验的重复性,在12只ep管中分别加入20μl一定浓度的pb溶液和120μl的0.004mg/ml的干gsh,再加入100μl的tmb显色液,显色液现用现配,混匀后反应20min。将待测液移入酶标板中,每孔加样品100μl。用酶标仪测定450nm波长下的吸光度值;将待测液40μl移入ep管中,用热像仪测定3w红外光照射70s的温升。计算12只ep管的cv值(cv值=标准偏差/平均值)。
[0090]
1.10.2特异性评价
[0091]
为了证明该方法对gsh具有选择性,用抗坏血酸、葡萄糖、l-组氨酸、l-半胱氨酸、l-丝氨酸、蔗糖作为干扰物质进行选择性实验。
[0092]
在ep管中加入20μl一定浓度的pb溶液,分别加入120μl的0.004mg/ml的干扰物和gsh,再加入100μl的tmb显色液,显色液现用现配,混匀后反应20min。将待测液移入酶标板中,每孔加样品100μl,每个样品设3组平行,用酶标仪测定450nm波长下的吸光度值;将待测液40μl移入ep管中,用热像仪测定3w红外激光照射70s的温升。
[0093]
1.10.3回收率评价
[0094]
为了考查食品基质对该检测方法是否有影响,选取了黄瓜、梨、苹果三种果蔬,用其稀释后的果蔬汁进行回收率评价。
[0095]
用稀释后的果蔬汁分别配制0.0016mg/ml、0.004mg/ml、0.008mg/ml的谷胱甘肽溶液。
[0096]
在ep管中加入20μl一定浓度的pb溶液,分别加入120μl三种浓度用相应果蔬汁配制的gsh溶液,再加入100μl的tmb显色液,显色液现用现配,混匀后反应20min。将待测液移入酶标板中,每孔加样品100μl,每个样品设3组平行,用酶标仪测定450nm波长下的吸光度值;将待测液40μl移入ep管中,用热像仪测定3w红外激光照射70s的温升。
[0097]
2.结果与分析
[0098]
2.1材料表征
[0099]
通过透射电子显微镜观察pb的形态结构,如图1a所示,pb为100nm的立方体结构,且具有一定的分散性;图1b展示的是pb纳米材料的光热转化效率,且在加入tmb体系后整体的显色体系光热转化效率有一定的提高,这可能反应体系生成的氧化性tmb也具有一定的光热转化效率,从而使整体光热转化效率大于pb纳米材料的光热转化效率;通过图1c和d,计算出tmb体系的酶动力学常数km为0.05422m。
[0100]
2.2普鲁士蓝催化h2o2和dab反应条件的优化结果
[0101]
2.2.1反应体系ph优化结果
[0102]
酶是有两性电解质性质的蛋白质,在一定溶液中会发生解离,酶的解离行为受到h
+
的影响,酶活性中心的功能基团的解离状态会影响酶的催化能力以及酶对底物的亲和力,因此,溶液ph的改变对反应速度有显著影响。普鲁士蓝在中性和碱性溶液中溶解会变得不稳定,在酸性条件下较稳定。pb具有其最适催化ph,底物dab也有其最适显色ph,本实验通过改变缓冲液的ph,提供不同ph的反应体系,找到普鲁士蓝催化dab显色的最佳ph。
[0103]
缓冲液ph不同,pb催化dab显现的颜色不同,酸性环境显红色,随着反应体系ph的增加,反应显色由红色过渡到褐色。结果如图2a所示,在酸性环境下,吸光度值较大,催化效果较好,而碱性环境吸光度值较小,不利于催化反应进行,ph=5时,吸光度值达到最大,因此ph=5为反应最优ph,普鲁士蓝在酸性环境下较稳定。
[0104]
2.2.2反应时间优化结果
[0105]
反应过程中反应时间也十分重要,反应时间太短则导致反应不充分,反应时间太长则可能会导致反应产物分解。所以,优化反应时间至关重要。
[0106]
加入显色剂后,普鲁士蓝开始催化底物显色,随着时间延长,颜色逐渐加深,结果如图2b所示,吸光度值呈直线上升,在这期间pb与底物的量均充足;7min后吸光度值增加速
率减缓,可能是底物浓度减小。故认为7min为最优反应时间。
[0107]
2.2.3普鲁士蓝浓度优化结果
[0108]
酶浓度对催化反应至关重要,酶浓度过高会导致酶不能充分利用,造成浪费;酶浓度不足会导致反应时间增长,反应不充分。因此,优化普鲁士蓝浓度至关重要。
[0109]
pb浓度不同,催化dab显现的颜色不同。结果如图2c所示,普鲁士蓝浓度较低时,随普鲁士蓝浓度增加,吸光度值增加较大,当pb浓度到达0.25mg/ml时,吸光度值增加速度减缓,当pb浓度到达0.5mg/ml时,随普鲁士蓝浓度增加吸光度也不再增加。结合反应呈现的颜色,当pb浓度为0.25mg/ml时是理想颜色。因此认为0.25mg/ml是普鲁士蓝的最优浓度。
[0110]
2.2.4h2o2体积优化结果
[0111]
h2o2含量会影响显色液的显色时间。显色的所需时间会随h2o2含量的减少而增长,h2o2超过一定的浓度,会使显色反应过程进行过快而导致背景加深;而过量的h2o2又会使酶失活,达不到预期效果。
[0112]
h2o2浓度较低时,随着h2o2浓度增加吸光度值直线上升,结果如图2d所示,由于h2o2含量增加,会解离出更多的自由基,使反应速率加快。当h2o2浓度达到0.4μl/ml时,随着h2o2浓度再增加,吸光度值无明显变化,可能是由于普鲁士蓝催化活力受到高浓度h2o2的抑制,因此pb催化反应中,0.4μl/ml为h2o2的最优浓度。
[0113]
2.2.5dab浓度优化结果
[0114]
dab显色液中dab的合适含量可以减少dab的用量,节约处理dab的费用,减轻对环境污染的影响。
[0115]
由图2e可知,随着dab底物浓度的增加,吸光度值不断增大,刚开始dab的量对吸光度的影响较大,当浓度低于2mg/ml时,吸光度值随dab浓度变化增加较快,当dab浓度超过2mg/ml时,吸光度值增加减缓,直到dab浓度到4mg/ml时,随着dab底物浓度的增加吸光度值变化不大。在底物浓度较低时,只有部分普鲁士蓝能与底物结合,随着底物dab浓度增加,被底物结合的pb越来越多,催化效果增大,吸光度增加。当dab浓度达到4mg/ml时pb被饱和,故随着dab底物浓度的增加反应速率也不再增加,因此认为4mg/ml为底物dab的最佳浓度。
[0116]
2.3普鲁士蓝催化h2o2和tmb反应条件的优化结果
[0117]
2.3.1反应体系ph优化结果
[0118]
普鲁士蓝在中性和碱性溶液中溶解会变得不稳定,在酸性条件下较稳定。pb具有其最适催化ph,底物tmb也有其最适显色ph,本实验通过改变缓冲液的ph,提供不同ph的反应体系,找到普鲁士蓝催化tmb显色的最佳ph。
[0119]
缓冲液ph不同,pb催化tmb显现的颜色不同。结果如图3a所示,随着ph增加,吸光度降低,在较酸性环境下,吸光度值较大。ph=3时,吸光度值达到最大,但此时颜色为黄绿色而非蓝绿色,影响吸光度波长的选择,当ph=3.5时为理想颜色,因此ph=3.5为反应最优ph。
[0120]
2.3.2反应体系时间优化结果
[0121]
反应过程中反应时间也十分重要,反应时间太短斜率太高则导致实验操作难以完成,反应时间太长则可能会导致反应产物分解。所以,优化反应时间至关重要。
[0122]
加入显色剂后,普鲁士蓝开始催化底物显色,结果如图3b所示,随着时间延长,颜色逐渐变浅,吸光度值不断下降,0-5min吸光度值下降迅速,而5-10min时吸光度值下降速
度降低,为提高实验结果的稳定性,故认为5min为最优反应时间。
[0123]
2.3.3反应体系h2o2体积优化结果
[0124]
h2o2含量会影响显色液的显色时间。显色的所需时间会随h2o2含量的减少而增长,h2o2超过一定的浓度,会使显色反应过程进行过快而导致背景加深;而过量的h2o2又会使酶失活,达不到预期效果。
[0125]
h2o2浓度较低时,随着h2o2浓度增加吸光度值直线上升,结果如图3c所示,由于h2o2含量增加,会解离出更多的自由基,使反应速率加快。当h2o2浓度达到5μl/ml时,吸光度值达到最大,但反应过于迅速,5min后颜色肉眼可见的变浅,随着h2o2浓度再增加,吸光度值不断下降,可能是由于普鲁士蓝催化活力受到高浓度h2o2的抑制,因此pb催化反应中,2.5μl/ml为h2o2的最优浓度。
[0126]
2.3.4反应体系pb浓度优化结果
[0127]
pb浓度不同,催化tmb显色的效率不同。结果如图3d所示,随着pb浓度不断的增加,体系吸光度值不断上升,反应体系的颜色也越来越深,但当pb浓度达2mg/ml时pb较难溶解,为实验带来不便,因此选pb为1mg/ml时作为最优浓度。
[0128]
2.3.5反应体系tmb浓度优化结果
[0129]
tmb显色液中tmb的合适含量可以减少tmb的用量,节约处理tmb的费用,减轻对环境污染的影响。
[0130]
由图3e可知,随着tmb底物浓度的增加,吸光度值不断增大,当浓度高于15mg/ml时,吸光度值随tmb浓度变化增速变缓,随着tmb底物浓度的增加吸光度值变化不大。在底物浓度较低时,只有部分普鲁士蓝能与底物结合,随着底物dab浓度增加,被底物结合的pb越来越多,催化效果增大,吸光度增加。当tmb浓度达到15mg/ml时pb接近饱和,故随着tmb底物浓度的增加反应速率增幅不大,因此认为15mg/ml为底物tmb的最佳浓度。
[0131]
2.4普鲁士蓝催化dab和tmb反应光热条件优化结果
[0132]
2.4.1dab光热照射时间优化结果
[0133]
随照射时间增加,反应物温度也会升高,温度升到一定程度,则温升变化不大。如果照射时间太短,可能温度还在较快上升,导致实验误差较大;如果照射时间太长,会增大实验误差,延长检测时间。由图4a可得,随照射时间增加,反应物温度也会升高,当120s后,温升变化不大。当照射时间超过120s,虽然温度仍在增加,但增加速率减小。因此,120s为最优照射时间。
[0134]
2.4.2dab光热照射功率优化结果
[0135]
照射功率对温度变化至关重要,照射功率太低,会导致温升变化不大,照射功率太高,会导致温度升高过快,不容易控制实验操作,甚至可能损坏实验仪器。由图4b可知,当照射功率低于3w时,随照射功率增加,温升增加,当照射功率大于3w时,温度仍在增加,但速度减缓,当功率大于3w时,温度过高。因此,3w为最优照射功率。
[0136]
2.4.3tmb光热照射时间优化结果
[0137]
由图4c可得,随照射时间增加,反应物温度也会升高,当70s后,温升变化不再增加。因此,70s为最优照射时间。
[0138]
2.4.4tmb光热照射功率优化结果
[0139]
由图4d可知,随照射功率增加,温升增加,当功率达到3.5w时温度升达74.8℃,液
体实际温度达99℃,当功率进一步升高,局部最高温度将超过100℃,这会导致液体的蒸发,从而影响检测结果;因此,3.5w为最优照射功率。
[0140]
2.5基于普鲁士蓝性能的谷胱甘肽检测
[0141]
2.5.1反应体系的选择
[0142]
在建立的pb催化3,3-二氨基联苯胺(dab)与过氧化氢(h2o2)反应生成红棕色的氧化型dab(ox-dab)体系,和pb催化3,3',5,5'-四甲基联苯胺(tmb)与过氧化氢(h2o2)反应生成蓝绿色的氧化型tmb(ox-tmb)体系下进行检测谷胱甘肽时发现,在dab体系下,光热性能梯度不理想,无法得出所需的标准曲线;而tmb体系光热性能梯度较dab体系更优异,能够得出吸光度法检测谷胱甘肽的标准曲线(图5a)和光热法检测谷胱甘肽的标准曲线(图5b),故实验最终选择使用tmb体系。
[0143]
2.5.2通过吸光度检测gsh标准曲线(tmb体系)
[0144]
在最佳条件下,通过与不同浓度gsh反应,确定了用比色法检测gsh的标准曲线,如图5a所示。450nm处的溶液吸光度随gsh浓度增加而降低,吸光度(y)与gsh浓度(x)呈良好的线性关系。线性回归方程为y=15.139x-0.07295(r2=0.99),计算得检测限为0.0148mg/ml。
[0145]
2.5.3通过光热检测gsh标准曲线(tmb体系)
[0146]
在最佳条件下,通过与不同浓度gsh反应,确定了用光热性质检测gsh的标准曲线,如图5b所示。将反应溶液在3w的红外激光下照射70s,与空白的温升差值随gsh浓度增加而降低,温升差(y)与gsh浓度的自然对数(x)呈良好的线性关系。线性回归方程为y=3.0838x+22.976(r2=0.9825),计算得检测限为0.0011mg/ml。
[0147]
2.6谷胱甘肽检测灵敏度的确定
[0148]
在最佳条件下,通过与不同浓度gsh反应,确定了用比色法和光热法检测gsh的标准曲线,比色法的线性回归方程为y=15.139x-0.07295(r2=0.99),检测限0.0148mg/ml;光热法的线性回归方程为y=3.0838x+22.976(r2=0.9825),检测限为0.0011mg/ml,光热检测进一步提升了检测灵敏度。
[0149]
2.7检测性能评价结果
[0150]
2.7.1重复性评价结果
[0151]
分别计算12个样品吸光度和光热的平均值和标准偏差。吸光度的平均值为0.9728,标准偏差为0.0205,cv值为0.0211;光热的平均温升为45.4667,标准偏差为1.3796,cv值为0.0303。
[0152]
2.7.2特异性评价结果
[0153]
如图5c、5d所示,相同浓度的干扰物(抗坏血酸、葡萄糖、组氨酸、半胱氨酸、丝氨酸、蔗糖)与谷胱甘肽的吸光度与空白溶液的吸光度值相比,除谷胱甘肽引起明显的吸光度值改变,干扰物质的吸光度变化较小,说明该方法对谷胱甘肽特异性强。
[0154]
2.7.3回收率评价结果
[0155]
如图5e、图5f所示,梨、苹果、黄瓜机制下谷胱甘肽三个浓度的吸光度回收率和光热回收率均在80%-120%之间,符合检测要求。
[0156]
3.结论
[0157]
本发明基于普鲁士蓝的催化性能,设立了pb催化dab与tmb两个反应体系,优化了
两个体系的反应条件,表征了pb纳米的结构,光热转化效率和tmb的酶动力常数。其中pb为粒径100nm左右的立方体结构,其光热转化效率17%左右;tmb的酶动力学常数km为0.05521m;普鲁士蓝催化dab反应体系的最优ph为5,反应时间为7min,pb浓度为0.25mg/ml,h2o2体积为0.4μl/ml,dab浓度为4mg/ml,光热照射时间为120s,照射功率为3w;普鲁士蓝催化tmb反应体系的最优ph为3.5,反应时间为5min,pb浓度为1mg/ml,h2o2体积为2.5μl/ml,tmb浓度为15mg/ml光热照射时间为70s,照射功率为3.5w。由于在dab体系下,光热温度差效果较差,故最终选用tmb体系进行谷胱甘肽的检测。基于普鲁士蓝的催化性能和良好的光热性能,建立了检测谷胱甘肽的比色法和光热法,通过制定标准曲线实现了谷胱甘肽的定量检测,其线性检测范围为0.0008mg/ml-0.02mg/ml,比色法检测限为0.0148mg/ml,光热法检测限为0.0011mg/ml。此外该方法具有良好的重复性,特异性和回收率,因此对食品中谷胱甘肽的检测有一定的应用价值。
[0158]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,尽管参照前述实施例对本技术进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
