1.本发明涉及生物技术领域,尤其涉及一种植物外泌体微囊包埋冻干粉及其制备方法。
背景技术:
2.现有植物外泌体的制备方法主要是通过提取分离制成液体直接使用,但液态的外泌体浓度较低,对温度也较为敏感,需冷藏储存、运输,含植物外泌体的产品在加工、存贮、运输中受到温度、水分、等环境因素的胁迫,限制了外泌体的应用;将外泌体进行干燥后,可克服水分影响,常用的干燥方式主要有喷雾干燥和真空冷冻干燥,其中,喷雾干燥法成本低,效率高,但是由于需要经过高温,会影响外泌体结构及活性,这种干燥方式更适合热敏性低的液体样品,采用真空冷冻干燥后,易储存并可延长保质期,扩宽外泌体的使用范围,既可以用于液体产品也可以用于固体饮料、压片糖果、胶囊等,但直接将外泌体冻干,在冻干过程中可能对外泌体结构引起一定的破坏且直接冻干后易吸潮;无论是液体还是冻干后的外泌体,在应用于产品时,加工过程中其活性会受到一定影响,其进入体内后也会受胆盐、胃酸等影响,降低活性及靶向性。所以需要研究一种能对外泌体进行保护并可提高其利用率的新方法对其进行处理;为了克服以上问题,许多保护技术被研究和利用。其中,微囊技术凭借粒径小和对包埋物质保护性好、释放性佳等特点得以研究应用。但微胶囊的制备方法众多,壁材选择不合适和包埋方法不正确会引起微胶囊易簇集、易破裂、颗粒大小不均一等缺点,所以选择合适的壁材及包埋方法成为重点研究的方向。用微囊包埋技术对外泌体进行保护的方法和技术还未得以应用,需进行深入研究探索。同时选择合适的保护剂及干燥方式也影响着最终的活性和应用。
技术实现要素:
3.针对现有技术存在的问题,本发明提供了一种植物外泌体微囊包埋冻干粉及其制备方法。
4.为达到上述目的,本发明提供如下技术方案:
5.一方面,提供一种植物外泌体微囊包埋冻干粉,其特征在于,包括植物外泌体、一次包衣和二次包衣;所述一次包衣包裹于所述植物外泌体表面,所述二次包衣包裹于所述一次包衣表面;所述一次包衣的成分选自海藻酸盐;所述二次包衣的成分选自动物性纤维素。
6.优选地,所述海藻酸盐选自海藻酸钠或海藻酸钙;所述动物性纤维素选自壳寡糖。
7.优选地,所述的植物外泌体微囊包埋冻干粉还含有冻干保护剂。
8.优选地,所述冻干保护剂选自抗性糊精。
9.优选地,所述植物外泌体选自生姜外泌体、洋葱外泌体、葡萄柚外泌体、西兰花外泌体和姜黄外泌体等。
10.优选地,所述植物外泌体微囊包埋冻干粉的制备方法如下:采用海藻酸钠溶液对
植物外泌体进行一次包被,获得一次包被微胶囊,采用壳寡糖对所述一次包被微胶囊进行二次包被,获得二次包被微胶囊,将所述微胶囊与抗性糊精混合后,进行真空冷冻干燥,获得植物外泌体微囊冻干粉。
11.另一方面,提供一种植物外泌体微囊包埋冻干粉的制备方法,包含以下步骤:采用海藻酸钠溶液对植物外泌体进行一次包被,获得一次包被微胶囊,采用壳寡糖对所述一次包被微胶囊进行二次包被,获得二次包被微胶囊,将所述微胶囊与抗性糊精混合后,进行真空冷冻干燥,获得植物外泌体微囊冻干粉。
12.优选地,采用海藻酸钠溶液对植物外泌体进行一次包被的具体过程如下:
13.(1)取质量分数为1-4%的海藻酸钠溶液分别与25ml浓度为15-25mmol/l ca
2+-溶液混合,取上述混合溶液与植物外泌体混合均匀,加入到含1.2%span80的植物油中,250-350r/min 机械搅拌10-20min;
14.(2)按照冰乙酸和ca
2+-溶液的摩尔比为5:1配制酸化液,逐滴加入含有冰醋酸的植物油, 120r/min机械搅拌25-35min;
15.(3)向上述溶液中加入含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
16.优选地,所述步骤(1)中混合溶液、植物外泌体与植物油的体积比为2:3:14。
17.优选地,所述ca
2+-为ca-edta。
18.优选地,所述步骤(2)中冰乙酸与ca
2+-的摩尔比为(4.5-5.5):1。
19.优选地,所述植物油选自无菌大豆油或玉米胚芽油。
20.优选地,所述无菌大豆油或玉米胚芽油中含有span80。
21.优选地,所述span80在大豆油或玉米胚芽油中的质量百分数为1.2%。
22.优选地,采用壳寡糖对所述一次包被微胶囊进行二次包被的具体过程如下:
23.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
24.优选地,所述壳寡糖与所述一次包被微胶囊的投料质量比为:(0.45-0.5):(8-10)。
25.优选地,真空冷冻干燥的具体过程如下:将所述二次包被微胶囊与冻干保护剂按照1:10-15 的比例进行混合后,进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40~-30℃左右冷冻1-2h直至物料中心温度在-30~-20℃,再将物料放置加热板进行加热,在0.5~1h内将加热板温度升高至90~100℃,并在此温度下维持4-5h;在0.5~1h内将加热板温度降至80-90℃,并在此温度下维持4-5h;在0.5~1h内将加热板温度降至70-80℃,并在此温度下维持5h;在0.5~1h内将加热板温度降至50-70℃,并在此温度下维持4-5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
26.优选地,所述冻干保护剂选自抗性糊精。
27.优选地,所述植物外泌体选自血橙外泌体、苹果外泌体、树莓外泌体、甘薯外泌体、荔枝外泌体、番茄外泌体、冬瓜外泌体、菠萝外泌体、白菜外泌体、苦瓜外泌体、覆盆子外泌体、芥蓝外泌体、茄子外泌体、茼蒿外泌体、芒果外泌体、火龙果外泌体、梅子外泌体、菠菜外
泌体、空心菜外泌体、南瓜外泌体、玉米外泌体、马铃薯外泌体、金针菇外泌体、山药外泌体、香菇外泌体、黑豆外泌体、芋头外泌体、青梅外泌体、沙棘外泌体、枸杞外泌体、枇杷外泌体、西芹外泌体、丝瓜外泌体、杨桃外泌体、莲雾外泌体、花椰菜外泌体、番薯叶外泌体、甜菜根外泌体、芦笋外泌体、青椒外泌体、银耳外泌体、佛手瓜外泌体、豌豆苗外泌体、雪里红外泌体、西番莲外泌体、猕猴桃外泌体、柑橘外泌体、诺丽果外泌体、奇异果外泌体、肉桂外泌体、昆布外泌体、草莓外泌体、荷叶外泌体、黑果枸杞外泌体、甘草外泌体、葛根外泌体、橄榄外泌体、接骨木莓外泌体、洛神花外泌体、玫瑰茄外泌体、朝鲜蓟外泌体、黑加仑外泌体、红参外泌体、决明子外泌体、郁李仁外泌体、角豆外泌体、茶叶外泌体、余甘子外泌体、山竹外泌体、桑叶外泌体、黑大豆外泌体、白云豆外泌体、海藻外泌体、桑叶外泌体、大麦苗外泌体、生姜外泌体、大蒜外泌体、大葱外泌体、洋葱外泌体、葡萄柚外泌体、西兰花外泌体、黄瓜外泌体、姜黄外泌体、红葡萄外泌体、蔓越莓外泌体、红石榴外泌体、橙子外泌体、秋葵外泌体、西红柿外泌体、木瓜外泌体、芡实外泌体、莲藕外泌体、柴胡外泌体、地黄外泌体、苦参外泌体、雪菊外泌体、五味子外泌体、紫苏子外泌体、杏仁外泌体、山楂外泌体、桃仁外泌体、百香果外泌体、白豆蔻外泌体、红豆蔻外泌体、山药外泌体、南瓜外泌体、香菜外泌体、胡萝卜外泌体、芹菜外泌体、桃子外泌体、樱桃外泌体、橙子外泌体、柠檬外泌体、小茴香外泌体、玫瑰花外泌体、丹参外泌体、西洋参外泌体、人参外泌体、党参外泌体、黄芪外泌体、甘草外泌体、黄精外泌体、藿香外泌体、苍术外泌体、石斛外泌体、红景天外泌体、藏红花外泌体、罗汉果外泌体、玫瑰茄外泌体、芦荟外泌体、绿茶外泌体、竹叶外泌体、玛卡外泌体、百合外泌体、薰衣草外泌体、金银花外泌体罗勒外泌体、薄荷外泌体、马齿苋外泌体、金纽扣花、外泌体或山茶花外泌体。
28.优选地,本发明所述植物外泌体的制备方法如下:取植物果实或根茎100-200g,倒入榨汁机中,向其中加入100-200ml灭菌pbs,榨汁匀浆之后在2500-3500g,4℃离心10-25min,去除较大的残渣;取中间层的透明溶液在8000-12000g,4℃离心60-80min;取上清液在 100000-120000g,4℃超速离心50-80min,然后使用无菌pbs重悬沉淀再在110000-130000g, 4℃超速离心50-80min;离心后,用无菌pbs重悬沉淀,此时即得植物外泌体。
29.相对于现有技术,本发明的有益效果在于:
30.本发明提供一种植物外泌体微囊包埋技术,首先通过对外泌体的提取分离技术进行优化,可获得高浓度高活性的外泌体提取液,通过筛选合适的壁材及包埋方法对植物外泌体进行微囊包埋,提高其浓度、活性、耐受性、靶向性等,使植物外泌体可更广泛应用于不同基质的产品中,同时合适的壁材及包埋方法不仅不会影响产品品质,还有利于提高产品风味口感及稳定性,尤其是对本身有不良风味的外泌体,通过包埋可以遮掩一部分不良风味。微囊化包埋还可以提高植物外泌体在肠道中的黏附功能。
具体实施例
31.下面将对本发明实施例中的技术方案进行详细地描述。
32.实施案例1
33.本实施例提供一种植物外泌体微囊包埋冻干粉,包括植物外泌体、一次包衣和二次包衣;所述一次包衣包裹于所述植物外泌体表面,所述二次包衣包裹于所述一次包衣表面;所述一次包衣的成分选自海藻酸盐;所述二次包衣的成分选自动物性纤维素。
34.在一些实施例中,所述海藻酸盐选自海藻酸钠或海藻酸钙;所述动物性纤维素选自壳寡糖。
35.在一些实施例中,所述的植物外泌体微囊包埋冻干粉还含有冻干保护剂;所述冻干保护剂选自抗性糊精。
36.在一些实施例中,所述植物外泌体选自生姜外泌体、大蒜外泌体、大葱外泌体、洋葱外泌体、葡萄柚外泌体、西兰花外泌体、黄瓜外泌体、姜黄外泌体、红葡萄外泌体、蔓越莓外泌体、红石榴外泌体、橙子外泌体、秋葵外泌体、西红柿外泌体、木瓜外泌体、芡实外泌体、莲藕外泌体、柴胡外泌体、地黄外泌体、苦参外泌体、雪菊外泌体、五味子外泌体、紫苏子外泌体、杏仁外泌体、山楂外泌体、桃仁外泌体、百香果外泌体、白豆蔻外泌体、红豆蔻外泌体、山药外泌体、南瓜外泌体、香菜外泌体、胡萝卜外泌体、芹菜外泌体、桃子外泌体、樱桃外泌体、橙子外泌体、柠檬外泌体、小茴香外泌体、玫瑰花外泌体、丹参外泌体、西洋参外泌体、人参外泌体、党参外泌体、黄芪外泌体、甘草外泌体、黄精外泌体、藿香外泌体、苍术外泌体、石斛外泌体、红景天外泌体、藏红花外泌体、罗汉果外泌体、玫瑰茄外泌体、芦荟外泌体、绿茶外泌体、竹叶外泌体、玛卡外泌体、百合外泌体、薰衣草外泌体、罗勒外泌体、薄荷外泌体、马齿苋外泌体、金纽扣花外泌体或山茶花外泌体。
37.在一些实施例中,所述植物外泌体微囊包埋冻干粉的制备方法如下:采用海藻酸钠溶液对植物外泌体进行一次包被,获得一次包被微胶囊,采用壳寡糖对所述一次包被微胶囊进行二次包被,获得二次包被微胶囊,将所述微胶囊与抗性糊精混合后,进行真空冷冻干燥,获得植物外泌体微囊冻干粉。
38.实施案例2
39.本实施例提供一种生姜外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
40.称取150g新鲜生姜倒入榨汁机中,向其中加入150ml灭菌pbs,榨汁匀浆之后在3000g, 4℃离心20min,去除较大的残渣;取中间层的黄色透明溶液在10000g,4℃离心70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g,4℃超速离心60min;离心后,用1ml无菌pbs重悬沉淀,此时即得生姜外泌体提取液。
41.将上述生姜外泌体提取液、浓度为30mg/ml的无菌海藻酸钠溶液和含有2μl/mlspan80 的无菌大豆油以1∶1∶10的体积比混合,使用180r/min磁力搅拌10min,获得乳化液。向乳化液中迅速加入100ml浓度为20mg/ml无菌cacl2溶液,继续搅拌25min。2000r/min离心 10min收集一次包被微胶囊,在4℃用体积分数0.1%无菌生理盐水洗涤2-3次以除去过量的钙离子和未被包裹的植物外泌体。
42.将0.45g壳寡糖溶解于90ml蒸馏水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用蒸馏水将溶液的总体积调节至100ml,得到5mg/ml的壳寡糖溶液。将10g一次包被微胶囊浸入100ml过滤除菌的浓度为5mg/ml的壳寡糖溶液中,用磁力搅拌器100r/min搅拌 20min进行涂覆,过滤收集二次包被微胶囊。
43.将上述所得的二次包被微胶囊进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40℃左右冷冻1h直至物料中心温度在-30~-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至90℃,并在此温度下维持5h;在0.5h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至70℃,并在此
温度下维持5h;在0.5h内将加热板温度降至60℃,并在此温度下维持4-5h直至物料温度不再变化后取出,即为生姜外泌体微囊包埋冻干粉。
44.实施案例3
45.本实施例提供一种生姜外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
46.称取200g新鲜生姜倒入榨汁机中,向其中加入225ml灭菌pbs,榨汁匀浆之后在3500g, 4℃离心30min,去除较大的残渣;取中间层的黄色透明溶液在15000g,4℃离心70min;取上清液在150000g,4℃超速离心80min,然后使用2ml无菌pbs重悬沉淀再在150000g,4℃超速离心80min;离心后,用2ml无菌pbs重悬沉淀,此时即得生姜外泌体。
47.制备用质量分数为2%的海藻酸钠溶液与25mmol/l的ca-edta溶液制混合,取25ml 配好的上述溶液与15ml生姜外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,280r/min机械搅拌20min;
48.按照冰乙酸和ca-edta的摩尔比5.5:1配制成酸化液,向所述酸化液逐滴加入含有0.25 g冰醋酸的25ml玉米胚芽油,150r/min条件下机械搅拌30min;
49.向上述溶液中中加入150ml含0.9%nacl的磷酸盐缓冲液,所述磷酸盐缓冲液的浓度为 0.1mol/l,ph值为7.0,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
50.将0.45g壳寡糖溶解于90ml蒸馏水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用蒸馏水将溶液的总体积调节至100ml,得到5mg/ml的壳寡糖溶液,将10g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌20min进行涂覆,过滤收集,获得二次包被微胶囊。
51.将上述所得的二次包被微胶囊进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-35℃左右冷冻1-2h直至物料中心温度在-25℃,再将物料放置加热板进行加热,在0.5~1h内将加热板温度升高至90℃,并在此温度下维持5h;在0.5h内将加热板温度降至80℃,并在此温度下维持4h;在1h内将加热板温度降至70℃,并在此温度下维持 5h;在0.5h内将加热板温度降低至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
52.实施案例4
53.本实施例提供一种洋葱外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
54.称取100g新鲜洋葱倒入榨汁机中,向其中加入100ml灭菌pbs,榨汁匀浆之后在3200g,4℃离心15min,去除较大的残渣;取中间层的黄色透明溶液在12000g,4℃离心40-70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g,4℃超速离心80min;离心后,用1ml无菌pbs重悬沉淀,此时即得洋葱外泌体。
55.取30ml质量分数为3%的海藻酸钠溶液分别与50ml浓度为20mmol/l的ca-edta 混合,取10ml配好的上述溶液,加入15ml洋葱外泌体混合均匀后,加入到含1.2%span80 的70ml玉米胚芽油中,300r/min机械搅拌15min;
56.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油中,120r/min机械搅拌25min;
57.向100ml上述溶液中加入150ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
58.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
59.将所述二次包被微胶囊进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-35℃左右冷冻1.5h直至物料中心温度在-25℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至60℃,并在此温度下维持5h;在1h内将加热板温度升至 80℃,并在此温度下维持5h;在0.5h内将加热板温度降至70℃,并在此温度下维持4.5h;在 0.5h内将加热板温度升降至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为洋葱外泌体微囊包埋冻干粉。
60.实施案例5
61.本实施例提供一种洋葱外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
62.称取100g新鲜洋葱倒入榨汁机中,向其中加入100ml灭菌pbs,榨汁匀浆之后在3200g, 4℃离心15min,去除较大的残渣;取中间层的黄色透明溶液在12000g,4℃离心40-70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g,4℃超速离心80min;离心后,用1ml无菌pbs重悬沉淀,此时即得洋葱外泌体。
63.取35ml质量分数为3%的海藻酸钠溶液与50ml浓度为20mmol/l ca-edta混合溶液,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
64.按照冰乙酸和ca-edta的摩尔比为5:1进行混合获得酸化液,向所述酸化液中逐滴加入含有0.15g冰醋酸的25ml玉米胚芽油,120r/min机械搅拌25min;
65.向120ml上述溶液中加入150ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
66.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
67.将上述所得的二次包被微胶囊液与抗性糊精按照1:15的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40℃左右冷冻1h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至96℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h 内将加热板温度降至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
68.实施案例6
69.本实施例提供一种葡萄柚外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
70.取新鲜葡萄柚,去皮,称取200g新鲜葡萄柚倒入榨汁机中,向其中加入200ml灭菌pbs,榨汁匀浆之后在3500g,4℃离心15min,去除较大的残渣;取中间层的黄色透明溶液在
10000g, 4℃离心40-70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在150000g,4℃超速离心60min;离心后,用1.5ml无菌pbs重悬沉淀,此时即得葡萄柚外泌体;
71.取25ml质量分数为3%的海藻酸钠溶液分别与40ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
72.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25 ml玉米胚芽油,120r/min机械搅拌25min;
73.向120ml上述溶液中加入150ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊;
74.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊;
75.将上述所得的二次包被微胶囊进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40℃左右冷冻1h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至96℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h内将加热板温度降至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
76.实施案例7
77.本实施例提供一种葡萄柚外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:
78.取新鲜葡萄柚,祛皮,称取100g新鲜葡萄柚倒入榨汁机中,向其中加入100ml灭菌pbs,榨汁匀浆之后在3200g,4℃离心15min,去除较大的残渣;取中间层的黄色透明溶液在12000g, 4℃离心40-70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g,4℃超速离心80min;离心后,用1ml无菌pbs重悬沉淀,此时即得葡萄柚外泌体。
79.取60ml质量分数为3%的海藻酸钠溶液分别与80ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
80.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
81.向13o ml上述溶液中加入150ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
82.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
83.先将所述二次包被微胶囊与抗性糊精按照1:14的比例进行混合,再将添加有冻干保护剂的葡萄柚外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-35℃左右冷冻1.5h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在 0.5h内将加热板温度升高至95℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h 内将加热板温度升高至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为葡萄柚外泌体微囊冻干粉。
84.实施案例8
85.本实施例提供一种西兰花外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜西兰花,称取250g新鲜西兰花倒入榨汁机中,向其中加入300ml灭菌pbs,榨汁匀浆之后在 3500g,4℃离心18min,去除较大的残渣;取中间层的黄色透明溶液在12000g,4℃离心40-70min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g, 4℃超速离心80min;离心后,用2ml无菌pbs重悬沉淀,此时即得西兰花外泌体提取液。
86.将西兰花外泌体提取液、浓度为30mg/ml的无菌海藻酸钠溶液和含有2μl/mlspan80的无菌玉米胚芽油以1∶1∶12(v/v)的比例混合。200r/min磁力搅拌10min将混合物乳化。向乳化液中迅速加入100ml浓度为20mg/ml的无菌caedta溶液,继续搅拌30min。2000 r/min离心10min收集微胶囊,在4℃用体积分数0.1%无菌生理盐水洗涤2-3次以除去过量的钙离子和未被包裹的植物外泌体。
87.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
88.将上述所得的二次包被微胶囊液与抗性糊精按照1:12的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40℃左右冷冻1h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至96℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h 内将加热板温度降温至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
89.实施案例9
90.本实施例提供一种秋葵外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜秋葵,称取150g新鲜秋葵倒入榨汁机中,向其中加入200ml灭菌pbs,榨汁匀浆之后在3500g, 4℃离心12min,去除较大的残渣;取中间层的黄色透明溶液在15000g,4℃离心60min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g,4℃超速离心80min;离心后,用1ml无菌pbs重悬沉淀,此时即得秋葵外泌体。
91.取20ml质量分数为3%的海藻酸钠溶液分别与25ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
92.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
93.向130ml上述溶液中加入145ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
94.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
95.将上述所得的二次包被微胶囊液与抗性糊精按照1:15的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-40℃左右冷冻1h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至96℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h 内将加热板温度降至50℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
96.实施案例10
97.本实施例提供一种金银花外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜金银花,称取200g新鲜金银花倒入榨汁机中,向其中加入300ml灭菌pbs,榨汁匀浆之后在 4000g,4℃离心20min,去除较大的残渣;取中间层的黄色透明溶液在12000g,4℃离心60min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在150000g, 4℃超速离心70min;离心后,用2ml无菌pbs重悬沉淀,此时即得金银花外泌体提取液。
98.取20ml质量分数为3%的海藻酸钠溶液分别与25ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
99.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
100.向130ml上述溶液中加入145ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
101.将0.5g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
102.将上述所得的二次包被微胶囊液与抗性糊精按照1:10的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-33℃左右冷冻1.8h直至物料中心温度在-25℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至95℃,并在此温度下维持3.5h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持5h;在0.5h内将加热板温度降至50℃,并在此温度下维持5h直至物料温度不再变化后
取出,即为植物外泌体微囊冻干粉。
103.实施案例11
104.本实施例提供一种酸樱桃外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜酸樱桃,称取225g新鲜酸樱桃倒入榨汁机中,向其中加入285ml灭菌pbs,榨汁匀浆之后在3800g,4℃离心16min,去除较大的残渣;取中间层的黄色透明溶液在12000g,4℃离心65min;取上清液在120000g,4℃超速离心60min,然后使用1ml无菌pbs重悬沉淀再在120000g, 4℃超速离心80min;离心后,用2ml无菌pbs重悬沉淀,此时即得酸樱桃外泌体提取液。
105.取20ml质量分数为2%的海藻酸钠溶液分别与25ml浓度为30mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
106.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
107.向130ml上述溶液中加入145ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
108.将0.55g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将8g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
109.将上述所得的二次包被微胶囊液与抗性糊精按照1:11.5的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-35℃左右冷冻1.5h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至96℃,并在此温度下维持4h;在1h内将加热板温度降至80℃,并在此温度下维持5h;在0.5h内将加热板温度降至75℃,并在此温度下维持4.5h;在0.5h 内将加热板温度降至54℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
110.实施案例12
111.本实施例提供一种树莓外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜树莓,称取180g新鲜树莓倒入榨汁机中,向其中加入250ml灭菌pbs,榨汁匀浆之后在4200g, 4℃离心14min,去除较大的残渣;取中间层的黄色透明溶液在13000g,4℃离心60min;取上清液在110000g,4℃超速离心80min,然后使用1ml无菌pbs重悬沉淀再在150000g,4℃超速离心60min;离心后,用2ml无菌pbs重悬沉淀,此时即得树莓外泌体提取液。
112.取20ml质量分数为3%的海藻酸钠溶液分别与25ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
113.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
114.向130ml上述溶液中加入145ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐
缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
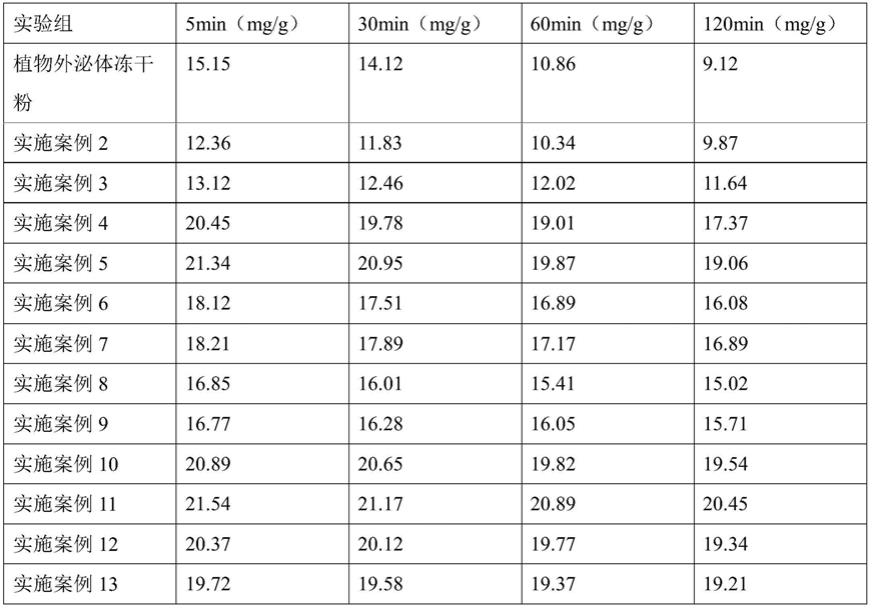
115.将0.55g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将5g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
116.将上述所得的二次包被微胶囊液与抗性糊精按照1:12.5的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-35℃左右冷冻1h直至物料中心温度在-20℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至90℃,并在此温度下维持4.5h;在1h内将加热板温度降至75℃,并在此温度下维持6h;在0.5h内将加热板温度降至65℃,并在此温度下维持6h;在0.5h内将加热板温度将至45℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
117.实施案例13
118.本实施例提供一种积雪草外泌体微囊包埋冻干粉的制备方法,具体包括以下步骤:取新鲜积雪草,称取175g新鲜积雪草倒入榨汁机中,向其中加入230ml灭菌pbs,榨汁匀浆之后在4200g,4℃离心18min,去除较大的残渣;取中间层的黄色透明溶液在13000g,4℃离心60min;取上清液在120000g,4℃超速离心80min,然后使用1ml无菌pbs重悬沉淀再在150000g, 4℃超速离心60min;离心后,用2ml无菌pbs重悬沉淀,此时即得积雪草外泌体提取液。
119.取20ml质量分数为3%的海藻酸钠溶液分别与25ml浓度为20mmol/l ca-edta混合,取10ml配好的上述溶液与15ml植物外泌体混合均匀,加入到含1.2%span80的70ml玉米胚芽油中,300r/min机械搅拌15min;
120.按照冰乙酸和ca-edta的摩尔比为5:1配制酸化液,逐滴加入含有0.15g冰醋酸的25ml 玉米胚芽油,120r/min机械搅拌25min;
121.向135ml上述溶液中加入150ml含0.9%nacl,浓度为0.1mol/l,ph值7.0的磷酸盐缓冲液,静置1~2h,弃去油层,离心,洗涤,收集,即得到一次包被微胶囊。
122.将0.58g壳寡糖溶解于90ml纯净水中,用0.1mol/l的naoh溶液将ph值调节至7.0,再用纯净水将溶液的总体积调节至100ml,即得5mg/ml的壳寡糖溶液。将5g一次包被微胶囊浸入100ml过滤除菌的5mg/ml壳寡糖溶液中,用磁力搅拌器100r/min搅拌30min进行涂覆,过滤收集,获得二次包被微胶囊。
123.将上述所得的二次包被微胶囊液与抗性糊精按照1:11.8的比例进行混合,再将添加有冻干保护剂的植物外泌体微囊液进行真空冷冻干燥,在进行真空冷却干燥前需进行具体的真空冷冻干燥工艺为:在-37℃左右冷冻1.2h直至物料中心温度在-25℃,再将物料放置加热板进行加热,在0.5h内将加热板温度升高至93℃,并在此温度下维持4.8h;在1h内将加热板温度降至77℃,并在此温度下维持5.8h;在0.5h内将加热板温度降至68℃,并在此温度下维持5.5h;在0.5h 内将加热板温度将至47℃,并在此温度下维持5h直至物料温度不再变化后取出,即为植物外泌体微囊冻干粉。
124.实施案例14植物外泌体的体外耐胃酸实验
125.模拟胃液:用浓盐酸将2mg/ml nacl溶液的ph值调至2.0,再加入胃蛋白酶并使最
终质量浓度达到0.3g/l,过滤除菌。
126.植物外泌体浓度的检测方法:2,2
′‑
联喹啉-4,4
′‑
二二羧酸法(bca法)。
127.分别取实施案例中的植物外泌体微胶囊、未包埋的植物外泌体各1g,置于在37℃预热的9ml模拟胃液中,于37℃、120r/min的摇床中温育2h。在5、30、60、120min时,取微胶囊或植物外泌体与模拟胃液的均匀混合物各1ml,加入9ml解囊液中,振摇15min至完全解囊。用bca法测定植物外泌体的浓度。具体实验结果见下表:
128.表1植物外泌体耐胃酸实验结果
[0129][0130]
上述结果显示:对比实施案例2和3,采用内源法较外源法的植物外泌体耐胃酸性强;对比实施案例4和5及6和7来看,使用冻干保护剂抗性糊精也可以提高植物外泌体的耐胃酸性。
[0131]
实施案例15植物外泌体在模拟消化道体系中的存活实验及微胶囊的崩解实验
[0132]
解囊液:将nahco3溶于0.1mol/l ph 7.0磷酸盐缓冲液(phosphate buffer solution,pbs) 中(nahco3的终浓度为0.2mol/l),过滤除菌。
[0133]
食管到胃连续过程的模拟液:将5mg/ml的胃蛋白酶溶于生理盐水中,分别将ph值调节至5.5、4.6、3.8、2.8、2.3、2.0,过滤除菌。
[0134]
十二指肠模拟液:将10mg/ml的胰蛋白酶和3mg/ml的胆盐分别溶于生理盐水中,将 ph值调节至5.0,过滤除菌。
[0135]
小肠模拟液:用0.1mol/l的nahco3溶液将上述十二指肠模拟液的ph值调节至6.5,过滤除菌。
[0136]
植物外泌体结构:透射电镜观察。
[0137]
分别取实施案例中的植物外泌体微胶囊、未包埋的植物外泌体各1g,置于在37℃预热的9ml模拟消化液中,于37℃、120r/min的摇床中温育。每次更换模拟消化液前,以
10000 r/min离心1min沉淀植物外泌体和微胶囊,再用移液器将上清液小心地吸出。每次更换模拟消化液后,涡旋30s以充分混合。处理步骤如表1所示。分别在食管到胃的模拟液、十二指肠模拟液和小肠模拟液处理后,取微胶囊或植物外泌体与模拟消化液的均匀混合物各1ml,加入9ml解囊液中,振摇15min至完全解囊,再用bca法测定植物外泌体的浓度。
[0138]
表2模拟消化道体系的处理步骤
[0139][0140]
表3植物外泌体在模拟消化道体系中的稳定性结果
[0141]
[0142][0143]
以上数据显示,植物外泌体在消化系统中会受到一定的破坏,这可能是由于系统的ph等对其结构有一定的破坏作用,通过包埋技术,能减少这种破坏损失,直接将植物外泌体冻干后,经消化系统后其损失远大于经包埋处理的实验组,说明选择合适的包材方法和壁材能有效防止其被胃酸等破坏;对比以上实施案例,可以发现,采用内源法,以壳寡糖-微胶囊并添加冻干保护剂后能更好的保护植物外泌体。
[0144]
实施案例16微胶囊在模拟消化道体系中的崩解实验
[0145]
每隔5-6min取微胶囊与模拟消化液的均匀混合物,于透射电镜下观察其结构,记录微胶囊的崩解时间。具体结果见下表:
[0146]
表4崩解时间结果
[0147]
实验组崩解时间/h植物外泌体冻干粉5.2
实施案例25.8实施案例36.1实施案例46.5实施案例56.9实施案例65.6实施案例76.2实施案例87.1实施案例97.9实施案例107.3实施案例117.5实施案例127.7实施案例137.5
[0148]
经包埋的植物外泌体崩解时间比未包埋的长,采用内源法包埋的壳寡糖-微囊并添加冻干保护剂的实施例崩解时间较长。
[0149]
实施案例17植物外泌体微胶囊贮藏稳定性实验
[0150]
25℃恒温环境中,植物外泌体微胶囊被分别放置在相对湿度33%和70%的干燥器内。在 0、7、14、21和35d取样,检测植物外泌体浓度。
[0151]
表5植物外泌体稳定性实验结果
[0152]
[0153][0154]
实验结果显示,在湿度为33%和70%的环境下贮存,随着时间的延长,外泌体浓度均有所降低,但经包埋后外泌体得到一定的保护,相比于未包埋的保存效果更好,尤其是实施案例 2,4,6,8中,经30天的贮存后外泌体浓度降低少。
[0155]
以上所述,仅为本技术的具体实施方式,但本技术的保护范围并不局限于此,任何在本技术揭露的技术范围内的变化或替换,都应涵盖在本技术的保护范围之内。因此,本技术的保护范围应以所述权利要求的保护范围为准。
