1.本发明属于硫代钼酸盐的应用,尤其涉及硫代钼酸盐的应用在增肌、改善肌肉功能、增强运动能力、预防或治疗肌肉系统相关疾病等领域中的应用。
背景技术:
2.肌肉是人体最丰富的蛋白储存库,对机体健康和糖脂代谢具有重要的调节作用(sartori et al., nat commun 2021, 12, 330)。然而,在正常情况下,人体骨骼肌随年龄的增加而不断的衰减,一般50岁以后,骨骼肌平均每年减少1%~2%,而肌肉减少30%将影响其正常功能,导致少肌症(sarcopenia)的发生。在多种病理条件下(如:内分泌功能改变、慢性疾病、炎症、胰岛素抵抗和营养缺乏),肌肉质量更有可能加速下降,从而导致肌肉功能异常(fielding et al., j am med dir assoc 2011, 12, 249-256, kalyani et al., lancet diabetes endocrinol 2014, 2, 819-829)。其中,肌肉质量的下降也会影响肌肉功能,导致运动功能下降、能量稳态失衡、增加慢性疾病发生的风险(sartori et al., nat commun 2021, 12, 330)。因此,在整个生命周期中维持适度肌肉质量不仅有利于加强运动功能,而且还有利于改善机体健康状况。
3.肌肉肥大是增肌的科学术语,增肌的理论基础在于肌肉蛋白合成增加,分解减少。在分子层面,调节肌肉蛋白生长的主要信号通路包括igf1-pi3k-akt-mtor和肌生长抑制素-smad3等;在细胞层面,成肌分化因子(myod)启动一系列增肌特异性基因的表达,并诱导肌卫星细胞分化为成肌细胞。成肌细胞表达的肌细胞生成素(myog),促进肌细胞相互融合形成肌管,最终形成肌肉。所以理想的增肌方式作用机理既包括刺激肌肉蛋白质合成,又包括促进肌卫星细胞的分化和肌管的形成。
4.目前,增肌的方式主要包括抗阻运动、营养补充与药物。抗阻运动的应用人群有一定局限,例如不适用于行动能力弱的老年人和急性疾病患者;而营养补充(主要是蛋白质)只简单解决了增肌中营养需求的问题,且很容易导致肥胖。因此,近年来,增肌药物逐渐受到人们关注。我国已经处于老龄化阶段并且程度正进一步加深,这无疑将导致肌肉流失和肌肉功能障碍的发生率大大增加。因此,开发高效安全的新型增肌药物,从而达到优化肌肉质量、预防及治疗肌肉系统疾病的目的,在临床需求上显得更为紧要和迫切。
5.现有增肌药物主要集中在改善食欲、调节炎症、干预合成和分解代谢等方面,如胃饥饿素、睾丸素和羟甲基丁酸盐等,但大部分市售的增肌药物都具有一定的副作用,对健康有巨大风险,因此现有增肌药物的使用仍颇具争议。即使部分增肌药物的安全性满足了医药审批要求,但这部分市售的具有增肌功能的产品或药物仍主要是针对运动员或运动人群而研制,其定位不能满足其他人群(如老年人、肌肉损失及肌肉功能障碍患者)的增肌诉求。
6.据此,研发普适型且高安全性的增肌产品或药物,使其既能通过增肌改善运动能力,又能预防和治疗肌肉系统疾病,成为本领域亟待解决的技术难题。
7.另外,在四硫代钼酸盐的应用方面,现有技术表明:四硫代钼酸盐可以作为硫化物供体或铜离子螯合剂起作用(dyson et al., plos med 2017, 14, e1002310),但具体作
用靶分子仍未完全明了。因此,目前硫代钼酸盐的应用还比较局限。根据drugbank的数据(https://go.drugbank.com/drugs),当前临床应用和临床试验中主要利用了四硫代钼酸盐作为铜离子螯合剂的功能,如它的唯一一项已经获批的临床应用就是治疗铜离子异常堆积引起的神经性威尔逊病(wilson's disease),另有17项临床试验正在进行中,主要涉及肿瘤治疗。
8.在四硫代钼酸盐与肌肉相关的研究中,现有技术只涉及两个方面:一项涉及治疗心肌梗死(ep2578221a1;us10781162b2),另一项涉及治疗肌萎缩性侧索硬化(tokuda et al., neurobiol dis 2013, 54, 308-319)。在涉及治疗心肌梗死的应用中,其原理是四硫代钼酸盐能降低机体或器官的耗氧率,从而能潜在地在心肌梗死相关疾病中应用(dyson et al., plos med 2017, 14, e1002310),但该项技术只涉及改善缺血再灌注引起的心肌梗死,并没涉及肌肉本身的功能。在涉及治疗肌萎缩性侧索硬化的应用中,主要考虑到肌萎缩性侧索硬化是一种严重的神经肌肉疾病,其特征是运动神经元的退行性丧失,通常在发病后2-5年内导致肌肉严重流失、甚至瘫痪和死亡(gil-bea et al., expert rev mol med 2017, 19, e7)。由于铜稳态的异常被认为是导致运动神经元损伤的原因之一(gil-bea et al., expert rev mol med 2017, 19, e7),因此,有研究认为:四硫代钼酸盐通过螯合铜离子,能减缓运动神经元的退行性丧失,从而减缓肌肉流失(tokuda et al., neurobiol dis 2013, 54, 308-319)。很明显,该技术只涉及肌肉的消耗,并没有涉及增肌。此外,有点矛盾的是,氧化应激被认为是导致肌萎缩性侧索硬化的核心致病原因(miana-mena et al., j neurol 2011, 258, 762-769),但四硫代钼酸盐螯合铜离子后,会抑制超氧化物歧化酶i的活性,导致机体内的超氧化物阴离子水平急剧升高(juarez et al., clin cancer res 2006, 12, 4974-4982),加剧氧化应激。也正因为如此,四硫代钼酸盐通过螯合铜离子来治疗肌萎缩性侧索硬化的数据仍存在较大争议。综合来看,虽然四硫代钼酸盐在肌肉相关研究中有所涉及,但到目前为止,仍没有该技术涉及四硫代钼酸盐能促进增肌,也未见有相关理论能依据现有技术引申或推导出四硫代钼酸能促进增肌。
技术实现要素:
9.本发明所要解决的技术问题是,克服以上背景技术中提到的不足和缺陷,提供一种简单、方便、成本低、效果好、安全性好的四硫代钼酸盐在用于制备可实现增肌、改善肌肉功能、增强运动能力、预防或治疗肌肉系统相关疾病的产品或药品中的应用。
10.为解决上述技术问题,本发明提出的技术方案为四硫代钼酸盐在用于制备可实现增肌、改善肌肉功能、增强运动能力、预防或治疗肌肉系统相关疾病的产品或药品中的应用。
11.上述的应用中,优选的,所述四硫代钼酸盐(英文名为tetrathiomolybdate)的分子通式为x
+
mos
42
‑ y
+
,其结构式通式为:;其中,4个硫离子的成离子键的位置可互换;x
+
和y
+
为相同或不同的阳离子。
12.上述的应用中,优选的,所述阳离子为可在溶液中离解产生mos
42-或可在生物体系内酶解产生mos
42-的无机阳离子和/或有机阳离子。因为我们的实验表明,该四硫代钼酸盐的活性单元主要为四硫代钼酸根离子(mos
42-),因此可选择的阳离子范围较广,后期产品可选择、可调整的空间较大。
13.上述的应用中,优选的,所述无机阳离子包括na
+
、k
+
、nh
4+
中的至少一种;所述有机阳离子包括胺离子、胆碱离子中的至少一种。
14.上述的应用中,优选的,所述无机阳离子包括nh
4+
;所述有机阳离子包括胆碱离子。
15.上述的应用中,优选的,所述增肌包括实现促进成肌细胞的增殖、促进成肌细胞分化为肌细胞、增加机体肌肉质量中的至少一种情形。
16.上述的应用中,优选的,所述改善肌肉功能包括实现增强肌肉的伸缩功能、增强肌肉的运动功能、改善肌肉的内分泌功能、改善肌肉的代谢功能、增强肌肉对血糖的调节能力中的至少一种情形。现有理论研究表明,肌肉除了是运动器官和代谢器官,也是内分泌器官,其通过分泌多种内分泌因子,对机体的代谢具有重要的调节作用,而肌肉质量是其发挥功能的决定因素(参见giudice et al., curr opin pharmacol 2017, 34, 49-55, iizuka et al., j pharmacol sci 2014, 125, 125-131, kim et al., endocrinol metab (seoul) 2020, 35, 1-6)。因此,维持稳定的肌肉质量,是维持肌肉的力量输出、内分泌、调控代谢等功能的保证,因此增加肌肉对改善肌肉的内分泌功能、改善肌肉的代谢功能、增强肌肉对血糖的调节能力都具有重要意义。
17.上述的应用中,优选的,所述肌肉系统相关疾病包括肌无力、少肌症、皮肌炎、进行性肌营养不良、先天性肌病、代谢性肌病、感染性肌病、伴发性肌病、线粒体肌病、横纹肌溶解、恶病质中的至少一种。
18.上述的应用中,优选的,所述增强运动能力是针对运动员、老年人、肌肉损失或肌肉功能障碍患者等特定人群的运动能力。
19.现有大量的研究表明,肌肉质量的下降,不仅会直接导致运动能力下降和能量代谢稳态失衡、加速肌肉系统疾病的发生发展,也会间接增加多种慢性疾病发生的风险,并导致人群的死亡率上升(isoyama et al., clin j am soc nephrol 2014, 9, 1720-1728, moisey et al., crit care 2013, 17, r206)。因此,在整个生命周期中维持适度肌肉质量,不仅有利于加强运动功能、改善内分泌和代谢功能、减少肌肉系统疾病的发生,而且还有利于改善机体健康状况、降低多种慢性疾病发生的风险、并降低全因死亡率。
20.上述的应用中,优选的,将所述四硫代钼酸盐制备成1nmol/l~200mmol/l或 1nmol/kg~200mmol/kg的可口服、饮用或注射的营养液或药物溶液,或者制备成固态的营养组合物或药物组合物。
21.上述的应用中,优选的,所述营养液、药物溶液、营养组合物或药物组合物中包含药学上可接受的稀释剂、赋形剂、佐剂或现有增肌药中的至少一种。
22.上述的应用中,优选的,将所述四硫代钼酸盐制备成保健品、功能食品或功能饮品,且四硫代钼酸盐作为主要功能成分或辅助功能成分。
23.上述的应用中,优选的,所述四硫代钼酸盐是应用于制备不会导致肥胖和/或无肝损伤毒性和/或无神经系统损伤毒性的产品或药品。
24.与现有技术相比,本发明的有益效果为:本发明提供四硫代钼酸盐在用于制备可
实现增肌、改善肌肉功能、增强运动能力、预防或治疗肌肉系统相关疾病的产品或药品中的应用,四硫代钼酸盐的应用不仅可以增加肌肉质量、增加肌肉蛋白含量、增加肌纤维横截面积,还可促进成肌细胞的分化,激活mtor增肌信号通路,而且在动物实验过程中不引起肝功能损害,也不导致体脂增加,效果显著。
25.本发明中四硫代钼酸盐的使用方法和剂量取决于各种因素,包括给药途径和施药时长,以及使用者的年龄、体重、健康状况、性别和饮食情况。因此,本领域普通技术人员将能够确定上述各种用途的适当有效剂量、剂型、给药途径或给药方法。
附图说明
26.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
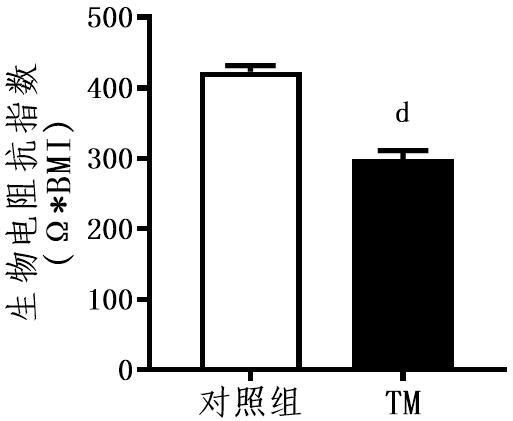
27.图1为本发明实施例1中四硫代钼酸盐对实验动物生物电阻抗指数(bioelectrical impedance index)影响的对比效果图。
28.图2为本发明实施例1中四硫代钼酸盐给药对实验动物腓肠肌(gastrocnemius)、股直肌(rectus femoris)的重量指数影响对比效果图。(重量指数即腓肠肌或股直肌重量对小鼠体重标准化后的值,具体计算方法是:完整腓肠肌或股直肌重量除以小鼠的重量以后,再乘以100,单位为g/100g体重)图3为本发明实施例1中四硫代钼酸盐对实验动物腓肠肌总蛋白质容量提升的对比效果图。
29.图4为本发明实施例1中四硫代钼酸盐对实验动物腓肠肌肌纤维横截面积变化的影响效果对比图。
30.图5为本发明实施例1中四硫代钼酸盐对实验动物腓肠肌中较粗肌纤维占比的影响效果对比图。
31.图6为本发明实施例1中四硫代钼酸盐对实验动物腓肠肌mtor增肌信号通路相关分子的mrna表达的影响效果对比图。
32.图7为本发明实施例1中四硫代钼酸盐对实验动物皮下脂肪和内脏脂肪的重量指数的影响效果对比图。
33.图8为本发明实施例1中四硫代钼酸盐对实验动物肝细胞损伤的影响效果对比图[测试血清谷丙氨酸转氨酶(alt)]。
[0034]
图9为本发明实施例1中四硫代钼酸盐对实验动物肝细胞损伤的影响效果对比图[测试血清天门冬氨酸转氨酶(ast)]。
[0035]
图10为本发明实施例2中四硫代钼酸盐对c2c12细胞分化速度影响的效果对比图。
[0036]
图11为本发明实施例2中四硫代钼酸盐对c2c12细胞诱导分化的肌细胞生成素(myog)mrna表达影响的效果对比图。
[0037]
图12为本发明实施例2中四硫代钼酸盐对c2c12细胞肌管形成的肌球蛋白(myhc)mrna表达影响的效果对比图。
[0038]
图13为本发明实施例3中四硫代钼酸盐对实验动物在morris水迷宫实验中的游泳
速度的对比测试效果图。
[0039]
图14为本发明实施例3中四硫代钼酸盐对实验动物在morris水迷宫实验中找到平台前的潜伏期的对比测试效果图。
[0040]
图15为本发明实施例3中四硫代钼酸盐对实验动物在morris水迷宫实验中的穿过隐藏平台的次数的对比测试效果图。
[0041]
图16为本发明实施例4中不同四硫代钼酸盐对c2c12细胞增殖影响的效果对比图。
[0042]
以上各附图中, tm为四硫代钼酸盐处理组。数据结果用平均数
±
标准误表示,小写英文字母代表tm相对于对照组具有统计学意义,其中:a表示p<0.05,b表示p<0.01,c表示p<0.005,d表示p<0.001。
具体实施方式
[0043]
为了便于理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面、细致地描述,但本发明的保护范围并不限于以下具体实施例。
[0044]
除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
[0045]
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
[0046]
实施例1:本实施例提供四硫代钼酸盐在动物水平的增肌功能演示实例。
[0047]
采用健康小鼠模型,观察四硫代钼酸盐(本实施例中具体使用的是四硫代钼酸铵)给药对小鼠模型的增肌作用,并分析受试动物分子生物学层面各指标的变化。
[0048]
实验过程如下:1)实验动物:雄性c57bl/6j小鼠,spf级,体重24
±
1g,购自湖南斯莱克景达实验动物有限公司,随机分为四硫代钼酸盐处理组和对照组,每组6只。动物在spf级笼具饲养,环境温度为22℃,湿度适宜;2)饲养操作:动物适应阶段于每日14:00记录体重,记录每24小时食物重量的变化以算得单位体重的饮食量,并观察动物的精神状态和粪便形态;3)四硫代钼酸盐处理方法:将四硫代钼酸盐分别按比例加入饮水中、加入饮食中、制成药丸等方式处理,或制成溶液然后采用灌胃或不同注射方式处理,在处理剂量为38.4nmol/kg体重~768μmol/kg体重的条件下,均能发挥一定的增肌效果,下面是各种处理方式的具体步骤:3.1)将四硫代钼酸盐添加到日粮中的具体实施步骤:i)取健康动物模型(如:小鼠、大鼠),连续一周每日称量其体重和粮食摄入量,计算每日粮食摄入量与体重的比值;ii)基于需要探索的四硫代钼酸盐的处理剂量(如:x μmol/kg体重),将处理剂量除以“每日粮食摄入量与体重的比值”后,提前做好含有相应剂量四硫代钼酸盐的粮食;iii)处理期间,让处理组动物进食包含四硫代钼酸盐的粮食,对照组进食不添加四硫代钼酸盐的粮食;
iv)粮食做好并成型后,尽量现配现用,需要保存时,需低温密封避光。
[0049]
3.2)将四硫代钼酸盐添加到饮水中的具体实施步骤:i)取健康动物模型(如:小鼠、大鼠),连续一周每日测量其体重和饮水量,计算每日饮水量与体重的比值;ii)基于需要探索的四硫代钼酸盐的处理剂量(如:x μmol/kg体重),将处理剂量除以“每日饮水量与体重的比值”后,配好含有相应剂量四硫代钼酸盐的饮水;iii)处理期间,让处理组动物饮用含有四硫代钼酸盐的水,对照组饮用不含四硫代钼酸盐的水;iv)饮水需要每天更换一次,且现配现用。
[0050]
3.3)四硫代钼酸盐药丸给药的具体实施步骤:i)取健康动物模型(如:小鼠、大鼠),每天称量其体重;ii)基于需要探索的四硫代钼酸盐的给药剂量(如:x μmol/kg体重)确定四硫代钼酸盐与赋形剂的混合比例(其中,赋形剂中可适当添加一定量的培根,方便训练动物自主摄入药丸);iii)四硫代钼酸盐与赋形剂充分混合均匀后压片,并冷冻保存;iv)给药的前三天为动物主动摄取药丸训练期,即在这三天内,每天在给药之前,先让动物饥饿6-8小时,训练动物主动摄取药丸,让实验组动物摄取包含四硫代钼酸盐的药丸,对照组摄取不包含四硫代钼酸盐的完全赋形剂药丸;v)药丸每天定时投放,每批次的实验都新制一批药丸。
[0051]
3.4)四硫代钼酸盐灌胃处理的具体步骤:i)取健康动物模型(如:小鼠、大鼠),每天称量其体重;ii)基于需要探索的四硫代钼酸盐的处理剂量(如:x μmol/kg体重)配制一定浓度的四硫代钼酸盐溶液,为了方便灌注定量,通常使四硫代钼酸盐溶液的浓度满足每克体重灌注1~10μl溶液为宜;iii)以动物专用的灌胃针连接适宜刻度的注射器,每天定时对动物进行灌胃,处理组灌注包含四硫代钼酸盐的溶液,对照组灌注不包含四硫代钼酸盐的对照溶液;iv)溶液每次都现配现用。
[0052]
3.5)四硫代钼酸盐皮下注射给药的具体步骤:i)取健康动物模型(如:小鼠、大鼠),每天称量其体重;ii)基于需要探索的四硫代钼酸盐的给药剂量(如:x μmol/kg体重)配制一定浓度的四硫代钼酸盐溶液,为了方便灌注定量,通常使四硫代钼酸盐溶液的浓度满足每克体重灌注1~10μl溶液为宜;iii)根据动物的大小,选用适宜的注射器针头,根据需要注射的量选用适宜刻度的注射器,每天定时对动物进行皮下注射,实验组注射包含四硫代钼酸盐的溶液,对照组注射不包含四硫代钼酸盐的对照溶液;iv)注射时,动物背部朝上禁制,然后用手的食指和拇指稍微提起动物背部皮肤,从操作人员的食指和拇指之间下针,针进入皮下1cm左右时,用两指撵紧针头(避免注射液从皮肤中回流渗出,导致注射剂量不准),然后开始注射;v)溶液每次都现配现用。
[0053]
3.6)四硫代钼酸盐腹腔注射给药的具体步骤:i)取健康动物模型(如:小鼠、大鼠),每天称量其体重;ii)基于需要探索的四硫代钼酸盐的给药剂量(如:x μmol/kg体重)配制一定浓度的四硫代钼酸盐溶液,为了方便灌注定量,通常使四硫代钼酸盐溶液的浓度满足每克体重灌注1~10μl溶液为宜;iii)根据动物的大小,选用适宜的注射器针头,根据需要注射的量选用适宜刻度的注射器,定时对动物进行腹腔注射,实验组注射包含四硫代钼酸盐的溶液,对照组注射不包含四硫代钼酸盐的对照溶液;iv)注射时,动物腹部朝上禁制,操作人员从动物后肢与腹中线连线的中点让针头与动物身体成45
°
角从后往前进针,当感觉到针穿透腹膜后,开始注射;v)溶液每次都现配现用。
[0054]
3.7)四硫代钼酸盐静脉注射给药的具体步骤:i)取健康动物模型(如:小鼠、大鼠),每天称量其体重;ii)基于需要探索的四硫代钼酸盐的给药剂量(如:x μmol/kg体重)配制一定浓度的四硫代钼酸盐生理盐水溶液,为了方便灌注定量,通常使四硫代钼酸盐溶液的浓度满足每克体重灌注1~10μl溶液为宜;iii)根据动物的大小,选用适宜的注射器针头,根据需要注射的量选用适宜刻度的注射器,定时对动物进行尾静脉注射,实验组注射包含四硫代钼酸盐的生理盐水溶液,对照组注射生理盐水溶液;iv)注射时,将动物禁制在静脉注射专用的禁制器上,操作人员从动物尾端1/3处沿两侧尾静脉进针,当感觉到针进入尾静脉后,开始注射;v)注射过程中如无明显阻力,说明针一直在尾静脉内,如感觉到有明显阻力,说明针已经不在尾静脉内,需要换另一侧尾静脉或同侧尾静脉的尾端2/3处重新进针;vi)溶液每次都现配现用。
[0055]
4)组织收集:在为期28天的给药结束后,实验动物于14:00测得生物电阻抗数据后集中处理、解剖,收集各器官并详细称重后,一部分组织放入4%多聚甲醛用于后续组织化学分析,剩余部分放入液氮速冻用于后续生物化学测试;5)将上述实验数据统计分析后绘制成图(由于将四硫代钼酸盐加入饮水、加入饮食、制成药丸、制成溶液灌胃或不同注射方式处理,均能发挥出本发明的增肌效果,此处仅以四硫代钼酸盐加入动物日粮饮食为代表展示增肌效果的对比实验数据,具体参见图1~图9)。
[0056]
上述实施例中,四硫代钼酸盐对实验动物生物电阻抗指数影响的对比效果图如图1所示,由图1可见,四硫代钼酸盐组显著降低了生物电阻抗指数,该指数越小,表明肌肉占比越高,即四硫代钼酸盐提高了实验动物瘦体重占比。
[0057]
上述实施例中,四硫代钼酸盐给药对实验动物腓肠肌(rectus femoris)、股直肌(percentage fibers)的重量指数(骨骼肌指数)影响对比效果如图2所示,由图2可见,本发明实施例1中四硫代钼酸盐显著提高了实验动物腓肠肌、股直肌的重量指数。
[0058]
上述实施例中,四硫代钼酸盐对实验动物腓肠肌总蛋白质容量的提升效果如图3所示,由图3可见,四硫代钼酸盐显著提高了实验动物腓肠肌总蛋白质容量。
514-529),重新激活mtor能改善恶病质典型表型——肌肉损失(white et al., am j physiol endocrinol metab 2013, 304, e1042-1052)。因此,四硫代钼酸盐通过激活mtor通路所引起的增肌效应将可应用于制备能够治疗少肌症、肌营养不良、肌无力、皮肌炎、代谢性肌病、横纹肌溶解、先天性肌病、伴发性肌病、线粒体肌病、恶病质等病症的相关产品或药物。
[0066]
本实施例提供了四硫代钼酸盐不同给药方法对增肌相关功能的一致性。本实施例采用健康小鼠模型,探索了四硫代钼酸盐不同给药方式对小鼠增肌的影响,实验结果表明:上述实施例中,不同的给药方法(将四硫代钼酸盐加入饮水中、加入饮食中、制成药丸、或制成溶液采用不同注射方式给药)均能发挥类似的增肌效果。
[0067]
实施例2:本实施例提供四硫代钼酸盐在动物细胞水平实现增肌功能的演示实例。
[0068]
采用c2c12小鼠成肌细胞模型,观察四硫代钼酸盐对小鼠成肌细胞分化的影响,并分析该模型分子生物学层面各指标的变化。
[0069]
实验过程如下:1)细胞培养:将c2c12小鼠成肌细胞用含有10%胎牛血清的培养基(dmem高糖)稀释到1
×
105个细胞/ml,接种到6孔板中,在37℃,5% co2环境下培养;当细胞密度达到约80-85%时,清除孔中的培养基,添加含有2%马血清的培养基(dmem高糖),用于诱导肌管分化;其中实验组加入dmso溶解的四硫代钼酸盐(由于前期实验发现四硫代钼酸盐在培养基的浓度在1nmol/l~200mmol/l的条件下,均对c2c12细胞的功能有影响,实验过程中,可以根据实验目的,加入特定浓度的四硫代钼酸盐溶液),对照组加入相应量的dmso;2)分化观察:在0-7天的分化过程中,每24小时拍照记录实验组和对照组的细胞分化情况;3)细胞收集:在0-7天的分化过程中,每24小时收集细胞提取mrna用于分析成肌细胞分化相关基因的表达变化;4)将上述实验数据统计分析后绘制成图(参见图10-图12)。
[0070]
上述实施例中,四硫代钼酸盐处理后对c2c12细胞分化速度的影响效果对比图如图10所示,由图10可见,四硫代钼酸盐给药后使c2c12细胞分化速度明显加快。
[0071]
上述实施例中,四硫代钼酸盐处理后对c2c12细胞诱导分化的肌细胞生成素(myog) mrna表达的影响效果对比如图11所示,由图11可见,四硫代钼酸盐给药后,反映c2c12细胞诱导分化的肌细胞生成素(myog)mrna表达显著升高。
[0072]
上述实施例中,四硫代钼酸盐处理后对c2c12细胞肌管形成的肌球蛋白(myhc)mrna表达的影响效果对比如图12所示,由图12可见,四硫代钼酸盐处理后,反映c2c12细胞肌管形成的肌球蛋白(myhc)mrna表达显著升高。
[0073]
上述实验结果显示:四硫代钼酸盐可促进c2c12小鼠成肌细胞的分化,加快c2c12细胞形成肌管的速度,并且提高了肌细胞生成素(myog)和肌球蛋白(myhc)mrna的表达。
[0074]
实施例3:本实施例提供四硫代钼酸盐改善动物运动能力和学习记忆能力的功能演示实例。
[0075]
采用健康小鼠模型,观察四硫代钼酸盐给药后小鼠模型在morris水迷宫实验中的表现,并分析小鼠在代表运动能力和学习记忆能力的各指标中的变化(参见图13~图15)。
[0076]
由图13可见,本实施例中四硫代钼酸盐处理后增加了小鼠的游泳速度,速度越快,代表小鼠的运动能力越好。
[0077]
由图14和15可见,本实施例中四硫代钼酸盐处理缩短了小鼠找到平台前的潜伏期、并增加了小鼠穿过隐藏平台的次数,这两项指标均显示小鼠的学习记忆能力增强,这说明四硫代钼酸盐处理对神经系统至少没有损伤。
[0078]
现有的理论研究表明:肌肉除了是运动器官和代谢器官,也是内分泌器官,其通过分泌多种内分泌因子,对机体的代谢具有重要的调节作用,而肌肉质量是其发挥功能的决定因素(giudice et al., curr opin pharmacol 2017, 34, 49-55, iizuka et al., j pharmacol sci 2014, 125, 125-131, kim et al., endocrinol metab (seoul) 2020, 35, 1-6)。由此可以看出:维持稳定的肌肉质量,是维持肌肉的力量输出、内分泌、调控代谢等功能的基础。以上实验已经从运动能力的加强验证了“四硫代钼酸盐通过增加肌肉质量,可以增强运动功能”,因此,结合现有研究术可以发现:硫代钼酸盐促成的小鼠肌肉质量的增加,将增强其内分泌功能和调控代谢的功能,能显著提高小鼠的运动能力,并对神经系统没有副作用。。
[0079]
实施例4:本实施例提供四硫代钼酸盐发挥增肌功能的活性单元。
[0080]
采用c2c12小鼠成肌细胞模型,观察两种四硫代钼酸盐(四硫代钼酸铵、四硫钼酸二胆碱)以相同摩尔浓度或相同质量浓度给药后,对c2c12成肌细胞增殖和分化的影响(参见图16)。
[0081]
实验结果显示:两种四硫代钼酸盐以相同摩尔浓度给药,其对c2c12成肌细胞增殖和分化有一致的促进程度;两种四硫代钼酸盐以相同质量浓度给药,其对c2c12成肌细胞的增殖和分化促进程度不一致。因此,四硫代钼酸盐的增肌的功效只与四硫代钼酸根离子(mos
42-)的摩尔浓度直接相关,而其结合的不同阳离子的质量分数对实验效果没有明显影响,这表明:四硫代钼酸根离子(mos
42-)为四硫代钼酸盐发挥增肌功能的活性单元。
[0082]
实施例5:本实施例提供四硫代钼酸盐发挥增肌效用的剂量范围和安全浓度。
[0083]
采用c2c12小鼠成肌细胞和健康小鼠模型,通过添加不同浓度的四硫代钼酸盐处理后,实验发现:其在低至1nmol/l条件下,四硫代钼酸盐仍对c2c12细胞的功能有影响;在每千克小鼠体重供给四硫代钼酸盐768μmol(768μmol /kg体重)的条件下,仍能促进小鼠增肌;且上述剂量均没有显示明显毒性。
