1.本发明涉及医药技术领域,尤其涉及延胡索乙素在治疗非酒精性脂肪性肝病中的应用。
背景技术:
2.非酒精性脂肪性肝病(non-alcoholfatty liver disease,nafld)是一种在不过量饮酒的基础上,脂肪在肝中大量累积所导致的代谢应激性肝损伤。nafld的疾病谱可从单纯性脂肪肝经非酒精性脂肪性肝炎发展为肝纤维化,甚至导致肝硬化、肝细胞癌或肝功能衰竭等终末期肝病。同时,nafld还可大大增加2型糖尿病、心血管疾病和心脏病以及慢性肾病的风险,给患者家庭和国家卫生系统带来巨大的负担。因此积极预防和治疗非酒精性脂肪性肝病对其产生的肝病综合征有着非常重要的意义。
3.迄今为止,临床上尚无批准的治疗nafld药物,是人类面临的一大健康难题。目前治疗措施也仅为取降血脂、降血糖、保肝药物治疗、行为矫正、饮食、锻炼和减肥等来逆转nafld。现有的药物维生素e和吡格列酮在治疗nafld虽然显示出一定的效果,但由于用药后会出现体重增加、液体潴留/充血性心力衰竭以及膀胱癌等风险,使其无法成为可靠的临床治疗药物,因此,开发nafld的干预药物已迫在眉睫。
4.延胡索乙素(levo-tetrahydropalmatine,thp)属于延胡索中的生物碱类化合物。其结构如式i:
[0005][0006]
目前,延胡索乙素的研究主要集中在其镇痛、镇静、催眠,抗心肌缺血,抑制胃酸分泌等方面,对改善nafld作用尚无报道。
技术实现要素:
[0007]
有鉴于此,本发明要解决的技术问题在于提供延胡索乙素在制备治疗非酒精性肝病中的应用。
[0008]
本发明提供了延胡索乙素在制备治疗非酒精性脂肪性肝病的药物中的应用。
[0009]
本发明中,所述治疗包括改善与脂质合成相关的mrna和/或与脂质氧化相关的mrna的表达。
[0010]
一些实施例中,所述脂质合成相关的mrna和/或与脂质氧化相关的mrna包括:pgc-1α、ampk、acc、hmgcr、tbc1d1、fas、srebp-1c和cpt-1中至少一种。
[0011]
本发明中,所述治疗包括降低脂肪酸合成酶蛋白fas和/或固醇类调节元件结合蛋
白srebp-1c水平、提高脂质氧化蛋白p-acc、sirt1、cpt-1a或pparα水平。
[0012]
本发明中,所述治疗包括重编程脂肪变性能量代谢表型从而改善脂质代谢紊乱。
[0013]
本发明中,所述治疗包括降低肝细胞中的脂质堆积。
[0014]
本发明中,所述治疗包括降低肝脏甘油三酯、总胆固醇、低密度脂蛋白胆固醇的水平和/或提高高密度脂蛋白胆固醇水平。
[0015]
本发明中,所述治疗包括降低谷草转氨酶和/或谷丙转氨酶水平。
[0016]
本发明中,所述治疗包括降低非酒精性脂肪性肝病动物体重、肝重、改善肝脏和/或干细胞形态。
[0017]
本发明中,所述非酒精性脂肪性肝病为高脂饮食导致的非酒精性脂肪性肝病。
[0018]
本发明还提供了一种治疗非酒精性脂肪性肝病的药物,其包括延胡索乙素。
[0019]
本发明还提供了一种非酒精性脂肪性肝病的治疗方法,其为给予含有延胡索乙素的药物。
[0020]
本发明中,所述延胡索乙素在治疗非酒精性脂肪性肝病中的用量为40mg/kg/day~80mg/kg/day。
[0021]
本发明以动物模型和细胞模型,证明延胡索乙素能够通过多种途径实现治疗非酒精性脂肪性肝病的效果。并且。实验表明有效剂量内延胡索乙素对于动物体或细胞不存在毒性。
附图说明
[0022]
图1为延胡索乙素治疗4周后可显著降低hfd小鼠的体重和肝重,control:为正常饲料喂养;hfd:高脂饲料喂养;
[0023]
图2为延胡索乙素治疗4周后显著降低hfd小鼠肝脏内脂质沉积;
[0024]
图3为延胡索乙素治疗4周后显著降低hfd小鼠肝脏甘油三酯(tg)、总胆固醇(t-cho)和低密度脂蛋白胆固醇(ldl-c)并提高高密度脂蛋白胆固醇(hdl-c)含量;
[0025]
图4为延胡索乙素治疗4周后显著降低hfd小鼠肝脏肝功能损伤指标-谷草转氨酶(ast)和谷丙转氨酶(alt);
[0026]
图5为延胡索乙素治疗4周后未对肝、心、脾、肺、肾等脏器造成损伤;
[0027]
图6为延胡索乙素治疗4周后显著降低hfd小鼠由hfd造成的脂肪酸合成酶蛋白fas及固醇类调节元件结合蛋白srebp-1c表达,提高脂质氧化蛋白p-acc、sirt1、cpt-1a和pparα表达;
[0028]
图7为延胡索乙素治疗脂肪变性细胞模型显著降低脂质堆积;
[0029]
图8为延胡索乙素治疗脂肪变性细胞模型未对细胞产生明显的细胞毒性;
[0030]
图9为延胡索乙素治疗脂肪变性细胞模型显著改善与脂质合成及脂质氧化相关的mrna表达;
[0031]
图10为延胡索乙素治疗脂肪变性模型后重编程脂肪变性能量代谢表型来改善脂质代谢紊乱。
具体实施方式
[0032]
本发明提供了延胡索乙素在治疗非酒精性脂肪性肝病中的应用,本领域技术人员
可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
[0033]
本发明通过高脂饮食(high-fatdiet,hfd)建立nafld小鼠模型,证明该药物有效地减少肝脏中脂肪堆积,减轻nafld小鼠体重。经血生化检测,延胡索乙素可以降低高脂饮食小鼠的血清甘油三酯(triglyceride,tg)、总胆固醇(totalcholesterol,t-cho)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,ldl-c)的水平,并提高高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,hdl-c)水平。延胡索乙素可恢复由hfd造成的肝功能损伤指标谷草转氨酶(aspartate aminotransferase,ast)和谷丙转氨酶(alanine aminotransferase,alt)异常水平,进而改善肝脏功能。同时,通过激活ampk表达来调节肝脏脂质代谢,从而达到治疗nafld的目的。在体外模型中,采用游离脂肪酸(free fattyacids,ffas)诱导人肝癌smmc-7721和bel-7402细胞构建nafld细胞模型,结果发现延胡索乙素能够显著促进ampk磷酸化,同时明显抑制由ffas造成的脂肪酸合成酶蛋白fas及固醇类调节元件结合蛋白srebp-1c的表达,提高脂质氧化蛋白p-acc、sirt1、cpt-1a和pparα的表达,此外重编程脂肪变性能量代谢表型来改善脂质代谢紊乱,从而分别抑制脂质从头合成途径和促进脂质氧化途径。由此可见,延胡索乙素对于治疗非酒精性脂肪性肝病具有重要作用。
[0034]
本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
[0035]
实施例1:动物模型实验
[0036]
一、高脂饲料(hfd)饮食诱导的小鼠非酒精性脂肪性肝病模型的制备
[0037]
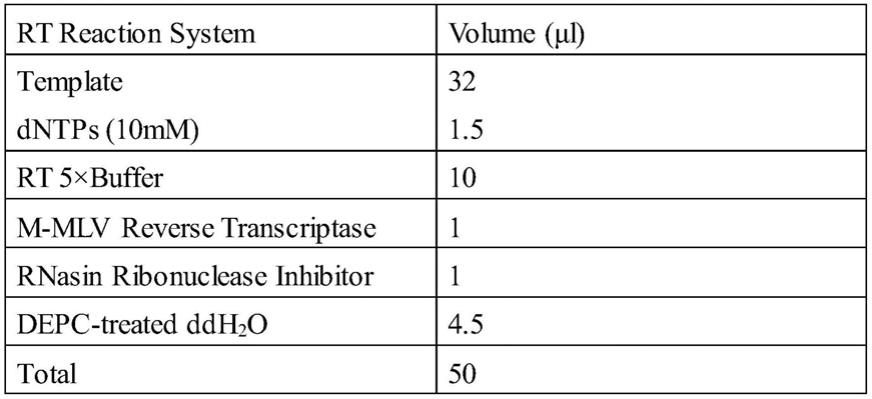
1.1试验分组
[0038]
本发明采用c57bl/6小鼠给予高脂饲料(hfd)12周的方法建立非酒精性脂肪性肝病动物模型,通过灌胃给予延胡索乙素方式验证其疗效;
[0039]
1.2具体过程:采用高脂饲料(hfd)喂养小鼠。hfd诱导的脂肪肝被公认为是nafld的经典模型之一,长期(16周)喂食hfd的啮齿类动物将自然进展为肝脏脂肪变性,同时发生肥胖、高脂血症,较少发生炎症与纤维化。选取c57bl/6j雄性小鼠,经适应性喂养1周后,随机分为正常饮食(control)组、高脂模型(hfd)组、高脂饲料+延胡索乙素(hfd+thp-40mg/kg)组、高脂饲料+延胡索乙素(hfd+thp-80mg/kg)组,每组8只小鼠。连续12周给予control组小鼠正常饲料(啮齿类动物维持饲料)、hfd组小鼠高脂饲料。hfd+thp组小鼠在高脂喂养基础上进行延胡索乙素灌胃给药;延胡索乙素小鼠灌胃量为40mg/kg/day、80mg/kg/day;同时以饮用水灌胃control组、hfd组,体积与hfd+thp组一致。
[0040]
1.3动物处死取材:实验结束后(实验前禁食12h,自由饮水),称完体重后,取材当日以3%戊巴比妥钠腹腔麻醉小鼠。待小鼠充分麻醉后,方可进行后续解剖操作。取腹主动脉血5ml,于4℃冰箱静置60min,3000r/min离心15min,离心后用移液枪分离血清。取完血液后,之后颈椎脱臼处死鼠,立即摘取肝脏,用预冷的生理盐水洗净,滤纸吸干,称取肝脏湿重,摊开拍照。取最大肝叶部位组织约300mg,放入rnase free冻存管,投入液氮中,再转入-80℃冰箱保存备用。取相同部位中间组织约0.5g,大小约1cm
×
1cm
×
0.5cm,用10%甲醛
(10%福尔马林)溶液固定,备用。再取肝右叶组织若干块,每块约0.5g左右,分别置于10mlep管中,保存于-80℃备用。
[0041]
二、作用研究
[0042]
2.1对于体重、肝重等常规指标的影响
[0043]
a)处死小鼠前测量小鼠体重,解剖小鼠后剥离肝脏进行称量;
[0044]
b)结果分析:如图1所示,延胡索乙素治疗可显著降低hfd小鼠的体重、肝重,起到减重的效果。
[0045]
2.2对于非酒精性脂肪性肝病的脂质堆积的影响
[0046]
a)测定小鼠肝脏油红染色;
[0047]
b)测定方法:(1)制备新鲜骨髓、血液涂片,加入oro fixative固定10-15min;(2)取出涂片,放于流通的空气中10-15min;(3)加入新配制好的oro stain,浸染15min;(4)加入60%异丙醇漂洗20-30s,流水冲洗,入蒸馏水稍微清洗;(5)加入mayer苏木素染色液,复染核2min;(6)加入oro buffer1min。
[0048]
c)结果分析:如图2肝脏油红o染色结果所示,hfd喂养小鼠肝细胞内红色脂滴阳性面积明显高于control喂养小鼠,出现较为明显的气球样变。经过4周延胡索乙素灌胃治疗,肝细胞气球样变性程度、脂肪变性面积明显减轻。延胡索乙素治疗可显著降低hfd小鼠脂肪堆积,提示其具有治疗脂肪肝的效果。
[0049]
2.3对于非酒精性脂肪性肝病的肝脏甘油三酯(tg)、总胆固醇(t-cho)和低密度脂蛋白胆固醇(ldl-c)及高密度脂蛋白胆固醇(hdl-c)含量的影响
[0050]
a)测定方法:小鼠肝脏tg、t-cho、ldl-c及hdl-c含量按照南京建成公司tg、t-cho、ldl-c及hdl-c测定商品试剂盒说明书进行测定;
[0051]
b)结果分析:如图3所示,延胡索乙素治疗4周后显著降低hfd小鼠肝脏甘油三酯(tg)、总胆固醇(t-cho)和低密度脂蛋白胆固醇(ldl-c)并提高高密度脂蛋白胆固醇(hdl-c)含量;
[0052]
2.4对于非酒精性脂肪性肝病的肝功能损伤指标-谷草转氨酶(ast)和谷丙转氨酶(alt)含量的影响
[0053]
a)测定方法:小鼠肝脏ast及alt测定商品试剂盒说明书进行测定;
[0054]
b)结果分析:如图4所示,延胡索乙素治疗4周后显著降低hfd小鼠肝脏肝功能损伤指标-谷草转氨酶(ast)和谷丙转氨酶(alt)。
[0055]
2.5对于非酒精性脂肪性肝病的肝、心、脾、肺、肾等脏器形态及病理组织切片结果的观察
[0056]
a)通过h&e染色测定延胡索乙素治疗对于非酒精性脂肪性肝病的影响;
[0057]
b)测定方法:苏木素伊红(hematoxylin and eosin,h&e)染色:(1)制备肝脏石蜡切片:统一取小鼠肝中叶中间2/3以及肝左叶,置于包埋盒后浸入10%中性福尔马林,过夜固定,继续脱水、透明,顺序为50%乙醇1h
→
75%乙醇1h
→
85%乙醇1h
→
95%乙醇1h
→
100%乙醇30min
→
100%乙醇30min
→
100%乙醇+二甲苯(1:1,v/v)45min
→
二甲苯i30min
→
二甲苯ii 30min,三次浸蜡,二甲苯+石蜡(1:1,v/v)45min
→
石蜡1h
→
石蜡过夜,制备肝脏石蜡包埋块后,制备厚度5μm的肝脏石蜡切片,75℃温箱烘烤1h后,室温保存备用;(2)取出待染肝脏石蜡切片,依次移入二甲苯与梯度乙醇进行脱蜡与水化,顺序如下:二甲苯
i15min
→
二甲苯ii 15min
→
100%乙醇i 5min
→
100%乙醇ii 5min
→
95%乙醇5min
→
75%乙醇5min
→
50%乙醇5min
→
流水贴染色缸侧边(流水勿触及切片,防止脱片)冲洗5min;(3)切片浸入mayer苏木素8min,流水贴染色缸侧边冲洗1min;(4)切片浸入0.5%盐酸酒精30s,流水贴染色缸侧边冲洗10min,至细胞核返蓝;(5)切片浸入1%伊红7min,流水贴染色缸侧边冲洗1min,洗去浮色。(6)切片进行脱水与透明,顺序如下:50%乙醇5min
→
75%乙醇5min
→
95%乙醇5min
→
100%乙醇i 5min
→
100%乙醇ii 5min
→
二甲苯i15min
→
二甲苯ii 15min;(7)封片:中性树胶封片,静置至树胶凝固、二甲苯完全挥发;(8)白光显微镜下观察与拍照;
[0058]
c)结果分析:如图5肝脏h&e染色结果所示,肝脏大体形态显示,control组喂养小鼠肝脏形态正常,色泽红润,质地柔软,hfd喂养小鼠肝脏体积异常增大,质地较硬,表面油腻感较显著,提示该组小鼠产生脂肪变性;给予延胡索乙素治疗后,肝脏体积减小,色泽、质地均有显著改善。同时,给药治疗后,延胡索乙素未对心、脾、肺、肾等脏器造成损伤。
[0059]
2.6对于非酒精性脂肪性肝病的fas、srebp-1c、p-acc、sirt1、cpt-1a和pparα蛋白表达的观察
[0060]
a)通过westernblot测定延胡索乙素治疗对于非酒精性脂肪性肝病蛋白表达的影响;
[0061]
b)测定方法:(1)肝脏总蛋白提取:取保存在4%多聚甲醛溶液中肝组织大约100mg,使用组织匀浆器将各组肝组织研磨成匀浆,加入适量ip组织裂解液(含磷酸酶抑制剂、蛋白酶抑制剂和pmsf),冰上裂解30min,超声破碎后,4℃,10000rpm离心10min,转移上清至新ep管;(2)使用bca法测定总蛋白浓度。标准品准备:将蛋白标准(30mg bsa)配制成25mg/ml的蛋白标准溶液。取40μl蛋白标准溶液,加入1960μl去离子水,稀释至终浓度为0.5mg/ml,配制后可立即使用,也可以放-20℃冰箱保存备用。bca工作液配制及蛋白浓度测定:将bca试剂a和bca试剂b按50:1比例配制适量的bca工作液,两者充分混匀。将蛋白标准溶液浓度分别稀释成0、0.025、0.05、0.1、0.2、0.3、0.4、0.5mg/ml。每个样品取2μl加入到标记好的96孔板中,补加18μl去离子水至20μl。加入200μl/孔bca工作液至每个待处理样品中,在无co2的37℃培养箱中避光孵育30min。540-595nm之间用酶标仪测定吸光度。根据标准蛋白浓度与吸光度的关系构建标准曲线并利用此曲线计算样品的蛋白浓度。(3)
①
配胶、上样及电泳:利用page凝胶快速制备试剂盒配制方法—1.取等体积4.0ml的下层胶缓冲液和下层胶溶液,充分吹打混匀;2.向上述步骤1的下层胶混合溶液中加入改良型促凝剂80μl,充分吹打混匀;3.将上述步骤2中的混合溶液注入配胶厚、薄玻璃板中,使混合溶液的液面和薄玻璃板上沿之间的距离比梳齿长50mm即可,随后注入1ml去离子水或醇类溶液(如正丁醇、异丙醇等)覆盖在下层胶溶液上层;4.室温下,约5~10min后下层胶可凝固,去除上层覆盖的去离子水或醇类溶液;5.取等体积1.0ml的彩色上层胶缓冲液和上层胶溶液,充分吹打混匀;6.向上述步骤5的上层胶混合溶液中加入改良型促凝剂20μl,充分吹打混匀;7.将上述步骤6的上层胶混合溶液注入厚、薄玻璃板中,插入制胶梳子;8.室温下,约10~15min后,上层胶可凝固后,拔去梳子即可进行蛋白电泳。在凝胶加样孔加入30μg/孔蛋白样品开始电泳。上层胶时采用80v电泳,电泳至下层胶中时转换为120v继续电泳,当样品前端的溴酌蓝电泳至下层胶下边缘时,可停止电泳。
②
转膜:将pvdf膜提前浸泡到甲醇溶液中,然后转入膜转缓冲液中。在转膜仪上提前铺好湿润过的转膜滤纸,随后将pvdf膜铺在转膜滤纸
上,在制胶玻璃板之间取出凝胶,将其放在已铺好的pvdf膜上,最后将另外的转膜滤纸覆盖在凝胶上。采用15v,40min进行电转膜。
③
封闭:使用质量浓度为5%(w/v)脱脂奶粉的1
×
tbst封闭液室温封闭不少于3h,水平摇床20rpm。
④
抗体孵育及洗膜:用封闭液将抗fas、srebp-1c、p-acc、sirt1、cpt-1a和pparα一抗稀释为1:1000,然后将抗体与封闭完毕的pvdf膜4℃孵育过夜。抗体孵育结束后,水平摇床70rpm,1
×
tbst洗pvdf膜3~5次,每次洗膜6~8min。用封闭液稀释对应种属的二抗(1:1000),室温静置放置pvdf膜,孵育1h。二抗孵育结束后,水平摇床70rpm,1
×
tbst洗pvdf膜3~5次,每次洗膜6-8min。
⑤
显影及曝光:采用超敏ecl化学发光溶液进行显影,使用dnr bio-imaging systems化学发光成像仪进行曝光;
[0062]
c)结果分析:如图6所示,延胡索乙素治疗4周后显著降低hfd小鼠由hfd造成的脂肪酸合成酶蛋白fas及固醇类调节元件结合蛋白srebp-1c表达,提高脂质氧化蛋白p-acc、sirt1、cpt-1a和pparα表达。
[0063]
实施例2:体外细胞模型实验
[0064]
1、选用smmc-7721和bel-7402肝癌细胞系,以1mmffas刺激smmc-7721和bel-7402细胞24h,成功建立细胞脂肪变性模型后,再以延胡索乙素(75、100μm)孵育24h,同时设置bsa组(以含1%bsa、不含胎牛血清的培养基培养smmc-7721和bel-7402细胞)。药物干预结束后,收集细胞与细胞蛋白,后期检测细胞内脂滴含量变化。
[0065]
2、脂滴染色:(1)smmc-7721与bel-7402细胞培养24h后,弃掉smmc-7721与bel-7402细胞对应细胞培养基,用pbs清洗2次,加oro fixative细胞固定液固定30min;(2)弃掉smmc-7721与bel-7402细胞对应孔的oro fixative细胞固定液,用mill-q水清洗smmc-7721与bel-7402细胞2~3次;(3)每个细胞培养孔中加入已配置好的60%异丙醇溶液,室温将smmc-7721与bel-7402细胞放置5min;(4)用移液枪将每孔的60%异丙醇溶液吸掉,加入已配制好的oro stain染色液(现用现配)至smmc-7721与bel-7402细胞中,室温浸染10~20min;(5)弃掉smmc-7721与bel-7402细胞中的oro stain染色液,使用mill-q水清洗2~5次,直到每个培养孔中无多余oro stain染色液;(6)接下来向smmc-7721与bel-7402细胞中加入mayer苏木素染色液,在室温条件下,复染细胞核1~2min,弃去smmc-7721与bel-7402细胞中mayer苏木素染液后,使用mill-q水清洗各个细胞培养孔2~5次;(7)随后向每孔smmc-7721与bel-7402细胞中入oro buffer,室温放置1min,弃掉;(8)加mill-q水覆盖细胞并在光学或荧光显微镜下观察smmc-7721与bel-7402细胞中脂滴情况。
[0066]
3、结果分析:如图7所示,延胡索乙素治疗脂肪变性细胞模型显著降低脂质堆积。
[0067]
3.1、检测延胡索乙素与ffas共培养体系对smmc-7721与bel-7402细胞的细胞毒性。
[0068]
a)通过rtcaxcelligence系统测定延胡索乙素与ffas共培养体系对smmc-7721与bel-7402细胞毒性的影响;
[0069]
b)测定方法:(1)首先在e-plate 16细胞培养板中加入50μl/孔smmc-7721与bel-7402细胞培养对应的dmem和rpmi-1640培养基;(2)随后装有空白培养基的e-plate 16细胞培养板转移至rtcadp station中,进行基线检测准备。(3)rtcadp系统会自动进行“scan plate”,检查e-plate 16细胞培养板与探针是否接触良好;(4)开始检测基线,确定所自定义选择的孔接触正常,并且所有孔的“cellindex”均低于0.063;(5)在选择的e-plate 16细胞培养板每孔中加入100μl混合均匀的smmc-7721细胞与bel-7402细胞消化后悬液,使每孔
中细胞密度规定为5.0
×
103个/100μl,细胞悬液加入e-plate16细胞培养板后无需再混匀;(6)将e-plate 16细胞培养板置于超净台工作台中室温静置30min以上;(7)将e-plate 16细胞培养板放到细胞培养箱中对应rtcadp station的板槽中;(8)在rtcad station系统自动扫描后,添加并运行step 2,设置“duration”为96h,“interval”为15min,每隔15min检测一次细胞指数(cellindex,ci),过夜检测细胞增殖曲线;(9)rtcadp station运行24h后,停止程序运行,取出e-plate 16细胞培养板,弃掉50μl/孔细胞培养基,将配制好的定容为终浓度为50μl体系的不同浓度药物加入e-plate 16细胞培养板中(smmc-7721细胞75、100μm;bel-7402细胞50、75μm),室温静置30min,放置到原来位置的rtcadp station中,继续运行程序,选中复孔位置,勾选“average”与“std dev”。实验结束后,将实验结果导出并进行数据分析;
[0070]
c)结果分析:如图8所示,延胡索乙素治疗脂肪变性细胞模型未对细胞产生明显的细胞毒性。
[0071]
3.2检测延胡索乙素对smmc-7721与bel-7402模型细胞mrna表达
[0072]
a)通过实时荧光定量pcr测定延胡索乙素对smmc-7721与bel-7402模型细胞mrna表达的影响;
[0073]
b)测定方法:(1)将处于对数生长期的smmc-7721与bel-7402细胞制备细胞悬液,接种细胞悬液于6孔细胞培养板中制备单层细胞(2.0
×
105个/孔),将1mmffas同时加入细胞悬液中,rpmi-1640或dmem培养基定容至2ml,37℃、5%co2培养箱中培养24h后,分别加入延胡索乙素75、100μm,药物作用24h,同时间段未做任何处理的细胞作为空白对照组,还包括单纯ffas组,thp+ffas组;(2)对应的细胞沉淀每管分别加入500μltrizol裂解液,移液器反复吹打至充分重悬细胞沉淀,室温静置10min,使核酸与核蛋白完全分离;(3)加入200μl氯仿至每个样品,剧烈漩涡振荡持续30s,室温静置3min,4℃12000rpm离心10min;慢慢吸取上层水相转移至rnase-free ep管中,加入上层水相一半体积的无水乙醇,充分吹打混匀体系;(4)将吸附柱放到收集管中,用移液枪将全部溶液溶液及半透明纤维状悬浮物转移至吸附柱中,室温静置2min,4℃12000rpm离心3min,倒净收集管中所有废液;(5)将吸附柱放回收集管中,每管加入500μlrpe溶液,室温静置2min,4℃10000rpm离心30s,倒净收集管中废液;重复上述步骤一次;将吸附柱放回收集管中,4℃10000rpm离心2min;(6)将吸附柱转移至1.5mlrnase-free ep管中,用移液器在吸附膜中央缓慢滴加32μl depc-treated dd h2o,室温静置5min,4℃ 12000rpm离心2min,将收集到的rna放置-80℃超低温冰箱保存或者立即用于后续试验;(7)吸取2μl rna溶液采用nano drop测定浓度,规定以最小rna质量进行定量,定量体系32μl:规定最小rna质量的相应体积,depc-treated dd h2o补齐体积,random primer91.5μl。将上述定量体系在75℃水浴中持续5min;冰上至少孵育2min:(8)反转录体系总体系50μl:
[0074]
表1反转录体系
[0075][0076]
反转录体系条件:42℃水浴中持续50min;75℃水浴中持续15min,-40℃冰箱保存备用或立即使用;(9)相对qpcr总体系为20μl:当反转录成cdna后,进行
δδ
ct相对qpcr,反应体系如下:
[0077]
表2荧光定量pcr反应体系
[0078]
reaction systemvolume(μl)2
×
gotaq qpcr master mix10forward primer0.2reverse primer0.2nuclease-free water8.6cdna1total20
[0079]
qpcr反应条件:qpcr循环体系为95℃15s,60℃30s,72℃30s,循环40次,72℃10min延伸。引物序列及pcr产物如下:
[0080]
表3引物序列及pcr产物
[0081][0082]
c)结果分析:如图9所示,延胡索乙素治疗脂肪变性细胞模型显著改善与脂质合成及脂质氧化相关的mrna表达。
[0083]
3.3、检测延胡索乙素对smmc-7721与bel-7402模型细胞能量代谢
[0084]
a)通过体外流量分析系统测定延胡索乙素对smmc-7721与bel-7402模型细胞能量代谢的影响;
[0085]
b)测定方法:线粒体有氧呼吸压力测试实验:(1)采用常规细胞培养操作,将细胞悬液接种于对应培养基中,并将细胞数目调整到所适合数量。将游离脂肪酸ffas加入细胞悬液中,rpmi-1640或dmem培养基定容至50μl,过夜培养;(2)枪头贴壁倾斜缓慢加入50μl细胞悬浮液于mini-plate细胞培养板的微孔中(空白背景孔只添加培养基)边孔每孔添加400μlpbs或生理盐水(防止蒸干),然后37℃5%co2培养箱中过夜正常培养。培养24h后,需添加药物进行干预,在持续培养24h;(3)水化探针。在探针板每孔中加入200μl水化平衡液,边孔每孔加400μl水化平衡液,然后置于37℃无co2恒温培养箱中水化过夜,探针板需置于37℃温箱中12h以上;(4)准备分析用培养基:称取葡萄糖0.45g,加入2000μl超纯水,充分混匀溶解,使其终浓度为2.5m;称取谷氨酰胺0.1461g,加入5000μl超纯水,充分混匀溶解,使其终浓度为0.2m;称取丙酮酸钠0.11g,加入10000μl超纯水,充分混匀溶解,使其终浓度为0.1m;取200μl葡萄糖,200μl谷氨酰胺,100μl丙酮酸钠加入到9500μl不含血清、碳酸氢盐的细胞基础培养基中,待分析培养基温度达到37℃时,用1mmnaoh溶液调整其ph至7.3-7.4;(5)seahorse体外流量分析仪机器开机预热至37℃方可使用;(6)代谢调节药物配制:oligomycin加入252μl分析培养基,使其终浓度为1μm;fccp加入288μl分析培养基0.5μm;rotenone/antimycin a加入216μl分析培养基0.5μm,注:fccp浓度需根据细胞种类而定;(7)手动换液:取前一天培养的细胞,用移液器吸取培养基使其保留为20μl体积。每孔分别
加入200μl已配制好的分析培养基进行清洗并全部吸掉,重复本步骤一次。每孔分别加入160μl分析培养基,最终使每孔分析培养基的终体积为180μl,放置无co2培养箱中待用。添加代谢药物:将水化好的探针板取出,将每孔20μl的ologomycin添加到mini-plate培养板的第一个药物注射槽之中(a-h孔),每孔22μl的fccp加入第二个药物注射槽(a-h孔),每孔25μl的rotenone/antimycina加入第三个药物注射槽(a-h孔);(8)上机:选择线粒体程序,探针板进入程序自动校正,校正好后探针板底板自行退出程序,取出探针板底板换上已经制备好的样品细胞板培养板,确认程序进行。待分析完成后,用wave软件打开原始数据处理数据糖酵解测试实验:糖酵解测试实验(1)-(3)步骤同线粒体有氧呼吸压力测试实验(1)-(3)步骤;(4)准备分析用培养基:称取谷氨酰胺0.1461g,加入5000μl超纯水,充分混匀溶解,使其终浓度为0.2m;取200μl谷氨酰胺加入到9800μl不含血清、碳酸氢盐的细胞基础培养基中,待分析培养基温度达到37℃时,用1mmnaoh溶液调整其ph至7.3-7.4;(5)同线粒体有氧呼吸压力测试实验步骤(5);(6)代谢调节药物配制:glucose加入300μl分析培养基,使其终浓度为10mm;oligomycin加入288μl分析培养基10mm;2-dg加入300μl分析培养基50mm;(7)手动换液:取前一天培养的细胞,用移液器吸取培养基使其保留为20μl体积。每孔分别加入200μl已配制好的分析培养基进行清洗并全部吸掉,重复本步骤一次。每孔分别加入160μl分析培养基,最终使每孔分析培养基的终体积为180μl,放置无co2培养箱中待用。添加代谢药物:将水化好的探针板取出,将每孔20μl的glucose添加到mini-plate培养板的第一个药物注射槽之中(a-h孔),每孔22μl的oligomycin加入第二个药物注射槽(a-h孔),每孔25μl的2-dg加入第三个药物注射槽(a-h孔);(8)上机:选择糖酵解程序,探针板进入程序自动校正,校正好后探针板底板自行退出程序,取出探针板底板换上已经制备好的样品细胞板培养板,确认程序进行。待分析完成后,用wave软件打开原始数据处理数据。
[0086]
c)结果分析:如图10所示,延胡索乙素治疗脂肪变性模型后重编程脂肪变性能量代谢表型来改善脂质代谢紊乱。
[0087]
综上,结果发现延胡索乙素可显著降低hfd小鼠的hfd小鼠的体重、肝重,降低肝脏的脂质沉积。血生化检测发现延胡索乙素还可以降低hfd小鼠肝脏甘油三酯(tg)、总胆固醇(t-cho)和低密度脂蛋白胆固醇(ldl-c)并提高高密度脂蛋白胆固醇(hdl-c)含量;同时,改善肝功能损伤指标-谷草转氨酶(ast)和谷丙转氨酶(alt),并未对其他脏器造成明显的损伤。根据肝脏蛋白表达情况发现,延胡索乙素可明显改善脂质相关合成及氧化蛋白的表达,进而改善脂代谢紊乱。除体内动物模型以外,还建立了2种肝细胞脂质沉积的体外细胞模型(包括肝癌细胞smmc-7721+ffas模型和肝癌细胞bel-7402+ffas模型),发现延胡索乙素在具有细胞保护作用的情况下可降低肝模型细胞的脂质堆积。此外,延胡索乙素可显著改善脂肪变性细胞模型中与脂质合成及脂质氧化相关的mrna表达,并重编程脂肪变性细胞模型能量代谢表型来改善脂质代谢紊乱。最终达到治疗非酒精性脂肪性肝病的目的。
[0088]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
