1.本发明涉及医药技术领域,尤其涉及表柔比星复方制剂,以及制备方法和在膀胱疾病中的应用。
背景技术:
2.临床上常见的膀胱癌主要有两种,非肌层浸润膀胱癌(non-muscle invasive bladder cancer,nmibc)和肌层浸润膀胱癌(muscle invasive bladder cancer,mibc)。其中,经尿道膀胱肿瘤切除术(turbt)辅以灌注药物治疗是非肌层浸润膀胱癌的一线标准治疗方案。有研究表明,非肌层浸润膀胱癌患者在接受turbt膀胱肿瘤切除手术后,5年内有50%~70%的复发概率。膀胱灌注是在turbt手术切除肿瘤后通过将化疗药物等肿瘤治疗制剂注入膀胱内部,直接杀伤肿瘤细胞或诱导体内非特异性免疫反应,达到抑制膀胱癌转移复发的效果。但是目前临床上膀胱灌注治疗的绝对缓解率低、肿瘤复发率较高,并且毒副作用大,病人预后差。
3.蒽环类药物对多种移行上皮细胞癌具有较高的易感性,表柔比星是第三代蒽环类半合成化合物,能够直接嵌入dna碱基对之间,干扰转录过程,阻止mrna的形成而起到抗肿瘤作用。目前,以表柔比星、吡柔比星为代表的蒽环类化疗药物是膀胱癌灌注治疗的一线治疗药物。但是,对于高危非肌层浸润膀胱癌患者,在施用表柔比星或吡柔比星进行膀胱灌注治疗后,肿瘤依然具有很高的一年内复发率(超过50%)。
技术实现要素:
4.申请人尝试将化疗药物表柔比星与咪喹莫特直接混合后用于膀胱癌的灌注治疗。结果发现,当化疗药物表柔比星与咪喹莫特的浓度比例在一个合适的范围之间时,可以获得与单独化疗药物灌注相比显著提高的治疗效果,且不增加毒副作用,有望成为一种具有显著临床价值的膀胱灌注新型药物制剂。进一步研究表明,这一新型制剂抗肿瘤机理,主要是通过表柔比星等化疗药物诱导肿瘤细胞的免疫原性细胞死亡暴露肿瘤抗原,同时咪喹莫特作为tlr7激动剂可以激活免疫系统,招募抗原呈递细胞到肿瘤内来识别肿瘤抗原,进而激活针对肿瘤的t细胞免疫反应。
5.但是,我们在进一步地制剂研究中发现,化疗药物如表柔比星与免疫佐剂咪喹莫特的简单混合制剂中,咪喹莫特分子的存在会导致表柔比星等化疗药物分子结构的不稳定,不论是以注射液的溶液形态保存、还是以混合后冻干粉的形态保存,该制剂中杂质的含量都会明显增加,并在很短时间内突破药典规定的药物的杂质限度,无法成为可以稳定保存便于临床应用的药物制剂,二者的简单混合不利于药物分子的化学稳定性。因此,如何提高表柔比星与咪喹莫特复方制剂的化学稳定性,是设计制备二者联合用药的复方制剂的关键问题。
6.为了解决上述问题,我们对各种条件下表柔比星与咪喹莫特复方制剂的稳定性进行了系统研究。我们发现表柔比星与咪喹莫特在溶液中低ph值(如ph=3.0)条件下更为稳
定(远远优于ph 4.0的条件),但仍然会逐渐降解导致制剂无法长期储存,因此注射液剂型对于本制剂不可行。对于冻干粉制剂而言,我们发现乳糖对该制剂的稳定性具有显著的保护效果,同时乳糖的含量增加会有利于制剂稳定性的提升。尽管如此,在ph 3.0的条件下制得的冻干制剂依然无法长期保存,无法通过稳定性加速实验的考察。出乎意料的是,我们发现这一复方冻干制剂有一个稳定性的“ph黄金区间”,在这个ph范围内制备得到的表柔比星/咪喹莫特复方制剂具有非常好的稳定性。该现象与人们对表柔比星单一制剂溶液状态的稳定性趋势的常规理解以及我们对该复方制剂溶液状态稳定性考察结果相反。
7.通过进一步深入分析表柔比星的杂质谱图和化学结构,我们发现表柔比星与咪喹莫特的复方体系在水溶液和冻干制剂状态下的降解机理是不同的。首先,盐酸表柔比星不论在注射液还是冻干粉状态下都是稳定的,目前上市的表柔比星制剂存在注射液和冻干粉两种剂型。但对于复方制剂而言,在溶液相,咪喹莫特的存在会导致表柔比星一个未知单杂组分的快速上升,这个反应的速率随ph的升高而升高,在ph 3.0这一低ph值下,该反应依然会缓慢发生(注:更低的ph值的药液虽然对稳定性有利,但是会在使用时对膀胱造成很大的刺激和损害)。
8.在冻干的固态下,咪喹莫特的存在则会导致表柔比星杂质a(脱去糖环结构的降解产物)的快速上升,其原因猜测是咪喹莫特分子结构中芳香环上氮原子的孤对电子作为亲核基团进攻表柔比星的糖苷键,导致该化学键的断裂和降解杂质a的产生。通过加入乳糖作为冻干保护剂,可以一定程度上阻隔表柔比星分子和咪喹莫特分子的直接接触,从而减缓这一反应的发生。同时,这一反应从现象来看是酸催化加速的反应(低ph下糖苷键上氧原子的质子化是反应的中间步骤),因此ph的升高会显著减缓杂质a的产生。另一方面,我们发现过高的ph则会导致咪喹莫特分子溶解性的下降(ph 5.0以上咪喹莫特从溶液中析出),同时过高的ph还会导致表柔比星另外一个未知杂质(推断为表柔比星的氧化产物)的增加。综上,表柔比星与咪喹莫特的复方制剂在一个合适的ph区间、合适含量的辅料(乳糖)存在下,可以获得一个可以稳定保存的剂型。
9.此外,我们还发现加入在本制剂中加入粘膜促渗剂,可以增强药物溶液灌注治疗后在膀胱粘膜中的渗透和滞留,有助于进一步提升本制剂的疗效。
10.本发明提供一种表柔比星和咪喹莫特混合冻干粉制剂。在大量实验分析中发现,冻干粉剂型相较于传统的注射剂型,更有助于保护表柔比星在混合物中的长期化学稳定性,同时,混合制剂在膀胱灌注肿瘤治疗中,具有较好的肿瘤抑制效果,能够引起更强烈的抗肿瘤免疫反应。
11.本发明提出了一种表柔比星复方制剂,包括表柔比星或其可溶性盐,咪喹莫特或其可溶性盐,ph调节剂和冻干保护剂。
12.进一步地,所述表柔比星复方制剂为冻干粉剂型。
13.进一步地,表柔比星或其可溶性盐与咪喹莫特或其可溶性盐的质量比为1:1~1:10。
14.进一步可选地,表柔比星或其可溶性盐与咪喹莫特或其可溶性盐的质量比为1:2~1:4。
15.进一步地,所述ph调节剂可以是弱碱、氢氧化钠、盐酸。
16.进一步可选地,所述ph调节剂是碳酸氢钠、盐酸。
17.进一步地,所述冻干保护剂包括蔗糖、乳糖、甘露醇、环糊精。
18.进一步地,所述冻干保护剂为乳糖。
19.进一步地,所述冻干保护剂在冻干粉制剂中的质量分数为65%~96%。
20.进一步可选地,冻干保护剂的质量分数为80%~94%。
21.进一步地,所述表柔比星和咪喹莫特混合冻干粉制剂还包括粘膜促渗剂。
22.进一步地,所述粘膜促渗剂包括氮酮、透明质酸酶、月桂醇、油酸中的至少一种。
23.进一步地,所述粘膜促渗剂可以在制备过程中加入,也可以在使用前混合。
24.进一步地,所述表柔比星和咪喹莫特混合制剂冻干前的ph为3.8~5.5。需要说明的是,这里定义复溶浓度的目的是为了定义复溶后的ph值的范围,并不是对复溶浓度的限定。
25.进一步地,所述表柔比星和咪喹莫特混合冻干粉制剂复溶后,表柔比星浓度为1~5mg/ml时的ph为3.8~5.5。需要说明的是,这里定义复溶浓度的目的是为了定义复溶后的ph值的范围,并不是对复溶浓度的限定。
26.进一步地,所述冻干粉剂型的复溶后表柔比星的浓度为1mg/ml时的ph为4.0~5.0。
27.进一步可选地,所述冻干粉剂型复溶后表柔比星浓度为1mg/ml时ph值为4.0~4.4,4.4~5.0,5.0~5.5。
28.本发明提出了一种表柔比星和咪喹莫特混合冻干粉制剂的制备方法。
29.包括如下步骤:
30.s1:用稀酸溶解咪喹莫特或其可溶性盐,得到咪喹莫特稀酸盐溶液;
31.s2:用s1的溶液溶解表柔比星,得到混合溶液;
32.s3:用碱性缓冲液或碱性溶液调节混合溶液的ph至3.8~5.5;
33.进一步地:所述步骤s3还包括:
34.s31:向所述混合溶液中加入粘膜促渗剂;
35.进一步地,s1中所述稀酸溶液为盐酸、乳酸、醋酸。
36.进一步地,s3中调节ph的优选范围是4.0~5.0。
37.进一步可选地,s3中调节ph值可以是3.8~4.0,4.0~4.4,4.4~5.0。
38.进一步地,还包括s4:对s3中得到的最终溶液进行冻干处理得到冻干粉制剂。
39.本发明还提供所述冻干粉混合制剂在制备膀胱灌注药物中的应用。
40.采用本发明的技术方案,具有如下的有益效果:
41.本发明所述表柔比星和咪喹莫特混合制剂能够通过简单的复溶操作实现临床应用,通过灌注的方法有效抑制肿瘤生长和复发。表柔比星在引起肿瘤免疫原性死亡后,咪喹莫特能够进一步刺激抗原呈递细胞对抗原的摄取、处理以及呈递给t细胞,进一步放大抗肿瘤免疫反应。
42.实现了表柔比星和咪喹莫特混合制剂的长期化学稳定性,显著降低了咪喹莫特存在的情况下表柔比星杂质的产生速率,提高了制剂长期储存稳定性,增加了制剂使用的便利性和安全性。
附图说明
43.图1是膀胱灌注治疗第二次给药后第3天,不同组别小鼠病灶部位解剖图;
44.图2是膀胱灌注治疗第二次给药后第3天,不同组别小鼠病灶部位组织质量统计图;
45.图3是膀胱灌注治疗第二次给药后第3天,不同组别小鼠肿瘤部浸润的杀伤性t细胞流式分析统计图;
46.图4是膀胱灌注治疗第二次给药后第3天,不同组别小鼠肿瘤部位cd3
+
/cd4
+
t细胞的流式分析统计图;
47.图5是膀胱灌注治疗第二次给药后第3天,不同组别小鼠肿瘤部位cd8
+
细胞经细胞刺激混合物刺激后,胞内ifn-γ含量统计图;
48.图6是膀胱灌注治疗第二次给药后第3天,不同组别小鼠病灶部位肿瘤坏死因子相对含量统计图;
49.图7是膀胱灌注治疗第二次给药后第3天,不同组别小鼠病灶部位γ干扰素的相对含量统计图。
50.图8是有无粘膜促渗剂存在的情况下,表柔比星在膀胱中滞留量统计图;
51.图9是有无粘膜促渗剂存在的情况下,咪喹莫特在膀胱中滞留量统计图。
具体实施方式
52.实施例中涉及到的杂质,其名称、具体结构及对照品cas如下:
53.[0054][0055]
实施例a:对注射液剂型稳定性的研究
[0056]
实施例a1:不同药液ph条件下表柔比星复方注射制剂的化学稳定性。
[0057]
将咪喹莫特用盐酸溶解后加入盐酸表柔比星进行溶解,溶液的ph值较低,灌注时会对组织产生较大刺激,为了使用时减少对组织的刺激,需要选择兼顾制剂稳定性与使用安全性的酸碱值。
[0058]
用盐酸溶解r837得到浓度为4mg/ml的r837盐酸盐溶液,再加入盐酸表柔比星(epi)溶解,epi浓度为1mg/ml,然后使用碳酸氢钠调节溶液ph至3.0、3.5、4.0,分别标记为注射液1、注射液2、注射液3,用液相色谱检测配制当天以及放置于40℃环境下第5天的药物制剂中杂质的含量,表柔比星的杂质含量结果如表1所示。
[0059]
结果显示,在三种ph条件下,相较于原料药,制剂中表柔比星的总杂质含量随着时间而增长,并且,在40℃环境下放置第5天,总杂质含量是原料药总杂质含量的3倍以上。即使在ph=3.0的条件下,epi的最大未知单杂在40℃存放仅5天后,也有显著增加,预计很快就会超过药典规定的最大允许限度。同时发现咪喹莫特的杂质含量相对稳定,在多次检测中,咪喹莫特杂质b保持在0.05%左右,咪喹莫特杂质a保持在0.05%左右,咪喹莫特杂质c均未检出,最大未知单杂保持在0.18%左右,总杂质基本在0.39%以内,均未超出限度:杂质a含量0.15%、杂质b含量0.20%、杂质c含量0.15%、最大未知单杂含量0.20%,总杂质含量1.0%。因此,表柔比星/咪喹莫特复方注射液剂型并不具有良好的稳定性,且主要杂质增长来自于表柔比星,不能保证临床用药的安全性、有效性。
[0060]
表1:不同ph下表柔比星/咪喹莫特复方注射液剂型中表柔比星的起始杂质含量以及在40℃下静置5天的表柔比星(epi)的杂质含量记录表。
[0061][0062]
实施例a2:不同储藏条件对注射液剂型稳定性的影响
[0063]
考虑到实施例a1中制剂放置的温度为40℃,可能会加速杂质产生,因此探究较低温度下制剂的稳定性。采用实施例a1中的方法制备ph=3.0和ph=3.5的膀胱灌注注射剂,置于冷藏条件、15℃、25℃下,于样品制备完成当天以及在不同温度下放置第10天,检测制剂样品中杂质含量,结果如表2所示。随着存储温度的升高,两个ph条件下的注射液的总杂含量均有升高,印证了注射液剂型的稳定性与温度相关。同时发现,即便在冷藏条件下,最大未知单杂仍有增长趋势,最大未知单杂的升高同样不利于制剂的总体稳定性和安全性,因此,膀胱灌注的注射液剂型,极有可能不是该制剂的优选剂型。
[0064]
表2:表柔比星/咪喹莫特复方注射制剂中表柔比星(epi)的起始杂质含量以及在不同储藏温度下静置第10天,表柔比星/咪喹莫特复方注射制剂中表柔比星(epi)的杂质含量记录表。
[0065][0066]
实施例b:冻干剂型稳定性考察
[0067]
实施例a中的结果表明该复方制剂很难作为注射剂型生产、储存和使用,因此设计实验考察复方制剂的冻干粉剂型可行性。
[0068]
实施例b0:冻干剂型成药性研究:
[0069]
为了初步研究探究冻干粉制剂的成药可能性,对辅料、ph等可能对成药性产生影响的因素进行初筛。
[0070]
将咪喹莫特使用盐酸溶解或使用纯水溶解咪喹莫特盐酸盐得到咪喹莫特盐酸盐的水溶液,然后溶解盐酸表柔比星,得到含有有效成分的溶液,有效成分表柔比星和咪喹莫特的质量比为1:1~1:10;其次,尝试调节溶液ph,观察ph值变化是否影响溶液稳定性;随后加入冻干保护剂蔗糖、乳糖、甘露醇或环糊精(浓度在10mg/ml~50mg/ml之间),观察样品的状态,是否出现明显不稳定的情况,用冷冻干燥技术对样品进行冻干,冻干后冻干保护剂的质量分数为65%~96%,观察冻干粉外观,是否出现肉眼可辨的不成型、结团、结块或不均匀的样品;最后,将冻干样品加溶媒复溶,观察是否出现不溶解、不均匀的现象,并且复测溶液ph,当溶液中表柔比星浓度为1mg/ml时,ph值均与冻干前数值接近,约为3.8~5.5。
[0071]
在制剂制备过程中,ph调节过程、冻干保护剂的加入未导致溶液出现不均匀或沉淀等明显不稳定的情况,冻干后样品均保持较好的形貌,并且复溶顺利,未出现不溶解或溶解不均匀的现象,因此该冻干粉制剂配方可以做进一步的稳定性研究,检测杂质含量变化。
[0072]
实施例b1:初步尝试加入冻干保护剂对制剂稳定性的影响
[0073]
按照实施例a1的方法制备液体制剂,未调节ph值时,初始ph约为3.0,此外,使用碳酸氢钠调节ph至3.5,表柔比星和咪喹莫特的终浓度分别为1mg/ml和4mg/ml,并于冻干前加入不同含量的乳糖或甘露醇(制备时浓度为10mg/ml、25mg/ml、50mg/ml,换算得到质量分数为67%,83%,91%),考察其冻干后第0天的杂质含量。结果如表3所示。结果显示,不加入任何冻干保护剂时,复方制剂中起始的最大未知单杂含量已超出限度,加入合适含量的冻干保护剂后,起始杂质含量有所降低。乳糖对冻干制剂的保护效果优于甘露醇,ph的升高以及乳糖含量的增加,均有利于产品的稳定性。
[0074]
表3:加入不同含量的乳糖或甘露醇后,表柔比星/咪喹莫特复方冻干粉制剂中表柔比星(epi)的起始杂质含量记录表。
[0075]
[0076]
实施例b2:乳糖作为冻干保护剂,25℃下冻干粉制剂静置5天的稳定性。
[0077]
为了进一步探究冻干保护剂含量及起始ph对冻干粉稳定性的影响,将实施例b1中的4-1、5-1、6-1号样品放置于25℃条件下,于第5天复溶后检测样品的ph值及杂质含量,与0天的数据列表如表4所示。从杂质含量变化来看,起始ph值为3.5的冻干粉制剂,其杂质含量变化优于ph值为3.0的冻干粉制剂,同时,乳糖含量为91%时,杂质含量增长最少。
[0078]
表4:加入乳糖的表柔比星/咪喹莫特复方冻干粉制剂中表柔比星(epi)的起始杂质含量以及在25℃下放置5天表柔比星(epi)的杂质含量记录表。
[0079][0080]
实施例b3:不同冻干保护剂的筛选
[0081]
基于对冻干保护剂效果的初步探索及保护剂含量的尝试,进一步探究相同含量下,不同冻干保护剂对冻干粉制剂的稳定性的影响。并基于对ph值变化趋势和杂质变化趋势的关系,进一步尝试更高ph值下,冻干后的制剂稳定性。
[0082]
从注射剂常用冻干保护剂中选取乳糖(二塘)、甘露醇(非糖类)、环糊精(环状低聚糖)、葡萄糖(单糖)进行考察,验证其在91%的冻干保护剂用量下,对冻干粉制剂的保护效果。
[0083]
首先,按照实施例a1的方法制备液体制剂,调节溶液ph至3.5或4.0,分别加入不同的冻干保护剂,且最终咪喹莫特浓度为4mg/ml,表柔比星浓度为1mg/ml,冻干后冻干保护剂的质量分数为91%,检测其在40℃条件下放置5天的盐酸表柔比星杂质含量变化,结果如表5所示。表5中,起始ph为4.0的冻干粉制剂,当冻干保护剂为乳糖时,其稳定性最好,40℃下放置5天的杂质含量仍然保持较低水平,杂质无显著增长,ph=3.5条件下杂质增长显著;其他冻干保护剂在ph3.5和ph4.0的条件下,杂质均增长明显。因此,冻干保护剂优选乳糖。
[0084]
表5:加入不同冻干保护剂的不同起始ph的表柔比星/咪喹莫特复方冻干粉制剂。表柔比星的起始杂质含量以及在40℃下放置第5天时表柔比星(epi)的杂质含量记录表。
[0085][0086]
实施例b4:乳糖含量对冻干粉制剂稳定性的影响
[0087]
基于前面实施例的结果,考察ph值为4.0时,加入不同含量乳糖对冻干粉制剂杂质含量的影响。
[0088]
按照实施例a1所述的制备方法,配制epi与r837混合注射液,加入不同含量的乳糖保护剂后,用碳酸氢钠调节ph至4.0,最终咪喹莫特浓度为4mg/ml,表柔比星浓度为1mg/ml,冻干保护剂浓度为20mg/ml,30mg/ml,40mg/ml,50mg/ml,冻干后对应的冻干保护剂质量分数分别为80%、86%、89%、91%,并于冻干后当天、40℃下放置第5天、第13天检测杂质含量。结果如表6所示。随着冻干保护剂起始含量的增加,相同ph条件、相同温度下放置的不同复方制剂,其杂质含量增幅变缓,说明其化学稳定性增加。冻干保护剂含量在80%、86%、89%和91%的条件下,杂质含量均未超出限度冻干保护剂起始含量为91%时,化学稳定性最好。
[0089]
表6:加入不同含量的乳糖的表柔比星/咪喹莫特复方冻干粉制剂的ph为4.0的复溶液中,表柔比星(epi)的起始杂质含量以及在40℃下放置第5天、第13天的杂质含量记录表。
[0090][0091]
实施例b5:制备不同ph条件下的制剂样品,考察冻干后制剂的稳定性。
[0092]
用实施例a1的方法制备ph值分别为3.5、4.0,4.5和5.0的液体制剂,最终咪喹莫特浓度为4mg/ml,表柔比星浓度为1mg/ml,经预冷冻处理后进行冻干,在不同温度条件下放置一定时间后,复溶冻干粉,检测其中杂质含量,实验条件及结果如表7所示。与注射剂型中盐酸表柔比星的总杂变化趋势不同,当起始ph值升高,总杂质的含量增幅变缓,在冻干保护剂为乳糖、质量分数为91%的情况下,未知单杂、总杂的变化均低于注射液剂型的杂质含量增幅,即冻干粉制剂在相同的ph(ph=5.0)和温度条件(25℃)下,较长期放置(30天)的杂质含量远低于注射液剂型短期放置(5天)的杂质含量,并符合现行各国药典标准。其中制剂冻干前ph=3.5时,样品杂质在40℃下第5天已超过药典规定的限度,因此,该条件下样品不做30天杂质分析。
[0093]
表7:不同起始ph值下,表柔比星/咪喹莫特复方冻干粉制剂在不同温度环境中放置不同时间表柔比星(epi)的杂质含量记录表。
[0094]
[0095][0096]
实施例b6:改变两种组分的比例,研究冻干制剂的杂质含量变化。
[0097]
用实施例a1的方法制备ph值分别为3.5、4.0、4.5的液体制剂,加入乳糖,最终咪喹莫特浓度为2mg/ml,表柔比星浓度为1mg/ml,乳糖含量如表8中所示。记录冻干之后当天以及在40℃下存放27天的表柔比星杂质含量,记录如表8所示。结果显示,随着样品起始ph值的增加和乳糖含量的增加,在40℃下放置27天时样品的杂质含量减少,起始ph=4.0时,样品中乳糖含量为67%时,总杂含量在第27天超出限度,其余条件下杂质含量均低于限度。ph=4.5时,几种乳糖含量均能有效减少冻干后样品中杂质含量的增加。
[0098]
表8:不同起始ph值下,表柔比星/咪喹莫特复合复方冻干粉制剂在40℃环境中放置27天时表柔比星(epi)的杂质含量记录表。
[0099]
[0100][0101]
实施例b7:对最优ph进行进一步筛选
[0102]
按照实施例a1的方法配制表柔比星和咪喹莫特的混合溶液,调节溶液ph为3.8、4.0、4.2、4.4,加入冻干保护剂乳糖,两种规格的样品中表柔比星和咪喹莫特的比例为1:2或1:4,冻干保护剂的最终浓度为50mg/ml,在两种规格的冻干样品中对应的质量分数分别为94%和91%。冻干后在40℃条件下放置样品,不同时间点检测样品中的杂质含量,结果如表9所示。
[0103]
结果显示,不管何种浓度比例下,表柔比星杂质增长趋势与起始ph值相关,ph值越高,制剂越稳定,当ph值为3.8时,最大未知单杂的含量超出限度,ph在3.8以上时,均满足杂质含量稳定性要求。
[0104]
表9:不同起始ph值下,表柔比星/咪喹莫特复合复方冻干粉制剂中的表柔比星起始杂质含量以及在40℃环境中放置19天、30天时表柔比星(epi)的杂质含量记录表。
[0105][0106]
实施例c:肿瘤治疗实验
[0107]
实施例c1:治疗原位膀胱癌
[0108]
建立c57bl/6小鼠膀胱癌原位肿瘤模型,具体的,在第0天,对雌性c57bl/6小鼠接种2*105个luc-mb49细胞。接种后第4天,通过活体荧光成像判断肿瘤大小,挑选肿瘤生长较为均一的小鼠,进行分组。每组9只小鼠,共四组,其分组情况为:
[0109]
1:通过膀胱灌注100μl的5%葡萄糖溶液;
[0110]
2:通过膀胱灌注100μl的5%葡萄糖溶液溶解的表柔比星溶液;
[0111]
3:通过膀胱灌注100μl的5%葡萄糖溶液溶解的盐酸咪喹莫特冻干粉剂;
[0112]
4:通过膀胱灌注100μl的5%葡萄糖溶液溶解的本发明所述冻干粉制剂;
[0113]
其中,表柔比星的给药剂量为60μg/只,r837的剂量为240μg/只。在接种肿瘤的第4天和第11天分别进行膀胱灌注给药,第二次治疗后第3天,牺牲小鼠,取小鼠膀胱内的肿瘤,对肿瘤进行拍照记录,不同组别的小鼠膀胱肿瘤照片如图1所示,肉眼可见的,表柔比星+r837组小鼠膀胱直径最小,其余组别肿瘤大小不均一,且大多数肿瘤大于该组小鼠。对肿瘤
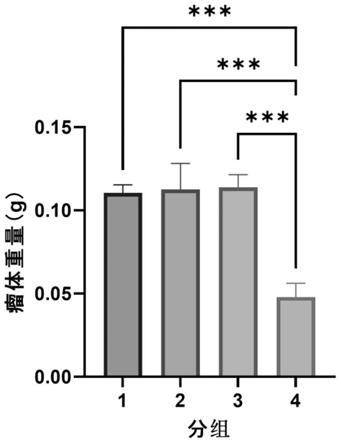
进行称重,统计不同组别小鼠膀胱肿瘤质量,结果如图2所示,第4组小鼠肿瘤质量越小,即冻干粉制剂具有最好的治疗效果,与图1中肉眼观测结果一致。
[0114]
实施例c2:对淋巴结和膀胱中的免疫细胞进行流式分析。
[0115]
用流式细胞仪检测分析实施例c1中不同样品的免疫细胞比例及活性。
[0116]
对膀胱和淋巴结样品分别进行匀浆处理,经1800rpm,5min离心处理后,分离上清和沉淀,并在沉淀中加入消化酶,制备组织单细胞悬液。使用流式抗体对不同免疫细胞进行标记,并用流式细胞仪对不同免疫细胞的含量进行分析,结果如图3-图5所示。图3为膀胱中cd3
+
、cd8
+
t细胞的浸润情况,cd8
+
t细胞为杀伤性t细胞,对肿瘤具有直接的杀伤作用,该细胞的存在说明免疫治疗在肿瘤治疗中发挥了作用,并且,cd8
+
t细胞浸润越多,免疫治疗效果越强,从统计图可以看出,表柔比星通过免疫原性死亡导致肿瘤部位免疫反应的产生,联合r837后,免疫杀伤作用进一步增强,说明本发明的膀胱灌注制剂,具有更好的免疫治疗潜力。
[0117]
图4为肿瘤中cd3
+
、cd4
+
t细胞的浸润情况,cd4
+
t细胞一方面可刺激cd8
+
t细胞的激活,维持和加强抗肿瘤免疫反应,另一方面可通过ifn-γ机制发挥抗肿瘤效果,因此,在治疗初期cd4
+
t细胞含量的增加有助于抗肿瘤免疫反应,从图4数据可以看出,肿瘤部位cd4
+
t细胞在膀胱灌注本发明所述制剂治疗组中,含量增加2倍以上,说明本发明所述表柔比星复方制剂能够引起更强烈的抗肿瘤免疫反应。
[0118]
图5为肿瘤部位cd8
+
t细胞经细胞刺激混合物刺激后,其中功能性cd8
+
t细胞的比例。cd8
+
t细胞中具有肿瘤杀伤潜力的细胞会在经过细胞刺激混合物刺激后,胞内分泌ifn-γ,通过流式抗体染色,标记cd8和胞内ifn-γ,检测双阳性信号的细胞占cd8单阳性细胞的比例。结果显示,经过本发明所述冻干粉制剂治疗的小鼠,其肿瘤部位浸润的cd8
+
t细胞中有30%左右能够在受到刺激后在胞内蓄积ifn-γ,是单组份治疗组相应细胞比例的1.5~6倍,说明肿瘤部位功能性cd8
+
t细胞比例更高,有更大的免疫治疗潜力,即本发明所述冻干粉制剂具有更强的膀胱癌免疫治疗的效果。
[0119]
综合几种免疫相关细胞的流式分析,说明膀胱灌注用冻干粉制剂具有良好的激活抗肿瘤免疫反应的效果。
[0120]
实施例c3:对实施例c2中离心后获得的上清液进行细胞因子分析。使用细胞因子检测试剂盒检测不同组别小鼠中肿瘤组织部位肿瘤坏死因子(tnf-α)和γ干扰素(ifn-γ)的含量,检测结果如图6、图7所示。tnf-α和ifn-γ的含量越高,说明肿瘤部位的抗肿瘤免疫反应越强。相比之下,复方制剂组中两种细胞因子含量都比较高,尤其是tnf-α的含量。如图6所示,复方制剂组中,tnf-α的含量为其它组别的2~3倍,证明混合制剂具有显著增强抗肿瘤免疫反应的作用。图7中,复方制剂组的ifn-γ含量高于任一组,约为其他组别的1.5~2倍。
[0121]
实施例d:粘膜促渗剂促进药物在膀胱部位滞留效果的验证
[0122]
分组:
[0123]
1.复合制剂:通过膀胱灌注100μl的表柔比星与咪喹莫特的复方制剂;
[0124]
2.氮酮+复合制剂:制备含有氮酮的复方冻干粉制剂,复溶后通过膀胱灌注向小鼠施用100μl的量;
[0125]
将上述混合液直接进行小鼠膀胱灌注,灌注过程在小鼠麻醉过程进行,灌注液在
膀胱中保留1小时,随后排出液体,小鼠脱离麻醉状态,以灌胃的方式帮助小鼠饮水500μl,促进排便,待药物排出6小时后,解剖获得小鼠膀胱样本,对每个样本进行称重记录。将样本置等体积的缓冲液中进行研磨处理,并用甲醇及萃取液对有效成分进行萃取,离心获得上清液,然后用高效液相色谱检测不同样本中萃取得到的有效成分的含量,计算其相对每克组织的含量,结果如图8、图9所示。图8是表柔比星的组织相对含量,图9是咪喹莫特的组织相对含量。其中增加氮酮组分的复方制剂,能够显著提高药物在膀胱组织的滞留,其滞留量达到2倍以上,说明促渗剂的加入能够有助于有效成分的滞留,进一步有潜在的增加疗效的作用效果。
[0126]
对所公开的实施例的上述说明,使得本技术领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对于本领域技术人员而言将是显而易见的。本发明不会被限制于本文所示的这些实施例,只需要符合与本文所公开的原理与特点一致即可。
