raf激酶的抑制剂
相关申请的交叉引用
1.本技术要求2019年5月3日提交的第62/843,197号美国临时申请的权益,该美国临时申请通过引用并入本技术的公开内容中。
背景技术:
2.raf激酶通过磷酸化和激活mek在ras-raf-mek-erk促分裂原活化蛋白激酶(mapk)途径(也称为mapk/erk途径)中起作用。通过改变转录因子的水平和活性,mapk导致对细胞周期而言至关重要的基因的转录发生改变。mapk活性的失调在肿瘤中常常发生。因此,需要靶向raf激酶活性的疗法,以用于治疗癌症和其他以异常mapk/erk途径信号传导为特征的病症。
技术实现要素:
3.本文提供了受体酪氨酸激酶效应物raf(raf)的抑制剂,包含所述化合物的药物组合物,以及使用所述化合物治疗疾病的方法。
4.一个实施方案提供了具有式(i)结构的化合物,或其药学上可接受的盐或溶剂化物:其中,v为氢、卤素、-cn、任选取代的c1-c4烷基、-cd3、任选取代的c1-c4烷氧基、任选取代的c1-c4烯基或任选取代的c1-c4炔基;u选自任选取代的烷基、-cd3、任选取代的环烷基、任选取代的环烷基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳烷基、任选取代的-co烷基、任选取代的-co环烷基;x为n、c-h、c-d或c-fr2为h、d或f;r4为卤素、任选取代的c1-c3烷基、-cd3或任选取代的c1-c3烷氧基;r6为h、d、cl或f;z选自:
(a)其中m为0、1、2或3;p为0、1、2、3或4;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;或者两个r
11
基团一起形成氧代;(b)其中m为0、1、2或3;p为0、1、2、3或4;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基);且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(c)其中m为0、1或2;n为0、1或2;m1为0、1或2;n1为0、1或2,条件是m1和n1两者不都是0;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(d)其中m为0、1或2;n为0、1或2;m1为1或2;p为0、1、2或3;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
、-ch
2-ch
2-、-ch
2-chr
11-、-ch
2-c(r
11
)
2-、-chr
11-ch
2-、-c(r
11
)
2-ch
2-、-nh-ch
2-、-nh-chr
11-、-nh-c(r
11
)
2-、-ch
2-nh-、-chr
11-nh-、-c(r
11
)
2-nh-、-n(r
11
)-ch
2-、-n(r
11
)-chr
11-、-n(r
11
)-c(r
11
)
2-、-ch
2-n(r
11
)-、-chr
11-n(r
11
)-、-c(r
11
)
2-n(r
11
)-;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选
取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;(e)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;(f)其中m为0、1、2或3;n为0、1、2或3,条件是m和n两者不都是0;p为0、1、2、3或4;且每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(g)其中m为1、2或3;n为1、2或3;p为0、1或2;且每个r
13
或r
14
独立地选自氢、卤素、-cn、任选取代的c1-c6烷基或任选取代的c3-c6环烷基;每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;
(h)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个偕(geminal)r
11
基团一起形成氧代;或者(i)任选取代的杂芳基。
5.一个实施方案提供了一种药物组合物,其包含式(i)化合物,或其药学上可接受的盐或溶剂化物,以及至少一种药学上可接受的赋形剂。
6.一个实施方案提供了一种治疗有需要的患者的疾病或病症的方法,其包括向所述患者施用式(i)化合物,或其药学上可接受的盐或溶剂化物。另一个实施方案提供了所述方法,其中所述疾病或病症是癌症。援引并入
7.本说明书中提到的所有出版物、专利和专利申请均为了此处所述的具体目的通过引用并入本文。
具体实施方式
8.如在本文中和在所附权利要求书中所用的,单数形式“一种”、“一个”和“该”包括复数指代物,除非上下文另有明确说明。因此,例如,提及“一种药剂”包括多种这样的药剂,而提及“该细胞”包括提及一种或多种细胞(或多个细胞)和本领域技术人员已知的其等同物,等等。当本文针对物理性质如分子量或化学性质如化学式使用范围时,旨在包括本文中范围和具体实施方案的所有组合和子组合。当提及数字或数值范围时使用的术语“约”是指所提及的数字或数值范围为在实验可变性范围内(或者在统计实验误差范围内)的近似值,因此在一些情况下,该数字或数值范围将在所述数字或数值范围的1%至15%之间变化。术语“包含”(以及相关的术语,如“包括”或“具有”或“含有”)并非旨在排除以下情形:在其他某些实施方案中,例如,本文描述的任何物质组成、组合物、方法或过程等的实施方案“由所述特征组成”或“基本上由所述特征组成”。定义
9.如在本说明书及所附权利要求书中所使用的,除非指出意思相反,否则下列术语具有以下所述的含义。
[0010]“氨基”是指
–
nh2基团。
[0011]“氰基”是指-cn基团。
[0012]“硝基”是指-no2基团。
[0013]“氧杂”是指-o-基团。
[0014]“氧代”是指=o基团。
[0015]“硫代”是指=s基团。
[0016]“亚氨基”是指=n-h基团。
[0017]“肟基”是指=n-oh基团。
[0018]“肼基”是指=n-nh2基团。
[0019]“烷基”是指仅由碳原子和氢原子组成、不含不饱和度、具有1-15个碳原子(例如,c
1-c
15
烷基)的直链或支链的烃链基团。在某些实施方案中,烷基包含1至13个碳原子(例如,c
1-c
13
烷基)。在某些实施方案中,烷基包含1至8个碳原子(例如,c
1-c8烷基)。在其他实施方案中,烷基包含1至5个碳原子(例如,c
1-c5烷基)。在其他实施方案中,烷基包含1至4个碳原子(例如,c
1-c4烷基)。在其他实施方案中,烷基包含1至3个碳原子(例如,c
1-c3烷基)。在其他实施方案中,烷基包含1至2个碳原子(例如,c
1-c2烷基)。在其他实施方案中,烷基包含一个碳原子(例如,c1烷基)。在其他实施方案中,烷基包含5至15个碳原子(例如,c
5-c
15
烷基)。在其他实施方案中,烷基包含5至8个碳原子(例如,c
5-c8烷基)。在其他实施方案中,烷基包含2至5个碳原子(例如,c
2-c5烷基)。在其他实施方案中,烷基包含3至5个碳原子(例如,c
3-c5烷基)。在其他实施方案中,该烷基选自甲基、乙基、1-丙基(正丙基)、1-甲基乙基(异丙基)、1-丁基(正丁基)、1,1-甲基丙基(仲丁基)、2-甲基丙基(异丁基)、1,1-二甲基乙基(叔丁基)、1-戊基(正戊基)。该烷基通过单键与该分子的其余部分连接。除非在说明书中另有明确规定,否则烷基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0020]“烷氧基”是指式-o-烷基的通过氧原子键合的基团,其中烷基为如上定义的烷基链。
[0021]“烯基”是指仅由碳原子和氢原子组成、含有至少一个碳碳双键且具有2至12个碳原子的直链或支链的烃链基团。在某些实施方案中,烯基包含2至8个碳原子。在其他实施方案中,烯基包含2至4个碳原子。该烯基通过单键与分子的其余部分连接,例如,乙烯基、丙-1-烯基(即烯丙基)、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。除非在说明书中另有明确规定,否则烯基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基
(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0022]“炔基”是指仅由碳原子和氢原子组成、含有至少一个碳碳三键、具有2-12个碳原子的直链或支链的烃链基团。在某些实施方案中,炔基包含2至8个碳原子。在其他实施方案中,炔基包含2至6个碳原子。在其他实施方案中,炔基包含2至4个碳原子。炔基通过单键与分子的其余部分连接,例如,乙炔基、丙炔基、丁炔基、戊炔基、己炔基等。除非在说明书中另有明确规定,否则炔基任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0023]“亚烷基”或“亚烷基链”指连接分子的其余部分与基团的直链或支链二价烃链,其仅由碳和氢组成,不包含不饱和度并具有1-12个碳原子,例如,亚甲基、亚乙基、亚丙基、亚正丁基等。亚烷基链通过单键与该分子的其余部分连接并通过单键与该基团连接。亚烷基链与分子的其余部分以及与基团的连接点是通过亚烷基链中的一个碳或通过该链内的任意两个碳。在某些实施方案中,亚烷基包含1至8个碳原子(例如,c
1-c8亚烷基)。在其他实施方案中,亚烷基包含1至5个碳原子(例如,c
1-c5亚烷基)。在其他实施方案中,亚烷基包含1至4个碳原子(例如,c
1-c4亚烷基)。在其他实施方案中,亚烷基包含1至3个碳原子(例如,c
1-c3亚烷基)。在其他实施方案中,亚烷基包含1至2个碳原子(例如,c
1-c2亚烷基)。在其他实施方案中,亚烷基包含1个碳原子(例如,c1亚烷基)。在其他实施方案中,亚烷基包含5至8个碳原子(例如,c
5-c8亚烷基)。在其他实施方案中,亚烷基包含2至5个碳原子(例如,c
2-c5亚烷基)。在其他实施方案中,亚烷基包含3至5个碳原子(例如,c
3-c5亚烷基)。除非在说明书中另有明确规定,否则亚烷基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0024]“亚烯基”或“亚烯基链”是指将分子的其余部分与基团连接的直链或支链二价烃链,其仅由碳和氢组成,含有至少一个碳碳双键,并且具有2至12个碳原子。亚烯基链通过单键连接至分子的其余部分,并且通过单键连接至基团。在某些实施方案中,亚烯基包含2至8个碳原子(例如,c
2-c8亚烯基)。在其他实施方案中,亚烯基包含2至5个碳原子(例如,c
2-c5亚烯基)。在其他实施方案中,亚烯基包含2至4个碳原子(例如,c
2-c4亚烯基)。在其他实施方案中,亚烯基包含2至3个碳原子(例如,c
2-c3亚烯基)。在其他实施方案中,亚烯基包含2个碳原子(例如,c2亚烯基)。在其他实施方案中,亚烯基包含5至8个碳原子(例如,c
5-c8亚烯基)。在其他实施方案中,亚烯基包含3至5个碳原子(例如,c
3-c5亚烯基)。除非在说明书中另有明确规定,否则亚烯基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0025]“亚炔基”或“亚炔基链”是指将分子的其余部分与基团连接的直链或支链二价烃链,其仅由碳和氢组成,含有至少一个碳碳三键,并且具有2至12个碳原子。亚炔基链通过单键连接至分子的其余部分,并且通过单键连接至基团。在某些实施方案中,亚炔基包含2至8个碳原子(例如,c
2-c8亚炔基)。在其他实施方案中,亚炔基包含2至5个碳原子(例如,c
2-c5亚炔基)。在其他实施方案中,亚炔基包含2至4个碳原子(例如,c
2-c4亚炔基)。在其他实施方案中,亚炔基包含2至3个碳原子(例如,c
2-c3亚炔基)。在其他实施方案中,亚炔基包含2个碳原子(例如,c2亚炔基)。在其他实施方案中,亚炔基包含5至8个碳原子(例如,c
5-c8亚炔基)。在其他实施方案中,亚炔基包含3至5个碳原子(例如,c
3-c5亚炔基)。除非在说明书中另有明确规定,否则亚炔基链任选地被一个或多个下列取代基取代:卤代、氰基、硝基、氧代、硫代、亚氨基、肟基、三甲基甲硅烷基、-ora、-sra、-oc(o)-ra、-n(ra)2、-c(o)ra、-c(o)ora、-c(o)n(ra)2、-n(ra)c(o)ora、-oc(o)-n(ra)2、-n(ra)c(o)ra、-n(ra)s(o)
t
ra(其中t为1或2)、-s(o)
t
ora(其中t为1或2)、-s(o)
t
ra(其中t为1或2)和-s(o)
t
n(ra)2(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、碳环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、碳环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)。
[0026]“芳基”是指通过从环碳原子上去除氢原子而由芳族单环或多环烃环体系衍生的基团。芳族单环或多环烃环体系仅包含氢和来自5-18个碳原子的碳,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔(h
ü
ckel)理论包含环状、离域的(4n+2)π-电子体
系。衍生出芳基的环系包括但不限于诸如苯、芴、茚满、茚、四氢化萘和萘等基团。除非在说明书中另有明确说明,否则术语“芳基”或前缀“芳”(如在“芳烷基”中)意在包括任选地被一个或多个独立地选自以下的取代基所取代的芳基基团:烷基、烯基、炔基、卤代、氟烷基、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2)(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0027]“芳烷基”是指式-r
c-芳基的基团,其中rc为如上文所定义的亚烷基链,例如,亚甲基、亚乙基等。芳烷基基团的亚烷基链部分如上文针对亚烷基链所述任选地被取代。芳烷基基团的芳基部分如上文针对芳基所述任选地被取代。
[0028]“芳烯基”是指式-r
d-芳基的基团,其中rd为如上文所定义的亚烯基链。芳烯基基团的芳基部分如上文针对芳基所述任选地被取代。芳烯基基团的亚烯基链部分如上文针对亚烯基所述任选地被取代。
[0029]“芳炔基”是指式-r
e-芳基的基团,其中re为如上文所定义的亚炔基链。芳炔基基团的芳基部分如上文针对芳基所述任选地被取代。芳炔基基团的亚炔基链部分如上文针对亚炔基链所述任选地被取代。
[0030]“芳烷氧基”是指式-o-r
c-芳基的通过氧原子键合的基团,其中rc为如上文所定义的亚烷基链,例如,亚甲基、亚乙基等。芳烷基基团的亚烷基链部分如上文针对亚烷基链所述任选地被取代。芳烷基基团的芳基部分如上文针对芳基所述任选地被取代。
[0031]“碳环基”是指仅由碳和氢原子组成的稳定的非芳族单环或多环烃基团,其包括稠环或桥环体系,具有3至15个碳原子。在某些实施方案中,碳环基包含3至10个碳原子。在其他实施方案中,碳环基包含5至7个碳原子。该碳环基通过单键与分子的其余部分连接。碳环基是饱和的(即仅包含单一c-c键)或不饱和的(即含有一个或多个双键或三键)。完全饱和的碳环基基团还被称为“环烷基”。单环环烷基的实例包括,例如,环丙基、环丁基、环戊基、环己基、环庚基和环辛基。不饱和的碳环基还被称为“环烯基”。单环环烯基的实例包括,例如,环戊烯基、环己烯基、环庚烯基和环辛烯基。多环碳环基基团包括,例如,金刚烷基、降冰片基(即,双环[2.2.1]庚烷基)、降冰片烯基、十氢萘基、7,7-二甲基-双环[2.2.1]庚烷基等。除非在说明书中另有明确说明,否则术语“碳环基”意在包括任选地被一个或多个独立地选自以下的取代基所取代的碳环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰
基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2)(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0032]“碳环基烷基”是指式-r
c-碳环基的基团,其中rc为如上文所定义的亚烷基链。亚烷基链和碳环基基团如上文所述任选地被取代。
[0033]“碳环基炔基”是指式-r
c-碳环基的基团,其中rc为如上文所定义的亚炔基链。亚炔基链和碳环基基团如上文所述任选地被取代。
[0034]“碳环基烷氧基”是指式-o-r
c-碳环基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。亚烷基链和碳环基基团如上文所述任选地被取代。
[0035]
如本文所用的,“羧酸生物电子等排体”是指表现出与羧酸部分类似的物理、生物和/或化学性质的官能团或部分。羧酸生物电子等排体的实例包括但不限于:和/或化学性质的官能团或部分。羧酸生物电子等排体的实例包括但不限于:等。
[0036]“卤代”或“卤素”是指溴代、氯代、氟代或碘代取代基。
[0037]“氟烷基”是指被一个或多个如上定义的氟代基团取代的如上定义的烷基基团,例如,三氟甲基、二氟甲基、氟甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基等。在一些实施方案中,氟烷基的烷基部分如以上针对烷基所述任选地被取代。
[0038]“杂环基”是指稳定的3至18元非芳族环基团,其包含2至12个碳原子和1至6个选自氮、氧和硫的杂原子。除非在说明书中另有明确说明,否则杂环基基团是单环、双环、三环或四环的环系,其任选地包括稠环或桥环体系。杂环基基团中的杂原子任选地被氧化。如果存在一个或多个氮原子,则其任选地被季铵化。杂环基是部分或完全饱和的。杂环基通过环中的任何原子连接至分子的其余部分。这类杂环基基团的实例包括但不限于二氧戊环基、噻吩基[1,3]二噻烷基、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧代哌嗪基、2-氧代哌啶基、2-氧代吡咯烷基、噁唑烷基、
哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三噻烷基、四氢吡喃基、硫代吗啉基、硫杂吗啉基、1-氧代-硫代吗啉基和1,1-二氧代-硫代吗啉基。除非在说明书中另有明确说明,否则术语“杂环基”意在包括任选地被一个或多个选自以下的取代基所取代的如上定义的杂环基基团:烷基、烯基、炔基、卤代、氟烷基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2)(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0039]“n-杂环基”或“n-连接的杂环基”是指含有至少一个氮的如上定义的杂环基基团,并且其中该杂环基基团与该分子的其余部分的连接点是通过该杂环基基团中的氮原子。n-杂环基基团如上文针对杂环基基团所述任选地被取代。这样的n-杂环基基团的实例包括但不限于1-吗啉基、1-哌啶基、1-哌嗪基、1-吡咯烷基、吡唑烷基、咪唑啉基和咪唑烷基。
[0040]“c-杂环基”或“c-连接的杂环基”是指含有至少一个杂原子的如上定义的杂环基基团,并且其中该杂环基基团与该分子的其余部分的连接点是通过该杂环基基团中的碳原子。c-杂环基基团如上文针对杂环基基团所述任选地被取代。这样的c-杂环基基团的实例包括但不限于2-吗啉基、2-或3-或4-哌啶基、2-哌嗪基、2-或3-吡咯烷基等。
[0041]“杂环基烷基”是指式-r
c-杂环基的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮的杂环基,则该杂环基任选地在该氮原子处连接至烷基基团。杂环基烷基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂环基烷基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0042]“杂环基烷氧基”是指式-o-r
c-杂环基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。如果杂环基为含氮的杂环基,则该杂环基任选地在该氮原子处连接至烷基基团。杂环基烷氧基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂环基烷氧基基团的杂环基部分如上文针对杂环基所述任选地被取代。
[0043]“杂芳基”是指由包含2至17个碳原子以及1至6个选自氮、氧和硫的杂原子的3至18元芳环基团衍生的基团。如本文所用的,杂芳基基团是单环、双环、三环或四环环系,其中该环系中的至少一个环是完全不饱和的,即,其根据休克尔(h
ü
ckel)理论包含环状、离域的(4n+2)π
–
电子体系。杂芳基包括稠合或桥连的环系。杂芳基基团中的杂原子任选地被氧化。如果存在一个或多个氮原子,则其任选地被季铵化。杂芳基通过环中的任何原子与分子的
其余部分连接。杂芳基的实例包括但不限于氮杂基、吖啶基、苯并咪唑基、苯并吲哚基、1,3-苯并二氧戊环基、苯并呋喃基、苯并噁唑基、苯并[d]噻唑基、苯并噻二唑基、苯并[b][1,4]二氧杂基、苯并[b][1,4]噁嗪基、1,4-苯并二噁烷基、苯并萘并呋喃基(benzonaphthofuranyl)、苯并噁唑基、苯并二氧戊环基、苯并二噁英基(benzodioxinyl)、苯并吡喃基、苯并吡喃酮基(benzopyranonyl)、苯并呋喃基、苯并呋喃酮基(benzofuranonyl)、苯并噻吩基(benzothienyl)(benzothiophenyl)、苯并噻吩并[3,2-d]嘧啶基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基、环戊并[d]嘧啶基、6,7-二氢-5h-环戊并[4,5]噻吩并[2,3-d]嘧啶基、5,6-二氢苯并[h]喹唑啉基、5,6-二氢苯并[h]噌啉基、6,7-二氢-5h-苯并[6,7]环庚并[1,2-c]哒嗪基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、呋喃并[3,2-c]吡啶基、5,6,7,8,9,10-六氢环辛并[d]嘧啶基、5,6,7,8,9,10-六氢环辛并[d]哒嗪基、5,6,7,8,9,10-六氢环辛并[d]吡啶基、异噻唑基、咪唑基、吲唑基、吲哚基、吲唑基、异吲哚基、吲哚啉基、异吲哚啉基、异喹啉基、吲嗪基、异噁唑基、5,8-甲桥-5,6,7,8-四氢喹唑啉基、萘啶基、1,6-萘啶酮基(1,6-naphthyridinonyl)、噁二唑基、2-氧代氮杂基、噁唑基、环氧乙烷基、5,6,6a,7,8,9,10,10a-八氢苯并[h]喹唑啉基、1-苯基-1h-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡咯基、吡唑基、吡唑并[3,4-d]嘧啶基、吡啶基、吡啶并[3,2-d]嘧啶基、吡啶并[3,4-d]嘧啶基、吡嗪基、嘧啶基、哒嗪基、吡咯基、喹唑啉基、喹喔啉基、喹啉基、异喹啉基、四氢喹啉基、5,6,7,8-四氢喹唑啉基、5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶基、6,7,8,9-四氢-5h-环庚并[4,5]噻吩并[2,3-d]嘧啶基、5,6,7,8-四氢吡啶并[4,5-c]哒嗪基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基、噻吩并[2,3-d]嘧啶基、噻吩并[3,2-d]嘧啶基、噻吩并[2,3-c]吡啶基和噻吩基(thiophenyl)(即噻吩基(thienyl))。除非在说明书中另有明确说明,否则术语“杂芳基”意在包括任选地被一个或多个选自以下的取代基所取代的如上所定义的杂芳基基团:烷基、烯基、炔基、卤代、氟烷基、卤代烯基、卤代炔基、氧代、硫代、氰基、硝基、任选取代的芳基、任选取代的芳烷基、任选取代的芳烯基、任选取代的芳炔基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳基烷基、-r
b-ora、-r
b-oc(o)-ra、-r
b-oc(o)-ora、-r
b-oc(o)-n(ra)2、-r
b-n(ra)2、-r
b-c(o)ra、-r
b-c(o)ora、-r
b-c(o)n(ra)2、-r
b-o-r
c-c(o)n(ra)2、-r
b-n(ra)c(o)ora、-r
b-n(ra)c(o)ra、-r
b-n(ra)s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ra(其中t为1或2)、-r
b-s(o)
t
ora(其中t为1或2)和-r
b-s(o)
t
n(ra)2(其中t为1或2)(其中t为1或2),其中每个ra独立地为氢、烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、氟烷基、环烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、环烷基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、芳烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂环基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代)、杂芳基(任选地被卤素、羟基、甲氧基或三氟甲基取代)或杂芳基烷基(任选地被卤素、羟基、甲氧基或三氟甲基取代),每个rb独立地为直接键或直链或支链亚烷基或亚烯基链,且rc为直链或支链亚烷基或亚烯基链,并且除非另有说明,其中上述取代基中的每一个为未取代的。
[0044]“n-杂芳基”是指含有至少一个氮的如上定义的杂芳基基团,并且其中该杂芳基基
团与该分子的其余部分的连接点是通过该杂芳基基团中的氮原子。n-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0045]“c-杂芳基”是指如上所定义的杂芳基,其中该杂芳基基团与该分子的其余部分的连接点是通过该杂芳基基团中的碳原子。c-杂芳基基团如上文针对杂芳基基团所述任选地被取代。
[0046]“杂芳基烷基”是指式
–rc-杂芳基的基团,其中rc为如上所定义的亚烷基链。如果杂芳基为含氮的杂芳基,则该杂芳基任选地在该氮原子处与烷基基团连接。杂芳基烷基基团的亚烷基链如上文针对亚烷基链所述任选地被取代。杂芳基烷基基团的杂芳基部分如上文针对杂芳基所述任选地被取代。
[0047]“杂芳基烷氧基”是指式
–
o-r
c-杂芳基的通过氧原子键合的基团,其中rc为如上所定义的亚烷基链。如果杂芳基为含氮杂芳基,则该杂芳基任选地在该氮原子处与烷基连接。杂芳基烷氧基基团的亚烷基链如上文针对亚烷基链所定义的任选地被取代。杂芳基烷氧基基团的杂芳基部分如上文针对杂芳基所定义的任选地被取代。
[0048]
在一些实施方案中,本文公开的化合物含有一个或多个不对称中心,因此产生了对映异构体、非对映异构体以及根据绝对立体化学被定义为(r)-或(s)-的其他立体异构形式。除非另有说明,否则本公开意在涉及本文公开的化合物的所有立体异构形式。当本文所述的化合物含有烯烃双键时,除非另有说明,否则本发明意在同时包括e和z几何异构体(例如,顺式或反式)。同样,还意在包括所有可能的异构体,以及其外消旋形式和光学纯形式,和所有互变异构形式。术语“几何异构体”是指烯烃双键的e或z几何异构体(例如顺式或反式)。术语“位置异构体”是指围绕中心环的结构异构体,如围绕苯环的邻位、间位和对位异构体。
[0049]“互变异构体”是指这样的分子,其中质子从分子的一个原子移动到同一分子的另一原子是可能的。在某些实施方案中,本文提出的化合物作为互变异构体存在。在可能发生互变异构的情形下,将存在互变异构体的化学平衡。互变异构体的确切比例取决于若干因素,包括物理状态、温度、溶剂和ph。互变异构平衡的一些实例包括:
[0050]
在一些实施方案中,本文公开的化合物以不同的富集同位素形式使用,例如,富含2h、3h、
11
c、
13
c和/或
14
c含量的形式。在一个特定实施方案中,所述化合物在至少一个位置处被氘化。这类氘化形式可通过美国专利5,846,514和6,334,997所述的程序制备。如美国专利5,846,514和6,334,997所述,氘化可改善代谢稳定性和/或功效,从而增加药物的作用持续时间。
[0051]
除非另有说明,否则本文所示的结构旨在包括仅在是否存在一个或多个同位素富集的原子方面不同的化合物。例如,除了氢被氘或氚替代或者碳被
13
c-或
14
c-富集的碳替代之外具有本结构的化合物也在本公开的范围内。
[0052]
本公开的化合物任选地在构成此类化合物的一个或多个原子处含有非天然比例的原子同位素。例如,可使用同位素如氘(2h)、氚(3h)、碘-125(
125
i)或碳-14(
14
c)标记化合物。用2h、
11
c、
13
c、
14
c、
15
c、
12
n、
13
n、
15
n、
16
n、
16
o、
17
o、
14
f、
15
f、
16
f、
17
f、
18
f、
33
s、
34
s、
35
s、
36
s、
35
cl、
37
cl、
79
br、
81
br、
125
i进行的同位素取代均在预期之内。在一些实施方案中,考虑用
18
f进行同位素取代。本发明化合物的所有同位素变化,无论是否为放射性的,均包括在本发明的范围内。
[0053]
在某些实施方案中,本文公开的化合物的一些或全部1h原子被2h原子替代。含氘化合物的合成方法是本领域已知的,仅作为非限制性实例,包括以下合成方法。
[0054]
使用各种方法来合成氘取代的化合物,所述方法例如描述于:dean,dennis c.编.recent advances in the synthesis and applications of radiolabeled compounds for drug discovery and development.[curr.,pharm.des.,2000;6(10)]2000,110pp;george w.;varma,rajender s.the synthesis of radiolabeled compounds via organometallic intermediates,tetrahedron,1989,45(21),6601-21;以及evans,e.anthony.synthesis of radiolabeled compounds,j.radioanal.chem.,1981,64(1-2),9-32。
[0055]
氘化起始材料容易获得,并且经受本文所述的合成方法以提供含氘化合物的合成。大量的含氘试剂和结构单元可以从化学供应商如aldrich chemical co.商购获得。
[0056]
适用于亲核取代反应的氘转移试剂如碘甲烷-d3(cd3i)易于获得,并且可用于在亲核取代反应条件下将氘取代的碳原子转移至反应底物。仅举例而言,cd3i的使用在以下的反应流程中示出。
[0057]
使用氘转移试剂如氘化铝锂(liald4)在还原条件下将氘转移至反应底物。仅举例而言,liald4的使用在以下的反应流程中示出。
[0058]
仅举例而言,如以下的反应流程所示,使用氘气和钯催化剂来还原不饱和的碳-碳键,并进行芳基碳-卤键的还原性取代。
[0059]
在一个实施方案中,本文公开的化合物含有一个氘原子。在另一个实施方案中,本文公开的化合物含有两个氘原子。在另一个实施方案中,本文公开的化合物含有三个氘原子。在另一个实施方案中,本文公开的化合物含有四个氘原子。在另一个实施方案中,本文公开的化合物含有五个氘原子。在另一个实施方案中,本文公开的化合物含有六个氘原子。在另一个实施方案中,本文公开的化合物含有多于六个氘原子。在另一个实施方案中,本文公开的化合物完全被氘原子取代,并且不含不可交换的1h氢原子。在一个实施方案中,氘并入的水平由使用氘化合成结构单元作为起始材料的合成方法决定。
[0060]“药学上可接受的盐”包括酸加成盐和碱加成盐。任一种本文所述的杂芳族raf抑制化合物的药学上可接受的盐均意在包括任何和所有药学上合适的盐形式。本文所述化合物的优选的药学上可接受的盐是药学上可接受的酸加成盐和药学上可接受的碱加成盐。
[0061]“药学上可接受的酸加成盐”是指保留了游离碱的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的,并且其是用诸如盐酸、氢溴酸、硫酸、硝酸、磷酸、氢碘酸、氢氟酸、亚磷酸等无机酸形成的。还包括用如下有机酸形成的盐:诸如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基链烷酸、链烷二酸、芳族酸、脂肪族和芳香族磺酸等,并且包括例如乙酸、三氟乙酸、丙酸、羟基乙酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。因此,示例性的盐包括硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、硝酸盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、氯化物、溴化物、碘化物、乙酸盐、三氟乙酸盐、丙酸盐、辛酸盐、异丁酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、扁桃酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、邻苯二甲酸盐、苯磺酸盐、甲苯磺酸盐、苯乙酸盐、柠檬酸盐、乳酸盐、苹果酸盐、酒石酸盐、甲磺酸盐等。还涉及氨基酸的盐如精氨酸盐、葡糖酸盐和半乳糖醛酸盐(参见,例如,berge s.m等人,"pharmaceutical salts,"journal of pharmaceutical science,66:1-19(1997))。在一些实施方案中,碱性化合物的酸加成盐通过按照熟练技术人员熟悉的方法和技术使其游离碱形式与足量的所需酸接触以产生盐而制备。
[0062]“药学上可接受的碱加成盐”是指保留了游离酸的生物有效性和性质的那些盐,其在生物学上或其他方面不是不合需要的。这些盐是通过向游离酸中加入无机碱或有机碱而制备的。在一些实施方案中,药学上可接受的碱加成盐用金属或胺如碱金属和碱土金属或有机胺形成。衍生自有机碱的盐包括但不限于钠盐、钾盐、锂盐、铵盐、钙盐、镁盐、铁盐、锌盐、铜盐、锰盐、铝盐等。衍生自有机碱的盐包括但不限于下列有机碱的盐:伯胺、仲胺和叔胺,取代胺(包括天然存在的取代胺),环胺和碱性离子交换树脂,例如,异丙胺、三甲胺、二
乙胺、三乙胺、三丙胺、乙醇胺、二乙醇胺、2-二甲基氨基乙醇、2-二乙基氨基乙醇、二环己基胺、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、n,n-二苄基乙二胺、氯普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、乙二胺、亚乙基二苯胺、n-甲基葡糖胺、葡糖胺、甲基葡糖胺、可可碱(theobromine)、嘌呤、哌嗪、哌啶、n-乙基哌啶、聚胺树脂等。参见berge等人,同上。
[0063]“药学上可接受的溶剂化物”是指作为溶剂加成形式的物质的组成物。在一些实施方案中,溶剂化物含有化学计量或非化学计量的量的溶剂,并且在与药学上可接受的溶剂如水、乙醇等制备的过程中形成。当溶剂为水时形成水合物,或者当溶剂为醇时形成醇化物。本文所述化合物的溶剂化物在本文所述的过程中方便地制备或形成。本文提供的化合物任选地以非溶剂化形式以及溶剂化形式存在。
[0064]
术语“受试者”或“患者”包括哺乳动物。哺乳动物的实例包括但不限于哺乳纲的任何成员:人,非人灵长类动物,如黑猩猩以及其他猿和猴物种;农畜,如牛、马、绵羊、山羊、猪;家畜,如兔、狗和猫;实验动物,包括啮齿动物,如大鼠、小鼠和豚鼠,等等。在一方面,该哺乳动物是人。
[0065]
如本文所用的,“治疗”或“处理”或“减轻”或“改善”可互换使用。这些术语是指获得有益的或期望的结果(包括但不限于治疗益处和/或预防益处)的途径。所谓“治疗益处”是指所治疗的潜在病症的消除或改善。另外,治疗益处也可以如下实现:一种或多种与该潜在病症相关的生理学症状得到根除或改善,使得在患者中观察到起色,虽然该患者仍受该潜在病症的折磨。对于预防益处,在一些实施方案中,将所述组合物施用于处于发生特定疾病的风险中的患者,或报告疾病的一种或多种生理学症状的患者,即便尚未作出该疾病的诊断。raf激酶家族
[0066]
raf激酶是丝氨酸/苏氨酸蛋白激酶家族,其构成ras
–
raf
–
mek
–
erk促分裂原活化蛋白激酶(mapk)信号级联(也称为mapk/erk途径)的核心成分,该途径介导信号从细胞表面受体传递到细胞核,以调节细胞生长、分化和存活。raf蛋白与逆转录病毒癌基因相关,并且从后生动物到哺乳动物在结构上是保守的,如同mapk/erk途径一样。它们的失调导致不受控制的细胞增殖、存活和去分化。因此,在大多数癌症中,raf激酶被改变或被不适当地激活。
[0067]
mapk/erk信号途径是细胞中的蛋白质网络,它将信号从细胞表面的受体传递到细胞核中的dna。当信号分子与细胞表面的受体结合时,信号开始,而当细胞核中的dna表达蛋白质并在细胞中产生一些变化如细胞分裂时,信号结束。该途径包括许多蛋白质,它们通过向邻近的蛋白质添加磷酸基团来进行传递,该蛋白质作为分子“开”或“关”开关,总体而言,该途径可分为3个步骤:(i)ras激活,(ii)激酶信号转导级联,以及(iii)翻译和转录的调节。简言之,细胞外促分裂原或信号分子与膜受体结合。这允许ras(一种小gtp酶)将其gdp换成gtp,并变得具有活性。活化的ras激活raf激酶的蛋白激酶活性。raf激酶磷酸化并激活mek(mek1和mek2)。然后mek磷酸化并激活mapk(也称为erk)。mapk激活调节数种转录因子的活性,并且还改变mrna向蛋白质的翻译。通过改变转录因子的水平和活性,mapk导致对细胞周期而言至关重要的基因的转录发生改变。
[0068]
存在三种已知的哺乳动物raf同种型:c-raf(也称为raf-1或c-raf-1)、b-raf和a-raf。所有raf激酶共有共同的模块结构,该模块结构由3个具有不同功能的保守区域(cr1、
gtp酶的显性抑制突变体。da-raf1通过介导分化所需的erk途径的抑制,是生肌分化的正调节剂。a-raf与其他raf激酶有若干不同之处。a-raf是唯一受类固醇激素调节的raf同种型。另外,a-raf蛋白在激酶结构域(n区)上游带负电荷的区域具有氨基酸置换,这导致其低基础活性。a-raf也仅被致癌h-ras和src微弱激活,并且还表现出对mek的低激酶活性(在raf激酶家族中对mek蛋白的激酶活性最低)。除了对mek进行磷酸化外,a-raf还抑制mst2——一种在mapk途径中未发现的肿瘤抑制物和促凋亡激酶。通过抑制mst2,a-raf阻止凋亡的发生。然而,这种抑制仅在剪接因子核内不均一核糖核蛋白h(hnrnp h)维持全长a-raf蛋白的表达时发生。肿瘤细胞通常过表达hnrnp h,这导致a-raf的全长表达,a-raf然后抑制凋亡,使应该被破坏的癌细胞保持存活。a-raf还与丙酮酸激酶m2(pkm2)结合,同样在mapk途径之外。pkm2是丙酮酸激酶的同工酶,负责癌细胞中的warburg效应。a-raf通过促进pkm2的构象变化来上调pkm2的活性。这导致pkm2从其低活性二聚体形式转变为高活性四聚体形式。这导致更多的葡萄糖碳转化为丙酮酸和乳酸,为细胞产生能量,将a-raf与能量代谢调节和细胞转化相关联,这两者在肿瘤发生中非常重要。raf激酶抑制剂
[0074]
mapk/erk途径的异常激活在各种癌症中经常发现,并且是癌症治疗的靶点。特别是,b-raf已成为癌症治疗中最具吸引力的分子靶点之一,因为在人类肿瘤中经常发现b-raf的体细胞突变。迄今为止测试的所有癌症样品中约有20%携带b-raf突变。b-raf-v600e是由第600位谷氨酸被置换为缬氨酸而生成的激酶结构域中的错义突变,是最常见的b-raf突变。在测试的各种肿瘤类型中约有1%发生c-raf突变,而a-raf的突变率甚至更低。b-raf和c-raf形成同源和异源二聚体,作为其激活机制的一部分,而a-raf稳定b-raf:c-raf复合物以维持信号传导效率。此外,c-raf将信号从致癌ras传递到mek,而b-raf则不能。因此,在不同的情况下,每个raf同种型都充当潜在的治疗靶点。
[0075]
索拉非尼是第一个进入临床试验的raf抑制剂。索拉非尼是一种宽特异性药物,其抑制其他激酶,包括血管内皮生长因子受体家族(vegfr-2和vegfr-3)、血小板衍生生长因子受体家族(pdgfr-b和kit)和flt3。临床试验显示,临床反应与b-raf突变状态之间没有相关性,表明它是b-raf的不良抑制剂。这导致了新一代b-raf抑制剂的开发,包括但不限于维罗非尼(vemurafenib)、sb-590885和达拉非尼(gsk2118436)。尽管b-raf突变型黑素瘤的临床研究的初步结果令人鼓舞,但随着其他b-raf突变型癌症(如甲状腺癌和结直肠癌)的临床试验开始,显然携带b-raf突变的不同细胞类型的肿瘤对选择性b-raf抑制具有不同的反应。此外,对raf抑制的原发性和继发性抗性的存在是raf激酶抑制剂治疗进展的最大挑战之一。抗性机制分为两大类。大约50%的患者表现出固有/原发性抗性。其他50%的患者最初对raf抑制剂有反应(》30%肿瘤缩小),但随后发展为与对raf抑制剂的获得性/继发性抗性相关的疾病进展。这两类并不相互排斥,因为几乎所有的反应者都有其余的疾病,因此可能表现出固有抗性。原发性raf抑制剂抗性的决定因素似乎因肿瘤类型而异,也涉及rtk信号传导的改变。继发性b-raf抑制剂抗性的潜在机制包括但不限于erk1/2途径的再激活、rtk信号传导的上调、受体酪氨酸激酶的上调、ras的突变和cot的上调。b-raf-v600e的b-raf选择性剪接和扩增也分别涉及约30%和20%的患者。此外,raf激酶抑制剂引起mapk途径的反常激活,在一些情况下,这会导致继发性ras突变驱动的恶性肿瘤的发展。因此,本领域需要能克服现有抑制剂的现有缺陷和所带来的挑战的新型raf激酶抑制剂。
杂芳族raf抑制化合物
[0076]
在一方面,本文提供了杂芳族raf抑制化合物。
[0077]
一个实施方案提供了具有式(i)结构的化合物,或其药学上可接受的盐或溶剂化物:其中,v为氢、卤素、-cn、任选取代的c1-c4烷基、-cd3、任选取代的c1-c4烷氧基、任选取代的c1-c4烯基或任选取代的c1-c4炔基;u选自任选取代的烷基、-cd3、任选取代的环烷基、任选取代的环烷基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基、任选取代的杂芳烷基、任选取代的-co烷基、任选取代的-co环烷基;x为n、c-h、c-d或c-fr2为h、d或f;r4为卤素、任选取代的c1-c3烷基、-cd3或任选取代的c1-c3烷氧基;r6为h、d、cl或f;z选自:(a)其中m为0、1、2或3;p为0、1、2、3或4;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;或者两个r
11
基团一起形成氧代;(b)其中m为0、1、2或3;p为0、1、2、3或4;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基);且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,
或者两个r
11
基团一起形成氧代;(c)其中m为0、1或2;n为0、1或2;m1为0、1或2;n1为0、1或2,条件是m1和n1两者不都是0;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(d)其中m为0、1或2;n为0、1或2;m1为1或2;p为0、1、2或3;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
、-ch
2-ch
2-、-ch
2-chr
11-、-ch
2-c(r
11
)
2-、-chr
11-ch
2-、-c(r
11
)
2-ch
2-、-nh-ch
2-、-nh-chr
11-、-nh-c(r
11
)
2-、-ch
2-nh-、-chr
11-nh-、-c(r
11
)
2-nh-、-n(r
11
)-ch
2-、-n(r
11
)-chr
11-、-n(r
11
)-c(r
11
)
2-、-ch
2-n(r
11
)-、-chr
11-n(r
11
)-、-c(r
11
)
2-n(r
11
)-;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;(e)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;
并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;(f)其中m为0、1、2或3;n为0、1、2或3,条件是m和n两者不都是0;p为0、1、2、3或4;且每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(g)其中m为1、2或3;n为1、2或3;p为0、1或2;且每个r
13
或r
14
独立地选自氢、卤素、-cn、任选取代的c1-c6烷基或任选取代的c3-c6环烷基;每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;(h)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个偕r
11
基团一起形成氧代;或者(i)任选取代的杂芳基。
[0078]
一个实施方案提供了式(i)化合物,或其药学上可接受的盐或溶剂化物,其具有式(ia)的结构:
其中,v为h或me;u选自任选取代的烷基、任选取代的环烷基、任选取代的环烷基烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂芳基或任选取代的杂芳烷基;x为n、c-h、c-d或c-fr2为h、d或f;r4为卤素、任选取代的c1-c3烷基、-cd3或任选取代的c1-c3烷氧基;r6为h、d、cl或f;z选自:(a)其中m为0、1、2或3;p为0、1、2、3或4;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;或者两个r
11
基团一起形成氧代;(b)其中m为0、1、2或3;p为0、1、2、3或4;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基);且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;
(c)其中m为0、1或2;n为0、1或2;m1为0、1或2;n1为0、1或2,条件是m1和n1两者不都是0;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(d)其中m为0、1或2;n为0、1或2;m1为1或2;p为0、1、2或3;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
、-ch
2-ch
2-、-ch
2-chr
11-、-ch
2-c(r
11
)
2-、-chr
11-ch
2-、-c(r
11
)
2-ch
2-、-nh-ch
2-、-nh-chr
11-、-nh-c(r
11
)
2-、-ch
2-nh-、-chr
11-nh-、-c(r
11
)
2-nh-、-n(r
11
)-ch
2-、-n(r
11
)-chr
11-、-n(r
11
)-c(r
11
)
2-、-ch
2-n(r
11
)-、-chr
11-n(r
11
)-、-c(r
11
)
2-n(r
11
)-;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;(e)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基;
(f)其中m为0、1、2或3;n为0、1、2或3,条件是m和n两者不都是0;p为0、1、2、3或4;且每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;(g)其中m为1、2或3;n为1、2或3;p为0、1或2;且每个r
13
或r
14
独立地选自氢、卤素、-cn、任选取代的c1-c6烷基或任选取代的c3-c6环烷基;每个r
11
独立地选自-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;(h)其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个偕r
11
基团一起形成氧代;或者(i)任选取代的杂芳基。
[0079]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中v为h。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中v为me。
[0080]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中x为n。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中x为c-h。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中x为c-f。
[0081]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r2为h。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其
中r2为f。
[0082]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r4为卤素。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r4为任选取代的c1-c3烷基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r4为甲基。
[0083]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r6为h。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r6为f。
[0084]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的烷基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的环烷基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的环烷基烷基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的杂环基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的杂环基烷基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的杂芳基。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中u为任选取代的杂芳烷基。
[0085]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为其中m为0、1、2或3;p为0、1、2、3或4;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基;或者两个r
11
基团一起形成氧代。一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为3。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
11
为任选取代的c1-c6烷基或任选取代的c3-c6环烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的c1-c6烷基或任选取代的c3-c6环烷基被至少一卤素所取代。
[0086]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其
中z为其中m为0、1、2或3;p为0、1、2、3或4;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基);且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为o。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为s。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1,且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1,且n为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
11
为任选取代的c1-c6烷基或任选取代的c3-c6环烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
11
为任选取代的c1-c6烷基或任选取代的c3-c6环烷基,并且所述任选取代的c1-c6烷基或任选取代的c3-c6环烷基被至少一卤素所取代。
[0087]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为其中m为0、1或2;n为0、1或2;m1为0、1或2;n1为0、1或2,条件是m1和n1两者不都是0;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1,且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为0,且n为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m1为0,且n1为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m1为1,且n1为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为o。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为ch2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为chr
11
。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为c(r
11
)2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐
或溶剂化物,其中r
11
为卤素且q为1。
[0088]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为其中m为0、1或2;n为0、1或2;m1为1或2;p为0、1、2或3;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
、-ch
2-ch
2-、-ch
2-chr
11-、-ch
2-c(r
11
)
2-、-chr
11-ch
2-、-c(r
11
)
2-ch
2-、-nh-ch
2-、-nh-chr
11-、-nh-c(r
11
)
2-、-ch
2-nh-、-chr
11-nh-、-c(r
11
)
2-nh-、-n(r
11
)-ch
2-、-n(r
11
)-chr
11-、-n(r
11
)-c(r
11
)
2-、-ch
2-n(r
11
)-、-chr
11-n(r
11
)-、-c(r
11
)
2-n(r
11
)-;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r
11
基团一起形成氧代;并且r
12
和r
13
各自独立地选自h或任选取代的c1-c6烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为0,n为1,且m1为1;并且w为-o-ch
2-或-ch
2-o-。
[0089]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr11或c(r11)2;每个r11独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个r11基团一起形成氧代;并且r12和r13各自独立地选自h或任选取代的c1-c6烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为o。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为ch2或chr11。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m1为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m1为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1且n为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为0且n为1。
[0090]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其
中z为其中m为0、1、2或3;n为0、1、2或3,条件是m和n两者不都是0;p为0、1、2、3或4;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1,且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为1,且n为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中至少一个r
11
连接至烯烃碳。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中至少一个r
11
不连接至烯烃碳。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
11
为任选取代的c1-c6烷基或任选取代的c3-c6环烷基。
[0091]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为其中m为1、2或3;n为1、2或3;p为0、1或2;且每个r
13
或r
14
独立地选自氢、卤素、-cn、任选取代的c1-c6烷基或任选取代的c3-c6环烷基;每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为2,且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为0。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
13
或r
14
之一不是氢。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
13
或r
14
之一为任选取代的c1-c6烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
13
为任选取代的c1-c6烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中r
14
为任选取代的c1-c6烷基。
[0092]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其
中z为其中m为0、1或2;n为0、1或2;m1为0、1或2;p为0、1或2;且q为0、1或2;w为o、s、s(o)、so2、nh或n(任选取代的c1-c6烷基)、ch2、chr
11
或c(r
11
)2;且每个r
11
独立地选自氨基、烷基氨基、二烷基氨基、-oh、卤素、任选取代的c1-c6烷基、任选取代的c3-c6环烷基、任选取代的c1-c6烷氧基、任选取代的c2-c6炔基、任选取代的-so2烷基、任选取代的c3-c6环烷基烷基、任选取代的杂环基或任选取代的杂环基烷基,或者两个偕r
11
基团一起形成氧代。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中w为o。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m为2,且n为1。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中m1为1或2。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中p为0或1,且q为0或1。
[0093]
一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为任选取代的杂芳基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中z为任选取代的含氮杂芳基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的含氮杂芳基为任选取代的单环含氮杂芳基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的单环含氮杂芳基为5元任选取代的单环含氮杂芳基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述5元任选取代的单环含氮杂芳基选自任选取代的吡咯、任选取代的噁唑、任选取代的噻唑、任选取代的咪唑、任选取代的吡唑、任选取代的异噁唑或任选取代的异噻唑。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述5元任选取代的单环含氮杂芳基为任选取代的吡唑。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的单环含氮杂芳基为6元任选取代的单环含氮杂芳基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述6元任选取代的单环含氮杂芳基选自任选取代的吡啶、任选取代的哒嗪、任选取代的嘧啶、任选取代的吡嗪或任选取代的三嗪(triazene)。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述6元任选取代的单环含氮杂芳基为任选取代的吡啶。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的含氮杂芳基被卤素或任选取代的c1-c4烷基所取代。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的c1-c4烷基为任选取代的c1-c2烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的c1-c4烷基为任选取代的c1烷基。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的c1烷基为-cf3基团。另一个实施方案提供了式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的吡啶被至少一-cf3基团所取代。另一个实施方案提供了
式(i)或(ia)化合物,或其药学上可接受的盐或溶剂化物,其中所述任选取代的吡啶为2-三氟甲基吡啶-4-基基团。
[0094]
在一些实施方案中,本文所述的杂芳族raf激酶抑制化合物具有表1中提供的结构。表1
[0095]
在一些实施方案中,本文所述的杂芳族raf激酶抑制化合物具有表2a中提供的结构,其中z选自表2b中示出的取代基。表2a表2a表2b
[0096]
在一些实施方案中,本文所述的杂芳族raf激酶抑制化合物具有表3a中提供的结构,其中w选自表3b中示出的取代基。表3a表3b
化合物的制备
[0097]
在本文所述的反应中使用的化合物根据本领域技术人员已知的有机合成技术,从可商购获得的化学品和/或从化学文献中描述的化合物开始进行制备。“可商购获得的化学品”从标准商业来源获得,该商业来源包括acros organics(pittsburgh,pa)、aldrich chemical(milwaukee,wi,包括sigma chemical和fluka)、apin chemicals ltd.(milton park,uk)、avocado research(lancashire,u.k.)、bdh inc.(toronto,canada)、bionet(cornwall,u.k.)、chemservice inc.(west chester,pa)、crescent chemical co.(hauppauge,ny)、eastman organic chemicals,eastman kodak company(rochester,ny)、fisher scientific co.(pittsburgh,pa)、fisons chemicals(leicestershire,uk)、frontier scientific(logan,ut)、icn biomedicals,inc.(costa mesa,ca)、key organics(cornwall,u.k.)、lancaster synthesis(windham,nh)、maybridge chemical co.ltd.(cornwall,u.k.)、parish chemical co.(orem,ut)、pfaltz&bauer,inc.(waterbury,cn)、polyorganix(houston,tx)、pierce chemical co.(rockford,il)、riedel de haen ag(hanover,germany)、spectrum quality product,inc.(new brunswick,nj)、tci america(portland,or)、trans world chemicals,inc.(rockville,md)和wako chemicals usa,inc.(richmond,va)。
[0098]
详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的合适的参考书籍和论文包括,例如,"synthetic organic chemistry",john wiley&sons,inc.,new york;s.r.sandler等人,"organic functional group preparations,"第2版,academic press,new york,1983;h.o.house,"modern synthetic reactions",第2版,w.a.benjamin,inc.menlo park,calif.1972;t.l.gilchrist,"heterocyclic chemistry",第2版,john wiley&sons,new york,1992;j.march,"advanced organic chemistry:reactions,mechanisms and structure",第4版,wiley-interscience,new york,1992。详述了在本文所述化合物的制备中有用的反应物的合成或对描述该制备的文章提供参考的其他合适的参考书籍和论文包括,例如,fuhrhop,j.和penzlin g."organic synthesis:concepts,methods,starting materials",第二次修订增补版(second,revised and enlarged edition)(1994)john wiley&sons isbn:3-527-29074-5;hoffman,r.v."organic chemistry,an intermediate text"(1996)oxford university press,isbn 0-19-509618-5;larock,r.c."comprehensive organic transformations:a guide to functional group preparations"第2版(1999)wiley-vch,isbn:0-471-19031-4;march,j."advanced organic chemistry:reactions,mechanisms,and structure"第4版(1992)john wiley&sons,isbn:0-471-60180-2;otera,j.(编著)"modern carbonyl chemistry"(2000)wiley-vch,isbn:3-527-29871-1;patai,s."patai's 1992guide to the chemistry of functional groups"(1992)interscience isbn:0-471-93022-9;solomons,t.w.g."organic chemistry"第7版(2000)john wiley&
sons,isbn:0-471-19095-0;stowell,j.c.,"intermediate organic chemistry"第2版(1993)wiley-interscience,isbn:0-471-57456-2;"industrial organic chemicals:starting materials and intermediates:an ullmann's encyclopedia"(1999)john wiley&sons,isbn:3-527-29645-x,8卷;"organic reactions"(1942-2000)john wiley&sons,超过55卷;以及"chemistry of functional groups"john wiley&sons,73卷。
[0099]
特定的和类似的反应物任选地通过由美国化学学会(american chemical society)的化学文摘服务(chemical abstract service)编制的已知化学品索引来确定,该索引可从大多数公共图书馆和大学图书馆以及通过在线数据库(联系美国化学学会,washington,d.c.获得更多细节)获得。目录中的已知但不可商购获得的化学品任选地由定制化学合成室(houses)制备,其中许多标准化学供应室(例如,上文列出的那些)提供定制合成服务。对于本文所述化合物的药用盐的制备和选择有用的参考文献是p.h.stahl和c.g.wermuth"handbook of pharmaceutical salts",verlag helvetica chimica acta,zurich,2002。药物组合物
[0100]
在某些实施方案中,本文所述的杂芳族raf激酶抑制化合物作为纯化学品施用。在其他实施方案中,本文所述的杂芳族raf激酶抑制化合物与药学上合适的或可接受的载体(本文中也为药学上合适的(或可接受的)赋形剂,生理学上合适的(或可接受的)赋形剂,或生理学上合适的(或可接受的)载体)组合,该载体是基于选定的给药途径和例如在remington:the science and practice of pharmacy(gennaro,第21版.mack pub.co.,easton,pa(2005))中描述的标准药学实践而选择的。
[0101]
本文提供了一种药物组合物,其包含至少一种本文所述的杂芳族raf激酶抑制化合物,或其立体异构体、药学上可接受的盐、水合物或溶剂化物,以及一种或多种药学上可接受的载体。如果该载体与该组合物的其他成分相容并且对该组合物的接受者(即,受试者或患者)无害,则该载体(或赋形剂)是可接受的或合适的。
[0102]
一个实施方案提供了包含药学上可接受的赋形剂和式(i)或(ia)化合物或其药学上可接受的盐或溶剂化物的药物组合物。
[0103]
一个实施方案提供了一种制备药物组合物的方法,其包括将式(i)或(ia)化合物或其药学上可接受的盐或溶剂化物与药学上可接受的载体混合。
[0104]
在某些实施方案中,式(i)或(ia)描述的杂芳族raf激酶抑制化合物或其药学上可接受的盐或溶剂化物是基本上纯的,因为其含有少于约5%,或少于约1%,或少于约0.1%的其他有机小分子,如例如在合成方法的一个或多个步骤中产生的未反应的中间体或合成副产物。
[0105]
合适的口服剂型包括,例如,片剂、丸剂、囊剂,或硬或软明胶、甲基纤维素或在消化道中易于溶解的另一合适材料的胶囊。在一些实施方案中,使用合适的无毒性固体载体,其包括例如药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁等。(参见,例如,remington:the science and practice of pharmacy(gennaro,第21版.mack pub.co.,easton,pa(2005))。
[0106]
在一些实施方案中,将式(i)或(ia)描述的杂芳族raf激酶抑制化合物或其药学上可接受的盐或溶剂化物配制成用于通过注射给药。在一些情况下,该注射制剂是水性制剂。
在一些情况下,该注射制剂是非水性制剂。在一些情况下,该注射制剂是基于诸如芝麻油等油的制剂。
[0107]
包含至少一种本文所述的杂芳族raf激酶抑制化合物的组合物的剂量根据受试者或患者(例如,人)的状况而不同。在一些实施方案中,这类因素包括总体健康状况、年龄和其他因素。
[0108]
药物组合物以适合于待治疗(或预防)的疾病的方式施用。适当的剂量和合适的给药持续时间和频率将取决于诸如患者的状况、患者疾病的类型和严重程度、活性成分的特定形式和给药方法等因素。通常,适当的剂量和治疗方案以足以提供治疗和/或预防益处(例如,改善的临床结果,例如更频繁的完全或部分缓解,或更长的无病和/或总体存活期,或症状严重程度的减轻)的量提供组合物。通常使用实验模型和/或临床试验确定最佳剂量。最佳剂量取决于患者的身体质量、体重或血容量。
[0109]
口服剂量一般在约1.0mg至约1000mg的范围内,每天一至四次或更多次。治疗方法
[0110]
一个实施方案提供了式(i)化合物,或其药学上可接受的盐或溶剂化物,其用于治疗人或动物体的方法中。
[0111]
一个实施方案提供了式(i)化合物,或其药学上可接受的盐或溶剂化物,其用于治疗癌症或赘生性疾病的方法中。
[0112]
一个实施方案提供了式(i)化合物或其药学上可接受的盐或溶剂化物在制备用于治疗癌症或赘生性疾病的药物中的用途。
[0113]
在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用式(i)化合物,或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用包含式(i)化合物或其药学上可接受的盐或溶剂化物和药学上可接受的赋形剂的药物组合物。在一些实施方案中,该癌症是乳腺癌、结直肠癌、卵巢癌、胰腺癌、前列腺癌或肺癌。
[0114]
一个实施方案提供了式(ia)化合物,或其药学上可接受的盐或溶剂化物,其用于治疗人或动物体的方法中。
[0115]
一个实施方案提供了式(ia)化合物,或其药学上可接受的盐或溶剂化物,其用于治疗癌症或赘生性疾病的方法中。
[0116]
一个实施方案提供了式(ia)化合物或其药学上可接受的盐或溶剂化物在制备用于治疗癌症或赘生性疾病的药物中的用途。
[0117]
在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用式(ia)化合物,或其药学上可接受的盐或溶剂化物。在一些实施方案中,本文描述了一种治疗有需要的患者的癌症的方法,其包括向所述患者施用包含式(ia)化合物或其药学上可接受的盐或溶剂化物和药学上可接受的赋形剂的药物组合物。在一些实施方案中,该癌症是乳腺癌、结直肠癌、卵巢癌、胰腺癌、前列腺癌或肺癌。
[0118]
本文提供了所述方法,其中所述药物组合物经口服施用。本文提供了所述方法,其中所述药物组合物通过注射施用。
[0119]
根据本公开,其他实施方案和用途对于本领域技术人员将是明显的。提供以下实施例仅仅是为了说明各实施方案,而不应解释为以任何方式限制本发明。
实施例i.化学合成
[0120]
在一些实施方案中,本文公开的杂芳族raf激酶抑制化合物按照以下实施例来合成。如以下所用的,在本发明的整篇说明书中,除非另有说明,否则下列缩写应理解为具有以下含义:℃
ꢀꢀꢀꢀ
摄氏度δhꢀꢀꢀꢀ
从四甲基硅烷向低场(downfield)的化学位移,百万分率dcm
ꢀꢀꢀ
二氯甲烷(ch2cl2)dmf
ꢀꢀꢀ
二甲基甲酰胺dmso
ꢀꢀ
二甲基亚砜ea
ꢀꢀꢀꢀ
乙酸乙酯esi
ꢀꢀꢀ
电喷雾电离et
ꢀꢀꢀꢀ
乙基g
ꢀꢀꢀꢀꢀ
克h
ꢀꢀꢀꢀꢀ
小时hplc
ꢀꢀ
高效液相色谱法hz
ꢀꢀꢀꢀ
赫兹j
ꢀꢀꢀꢀꢀ
耦合常数(在nmr谱分析中)lcms
ꢀꢀ
液相色谱质谱法μ
ꢀꢀꢀꢀ
微m
ꢀꢀꢀꢀꢀ
多重峰(光谱);米;毫m
ꢀꢀꢀꢀꢀ
摩尔m
+
ꢀꢀꢀꢀꢀ
母分子离子me
ꢀꢀꢀꢀ
甲基mhz
ꢀꢀꢀ
兆赫兹min
ꢀꢀꢀ
分钟mol
ꢀꢀꢀ
摩尔;分子(如在mol wt中)ml
ꢀꢀꢀꢀ
毫升ms
ꢀꢀꢀꢀ
质谱法nm
ꢀꢀꢀꢀ
纳米nmr
ꢀꢀꢀ
核磁共振ph
ꢀꢀꢀꢀ
酸碱度;水溶液的酸性或碱性的量度pe
ꢀꢀꢀꢀ
石油醚rt
ꢀꢀꢀꢀ
室温s
ꢀꢀꢀꢀꢀ
单峰(光谱)t
ꢀꢀꢀꢀꢀ
三重峰(光谱)t
ꢀꢀꢀꢀꢀ
温度tfa
ꢀꢀꢀ
三氟乙酸thf
ꢀꢀꢀ
四氢呋喃
中间体1:2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺
[0121]
在n2下向5-溴-2-氟-4-甲基苯胺(2.0g,9.8mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(2.7g,10.8mmol)和koac(2.9g,29.4mmol)在二氧杂环己烷(20ml)中的溶液中加入pd(dppf)cl2(359mg,0.49mmol),并将混合物在100℃下搅拌16h。将反应冷却至室温并过滤混合物。将滤液浓缩,得到2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(粗品),其不经任何进一步纯化而用于下一步。ms计算值:251,ms实测值:252([m+h]
+
)。中间体2:n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺
[0122]
在0℃下向2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(800mg,3.19mmol)和二(三氯甲基)碳酸酯(378.16mg,1.27mmol)在thf(40ml)中的搅拌溶液中逐滴加入diea(2.63ml,20.37mmol)。搅拌0.5h后,向反应混合物中加入在thf(1ml)中的3-(三氟甲基)吡咯烷盐酸盐(559.37mg,3.19mmol)。将反应混合物在环境温度下搅拌0.5h。将所得混合物减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的33%ea洗脱。将含有所需产物的级分浓缩,得到呈灰白色固体的n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(0.928g,64%)。针对c
19h25
bf4n2o3[m+h]
+
的ms esi计算值417.19,实测值417.15。1h nmr(400mhz,cdcl3)δ8.34(d,j=9.2hz,1h),6.86(d,j=12.0hz,1h),6.17(s,1h),3.81-3.53(m,4h),3.06-2.96(m,1h),2.47(s,3h),2.32-2.16(m,2h),1.31(s,12h)。中间体3:7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯
步骤1:
[0123]
向naoh(4.13g,103.43mmol)的水(56.00ml)溶液中加入4-氨基-2-(甲基硫基)嘧啶-5-甲醛(7.00g,41.37mmol)和丙酮醇(3.68g,49.65mmol)。将反应混合物在40℃下搅拌16h。将所得混合物冷却至5~10℃。在低于15℃下向上述混合物中逐滴加入hcl(105ml,1m水溶液)(ph=3~4)。将反应混合物在10~15℃下搅拌1h并过滤。将滤饼用水(10ml)洗涤并在55℃下减压干燥16h,得到呈棕色固体的7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-醇(8.00g,93%)。针对c9h9n3os[m+h]
+
的ms esi计算值208.05,实测值208.15。1h nmr(400mhz,d
6-dmso)δ10.86(s,1h),9.29(s,1h),7.55(s,1h),2.60(s,3h),2.59(s,3h)。步骤2:
[0124]
在低于20℃下,向7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-醇(8.00g,38.60mmol)在dcm(160.00ml)中的搅拌溶液中加入吡啶(12.21g,154.40mmol)。将反应混合物冷却至-5~0℃。在低于0℃下向上述混合物中逐滴加入三氟甲磺酸酐(16.33g,57.90mmol)在dcm(80ml)中的溶液。将反应混合物在0℃下搅拌2h。将所得混合物用hcl(80ml,2m水溶液)猝灭并用水(20ml x 2)洗涤。向有机层中加入5g硅胶。将所得混合物在10-20℃下搅拌1h并通过硅藻土过滤。将滤液减压浓缩。将残余物用pe(40ml)在10-20℃下浆化2h并过滤。将滤饼减压干燥,得到呈棕色固体的7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(11.00g,84%)。针对c
10
h8f3n3o3s2[m+h]
+
的ms esi计算值340.00,实测值340.00。1h nmr(400mhz,cdcl3)δ9.20(s,1h),8.10(s,1h),2.88(s,3h),2.77(s,3h)。步骤3:
[0125]
在低于5℃下,向7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(10.00g,29.47mmol)在dcm(200.00ml)中的溶液中分批加入m-cpba(5.98g,29.472mmol,85%)。将反应混合物在0℃下搅拌3h。在低于10℃下,向上述混合物中逐滴加入甲胺(44.21ml,88.416mmol)(在thf中2m)。将反应混合物在0-10℃下搅拌3h。将所得混合物用dcm(100ml)稀释并用水(50ml x 5)洗涤。将有机层减压浓缩。将残余物用dcm/pe(1:5)(200ml)在20℃下浆化1h并过滤。将滤饼减压干燥,得到呈淡黄色固体的7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(5.56g,58%)。针对c
10
h9f3n4o3s[m+h]
+
的ms esi计算值323.03,实测值323.00。1h nmr(400mhz,cdcl3)δ8.95(s,1h),7.87(s,1h),5.90(s,1h),3.20(s,3h),2.76(s,3h)。中间体4:3-[(三氟甲基)硫基]吡咯烷盐酸盐
步骤1:
[0126]
向3-羟基吡咯烷-1-甲酸叔丁酯(0.60g,3.20mmol)、四丁基碘化铵(14.2g,38.45mmol,12.00当量)、ki(4.2g,25.64mmol)在甲苯(30ml)中的混合物中加入[(三氟甲基)硫基]银(892.68mg,4.27mmol)。将反应混合物在120℃下搅拌16h。将所得混合物减压浓缩。残余物通过硅胶柱色谱法纯化,用ea/pe(0至15%)洗脱。合并含有所需产物的级分并浓缩,得到呈棕色油状物的3-[(三氟甲基)硫基]吡咯烷-1-甲酸叔丁酯(1g,粗品)。针对c
10h16
f3no2s[m+h
–
t-bu]
+
的ms esi计算值216.09,实测值215.95。步骤2:
[0127]
向3-[(三氟甲基)硫基]吡咯烷-1-甲酸叔丁酯(1.00g,3.69mmol)在meoh(4.00ml)中的混合物中加入在1,4-二氧杂环己烷(4.00ml,131.65mmol)中的hcl(气体)。将反应混合物在室温下搅拌16h。将所得混合物减压浓缩,得到呈棕色油状物的3-[(三氟甲基)硫基]吡咯烷盐酸盐(1g,粗品)。粗产物不经进一步纯化而直接用于下一步。针对c5h9clf3ns[m+h
–
hcl]
+
的ms esi计算值172.03,实测值172.05。中间体5:4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-n-[1-[2-(三氟甲基)吡啶-4-基]乙烯基]苯胺
[0128]
在0℃和氮气氛下,向2-(三氟甲基)吡啶-4-甲酸(1.23g,6.43mmol)和hatu(3.26g,8.58mmol)在dmf(10ml)中的搅拌溶液中加入tea(2.38ml,23.57mmol)和4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(1g,4.29mmol)。将反应混合物在环境温度下搅拌1.5h。所得混合物用水(30ml)稀释并用ea(3x80ml)萃取。合并的有机层用盐水(5x40ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的25%ea洗脱。合并含有所需产物的级分并浓缩,得到呈灰白色固体的4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-n-[1-[2-(三氟甲基)吡啶-4-基]乙烯基]苯胺(1.45g,83%)。针对c
30h39
f3n4o5[m+h]
+
的ms esi计算值407.17,实测值406.90.h-nmr(400mhz,cdcl3)δ8.93(s,1h),8.12(s,1h),7.70(d,j=2.4hz,1h),7.25-7.23(m,1h),2.56(s,3h),1.37(s,12h)。f-nmr(376mhz,cdcl3)δ-68.01。中间体6:2-(乙基氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯
[0129]
使用与中间体3中描述的程序类似的程序,使用乙胺代替甲胺制备标题化合物,得到作为固体的标题化合物。中间体7:2-[(2-羟基乙基)氨基]-7-甲基吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯
[0130]
使用与中间体3中描述的程序类似的程序,使用乙醇胺代替甲胺制备标题化合物,得到作为固体的标题化合物。中间体8:n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺甲酰胺步骤1:n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺
[0131]
在0℃下向2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(0.80g,3.19mmol)和二(三氯甲基)碳酸酯(0.38g,1.27mmol)在thf(40ml)中的搅拌溶液中逐滴加入diea(2.63ml,20.37mmol)。搅拌0.5h后,向上述混合物中加入在thf(1ml)中的3-(三氟甲基)吡咯烷盐酸盐(0.56g,3.19mmol)。将反应混合物在环境温度下搅拌0.5h。将所得混合物减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的33%ea洗脱。合并含有所需产物的级分并浓缩,得到呈灰白色固体的n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(0.928g,64%)。针对c
19h25
bf4n2o3[m+h]
+
的ms esi计算值417.19,实测值417.15.h-nmr(400mhz,cdcl3)δ8.34(d,j=9.2hz,1h),6.86(d,j=12.0hz,1h),6.17(s,1h),3.81-3.53(m,4h),3.06-2.96(m,1h),2.47(s,3h),2.32-2.16(m,2h),1.31(s,12h)。
[0132]
使用与中间体8中描述的程序类似的程序,使用合适的起始材料制备表4中的化合物。表4
[0133]
使用与中间体5中描述的程序类似的程序,使用合适的起始材料制备表5中的化合物。表5
中间体18:6-溴-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺步骤1:n-[(4-甲氧基苯基)甲基]-n-甲基胍盐酸盐
[0134]
在室温下向吡唑-1-甲脒盐酸盐(48.00g,327.47mmol)和[(4-甲氧基苯基)甲基](甲基)胺(49.52g,327.47mmol)在dmf(480ml)中的搅拌溶液中加入diea(44.44g,
343.84mmol)。将所得混合物在室温下搅拌16h。添加et2o(500ml),所需产物在烧瓶底部变成油状物。对混合物进行超声处理,并滗析顶部的醚层。该过程重复数次,直到所需产物固化。将固体在高真空下干燥,得到呈灰白色固体的n-[(4-甲氧基苯基)甲基]-n-甲基胍盐酸盐(37.3g,45%)。针对c
10h16
cln3o[m+h-hcl]
+
的ms esi计算值194.12,实测值194.10。h nmr(400mhz,cd3od)δ7.24-7.21(m,2h),7.02-7.21(m,2h),4.56(s,2h),3.81(s,3h),2.99(s,3h)。步骤2:6-溴-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺
[0135]
在室温和氮气氛下,向n-[(4-甲氧基苯基)甲基]-n-甲基胍盐酸盐(15.00g,65.30mmol)和5-溴-2-氟吡啶-3-甲醛(13.32g,65.30mmol)在acn(150ml)中的搅拌混合物中加入tea(19.8ml,195.90mmol)。将所得混合物在氮气氛下在180℃微波下搅拌30min。将所得混合物减压浓缩。残余物通过硅胶柱色谱法纯化,用pe/etoac(7:3)洗脱,得到呈棕色固体的6-溴-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺(10g,38%)。针对c
15h13
brn4o[m+h]
+
的ms esi计算值359.04,361.04,实测值358.95,360.95。h nmr(400mhz,dmso-d6)δ9.28(s,1h),8.95-8.94(m,1h),8.58-8.57(m,1h),7.27-7.21(m,2h),6.92-6.87(m,2h),4.96(s,1h),3.73(s,3h),3.19(s,3h)。中间体19:6-(5-氨基-2-甲基苯基)-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺
[0136]
向6-溴-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺(9.90g,27.55mmol)和4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(7.71g,33.07mmol)在1,4-二氧杂环己烷(100.00ml)和水(25.00ml)中的溶液中加入k2co3(11.43g,82.67mmol)和pd(pph3)4(3.18g,2.75mmol)。将混合物在氮气氛下于65℃搅拌16h。让反应混合物冷却至环境温度,用水(200ml)稀释,并用乙酸乙酯(3x200ml)萃取。合并的有机级分用盐水(200ml)洗涤,经无水硫酸钠干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe/etoac(1:5)洗脱。将含有所需产物的级分浓缩,得到呈黄色固体的6-(5-氨基-2-甲基苯基)-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺(9.2g,87%)。针对c
23h23
n5o[m+h]
+
的ms esi计算值386.19;实测值386.05。1h-nmr(400mhz,d
6-dmso)δ9.34(s,1h),8.85(d,j=2.8hz,1h),8.28-8.12(m,1h),7.25(s,2h),7.00(d,j=8.0hz,1h),6.90(d,j=8.4hz,2h),6.57(d,j=8.0hz,2h),5.04(s,2h),4.98(s,2h),3.73(d,j=1.2hz,3h),3.21(s,3h),2.12(s,3h)。中间体20:5-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-胺
[0137]
使用与中间体17中描述的程序类似的程序,使用6-溴-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺和6-甲基-5-(4,4,5-三甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-胺制备标题化合物,得到呈黄色固体的标题化合物。中间体21:6-溴-n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺步骤1:2-(甲基硫基)-7-(三氟甲基)吡啶并[2,3-d]嘧啶
[0138]
在0℃下向4-氨基-2-(甲基硫基)嘧啶-5-甲醛(2.00g,11.82mmol)和1,1,1-三氟丙酮(2.65g,23.64mmol)在h2o(16.00ml)中的搅拌混合物中分批加入koh(0.99g,17.73mmol)。将反应混合物在60℃下搅拌16h。通过过滤收集沉淀的固体,用水(3x30ml)洗涤,并在真空干燥箱中干燥。这产生呈灰白色固体的2-(甲基硫基)-7-(三氟甲基)吡啶并[2,3-d]嘧啶(1.76g,61%)。针对c9h6f3n3s[m+h]
+
的ms esi计算值246.02,实测值246.15。步骤2:n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺
[0139]
在0℃下向2-(甲基硫基)-7-(三氟甲基)吡啶并[2,3-d]嘧啶(1.70g,6.93mmol)在dcm(48.00ml)中的搅拌溶液中逐滴加入m-cpba (1.79g,10.40mmol)。将反应混合物在0℃下搅拌2h。在0℃下向上述混合物中逐滴加入甲胺(0.65g,20.93mmol)。将反应混合物在室温下再搅拌5h。将所得混合物在室温下用水(50ml)稀释并用dcm(3x50ml)萃取。合并的有机层用盐水(3x40ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe/(ea/etoh=3:1)(1.5:1)洗脱。合并含有所需产物的级分并浓缩,得到呈灰白色固体的n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺(1g,63%)。针对c9h7f3n4[m+h]
+
的ms esi计算值229.06,实测值229.20。步骤3:6-溴-n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺
[0140]
在室温下向n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺(0.55g,2.41mmol)在acoh(11.00ml)中的搅拌溶液中逐滴加入br2(1.93g,12.05mmol)。将反应混合物在110℃下搅拌16h。将所得混合物减压浓缩。将残余物在0℃下用饱和nahco3水溶液(150ml)稀释。所得混合物用dcm(3x100ml)萃取。合并的有机层用盐水(3x50ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过采用以下条件的反相柱色谱法纯化:柱:xbridge c18 obd prep column,5um,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内40b至70b。合并含有所需产物的级分并浓缩,得到呈灰白色固体的6-溴-n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺(85.2mg,11%)。针对c9h6brf3n4[m+h]
+
的ms esi计算值306.97,308.97,实测值308.05,310.05。
[0141]
使用与中间体21中描述的程序类似的程序,使用合适的起始材料制备表6中的化合物。表6
实施例1和实施例2:(3s)-n-[2-氟-4-甲基-5-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺;(3r)-n-[2-氟-4-甲基-5-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺的合成步骤1:
[0142]
向7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(270mg,0.84mmol)和n-[2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(697.45mg,1.68mmol)在1,4-二氧杂环己烷(4.00ml)和水(1.00ml)中的溶液中加入nahco3(211.15mg,2.51mmol)和pd(pph3)4(96.82mg,0.084mmol)。将反应混合物用氮气脱气三次并在50℃下搅拌16h。将所得混合物用水(10ml)稀释并用ea(3x30ml)萃取。合并的有机层用盐水(2x15ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过反相急骤色谱法纯化,用25%acn水溶液(0.1%fa)洗脱,得到约400mg产物,其进一步通过采用以下条件的制备型hplc纯化(柱:sunfire prep c18 obd column,19
×
150mm 5um 10nm;流动相a:水(0.05%tfa),流动相b:acn;流速:20ml/min;梯度:在6min内25b至35b;210/254nm),得到呈黄色固体的n-[2-氟-4-甲基-5-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(200mg,51%)。针对c
22h22
f4n6o[m+h]
+
的ms esi计算值463.18,实测值463.20。步骤2:
[0143]
n-[2-氟-4-甲基-5-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(220mg,0.48mmol)通过采用以下条件的手性sfc拆分:柱:chiralpak ie,3*25cm,5um;流动相a:hex:dcm=3:1(10mm nh3-meoh)
‑‑
hplc,流动相b:etoh
‑‑
hplc;流速:40ml/min;梯度:在21min内20b至20b;220/254nm。将含有所需产物的级分浓缩,得到两种对映异构体:(66.5mg,30%)在15.19min洗脱的第一异构体(ee》98%)和(66.3mg,30%)在18.44min洗脱的第二异构体(ee》98%)。第一洗脱异构体的1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.07(s,1h),7.91(s,1h),7.68(s,1h),7.31(d,j=8.0hz,1h),7.22(d,j=11.6hz,1h),3.67(t,j=9.4hz,1h),3.52-3.41(m,3h),3.31-3.27(m,1h),2.92(d,j=4.8hz,3h),2.31(s,3h),2.23-2.15(m,1h),2.05-2.01(m,4h)。第二洗脱异构体的1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.07(s,1h),7.91(s,1h),7.68(s,1h),7.31(d,j=8.0hz,1h),7.22(d,j=11.6hz,1h),3.67(t,j=9.4hz,1h),3.52-3.41(m,3h),3.31-3.27(m,1h),2.92(d,j=4.8hz,3h),2.31(s,3h),2.23-2.15(m,1h),2.05-2.01(m,4h)。针对c
22h22
f4n6o[m+h]
+
的ms esi计算值463.18,实测值463.15。实施例3:n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)-2,5-二氢-1h-吡咯-1-甲酰胺步骤1:
[0144]
在n2下向7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(1.5g,4.9mmol)、2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(1.6g,6.3mmol)和cs2co3(3.2g,9.7mmol)在二氧杂环己烷(30ml)和水(5ml)中的溶液中加入pd(dppf)cl2(356mg,0.5mmol),并将混合物在70℃下搅拌16h。将混合物冷却至室温,用水(100ml)稀释并用dcm(100ml*3)萃取。合并的有机层用h2o(100ml*2)和盐水(200ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过硅胶上的急骤色谱法纯化(pe:ea=10:1至pe:ea=2:1),得到6-(5-氨基-4-氟-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(1.0g,72%)。ms计算值:297,ms实测值:298([m+h]
+
)。步骤2:
[0145]
在0℃和n2气氛下,向6-(5-氨基-4-氟-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(80mg,0.2mmol)、diea(274mg,2.1mmol)在thf(10ml)中的溶液中加入在thf中的btc(32mg,0.1mmol),并将混合物在0℃下搅拌0.5h。然后添加3-(三氟甲基)-2,5-二氢-1h-吡咯三氟乙酸盐(粗品,0.5mmol),并将反应在0℃下搅拌1h。将混合物浓缩,并将残余物通过制备型hplc纯化,得到n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)-2,5-二氢-1h-吡咯-1-甲酰胺(22.1mg,17.9%)。1h nmr(400mhz,dmso-d6):δ2.01(s,3h),2.31(s,3h),2.92(d,j=4.4hz,3h),4.39(s,4h),6.72
(d,j=1.6hz,1h),7.23(d,j=12.0hz,1h),7.33(d,j=8.0hz,1h),7.68(brs,1h),7.92(s,1h),8.16(s,1h),9.08(s,1h)。ms计算值:460实测:461([m+h]
+
)。实施例6:n-[4-甲基-3-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺步骤1:
[0146]
在室温和氮气氛下,向7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(6.00g,18.63mmol)和4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(5.20g,22.32mmol)在1,4-二氧杂环己烷(80ml)和水(40ml)中的搅拌混合物中加入pd(pph3)4(2.16g,1.87mmol)和nahco3(4.7g,55.90mmol)。将反应混合物用氮气脱气三次并在50℃下搅拌16h。所得混合物用水(80ml)稀释并用ea(3x300ml)萃取。合并的有机层用盐水(3x100ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的52%ea/etoh(3/1)洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(4.6g,88%)。针对c
16h17
n5[m+h]
+
的ms esi计算值280.15,实测值280.20.h-nmr(300mhz,d
6-dmso)δ9.08(s,1h),7.86(s,1h),7.64(s,1h),6.98(d,j=8.1hz,1h),6.57-6.53(m,1h),6.38(d,j=2.4hz,1h),4.99(s,2h),2.92(d,j=4.8hz,3h),2.32(s,3h),1.85(s,3h)。步骤2:
[0147]
在0℃和氮气氛下,向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(4.76g,17.06mmol)和2-(三氟甲基)吡啶-4-甲酸(3.26g,17.06mmol)在dmf(48ml)中的搅拌溶液中加入hatu(9.72g,25.57mmol)和tea(7.1ml,51.08mmol)。将反应混合物在氮气氛下于室温搅拌1h。所得混合物用水(100ml)稀释并用ea(3x300ml)萃取。合并的有机层用盐水(6x150ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的55%ea/etoh(3/1)洗脱,得到约6g产物,其进一步通过与ea/正己烷(150ml)一起研磨纯化,得到呈黄色固体的n-[4-甲基-3-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺(4.89g,63%)。针对c
23h19
f3n6o[m+h]
+
的ms esi计算值453.16,实测值453.25。1h-nmr(400mhz,d
6-dmso)δ10.70(s,1h),9.11(s,1h),8.99(d,j=4.8hz,1h),8.37(s,1h),8.19(d,j=4.8hz,1h),7.97(s,1h),7.78-7.71(m,2h),7.63(d,j=2.0hz,1h),7.39(d,j=8.8hz,1h),2.93(d,j=4.4hz,3h),2.34(s,3h),2.05(s,3h).
19
f-nmr(400mhz,d
6-dmso)δ-66.46(s)。
[0148]
使用合适的起始材料和实施例1和2或实施例3中描述的程序制备表7中的化合物。使用表中指定的手性柱拆分外消旋产物。表7
实施例16:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)-2,5-二氢-1h-吡咯-1-甲酰胺的合成步骤1:
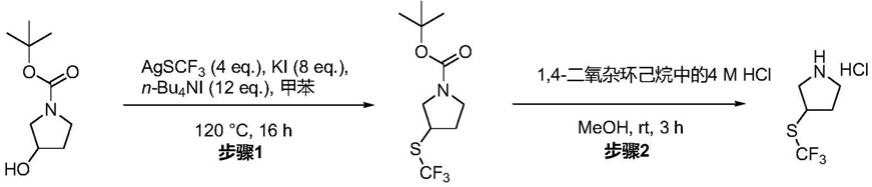
[0149]
在室温下向7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(180mg,0.58mmol)和n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-3-(三氟甲基)-2,5-二氢-1h-吡咯-1-甲酰胺(301mg,0.75mmol)在二氧杂环己烷(12ml)和h2o(2ml)中的溶液中加入pd(dppf)cl2(43mg,0.06mmol)和cs2co3(381mg,1.16mmol)。将反应混合物在n2下于70℃搅拌16hr。将反应混合物冷却至室温,用水(20ml)猝灭并用dcm(20ml*3)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)-2,5-二氢-1h-吡咯-1-甲酰胺(84.5mg,32.7%)。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.34(s,1h),7.91(s,1h),7.66(br s,1h),7.50(dd,j=2.4,8.4hz,1h),7.36(d,j=2.4hz,1h),7.23(d,j=8.4hz,1h),6.73(d,j=1.6hz,1h),4.41-4.37(m,4h),2.92(d,j=4.4hz,3h),2.32(s,3h),1.98(s,3h)。ms计算值:442,ms实测值:443([m+h]
+
)。实施例17和18:(r)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺和(s)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺
的合成步骤1:
[0150]
在0℃下向6-(5-氨基-4-氟-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(400mg,1.35mmol)和diea(869mg,6.73mmol)在thf(30ml)中的溶液中加入btc(160mg,0.53mmol)在thf(1ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加3-(2,2,2-三氟乙基)吡咯烷盐酸盐(383mg,2.02mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(pe:ea=1:1)纯化,得到混合物,其通过手性制备型sfc拆分(柱:chiralpak ib 5μm 20*250mm;流动相:co2:meoh:dea=80:20:0.2%,50g/min;温度:40℃;波长:214nm),得到两种对映异构体。
[0151]
第一洗脱峰:142.6mg,22.2%,rt=6.65min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),7.90(s,1h),7.89(s,1h),7.68(br s,1h),7.33(dd,j=2.8,8.4hz,1h),7.20(d,j=11.6hz,1h),3.66(t,j=8.0hz,1h),3.52(t,j=9.2hz,1h),3.28-3.26(m,1h),3.02(t,j=9.2hz,1h),2.92(d,j=4.4hz,3h),2.45-2.35(m,3h),2.31(s,3h),2.11-2.05(m,1h),2.00(s,3h),1.70-1.60(m,1h)。ms计算值:476,m实测:477([m+h]
+
)。
[0152]
第二洗脱峰:103.8mg,16.2%,rt=7.72min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),7.90(s,1h),7.89(s,1h),7.68(br s,1h),7.33(dd,j=2.8,8.4hz,1h),7.20(d,j=11.6hz,1h),3.66(t,j=8.0hz,1h),3.52(t,j=9.2hz,1h),3.28-3.26(m,1h),3.02(t,j=9.2hz,1h),2.92(d,j=4.4hz,3h),2.45-2.35(m,3h),2.31(s,3h),2.11-2.05(m,1h),2.00(s,3h),1.70-1.60(m,1h)。ms计算值:476,m实测值:477([m+h]
+
)。实施例19和20:(r)-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺和(s)-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺的合成
步骤1:
[0153]
在0℃下向4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(400mg,1.72mmol)和diea(1.1g,8.62mmol)在thf(20ml)中的溶液中加入btc(204mg,0.68mmol)在thf(1ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加3-(2,2,2-三氟乙基)吡咯烷盐酸盐(489mg,2.58mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(pe:ea=2:1)纯化,得到n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(700mg,99%)。ms计算值:412,ms实测值:413([m+h]
+
)。步骤2:
[0154]
在室温下向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(720mg,1.75mmol)和7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(385mg,1.25mmol)在二氧杂环己烷(60ml)和h2o(10ml)中的溶液中加入pd(dppf)cl2(92mg,0.12mmol)和cs2co3(815mg,2.50mmol)。将反应混合物在n2下于70℃搅拌16h。将反应混合物冷却至室温,用水(50ml)猝灭并用dcm(30ml*3)萃取。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(pe:ea=1:1)纯化,得到混合物,其通过手性制备型scf拆分(柱:chiralpak ig 5μm 20*250mm;流动相:co2:ipa:dea=60:40:0.2,50g/min;温度:40℃;波长:254nm),得到两种对映异构体。
[0155]
第一洗脱峰:108.3mg,18.9%,rt=8.45min,ee》98。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.17(s,1h),7.90(s,1h),7.67(br s,1h),7.48(dd,j=2.0,8.0hz,1h),7.35(s,1h),7.19(d,j=8.4hz,1h),3.66(t,j=8.0hz,1h),3.51(t,j=9.6hz,1h),3.30-3.26(m,1h),3.01(t,j=8.8hz,1h),2.92(d,j=4.4hz,3h),2.47-2.37(m,3h),2.31(s,3h),2.10-2.04(m,1h),1.96(s,3h),1.69-1.59(m,1h)。ms计算值:458,m实测值:459([m+h]
+
)。
[0156]
第二洗脱峰:132.2mg,23.1%,rt=10.37min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.17(s,1h),7.90(s,1h),7.67(br s,1h),7.48(dd,j=2.0,8.0hz,1h),7.35(s,1h),7.19(d,j=8.4hz,1h),3.66(t,j=8.0hz,1h),3.51(t,j=9.6hz,1h),3.30-3.26(m,1h),3.01(t,j=8.8hz,1h),2.92(d,j=4.4hz,3h),2.47-2.37(m,3h),2.31(s,3h),2.10-2.04(m,1h),1.96(s,3h),1.69-1.59(m,1h)。ms计算值:458,m实测值:459([m+h]
+
)。实施例21:3-(叔丁基)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吡咯烷-1-甲酰胺的合成
步骤1:
[0157]
在0℃下向6-(5-氨基-4-氟-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(320mg,1.08mmol)和diea(0.88ml,5.38mmol)在thf(20ml)中的溶液中加入btc(128mg,0.43mmol)在thf(1ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加3-(叔丁基)吡咯烷盐酸盐(211mg,1.29mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过制备型hplc纯化,得到3-(叔丁基)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吡咯烷-1-甲酰胺(61.4mg,12.6%)。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),7.91(s,1h),7.83(s,1h),7.69(d,j=3.6hz,1h),7.34(dd,j=4.0,8.0hz,1h),7.20(d,j=11.6hz,1h),3.54(t,j=8.4hz,1h),3.44(t,j=8.8hz,1h),3.33-3.30(m,1h),3.05(t,j=10.0hz,1h),2.91(d,j=4.4hz,3h),2.31(s,3h),2.03-2.00(m,4h),1.85-1.79(m,1h),1.62-1.56(m,1h),0.90(s,9h)。ms计算值:450,ms实测值:451([m+h]
+
)。实施例22和23:(r)-2-(叔丁基)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吗啉-4-甲酰胺和(s)-2-(叔丁基)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吗啉-4-甲酰胺的合成步骤1:
[0158]
在0℃下向2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(400mg,1.59mmol)和diea(1.0g,7.75mmol)在thf(20ml)中的溶液中加入btc(191mg,0.64mmol)在thf(5ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加2-(叔丁基)吗啉盐酸盐(344mg,1.91mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(pe:ea=2:1)纯化,得到2-(叔丁基)-n-(2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)吗啉-4-甲酰胺(460mg,62%)。ms计算值:420,ms实测值:421([m+h]
+
)。
步骤2:
[0159]
在室温下向2-(叔丁基)-n-(2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)吗啉-4-甲酰胺(460mg,1.09mmol)和7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(260mg,0.84mmol)在二氧杂环己烷(24ml)和h2o(4ml)中的溶液中加入pd(dppf)cl2(62mg,0.08mmol)和cs2co3(548mg,1.68mmol)。将反应混合物在n2下于70℃搅拌过夜。将反应混合物冷却至室温,用水(50ml)猝灭并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(100%ea)纯化,得到混合物,其通过手性制备型hplc拆分(柱:chiralpak ig 5μm 20*250mm;流动相:hex:etoh=50:50,15ml/min;温度:30℃;波长:254nm),得到两种对映异构体。
[0160]
第一洗脱峰:69.7mg,17.8%,rt=8.216min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.35(s,1h),7.91(s,1h),7.68(br s,1h),7.24-7.19(m,2h),3.98(d,j=12.8hz,1h),3.91-3.85(m,2h),3.41(t,j=11.2hz,1h),2.98-2.84(m,5h),2.64(t,j=12.0hz,1h),2.31(s,3h),2.01(s,3h),0.90(s,9h)。ms计算值:466,ms实测值:467([m+h]
+
)。
[0161]
第二洗脱峰:67.3mg,17.2%,rt=10.798min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.35(s,1h),7.91(s,1h),7.68(br s,1h),7.24-7.19(m,2h),3.98(d,j=12.8hz,1h),3.91-3.85(m,2h),3.41(t,j=11.2hz,1h),2.98-2.84(m,5h),2.64(t,j=12.0hz,1h),2.31(s,3h),2.01(s,3h),0.90(s,9h)。ms计算值:466,ms实测值:467([m+h]
+
)。实施例24:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-1-(三氟甲基)-5,6-二氢咪唑并[1,5-a]吡嗪-7(8h)-甲酰胺的合成步骤1:
[0162]
在0℃下向4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(233mg,1.00mmol)和diea(646mg,5.00mmol)在thf(20ml)中的溶液中加入btc(119mg,0.40mmol)在thf(1ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加1-(三氟甲基)-5,6,7,8-四氢咪唑并[1,5-a]吡嗪(287mg,1.50mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(pe:ea=5:1)纯化,得到n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-1-(三氟甲基)-5,6-二氢咪唑并[1,5-a]吡嗪-7(8h)-甲酰胺(395mg,88%)。ms计算值:450,ms实测值:451([m+h]
+
)。步骤2:
[0163]
在室温下向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-1-(三氟甲基)-5,6-二氢咪唑并[1,5-a]吡嗪-7(8h)-甲酰胺(395mg,0.88mmol)和7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(235mg,0.73mmol)在二氧杂环己
烷(30ml)和h2o(5ml)中的溶液中加入pd(dppf)cl2(53mg,0.07mmol)和cs2co3(476mg,1.46mmol)。将反应混合物在n2下于70℃搅拌16h。将反应混合物冷却至室温,用水(50ml)猝灭并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到呈黄色固体的n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-1-(三氟甲基)-5,6-二氢咪唑并[1,5-a]吡嗪-7(8h)-甲酰胺(136.0mg,37.6%)。1h nmr(400mhz,dmso-d6):δ9.08(s,1h),8.87(s,1h),7.92(s,1h),7.82(s,1h),7.70(br s,1h),7.45(dd,j=2.4,8.4hz,1h),7.30(d,j=2.4hz,1h),7.24(d,j=8.4hz,1h),4.81(s,2h),4.14(t,j=4.8hz,2h),3.89(t,j=5.2hz,2h),2.91(d,j=4.8hz,3h),2.31(s,3h),1.98(s,3h)。ms计算值:496,ms实测值:497([m+h]
+
)。实施例25和26:(r)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(2,2,2-三氟乙基)吗啉-4-甲酰胺和(s)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(2,2,2-三氟乙基)吗啉-4-甲酰胺的合成步骤1:
[0164]
在0℃下向2-氟-4-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(251mg,1.00mmol)和diea(646mg,5.00mmol)在thf(20ml)中的溶液中加入btc(119mg,0.40mmol)在thf(1ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加2-(2,2,2-三氟乙基)吗啉盐酸盐(308mg,1.50mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(pe:ea=2:1)纯化,得到n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-2-(2,2,2-三氟乙基)吗啉-4-甲酰胺(286mg,64%)。ms计算值:428,ms实测值:429([m+h]
+
)。步骤2:
[0165]
在室温下向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-2-(2,2,2-三氟乙基)吗啉-4-甲酰胺(286mg,0.64mmol)和7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(187mg,0.58mmol)在二氧杂环己烷(30ml)和h2o(5ml)中的溶液中加入pd(dppf)cl2(42mg,0.06mmol)和cs2co3(378mg,1.16mmol)。将反应混合物在n2下于70℃搅拌16h。将反应混合物冷却至室温,用水(50ml)猝灭并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到混合物,其通过手性制备型sfc拆分(柱:chiralpak ia 5μm 20*250mm;流动相:co2:ipa:dea=70:30:0.2,50g/min;温度:40℃;波长:230nm),得到两种对映异构体。
[0166]
第一洗脱峰:77.2mg,10.3%,rt=7.28min,ee=97%。1h nmr(400mhz,dmso-d6):δ9.07(s,1h),8.39(s,1h),7.91(s,1h),7.67(br s,1h),7.27-7.20(m,2h),4.00(d,j=13.2hz,1h),3.88-3.85(m,2h),3.69-3.66(m,1h),3.48(t,j=11.2hz,1h),3.29(s,2h),
2.98-2.91(m,4h),2.73-2.67(m,1h),2.31(s,3h),2.01(s,3h)。ms计算值:492,ms实测值:493([m+h]
+
)。
[0167]
第二洗脱峰:91.0mg,12.1%,rt=10.15min,ee=92%。1h nmr(400mhz,dmso-d6):δ9.07(s,1h),8.39(s,1h),7.91(s,1h),7.67(br s,1h),7.27-7.20(m,2h),4.00(d,j=13.2hz,1h),3.88-3.85(m,2h),3.69-3.66(m,1h),3.48(t,j=11.2hz,1h),3.29(s,2h),2.98-2.91(m,4h),2.73-2.67(m,1h),2.31(s,3h),2.01(s,3h)。ms计算值:492,ms实测值:493([m+h]
+
)。实施例27:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-4-(三氟甲基)吡啶酰胺的合成步骤1:
[0168]
在室温下向7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(200mg,0.62mmol)和4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯胺(159mg,0.68mmol)在二氧杂环己烷(30ml)和h2o(5ml)中的溶液中加入pd(dppf)cl2(49mg,0.06mmol)和cs2co3(404mg,1.24mmol)。将反应混合物在n2下于70℃搅拌16h。将反应混合物冷却至室温,用水(30ml)猝灭并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(100%ea)纯化,得到6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(190mg,》100%)。ms计算值:279,ms实测值:280([m+h]+)。步骤2:
[0169]
向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(190mg,0.681mmol)和4-(三氟甲基)吡啶甲酸(143mg,0.74mmol)在dmf(15ml)中的溶液中加入diea(439mg,3.40mmol)和pybop(389mg,0.74mmol)。将反应混合物在室温下搅拌过夜。将反应混合物在真空中浓缩并通过fcc(pe:ea=1:1)纯化,得到n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-4-(三氟甲基)吡啶酰胺(75.5mg,24.4%)。1h nmr(400mhz,dmso-d6):δ10.82(s,1h),9.10(s,1h),9.03(d,j=5.2hz,1h),8.33(s,1h),8.08(dd,j=1.2,5.2hz,1h),7.96(s,1h),7.89(dd,j=2.4,8.4hz,1h),7.79(d,j=2.0hz,1h),7.68(br s,1h),7.37(d,j=8.4hz,1h),2.93(d,j=4.4hz,3h),2.35(s,3h),2.04(s,3h)。ms计算值:452,ms实测值:453([m+h]
+
)。实施例28:(s)-3-(二氟甲氧基)-n-(2-氟-4-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吡咯烷-1-甲酰胺的合成
步骤1:
[0170]
在0℃下向6-(5-氨基-4-氟-2-甲基苯基)-n-(4-甲氧基苄基)-n-甲基吡啶并[2,3-d]嘧啶-2-胺(403mg,1.00mmol)和diea(0.82ml,5.00mmol)在thf(30ml)中的溶液中加入btc(119mg,0.40mmol)在thf(5ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加(s)-3-(二氟甲氧基)吡咯烷的tfa盐(504mg,2.00mmol)。将反应混合物在0℃下搅拌1h。将反应混合物浓缩。残余物通过fcc(100%ea)纯化,得到(s)-3-(二氟甲氧基)-n-(2-氟-5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)吡咯烷-1-甲酰胺(100mg,17.7%)。ms计算值:566,ms实测值:567([m+h]
+
)。步骤2:
[0171]
向(s)-3-(二氟甲氧基)-n-(2-氟-5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)吡咯烷-1-甲酰胺(80mg,0.14mmol)在dcm(5ml)中的溶液中加入tfa(5ml)。将反应混合物在40℃下搅拌4h。将反应混合物冷却至室温并真空浓缩。将残余物溶解于冰水(20ml)中,用饱和碳酸氢钠水溶液碱化至ph 7
–
8,并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过c18柱纯化(乙腈:水=05%至95%),得到(s)-3-(二氟甲氧基)-n-(2-氟-4-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)吡咯烷-1-甲酰胺(5.3mg,7.5%)。1h nmr(400mhz,dmso-d6):δ9.18(s,1h),8.82(d,j=2.0hz,1h),8.20(d,j=2.8hz,1h),8.03(s,1h),7.78(br s,1h),7.47(d,j=8.0hz,1h),7.21(d,j=11.6hz,1h),6.77(t,j=75.6hz,1h),4.85-4.83(m,1h),3.58-3.41(m,4h),2.93(d,j=4.4hz,3h),2.25(s,3h),2.13-2.06(m,2h)。ms计算值:446,ms实测值:447([m+h]
+
)。实施例29:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)苯甲酰胺的合成
步骤1:
[0172]
在室温下向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(250mg,0.896mmol)和3-(三氟甲基)苯甲酸(186mg,0.97mmol)在dmf(5ml)中的溶液中加入diea(574mg,4.45mmol)和pybop(509mg,0.980mmol)。将反应混合物在室温下搅拌过夜。将反应混合物在真空中浓缩并通过fcc(pe:ea=1:1)纯化,得到n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)苯甲酰胺(104.4mg,25.9%)。1h nmr(400mhz,dmso-d6):δ10.48(s,1h),9.10(s,1h),8.29-8.25(m,2h),7.96-7.95(m,2h),7.80-7.75(m,2h),7.68-7.62(m,2h),7.36(d,j=8.4hz,1h),2.93(d,j=4.4hz,3h),2.35(s,3h),2.04(s,3h)。ms计算值:451,ms实测值:452([m+h]
+
)。实施例30和31:(r)-n-(2-氟-4-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺和(s)-n-(2-氟-4-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺的合成步骤1:
[0173]
在0℃下向6-(5-氨基-4-氟-2-甲基苯基)-n-(4-甲氧基苄基)-n-甲基吡啶并[2,3-d]嘧啶-2-胺(600mg,1.48mmol)和diea(1.21ml,7.40mmol)在thf(100ml)中的溶液中加入btc(176mg,0.59mmol)在thf(5ml)中的溶液。将反应混合物在0℃下搅拌30min。然后在0℃下添加3-(2,2,2-三氟乙基)吡咯烷盐酸盐(310mg,1.63mmol)。将反应混合物在0℃至室温下搅拌16hr。将反应混合物浓缩。残余物通过fcc(dcm:meoh=10:1)纯化,得到n-(2-氟-5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(650mg,75%)。ms计算值:582,ms实测值:583([m+h]
+
)。步骤2:
[0174]
将n-(2-氟-5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(1.45g,2.45mmol)在tfa(5ml)中的溶液在50℃下搅拌12h。将反应混合物冷却至室温并真空浓缩。将残余物溶解于冰水(50ml)中,用饱和碳酸氢钠水溶液碱化至ph 7-8,并用dcm(50ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(dcm:meoh=10:1)纯化,得到混合物,其通过手性制备型hplc拆分(柱:chiralpak od-h 5μm 20*250mm;流动相:hex:etoh=70:30,15ml/min;温度:30℃;波长:230nm),得到两种对映异构体。
[0175]
第一洗脱峰:357.7mg,31.1%,rt=11.448min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.18(s,1h),8.82(d,j=2.0hz,1h),8.20(d,j=2.4hz,1h),7.93(s,1h),7.79-7.78(m,1h),7.47(d,j=8.4hz,1h),7.21(d,j=11.6hz,1h),3.69-3.65(m,1h),3.55-3.51(m,
1h),3.35-3.28(m,1h),3.03(t,j=9.2hz,1h),2.94(d,j=4.4hz,3h),2.49-2.38(m,3h),2.25(s,3h),2.10-2.07(m,1h),1.69-1.64(m,1h)。ms计算值:462,ms实测值:463([m+h]
+
)。
[0176]
第二洗脱峰:325.7mg,28.3%,rt=9.801min,ee》98%。1h nmr(400mhz,dmso-d6):δ9.18(s,1h),8.82(d,j=2.0hz,1h),8.20(d,j=2.4hz,1h),7.93(s,1h),7.79-7.78(m,1h),7.47(d,j=8.4hz,1h),7.21(d,j=11.6hz,1h),3.69-3.65(m,1h),3.55-3.51(m,1h),3.35-3.28(m,1h),3.03(t,j=9.2hz,1h),2.94(d,j=4.4hz,3h),2.49-2.38(m,3h),2.25(s,3h),2.10-2.07(m,1h),1.69-1.64(m,1h)。ms计算值:462,ms实测值:463([m+h]
+
)。实施例32:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)苯甲酰胺的合成步骤1:
[0177]
在室温下向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(250mg,0.89mmol)和5-(三氟甲基)烟酸(186mg,0.97mmol)在dmf(5ml)中的溶液中加入diea(574mg,4.45mmol)和pybop(509mg,0.98mmol)。将反应混合物在室温下搅拌过夜。将反应混合物在真空中浓缩并通过fcc(pe:ea=1:1)纯化,得到n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-5-(三氟甲基)烟酰胺(99.5mg,24.6%)。1h nmr(400mhz,dmso-d6):δ10.64(s,1h),9.36(d,j=1.6hz,1h),9.17-9.09(m,2h),8.68(s,1h),7.96(s,1h),7.75(dd,j=2.0,8.0hz,1h),7.68(br s,1h),7.62(d,j=2.0hz,1h),7.38(d,j=8.4hz,1h),2.93(d,j=4.8hz,3h),2.34(s,3h),2.04(s,3h)。ms计算值:452,ms实测值:453([m+h]
+
)。实施例33:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(三氟甲基)苯甲酰胺的合成
步骤1:
[0178]
在室温下向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(186mg,0.66mmol)和3-氯-2-(三氟甲基)异烟酸(150mg,0.66mmol)在dmf(5ml)中的溶液中加入diea(429mg,3.33mmol)和pybop(380mg,0.73mmol)。将反应混合物在室温下搅拌2h。将反应混合物倒入水(10ml)中并用ea(10ml)萃取三次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并真空浓缩,并通过制备型hplc纯化,得到3-氯-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(92.8mg,28.7%)。1h nmr(400mhz,dmso-d6):δ10.85(s,1h),9.09(s,1h),8.83(d,j=4.8hz,1h),8.04(d,j=4.8hz,1h),7.96(s,1h),7.68(br s,1h),7.61-7.56(m,2h),7.38(d,j=8.4hz,1h),2.92(d,j=4.8hz,3h),2.33(s,3h),2.03(s,3h)。ms计算值:486,ms实测值:487([m+h]
+
)。实施例34:2-甲基-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-6-(三氟甲基)异烟酰胺的合成步骤1:
[0179]
向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-2-(三氟甲基)异烟酰胺(500mg,2.22mmol)和2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(1.3ml,4.44mmol)在二氧杂环己烷(50ml)中的溶液中加入cs2co3(1.4g,4.44mmol)和x-phos pd g2(17mg,0.022mmol)。将反应混合物在n2下于120℃搅拌1h。将反应混合物用水(30ml)稀释并用ea(30ml)萃取三次。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过硅胶柱色谱法纯化(100%ea),得到2-甲基-6-(三氟甲基)异烟酸(400mg,88%)。ms计算值:205,ms实测值:206([m+h]
+
)。步骤2:
[0180]
在室温下向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(200mg,0.71mmol)和2-甲基-6-(三氟甲基)异烟酸(176mg,0.85mmol)在dmf(20ml)中的溶液中加入tea(145mg,1.43mmol)和pybop(447mg,0.86mmol)。将反应混合物在室温下搅拌3h。将反应混合物倒入水(10ml)中并用ea(10ml)萃取三次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并真空浓缩,并通过fcc(100%ea)纯化,得到2-甲基-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-6-(三氟甲基)异烟酰胺(129.7mg,38.6%)。1h nmr(400mhz,dmso-d6):δ10.63(s,1h),9.10(s,1h),8.15(s,1h),8.06(s,1h),7.96(s,1h),7.75-7.69(m,2h),7.61(d,j=2.0hz,1h),7.38(d,j=8.4hz,1h),2.92(d,j=4.8hz,3h),2.66(s,3h),2.34(s,3h),2.04(s,3h)。ms计算值:466,ms实测值:467([m+h]
+
)。实施例35:n-(3-(2-(乙基氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0181]
向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-2-(三氟甲基)异烟酰胺(1.4g,3.5mmol)和7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基三氟甲磺酸酯(2.0g,2.9mmol)在二氧杂环己烷(60ml)和h2o(10ml)中的溶液中加入cs2co3(1.9g,5.9mmol)和pd(dppf)cl2(216mg,0.29mmol)。将反应混合物在n2下于70℃搅拌8h。将反应混合物用水(100ml)稀释并用ea(100ml)萃取三次。合并的有机层用盐水(100ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过硅胶柱色谱法纯化(pe:ea=1:1),得到n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(1.61g,58%)。步骤2:
[0182]
将n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(250mg,0.53mmol)在dcm(10ml)中的混合物冷却至-5℃并添加m-cpba(108mg,0.53mmol)。将反应混合物在室温下搅拌2h。向混合物中逐滴加入乙胺(0.8ml)在thf(10ml)中的溶液,将其在40℃下搅拌8h。将反应混合物用水(20ml)稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(3-(2-(乙基氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(121.0mg,48.8%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.10(s,1h),8.99(d,j=5.2hz,1h),8.36(s,1h),8.18(dd,j=0.8,4.8hz,1h),7.95(s,1h),7.76(dd,j=2.0,8.0hz,1h),7.62(d,j=2.0hz,1h),7.38(d,j=8.4hz,1h),3.46-3.39(m,2h),2.33(s,3h),2.04(s,3h),1.20(t,j=7.2hz,3h)。ms计算值:466,ms实测值:467([m+h]
+
)。
(3-(7-乙基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(565.9mg,62%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.09(s,1h),8.98(d,j=4.8hz,1h),8.36(s,1h),8.19-8.18(m,1h),7.94(s,1h),7.76(dd,j=2.4,8.4hz,1h),7.68-7.63(m,2h),7.38(d,j=8.4,1h),2.94(d,j=4.4,3h),2.67-2.57(m,2h),2.03(s,3h),1.14(t,j=7.6hz,3h)。ms计算值:466,ms实测值:467([m+h]+)。实施例37:n-(3-(2-(环丙基氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0187]
在-5℃下向n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(250mg,0.53mmol)在dcm(5ml)中的混合物中加入m-cpba(108mg,0.53mmol)。将反应混合物在室温下搅拌2h。向混合物中逐滴加入环丙胺(91mg,1.59mmol)在thf(5ml)中的溶液,将其在40℃下搅拌8h。将反应混合物用水(20ml)稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(3-(2-(环丙基氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(96.6mg,37.9%)。1h nmr(400mhz,dmso-d6):δ10.70(s,1h),9.12(s,1h),8.99(d,j=4.8hz,1h),8.36(s,1h),8.18(d,j=4.8hz,1h),7.97(s,1h),7.93(d,j=2.0hz,1h),7.76(dd,j=2.0,8.0hz,1h),7.63(d,j=1.6hz,1h),7.39(d,j=8.4hz,1h),2.89-2.86(m,1h),2.35(s,3h),2.04(s,3h),0.76-0.75(m,2h),0.58-0.55(m,2h)。ms计算值:478,ms实测值:479([m+h]
+
)。实施例38:n-(4-甲基-3-(7-甲基-2-((2-吗啉代乙基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺的合成
(吡咯烷-1-基)乙基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(170.5mg,60%)。1h nmr(400mhz,dmso-d6):δ10.70(s,1h),9.11(s,1h),8.99(d,j=5.2hz,1h),8.36(s,1h),8.18(d,j=4.8hz,1h),7.96(s,1h),7.75(dd,j=2.0,8.0hz,1h),7.63-7.60(m,2h),7.39(d,j=8.4hz,1h),3.55-3.52(m,2h),2.71-2.68(m,2h),2.53-2.50(m,4h),2.34(s,3h),2.04(s,3h),1.72-1.68(m,4h)。ms计算值:535,ms实测值:536([m+h]
+
)。实施例40:n-(3-(2-((2-羟基乙基)氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0190]
在-5℃下向n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(250mg,0.53mmol)在dcm(10ml)中的混合物中加入m-cpba(108mg,0.53mmol)。然后将反应混合物在室温下搅拌2h。向混合物中逐滴加入2-氨基乙醇(97mg,1.59mmol)在thf(10ml)中的溶液。将反应混合物在40℃下搅拌8h。将反应混合物用水(20ml)稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(3-(2-((2-羟基乙基)氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(101.5mg,39.5%)。1h nmr(400mhz,dmso-d6):δ10.70(s,1h),9.11(s,1h),8.99(d,j=4.8hz,1h),8.36(s,1h),8.18(d,j=4.0hz,1h),7.96(s,1h),7.75(dd,j=2.0,8.0hz,1h),7.66-7.62(m,2h),7.39(d,j=8.4hz,1h),4.80-4.78(m,1h),3.62-3.60(m,2h),3.51-3.47(m,2h),2.34(s,3h),2.04(s,3h)。ms计算值:482,ms实测值:483([m+h]
+
)。实施例41:3-甲基-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0191]
向3-氯-2-(三氟甲基)异烟酸(330mg,1.46mmol)在dcm(20ml)中的溶液中缓慢加
入一滴dmf和草酰二氯(373mg,2.94mmol)。将反应混合物在室温下搅拌1h。将反应混合物在真空中浓缩。将残余物溶解于meoh(20ml)中,将其在室温下再搅拌1h。将混合物在真空中浓缩。残余物通过fcc(pe:ea=3:1)纯化,得到3-氯-2-(三氟甲基)异烟酸甲酯(300mg,86%)。ms计算值:239,ms实测值:240([m+h]
+
)。步骤2:
[0192]
向3-氯-2-(三氟甲基)异烟酸甲酯(250mg,1.05mmol)和2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(0.6ml,2.10mmol)在二氧杂环己烷(30ml)中的溶液中加入cs2co3(700mg,2.22mmol)和x-phos pd g2(8mg,0.011mmol)。将反应混合物在n2下于120℃搅拌11h。将反应混合物用水(30ml)稀释并用ea(30ml)萃取三次。合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过硅胶柱色谱法纯化(pe:ea=1:1),得到3-甲基-2-(三氟甲基)异烟酸(40mg,2%)。ms计算值:205,ms实测值:206([m+h]
+
)。步骤3:
[0193]
向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(46mg,0.16mmol)和3-甲基-2-(三氟甲基)异烟酸(26mg,0.13mmol)在dmf(4ml)中的溶液中加入tea(36mg,0.36mmol)和pybop(112mg,0.21mmol)。将反应混合物在室温下搅拌3h。将反应混合物倒入水(10ml)中并用ea(10ml)萃取三次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并真空浓缩。残余物通过fcc(100%ea)纯化,得到3-甲基-n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(8.4mg,14%)。1h nmr(400mhz,dmso-d6):δ10.70(s,1h),9.09(s,1h),8.68(d,j=4.8hz,1h),7.96(s,1h),7.80(d,j=5.2hz,1h),7.69-7.59(m,3h),7.36(d,j=8.4hz,1h),2.92(d,j=4.4hz,3h),2.46(d,j=1.6hz,3h),2.33(s,3h),2.03(s,3h)。ms计算值:466,ms实测值:467([m+h]
+
)。实施例42:n-(4-甲基-3-(7-甲基-2-((1-甲基哌啶-4-基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0194]
在-5℃下向n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(250mg,0.53mmol)在dcm(10ml)中的混合物中加入m-cpba(108mg,0.53mmol)。将反应混合物在室温下搅拌2h。向混合物中逐滴加入1-甲基哌啶-4-胺(182mg,1.59mmol)在thf(10ml)中的溶液,将其在40℃下搅拌8h。将反应混合物用水(20ml)
稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(4-甲基-3-(7-甲基-2-((1-甲基哌啶-4-基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(68.7mg,12%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.11(s,1h),8.99(d,j=5.2hz,1h),8.36(s,1h),8.18(dd,j=0.8,4.8hz,1h),7.95(d,j=1.2hz,1h),7.76-7.71(m,2h),7.62(d,j=2.0,hz,1h),7.38(d,j=8.4hz,1h),3.88-3.96(m,1h),2.85-2.82(m,2h),2.34(s,3h),2.29-2.16(m,8h),2.03-1.93(m,2h),1.62-1.59(m,2h)。ms计算值:535,ms实测值:536([m+h]
+
)。实施例43:n-(4-甲基-3-(7-甲基-2-((三氘代甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0195]
在-5℃下向n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(300mg,0.64mmol)在dcm(15ml)中的混合物中加入m-cpba(130mg,0.64mmol)。将反应混合物在室温下搅拌3h。向混合物中加入三氘代甲胺盐酸盐(182mg,1.59mmol)和diea(496mg,3.84mmol),将其在室温下搅拌8h。将反应混合物用水(20ml)稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(4-甲基-3-(7-甲基-2-((三氘代甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(71.5mg,24.6%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.10(s,1h),8.99(d,j=5.2hz,1h),8.36(s,1h),8.18(d,j=5.2hz,1h),7.96(s,1h),7.75(dd,j=2.0,8.0hz,1h),7.66-7.62(m,2h),7.39(d,j=8.4hz,1h),2.34(s,3h),2.04(s,3h)。ms计算值:455,ms实测值:456([m+h]
+
)。实施例44:n-(6-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺的合成
步骤1:
[0196]
在氮气氛下向n-(5-溴-6-甲基吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.0g,2.78mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(777mg,3.06mmol)和koac(545mg,5.56mmol)在二氧杂环己烷(20ml)中的溶液中加入pd(dppf)cl2(203mg,0.28mmol)。然后将反应混合物在氮气氛下于80℃搅拌16h。将反应混合物冷却至室温后,过滤并浓缩,得到n-(6-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.12g,粗品),其不经进一步纯化而用于下一步。ms计算值:406,ms实测值:407([m+h]
+
)。步骤2:
[0197]
在室温和氮气氛下,向n-(4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-3-(三氟甲基)吡咯烷-1-甲酰胺(748mg,2.32mmol)、n-(6-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.1g,2.78mmol)和cs2co3(1.5g,4.64mmol)在二氧杂环己烷(30ml)和水(5ml)中的溶液中加入pd(dppf)cl2(170mg,0.23mmol)。将反应混合物在氮气氛下于70℃搅拌10h。将反应混合物冷却至室温,过滤并浓缩。残余物通过fcc(ea:meoh=20:1)纯化,得到呈黄色固体的n-(6-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(300.5mg,28%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.10(s,1h),8.90(d,j=2.4hz,1h),8.32(s,1h),8.28(d,j=8.0hz,1h),8.05-7.98(m,3h),7.81(t,j=8.0hz,1h),7.74-7.73(m,1h),2.93(d,j=4.8hz,3h),2.36(s,3h),2.25(s,3h)。ms计算值:452,ms实测值:453([m+h]
+
)。实施例45:n-(6-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺的合成步骤1:
[0198]
在室温和氮气氛下,向6-溴-n-(4-甲氧基苄基)-n-甲基吡啶并[2,3-d]嘧啶-2-胺(1.08g,3.00mmol)、n-(6-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.94g,5.99mmol)和cs2co3(1.96g,6.01mmol)在二氧杂环己烷(30ml)和水(5ml)中的溶液中加入pd(dppf)cl2(220mg,0.30mmol)。将反应混合物在氮气氛下于70℃搅拌8h。将反应混合物冷却至室温,过滤并浓缩。残余物通过fcc(ea:pe=1:1)纯化,得到呈黄色固体的n-(5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.2g,71%)。ms计算值:558,ms实测值:559([m+h]+)。步骤2:
[0199]
将n-(5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.2g,2.15mmol)在tfa(12ml)中的溶液在50℃下搅拌过
6-基)-6-甲基吡啶-3-基)-2-(三氟甲基)异烟酰胺(250mg,80%)。ms计算值:559,ms实测值:560([m+h]+)。步骤4:
[0203]
将n-(5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-基)-2-(三氟甲基)异烟酰胺(250mg,0.45mmol)在tfa(2ml)中的溶液在50℃下搅拌8h。将反应混合物冷却至室温并真空浓缩。将残余物溶解于冰水(20ml)中,用饱和碳酸氢钠水溶液碱化至ph=8,并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到呈黄色固体的n-(6-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-2-(三氟甲基)异烟酰胺(41mg,21%)。1h nmr(400mhz,dmso-d6):δ10.94(s,1h),9.22(s,1h),9.02(d,j=4.8hz,1h),8.94(d,j=2.0hz,1h),8.90(d,j=2.4hz,1h),8.40(s,1h),8.34(d,j=2.4hz,1h),8.22(d,j=5.2hz,1h),8.16(d,j=2.4hz,1h),7.87-7.86(m,1h),2.95(d,j=4.8hz,3h),2.51(s,3h)。ms计算值:439,ms实测值:440([m+h]
+
)。实施例47:2-甲基-n-(6-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺的合成步骤1:
[0204]
将5-溴-6-甲基吡啶-3-胺(730mg,3.01mmol)、2-甲基-3-(三氟甲基)苯甲酸(875mg,4.29mmol)、hatu(1.78g,4.68mmol)和diea(2.52g,19.5mmol)在dmf(20ml)中的溶液在室温下搅拌8h。然后将混合物倒入水(60ml)中并用ea(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(ea:pe=1:2)纯化,得到呈黄色固体的n-(5-溴-6-甲基吡啶-3-基)-2-甲基-3-(三氟甲基)苯甲酰胺(1.26g,77%)。ms计算值:372,ms实测值:373([m+h]+)。步骤2:
[0205]
在氮气氛下向n-(5-溴-6-甲基吡啶-3-基)-2-甲基-3-(三氟甲基)苯甲酰胺(1.76g,3.38mmol)、4,4,4',4',5,5,5',5'-八甲基-2,2'-双(1,3,2-二氧杂硼杂环戊烷)(1.03g,4.06mmol)和koac(663mg,6.76mmol)在二氧杂环己烷(20ml)中的溶液中加入pd(dppf)cl2(247mg,0.33mmol)。然后将反应混合物在氮气氛下于80℃搅拌16h。将反应混合物冷却至室温后,过滤并浓缩,得到2-甲基-n-(6-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(1.4g,粗品),其不经进一步纯化而用于下一步。ms计算值:420,ms实测值:421([m+h]
+
)。步骤3:
[0206]
在室温和氮气氛下,向6-溴-n-(4-甲氧基苄基)-n-甲基吡啶并[2,3-d]嘧啶-2-胺(360mg,1.00mmol)、2-甲基-n-(6-甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(714mg,1.70mmol)和cs2co3(652mg,2.00mmol)在二氧杂环己烷(30ml)和水(5ml)中的溶液中加入pd(dppf)cl2(73mg,0.10mmol)。然后将反应混合物在氮气氛下于70℃搅拌8h。将反应混合物冷却至室温,过滤并浓缩。残余物通过fcc(ea:pe=1:1)纯化,得到呈黄色油状物的n-(5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-基)-2-甲基-3-(三氟甲基)苯甲酰胺(300mg,52%)。ms计算值:572,ms实测值:573([m+h]+)。步骤4:
[0207]
将n-(5-(2-((4-甲氧基苄基)(甲基)氨基)吡啶并[2,3-d]嘧啶-6-基)-6-甲基吡啶-3-基)-2-甲基-3-(三氟甲基)苯甲酰胺(300mg,0.52mmol)在tfa(15ml)中的溶液在50℃下搅拌16h。将反应混合物冷却至室温并真空浓缩。将残余物溶解于冰水(20ml)中,用饱和碳酸氢钠水溶液碱化至ph=8,并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到呈黄色固体的2-甲基-n-(6-甲基-5-(2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)吡啶-3-基)-3-(三氟甲基)苯甲酰胺(74.7mg,31%)。1h nmr(400mhz,dmso-d6):δ10.77(s,1h),9.22(s,1h),8.92(s,1h),8.79(d,j=2.0hz,1h),8.33(d,j=2.4hz,1h),8.16(d,j=2.4hz,1h),7.85-7.71(m,3h),7.55(t,j=7.6hz,1h),2.95(d,j=4.4hz,3h),2.48(s,3h),2.47(s,3h)。ms计算值:452,ms实测值:453([m+h]
+
)。实施例48:n-(3-(2-氨基-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0208]
在-5℃下,向n-(4-甲基-3-(7-甲基-2-(甲基硫基)吡啶并[2,3-d]嘧啶-6-基)苯基)-2-(三氟甲基)异烟酰胺(500mg,1.06mmol)在dcm(20ml)中的混合物中加入m-cpba(183mg,1.06mmol)。将反应混合物在室温下搅拌2h。向混合物中逐滴加入pmbnh2(455mg,3.18mmol)在thf(20ml)中的溶液,将其在40℃下搅拌8h。将反应混合物用水(20ml)稀释并用dcm(20ml)萃取四次。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到n-(3-(2-((4-甲氧基苄基)氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(600mg,90%)。ms计算值:558,ms实测值:559([m+h]
+
)。步骤2:
[0209]
将n-(3-(2-((4-甲氧基苄基)氨基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯
基)-2-(三氟甲基)异烟酰胺(250mg,0.45mmol)在tfa(5ml)中的溶液在50℃下搅拌5h。将反应混合物冷却至室温并真空浓缩。将残余物溶解于冰水(20ml)中,用饱和碳酸氢钠水溶液碱化至ph=7,并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到呈白色固体的n-(3-(2-氨基-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(52.8mg,27%)。1h nmr(400mhz,dmso-d6):δ10.69(s,1h),9.13(s,1h),8.98(d,j=5.2hz,1h),8.36(s,1h),8.18(d,j=4.8hz,1h),7.96(s,1h),7.55(dd,j=2.4,8.4hz,1h),7.62(d,j=2.0hz,1h),7.39(d,j=8.8hz,1h),7.16(s,2h),2.33(s,3h),2.01(s,3h)。ms计算值:438,ms实测值:439([m+h]
+
)。实施例49:n-(3-(2-(环丙烷甲酰胺基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺的合成步骤1:
[0210]
在室温下向n-(3-(2-氨基-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(70mg,0.16mmol)在吡啶(10ml)中的溶液中加入环丙烷甲酰氯(33mg,0.32mmol)。将反应混合物在115℃下搅拌4h。将反应混合物冷却至室温并浓缩。残余物通过制备型hplc纯化,得到呈白色固体的n-(3-(2-(环丙烷甲酰胺基)-7-甲基吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基)-2-(三氟甲基)异烟酰胺(8.6mg,11%)。(r)-n-(2-氟-4-甲基-5-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺。1h nmr(400mhz,dmso-d6):δ11.15(s,1h),10.73(s,1h),9.51(s,1h),8.99(d,j=4.8hz,1h),8.36(s,1h),8.26(s,1h),8.19(d,j=5.2hz,1h),7.78(dd,j=2.0,8.0hz,1h),7.68(d,j=2.0hz,1h),7.43(d,j=8.8hz,1h),2.46(s,3h),2.42-2.32(m,1h),2.05(s,3h),0.90-0.88(m,4h)。ms计算值:506,m实测值:507([m+h]
+
)。实施例50:n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-6-(三氟甲基)哒嗪-4-甲酰胺的合成
步骤1:
[0211]
将6-氯哒嗪-4-甲酸甲酯(500mg,2.85mmol)和nai(629mg,4.21mmol)在hi(4ml)中的溶液在50℃下搅拌16h。将反应混合物冷却至室温并用水(30ml)稀释。用饱和碳酸氢钠水溶液将混合物碱化至ph=7并用dcm(20ml*3)萃取。合并的有机层用盐水(20ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过制备型hplc纯化,得到呈灰白色固体的6-碘哒嗪-4-甲酸甲酯(500mg,58%)。ms计算值:264,ms实测值:265([m+h]
+
)。步骤2:
[0212]
将6-碘哒嗪-4-甲酸甲酯(200mg,0.68mmol)和1,10-菲咯啉(cucf3)(211mg,0.68mmol)在dmf(5ml)中的溶液在黑暗中在室温下搅拌1h。将反应混合物用水(20ml)猝灭并用ea(10ml*3)萃取。合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤并浓缩。残余物通过fcc(pe:ea=10:1)纯化,得到呈灰白色固体的6-(三氟甲基)哒嗪-4-甲酸甲酯(50mg,35%)。ms计算值:206,m实测值:207([m+h]
+
)。步骤3:
[0213]
将6-(三氟甲基)哒嗪-4-甲酸甲酯(50mg,0.24mmol)和lioh.h2o(25mg,0.61mmol)在thf(2.5ml)和h2o(2.5ml)中的溶液在室温下搅拌2h。用3m hcl将混合物酸化至ph=5。将混合物过滤并将固体干燥,得到呈灰白色固体的6-(三氟甲基)哒嗪-4-甲酸(46mg,100%)。ms计算值:192,ms实测值:193([m+h]
+
)。步骤4:
[0214]
向6-(5-氨基-2-甲基苯基)-n,7-二甲基吡啶并[2,3-d]嘧啶-2-胺(60mg,0.22mmol)和6-(三氟甲基)哒嗪-4-甲酸(46mg,0.22mmol)在dmf(2ml)中的溶液中加入diea(139mg,1.08mmol)和pybop(111mg,0.22mmol)。将反应混合物在室温下搅拌2h。将反应混合物在真空中浓缩并通过制备型hplc纯化,得到呈灰白色固体的n-(4-甲基-3-(7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基)苯基)-6-(三氟甲基)哒嗪-4-甲酰胺(6.5mg,6.7%)。1h nmr(400mhz,dmso-d6):δ10.87(s,1h),9.91(d,j=1.6hz,1h),9.10(s,1h),8.68(d,j=2.0hz,1h),7.97(s,1h),7.76-7.69(m,2h),7.62(d,j=2.0hz,1h),7.41(d,j=8.4hz,1h),2.93(d,j=4.4hz,3h),2.34(s,3h),2.05(s,3h)。ms计算值:453,ms实测值:454([m+h]
+
)。
[0215]
使用与实施例1和2中描述的程序类似的程序,使用合适的起始材料制备表8中的以下化合物。表8
实施例53:n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺步骤1:n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0216]
在室温下向6-(5-氨基-2-甲基苯基)-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺(3.00g,7.78mmol)和2-(三氟甲基)吡啶-4-甲酸(1.41g,7.39mmol)在mecn(18ml)中的搅拌溶液中分批加入hatu(2.96g,7.78mmol)和tea(1.58g,15.56mmol),搅拌2h。将反应混合物用(200ml)猝灭,并用乙酸乙酯(3x200ml)萃取。合并的有机级分用盐水(200ml)洗涤,经无水硫酸钠干燥并过滤。将滤液减压浓缩,残余物通过硅胶柱色谱法纯化,用pe中的55~70%ea洗脱。将含有所需产物的级分浓缩,得到呈黄色固体的n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(3.1g,74%)。针对c
30h25
f3n6o2[m+h]+的ms esi计算值559.20;实测值559.35。1h-nmr(400mhz,d
6-dmso)δ10.76(s,1h),9.38(s,1h),9.01(d,j=4.8hz,1h),8.95(d,j=2.8hz,1h),8.40(t,j=1.2hz,1h),8.33(d,j=2.8hz,1h),8.23-8.21(m,1h),7.80-7.78(m,2h),7.41(d,j=9.2hz,1h),7.26(s,2h),6.95-6.85(m,2h),5.00(s,2h),3.74(s,3h),3.30-3.19(m,3h),2.31(s,3h)。步骤2:n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0217]
在25摄氏度和氮气氛下向n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(3.10g,5.55mmol)在tfa(80ml)中的搅拌溶液。将所得混合物在室温下搅拌过夜。将反应混合物用nahco3水溶液(200ml)猝灭并用乙酸乙酯(3x200ml)萃取。合并的有机级分用盐水(200ml)洗涤,经无水硫
酸钠干燥并过滤。将滤液减压浓缩,残余物通过硅胶柱色谱法纯化,用pe中的50~70%(etoh/ea=1/3)洗脱。将含有所需产物的级分浓缩,得到2.0g产物。将产物(2.0g)与meoh一起研磨,得到1.6g产物(lcms显示纯度为99%,但是h-nmr显示含有甲醇)。将产物(1.6)在dcm(100ml)中的溶液减压浓缩。将残余物在红外线下干燥,获得n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺(1.4235g,58%)。针对c
22h17
f3n6o[m+h]+的ms esi计算值439.14;实测值439.10。1h-nmr(400mhz,d
6-dmso)δ10.74(s,1h),9.22(s,1h),9.00(d,j=6.4hz,1h),8.89(s,1h),8.38(s,1h),8.28(d,j=3.6hz,1h),8.21(d,j=6.8hz,1h),7.87-7.73(m,3h),7.40(d,j=8.4hz,1h),2.95(d,j=5.6hz,3h),2.29(s,3h)。实施例54和55:(3r)-n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]3(三氟甲基)吡咯烷-1-甲酰胺和(3s)-n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺步骤1:n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺
[0218]
在0摄氏度和氮气氛下,向6-(5-氨基-2-甲基苯基)-n-[(4-甲氧基苯基)甲基]-n-甲基吡啶并[2,3-d]嘧啶-2-胺(0.60g,1.56mmol)在thf(8ml)中的搅拌混合物中加入三光气(185mg,0.62mmol)和diea(1.29ml,7.78mmol)。将混合物在室温下搅拌0.5h。在室温下向上述混合物中加入在thf(2ml)中的3-(三氟甲基)吡咯烷盐酸盐(327.96mg,1.87mmol)。将所得混合物在室温下再搅拌3h。将所得混合物减压浓缩,得到呈棕色油状物的n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(0.600g,粗品)。针对c
29h29
f3n6o2[m+h]
+
的ms esi计算值551.23,实测值551.40。步骤2:n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0219]
在室温下向n-[3-(2-[[(4-甲氧基苯基)甲基](甲基)氨基]吡啶并[2,3-d]嘧啶-6-基)-4-甲基苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(0.600mg,粗品)的混合物中加入三氟乙酸(10ml)。将反应混合物在室温下搅拌16h。将所得混合物减压浓缩。粗产物通过采用以下条件的制备型hplc纯化(柱:xbridge c18 obd prep column,10μm,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内50b至80b;210/254nm;rt:5.23min,得到呈黄色固体的n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(230mg,47%)。针对c
21h21
f3n6o[m+h]
+
的ms esi计算值431.17,实测值431.15.h-nmr(400mhz,d
6-dmso)δ9.22(s,1h),8.85(s,1h),8.33(s,1h),8.24(d,j=2.8hz,1h),7.84(s,1h),7.51-7.47(m,2h),7.23(d,j=8.8hz,1h),3.71-3.64(m,1h),3.58-3.42(m,4h),2.96(d,j=4.7hz,3h),2.24-2.15(m,4h),2.05-1.97(m,1h),1.31-1.22(m,1h)。f-nmr(376mhz,d
6-dmso)δ-69.77(3f)。
[0220]
步骤3:(3r)-n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]3(三氟甲基)吡咯烷-1-甲酰胺和(3s)-n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺
[0221]
(n-[4-甲基-3-[2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(三氟甲基)吡咯烷-1-甲酰胺(230mg)通过采用以下条件的手性-hplc拆分(柱:chiralpak-ad-h-ul001,20x250mm,5um;流动相a:己烷(8mmol/l nh3.meoh),流动相b:ipa;流速:20ml/min;梯度:在35min内30b至30b;220/254nm;
[0222]
第一洗脱峰:rt1:22.991min,106.4mg(46%)黄色固体。针对c
21h21
f3n6o[m+h]
+
的ms esi计算值431.17,实测值431.10.h-nmr(400mhz,d
6-dmso)δ9.23(s,1h),8.86(s,1h),8.34(s,1h),8.27(d,j=2.8hz,1h),7.91(s,1h),7.51(d,j=7.6hz,2h),7.25-7.20(m,1h),3.72-3.67(m,1h),3.58-3.41(m,4h),3.35-3.28(m,1h),2.96(d,j=4.4hz,3h),2.27-2.16(m,4h),2.08-1.99(m,1h)。f-nmr(376mhz,d
6-dmso)δ69.78(3f)。
[0223]
第二洗脱峰:rt2:30.019min,92.1mg,(39%)黄色固体。针对c
21h21
f3n6o[m+h]
+
的ms esi计算值431.17,实测值431.05.h-nmr(400mhz,d
6-dmso)δ9.21(s,1h),8.85(s,1h),8.33(s,1h),8.22(d,j=2.8hz,1h),7.80(s,1h),7.53-7.48(m,2h),7.23(d,j=9.0hz,1h),3.72-3.67(m,1h),3.60-3.41(m,3h),2.95(d,j=4.8hz,3h),2.25-2.16(m,4h),2.09-1.98(m,1h)。f-nmr(376mhz,d
6-dmso)δ69.78(3f)。
[0224]
使用与实施例54和55中描述的程序类似的程序,使用合适的起始材料制备表9中的化合物。表9
实施例64:n-[3-[7-氯-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0225]
将n-[3-[7-羟基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(3.20g,7.04mmol)在pocl3(32.00ml)中的混合物在氮气氛下于100℃搅拌3.5h。将所得混合物减压浓缩。将残余物用etoac(50ml)稀释,并倒入nahco3水溶液(饱和,100ml)中。将所得混合物用etoac(3x100ml)萃取。合并的有机层用盐水(150ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的70%etoac洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-氯-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(1.3g,39%)。针对c
22h16
clf3n6o[m+h]
+
的ms esi计算值473.10,实测值473.15.h-nmr(400mhz,cdcl3)δ8.93-8.80(m,2h),8.66(s,1h),8.21(s,1h),8.04-8.03(m,1h),7.85(s,1h),7.72-7.70(m,1h),7.47(s,1h),7.33-7.26(m,1h),5.70(s,1h),3.18-3.09(m,3h),2.14(s,3h)。实施例65:n-[3-[7-乙烯基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0226]
向n-[3-[7-氯-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.25g,0.53mmol)、1-乙烯基-3,3,4,4-四甲基环戊硼烷(0.48g,3.17mmol)和k2co3(219.21mg,1.59mmol)在acn(5.00ml)和水(5.00ml)中的混合物中加入pd(pph3)4(0.15g,0.13mmol)。将反应混合物用氮气脱气三次并在60℃下搅拌16h。将所得混合物用ea(50ml)稀释。所得混合物用盐水(2x00ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的70%ea洗脱。合并含有所需产物的级分并浓缩,得到约200mg粗产物,将其进一步通过采用以下条件的制备型hplc纯化:xbridge c18 obd prep column,10μm,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内40b至75b。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-乙烯基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.11g,42%)。针对c
24h19
f3n6o[m+h]
+
的ms esi计算值465.16,实测值465.25.h-nmr(400mhz,cd3od)δ9.05(s,1h),8.89(d,j=4.8hz,1h),8.29(s,1h),8.11(d,j=4.8hz,1h),8.01(s,1h),7.76-7.73(m,1h),7.60(d,j=2.0hz,1h),7.37(d,j=8.4hz,1h),6.68-6.56(m,2h),5.57-5.53(m,1h),3.10(s,3h),2.07(s,3h)。实施例66:n-[3-[7-乙基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0227]
向n-[3-[7-乙烯基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(60.00mg,0.13mmol)在etoh(4.00ml)中的溶液中加入pd(oh)2/c(30.00mg)。将反应混合物用氢脱气三次并在室温下搅拌16h。将所得混合物过滤并将滤液减压浓缩。残余物通过采用以下条件的制备型hplc纯化:柱:sunfire prep c18 obd column,19
×
150mm 5um 10nm;流动相a:水(0.1%fa),流动相b:acn;流速:20ml/min;梯度:在4.3min内15b至50b。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-乙基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(20.6mg,34%)。针对c
24h21
f3n6o[m+h]
+
的ms esi计算值467.17,实测值467.25.h-nmr(300mhz,d
6-dmso)δ10.72(s,1h),9.12(s,1h),9.00(d,j=5.1hz,1h),8.38(s,1h),8.20(d,j=4.5hz,1h),7.97(s,1h),7.66-7.65(m,3h),7.40(d,j=8.4hz,1h),2.96(d,j=4.5hz,3h),2.65-2.61(m,2h),2.05(s,3h),1.16(d,j=7.4hz,3h)。实施例67:n-[3-[7-乙炔基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
步骤1:n-[4-甲基-3-[2-(甲基氨基)-7-[2-(三甲基甲硅烷基)乙炔基]吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0228]
在室温下向n-[3-[7-氯-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.30g,0.63mmol)、乙炔基三甲基硅烷(0.19g,1.90mmol)、pd(pph3)2cl2(44.53mg,0.063mmol)和cui(24.17mg,0.13mmol)在dmf(10ml)中的搅拌混合物中逐滴加入tea(1.76ml,17.43mmol)。将反应混合物用氮气脱气三次并在90℃下搅拌2h。所得混合物用水(20ml)稀释并用ea(3x50ml)萃取。合并的有机层用盐水(3x30ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe中的67%ea洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[4-甲基-3-[2-(甲基氨基)-7-[2-(三甲基甲硅烷基)乙炔基]吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺(52mg,14%)。针对c
27h25
f3n6osi[m+h]
+
的ms esi计算值535.18,实测值535.25。步骤2:n-[3-[7-乙炔基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0229]
在0℃和氮气氛下,向n-[4-甲基-3-[2-(甲基氨基)-7-[2-(三甲基甲硅烷基)乙炔基]吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺(52mg,0.097mmol)在thf(2.00ml)中的搅拌溶液中逐滴加入tbaf(0.15ml,0.15mmol)。将反应混合物在氮气氛下于室温搅拌16h。所得混合物用水(10ml)稀释并用ea(3x15ml)萃取。合并的有机层用盐水(2x10ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,
用pe中的70%ea洗脱,得到粗产物,将其进一步通过采用以下条件的制备型hplc纯化:柱:xbridge c18 obd prep column,10μm,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内40b至80b。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-乙炔基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(27.9mg,62%)。针对c
24h17
f3n6o[m+h]
+
的ms esi计算值463.14,实测值463.10.h-nmr(400mhz,d
6-dmso)δ10.71(s,1h),9.19(s,1h),8.99(d,j=5.2hz,1h),8.37(s,1h),8.20-8.17(m,2h),7.93(d,j=4.8hz,1h),7.80-7.77(m,1h),7.68(d,j=2.0hz,1h),7.37(d,j=8.4hz,1h),4.38(s,1h),2.94(d,j=4.4hz,3h),2.12(s,3h)。实施例68:n-[3-[7-甲氧基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0230]
在0℃下向n-[3-[7-氯-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.2g,0.42mmol)在meoh(4.00ml,0.13mmol)中的溶液中加入在meoh(33%)中的甲醇钠(6.41ml,2.12mmol)。将反应混合物在室温下搅拌2h。将所得混合物减压浓缩。将残余物用水(40ml)稀释。所得混合物用etoac(3x40ml)萃取。合并的有机层用盐水(50ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过采用以下条件的制备型hplc纯化:柱:xbridge c18obd prep column,10μm,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内30b至70b。合并含有所需产物的级分并浓缩,得到呈白色固体的n-[3-[7-甲氧基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(81.2mg,39%)。针对c
23h19
f3n6o2[m+h]
+
的ms esi计算值469.15,实测值469.25。1h nmr(400mhz,cdcl3)δ10.70(s,1h),8.98(d,j=5.2hz,2h),8.37(s,1h),8.19(d,j=4.8hz,1h),7.96(s,1h),7.73-7.63(m,3h),7.31(d,j=8.4hz,1h),3.96(s,3h),2.93(s,3h),2.08(s,3h)。
[0231]
使用与实施例68中描述的程序类似的程序,使用合适的起始材料制备表10中的化合物。表10
实施例72:n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺步骤1:n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0232]
将n-[3-[7-羟基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.30g,0.66mmol)在pobr3(1.89g,6.60mmol)中的混合物在氮气氛下于100℃搅拌1h。冷却至0℃后,将所得混合物用饱和nahco3水溶液猝灭。将所得混合物用etoac(3x20ml)萃取。合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用己烷/(etoac:etoh=3:1)=(1:1)洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(0.20g,59%产率)。针对c
22h16
brf3n6o[m+h]
+
的ms esi计算值517.05,519.05;实测值517.15,519.15。步骤2:n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0233]
在室温下向n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(80.00mg,0.16mmol)和锌粉(10.12mg,0.16mmol)、zn(cn)2(10.90mg,0.093mmol)、dppf(34.17mg,0.062mmol)在dma(2.00ml,22.96mmol)中的搅拌混合物中分批加入pd2(dba)3.chcl3(32.01mg,0.031mmol)。将反应混合物用氮气脱气三次并在80℃下搅拌2h。将所得混合物减压浓缩。将残余物用ea(10ml)稀释。将所得混合物用水(3x10ml)和盐水(10ml)洗涤。有机层经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用己烷/etoac(2:1)洗脱,得到178mg呈黄色固体的粗产物。粗产物(178mg)进一步通过采用以下条件的制备型hplc纯化:柱:xbridge shield rp18 obd column,19x250mm,10um;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.5min内60b至75b。合并含有所需产物的级分并浓缩,得到呈黄色固体的n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-2-(三氟甲基)吡啶-4-甲酰胺(25.7mg,36%)。针对c
23h16
f3n7o[m+h]
+
的ms esi计算值464.14;实测值464.20。1h nmr
(400mhz,dmso-d6)δ10.80(s,1h),9.33(s,1h),9.01-8.99(m,1h),8.48-8.44(m,2h),8.40-8.36(m,2h),7.85-7.80(m,2h),7.47-7.40(m,1h),2.97(d,j=4.8hz,3h),2.18(s,3h)。实施例73:n-[4-甲基-3-[2-(甲基氨基)-7-(三氟甲基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺
[0234]
向6-溴-n-甲基-7-(三氟甲基)吡啶并[2,3-d]嘧啶-2-胺(50.00mg,0.16mmol)和n-[4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-2-(三氟甲基)吡啶-4-甲酰胺(99.21mg,0.24mmol)在thf:h2o=10:1(0.55ml)中的混合物中加入xphos联苯基-2-胺氯化钯(ii)(12.81mg,0.016mmol)和k3po4(69.13mg,0.326mmol)。将反应混合物用氮气脱气三次并在60℃下搅拌6h。将所得混合物减压浓缩。将残余物用ea(10ml)稀释。将所得混合物用水(3x10ml)和盐水(10ml)洗涤。有机层经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用pe/ea(2:1)洗脱。合并含有所需产物的级分并浓缩,得到粗产物(98mg)。粗品进一步通过采用以下条件的制备型hplc纯化:柱:xbridge c18 obd prep column,5um,19mm x 250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.3min内68b至90b。合并含有所需产物的级分并浓缩,得到呈灰白色固体的n-[4-甲基-3-[2-(甲基氨基)-7-(三氟甲基)吡啶并[2,3-d]嘧啶-6-基]苯基]-2-(三氟甲基)吡啶-4-甲酰胺(60.0mg,73%)。针对c
23h16
f6n6o[m+h]
+
的ms esi计算值507.13,实测值507.15。1h-nmr(400mhz,dmso-d6)δ10.72(s,1h),9.30(s,1h),8.99-8.98(m,1h),8.36-8.33(m,2h),8.21-8.18(m,2h),7.79-7.77(m,1h),7.68(s,1h),7.39-7.37(m,1h),3.00-2.97(m,3h),2.02(s,3h)。f-nmr(376mhz,dmso-d6)δ-62.71(3f),-66.47(3f)。
[0235]
使用与实施例73中描述的程序类似的程序,使用合适的起始材料制备表11中的化合物。表11
实施例76:4-([4-甲基-3-[7-甲基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]苯基]氨基甲酰基)-2-(三氟甲基)吡啶-1-鎓-1-醇步骤1:4-羧基-2-(三氟甲基)吡啶-1-鎓-1-醇
[0236]
在0℃和氮气氛下,向2-(三氟甲基)吡啶-4-甲酸(1.00g,5.23mmol)和过氧化脲(2.74g,29.09mmol)在dcm(25.00ml)中的搅拌混合物中逐滴加入tfaa(4.05ml,19.267mmol)。将反应混合物在氮气氛下于室温搅拌16h。将所得混合物过滤。将滤饼用dcm(3x5ml)洗涤。将滤液用水(3x20ml)洗涤。合并水层,并用etoac(3x50ml)萃取。合并的有机层经无水na2so4干燥。过滤后,将滤液减压浓缩,得到呈灰白色固体的4-羧基-2-(三氟甲基)吡啶-1-鎓-1-醇(0.49g,45%),其不经进一步纯化直接用于下一步。针对c7h4f3no3[m-h]-的
3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(0.20g,0.49mmol)和6-溴-2-(甲基氨基)-8h-吡啶并[2,3-d]嘧啶-7-酮(0.14g,0.53mmol)、k2co3(0.20g,1.46mmol)在二氧杂环己烷(4.80ml)、h2o(1.20ml)中的搅拌溶液中加入pd(dppf)cl2.ch2cl2(39.62mg,0.05mmol)。将反应混合物用氮气脱气三次并在80℃下搅拌16h。将所得混合物减压浓缩。残余物通过硅胶柱色谱法纯化,用己烷/(etoac:etoh=3:1)(1:1)洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的(3s)-n-[4-甲基-3-[2-(甲基氨基)-7-氧代-8h-吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(0.27g,粗品)。针对c
22h23
f3n6o2[m+h]
+
的ms esi计算值461.18,实测值461.20。步骤2:(3s)-n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺
[0239]
在室温下向(3s)-n-[4-甲基-3-[2-(甲基氨基)-7-氧代-8h-吡啶并[2,3-d]嘧啶-6-基]苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(0.25g,0.54mmol)的混合物中加入pobr3(1.56g,5.43mmol)。将反应混合物在100℃下搅拌1h。将所得混合物在0℃下用nahco3猝灭。将所得混合物用etoac(3x20ml)萃取。合并的有机层用盐水(15ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用己烷/(etoac:etoh=3:1)(1:1)洗脱。合并含有所需产物的级分并浓缩,得到呈黄色固体的(3s)-n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(80mg,28%)。针对c
22h22
brf3n6o[m+h]
+
的ms esi计算值523.10,实测值523.15。步骤3:(3s)-n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺
[0240]
向(3s)-n-[3-[7-溴-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(60.00mg,0.12mmol)、zn(7.50mg,0.12mmol)、dppf(25.33mg,0.05mmol)、zn(cn)2(8.08mg,0.07mmol)在dma(1.50ml)中的搅拌混合物中加入pd2(dba)3.chcl3(23.73mg,0.02mmol)。将反应混合物用氮气脱气三次并在80℃下搅拌2h。将所得混合物过滤。将滤液减压浓缩。残余物通过硅胶柱色谱法纯化,用己烷/(etoac:etoh=3:1)(1:1)洗脱。合并含有所需产物的级分并浓缩,得到粗产物(50mg),其通过采用以下条件的制备型hplc纯化:柱:xbridge c18 obd prep column,10μm,19mm x250mm;流动相a:水(10mmol/l nh4hco3),流动相b:acn;流速:20ml/min;梯度:在5.8min内30b至50b;254/210nm;rt:5.52min。合并含有所需产物的级分并浓缩,得到呈黄色固体的(3s)-n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(2,2,2-三氟乙基)吡咯烷-1-甲酰胺(15mg,28%)。针对c
23h22
f3n7o[m+h]
+
的ms esi计算值470.18,实测值.470.25。1h-nmr(400mhz,d6-dmso)δ9.32(s,1h),8.41(s,1h),8.28-8.25(m,2h),7.58-7.54(m,2h),7.27-7.25(m,1h),3.70-3.66(m,1h),3.56-3.52(m,1h),3.33-3.31(m,1h),3.06-2.96(m,4h),2.51-2.41(m,3h),2.12-2.10(m,4h),1.67-1.61(m,1h)。实施例78:(3r)-n-[3-[7-氰基-2-(甲基氨基)吡啶并[2,3-d]嘧啶-6-基]-4-甲基苯基]-3-(三氟甲氧基)吡咯烷-1-甲酰胺
[0241]
使用与实施例79中描述的程序类似的程序,使用(3r)-n-[4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(三氟甲氧基)吡咯烷-1-甲酰胺代替(3s)-n-[4-甲基-3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]-3-(2,2,2-三氟乙
基)吡咯烷-1-甲酰胺制备标题化合物,得到作为固体的标题化合物。ii.生物学评价实施例1:激酶测定方案
[0242]
蛋白激酶测定:如先前(anastassiadis等人,2011)所述,使用测定平台测量激酶/抑制剂相互作用。简言之,对于每个反应,将激酶和底物在含有20mm hepes(ph 7.5)、10mm mgcl2、1mm egta、0.02%brij35、0.02mg/ml bsa、0.1mm na3vo4、2mm dtt和1%dmso的缓冲液中混合。所有化合物都溶解在dmso中。然后使用echo 550纳升分配器,通过声分配将化合物添加到每个反应混合物中。对于人raf1测试,使用人mek1(k97r)作为底物,浓度为3微摩尔,最终atp浓度为10微摩尔。对于人braf测试,使用人mek1(k97r)作为底物,浓度为1微摩尔,最终atp浓度为25微摩尔。从10微摩尔开始,采用3倍系列稀释,以10剂量ic
50
模式测试化合物。孵育20分钟后,以10mm的最终总浓度添加atp(sigma-aldrich,st.louis,mo 63178)和购自perkinelmer(boston,ma,02118,目录号blu 003h250uc)的[g33p]atp(比活性为10微ci/微升)。反应在室温下进行2小时,然后点样在p81离子交换纤维素色谱纸(reaction biology)上。将滤纸在0.75%磷酸中洗涤以去除未掺入的atp。对每个激酶/抑制剂对计算相对于含媒介物(dmso)激酶反应的剩余激酶活性百分比。使用prism 5(graphpad)计算ic
50
值。
[0243]
示例性化合物的代表性数据在表12中呈现。表12
注意:生化试验ic
50
数据在以下范围内给出:a:≤0.010μm c:》0.100μm至≤1μmb:》0.010μm至≤0.100μmiii.药物剂型的制备实施例1:口服胶囊
[0244]
活性成分是表1的化合物,或其药学上可接受的盐或溶剂化物。通过将1-1000mg活性成分与淀粉或其他合适的粉末掺合物混合来制备用于口服给药的胶囊。将该混合物引入适于口服给药的口服剂量单位如硬明胶胶囊中。实施例2:用于注射的溶液
[0245]
活性成分是表1的化合物或其药学上可接受的盐,并且配制为在芝麻油中浓度为50mg-eq/ml的溶液。
[0246]
本文所述的实施例和实施方案仅用于说明性目的,并且对本领域技术人员而言为提示性的各种修改或变化都将包含在本技术的精神和范围以及所附权利要求书的范围内。
