1.本发明涉及一种调控生物被膜杂合系统改善苹果酸生产性能的策略,属于生物工程技术领域。
背景技术:
2.四碳二羧酸l-苹果酸由于其舒适的酸度和柔软的口感被广泛应用于食品和饮料行业。此外,它还具有非食品应用,如制药、化妆品和常用的化学添加剂。美国能源部已将l-苹果酸指定为最顶级的生物质化学品之一,有望获得更大的市场吸收和应用。
3.目前生产苹果酸的方法主要有(i)设计酿酒酵母中的丙酮酸羧化、草酰乙酸还原和l-苹果酸转运系统以增加l-苹果酸产量;(ii)在黑穗病菌tz1中利用适应性实验室进化和培养基优化实现高细胞密度发酵来合成l-苹果酸;(iii)工程酿酒酵母通过spmae1(p)转运蛋白转运二羧酸,以增加l-苹果酸产量;(iv)在大肠杆菌细胞膜上表面展示cds纳米颗粒以吸收光能,转化成nadh用于l-苹果酸生物合成过程中nadh再生。但是存在含量低、耗时长、污染大的问题。
4.以光驱动纳米材料为基础的生物杂合系统可以通过光照半导体纳米材料实现电子转移,进而改善胞内辅因子的水平。近年来将光照半导体光驱动纳米材料与生物催化代谢相结合的半人工光合作用系统以生物细胞高度成熟的代谢通路为基础,结合纳米光敏材料,可实现高附加值多碳化学品、清洁能源等物质在光能驱动下高效、高特异性的转化。
技术实现要素:
5.为了解决上述问题,本发明通过结合生物被膜杂合系统改善苹果酸生产性能,提供一种高效生产苹果酸的基因工程菌,以及绿色高效的生产苹果酸的方法。
6.本发明的第一个目的是提供一种基因工程菌,所述基因工程菌表达碳酸酐酶ca、磷酸烯醇式丙酮酸激酶pck和苹果酸脱氢酶mdh;所述基因工程菌还表达耦联磷化铟(inp)或硫化镉(cds)的卷曲纤毛纤维形成蛋白csga。
7.在一种实施方式中,编码所述卷曲纤毛纤维形成蛋白csga基因的核苷酸序列如seq id no.1所示;编码碳酸酐酶ca的基因ca的核苷酸序列为seq id no.2所示,编码磷酸烯醇式丙酮酸激酶pck的基因pck的核苷酸序列为seq id no.3所示,编码苹果酸脱氢酶mdh的基因mdh的核苷酸序列为seq id no.4所示。
8.在一种实施方式中,所述编码碳酸酐酶的基因ca、编码磷酸烯醇式丙酮酸激酶的基因pck和编码苹果酸脱氢酶基因mdh受pj23119组成型启动子、fic启动子、bola启动子或s60启动子的调控。
9.在一种实施方式中,所述fic启动子、bola启动子和s60启动子的核苷酸序列如seq id no.5~7所示。
10.在一种实施方式中,所述基因工程菌以大肠杆菌为宿主。
11.在一种实施方式中,所述大肠杆菌包括jm109和f0601。
12.在一种实施方式中,所述大肠杆菌f0601已公开于文章dong,x 1,chen,et al.metabolic engineering of escherichia coli w3110 to produce l-malate[j].biotechnology and bioengineering,2000.(doi:10.1002/bit.26190)
[0013]
本发明的第二个目的是提供一种构建所述基因工程菌的方法,所述方法为先构建过表达苹果酸合成途径的质粒a与过表达卷曲纤毛纤维形成蛋白csga质粒b;随后将质粒a和质粒b共同转入宿主细胞,随后利用磷化铟(inp)或硫化镉(cds)进行苯酚功能化修饰细胞。
[0014]
在一种实施方式中,所述苹果酸合成途径包括碳酸酐酶ca、磷酸烯醇式丙酮酸激酶pck和苹果酸脱氢酶mdh。
[0015]
在一种实施方式中,利用pj01质粒过表达所述碳酸酐酶ca、磷酸烯醇式丙酮酸激酶pck、苹果酸脱氢酶mdh,利用petac质粒过表达卷曲纤毛纤维形成蛋白csga。
[0016]
在一种实施方式中,编码所述卷曲纤毛纤维形成蛋白csga基因的核苷酸序列如seq id no.1所示;编码碳酸酐酶ca的基因ca的核苷酸序列为seq id no.2所示,编码磷酸烯醇式丙酮酸激酶pck的基因pck的核苷酸序列为seq id no.3所示,编码苹果酸脱氢酶mdh的基因mdh的核苷酸序列为seq id no.4所示。
[0017]
在一种实施方式中,所述pj01质粒以质粒petm6r1为基础,在rrnb t1终止子后插入t7te终止子序列,去除sgrna表达框,获得仅含有双终止子和pj23119组成型启动子的质粒pj01。
[0018]
在一种实施方式中,所述pj01的pj23119组成型启动子还可替换为fic启动子、bola启动子或s60启动子。
[0019]
在一种实施方式中,所述fic启动子、bola启动子和s60启动子的核苷酸序列如seq id no.5~7所示。
[0020]
本发明的第三个目的是一种生产苹果酸的方法,所述方法为在光照条件下,利用上述基因工程菌发酵生产苹果酸。
[0021]
在一种实施方式中,所述发酵的培养基包括nbs无机盐培养基。
[0022]
在一种实施方式中,所述摇瓶发酵的条件为35-38℃,200-220rpm,菌株发酵初始od
600
为0.04-0.1,光照48~72h,发酵70-75h。
[0023]
在一种实施方式中,所述发酵罐发酵的条件为35-38℃,480-530rpm,菌株发酵初始od
600
为35~45,装液量为30-50%,ph为6.0-7.0,光照48~72h,通气量为1-2vvm,发酵80-100h。
[0024]
本发明的第四个目的是提供上述的基因工程菌或上述方法在制备苹果酸或下游衍生物中的应用。
[0025]
本发明的第五个目的是提供上述的基因工程菌或上述的方法在生物、制药、食品或化工领域内的应用。
[0026]
有益效果:
[0027]
本发明提供了一种调控生物被膜杂合系统改善苹果酸生产性能的策略,构建有cds-生物杂合系统的菌株有效提高nadh浓度和苹果酸产量,在黑暗条件下,nadh浓度和nadh/nad
+
比例分别降低了32%和39%,l-苹果酸产量和生产强度分别增加到7.77g/l和0.11g/l/h,相比未利用cds-生物杂合系统的菌株,分别增加了27.38%和27.38%。
[0028]
此外,通过替换启动子pj23119为启动子s60以进一步提高苹果酸产量,在光照条件下,l-苹果酸浓度和生产强度分别提高到9.84g/l和0.14g/l/h。5l发酵罐发酵生产该菌株,苹果酸产量达到45.93g/l,具有较好的应用前景。
[0029]
本发明提供的苹果酸合成方法设计简单,系统元件少。通过构建苹果酸生产工程菌株和引入调控基因线路,使得苹果酸产量达到45.93g/l,具有较好的应用前景。
附图说明
[0030]
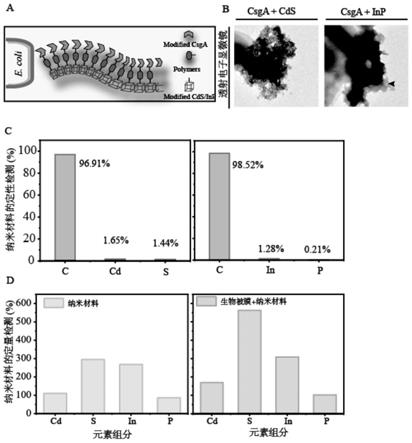
图1:生物被膜杂合系统的表征;a:苯酚功能化修饰生物被膜杂合系统;b:透射电镜确定光捕获纳米材料的有效附着;c:xps对生物被膜生物杂交体系中cd、inp纳米材料的元素组成的定性分析;d:icp-ms对生物被膜生物杂交体系中cd、inp纳米材料的元素组成的定量分析。
[0031]
图2:电子产生的表征;a:刚果红降解实验原理;b:刚果红结合量;c:刚果红降解颜色变化;d:光驱动调控生物被膜的cds-生物杂合系统再生nadh;e:nadh浓度。
[0032]
图3:苹果酸路径及生物被膜杂合系统的整合;a:cds-生物杂合系统在苹果酸合成中的应用;b:nadh代谢分析;c:苹果酸产量。
[0033]
图4:摇瓶及发酵罐中苹果酸的产量;a:工程菌株m2中cd和s的浓度;b:工程菌株m6中丙酮酸/l-苹果酸和nadh的含量比例;c:摇瓶或发酵罐中苹果酸产量情况。
具体实施方式
[0034]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品或者可以通过已知方法制备。
[0035]
下述实施例中涉及到的培养基:
[0036]
种子培养基:lb培养基,成分包含蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l。
[0037]
发酵培养基:nbs无机盐培养基,成分包含葡萄糖50g/l、cacl2·
2h2o 15mg/l、微量元素液0.667ml/l、灭菌后补加mgso4·
7h2o 0.25g/l,v
b1 0.5mg/l,盐酸甜菜碱1mm。微量元素液的配置方法为fecl3·
6h2o 2.4g/l、cocl2·
6h2o 0.3g/l、cucl
2 0.15g/l、zncl2·
4h2o 0.3g/l、namno
4 0.3g/l、h3bo
3 0.075g/l、mncl2·
4h2o 0.5g/l,溶于0.1m hcl中配制。
[0038]
下述实施例中涉及到的方法:
[0039]
(1)细胞形态学参数检测使用荧光显微镜(nikon microscop,80i)进行测定,控制环境温度30度。
[0040]
(2)发酵样品制备:取发酵液样品,12000rpm离心5min,取上清液稀释后,过0.22μm水系膜过滤,滤液作为用来液相色谱分析。
[0041]
(3)苹果酸含量的测定:胞外有机酸分析的液相设备为dionex ultimate 3000series;thermo scientific,waltham,ma,usa,并搭载离子交换柱aminex hpx-87h(300
×
7.8mm,bio-rad,usa),流动相为5mm稀硫酸,柱温设置为35℃,流速控制在0.6ml/min。运用紫外检测器对有机酸浓度进行检测,l-苹果酸检测波长为210nm。
[0042]
(4)刚果红降解实验:(a)生物被膜形成过程:将重组菌株接种于lb培养基,37℃下生长12h,将种子液转接在含有10g/l酪氨酸和1g/l酵母提取物的yesca培养基上,30℃,180rpm;或将细胞接种于甘油培养基中,37℃下生长12h,将种子液转接至m63基本培养基
(添加1mm mgso4和0.2%w/v葡萄糖或0.2%w/v甘油)中,30℃,180rpm。(b)刚果红(cr)降解实验:将100mg的待测样本(cds或步骤(a)重组菌株的湿菌体)加入到200ml的30mg/l刚果红溶液中,置于200ml烧杯中,在300rpm的黑暗条件下搅拌30min,以达到待测样本和刚果红溶液之间的吸附和降解。最终的反应溶液用20w的蓝光板下照射,距离4cm,在反应容器表面提供主要的可见光光源。分别在不同时间间隔(0、10、20、30、45、60min)提取5ml溶液,离心分离cds。采用紫外-可见吸收光谱法测定刚果红浓度。
[0043]
(5)nadh浓度测定:使用碧云天试剂盒(nad
+
/nadh检测试剂盒)测定,具体实施方式参见试剂盒说明书。
[0044]
下述实施例中涉及的质粒及菌株的构建:
[0045]
质粒构建采用经典分子生物手段进行。
[0046]
(1)质粒
[0047]
以质粒petm6r1(见文章:10.1016/j.ymben.2018.04.006)为基础,采用全质粒pcr的方式,在rrnb t1终止子后插入t7te终止子序列,以减少泄露表达;进一步地,采用全质粒pcr的方式,去除sgrna表达框,获得仅含有pj23119组成型启动子和双终止子的工程质粒pj01;
[0048]
以产琥珀酸放线杆菌(actinobacillus succinogenes)基因组(参考文献doi:10.1016/j.ymben.2018.05.007)为模板,设计引物pck f/pck r和mdh f/mdh r,分别扩增获得pck、mdh基因,将pck、mdh两个基因采用多基因一步同源重组的方式,插入至质粒pj01的pj23119启动子后的表达框中,获得pasac-pck-mdh质粒;
[0049]
以相同的方法,以集胞藻(synechocystis sp.)pcc 6803基因组为模板,设计引物ca f/ca r,将ca基因采用基因一步同源重组的方式,插入至质粒pasac-pck-mdh的pj23119启动子后的表达框中,最后组合成重组质粒pasac-ca-pck-mdh。
[0050]
(2)重组菌株
[0051]
m1:将重组质粒pasac-ca-pck-mdh转化f0601菌株中,获得大肠杆菌m1菌株。
[0052]
m2:将重组质粒pasac-ca-pck-mdh和petac-csga转化f0601菌株中,形成大肠杆菌m2菌株,并进行苯酚功能化修饰生物被膜杂合系统。在黑暗条件下进行发酵生产。
[0053]
m3:将重组质粒pasac-ca-pck-mdh和petac-csga电转转入大肠杆菌f0601菌株中,形成大肠杆菌m3菌株,并进行苯酚功能化修饰生物被膜杂合系统。在光照条件下进行发酵生产。
[0054]
m4,m5,m6:以重组质粒pasac-ca-pck-mdh为模板,通过全质粒pcr替换原有启动子,以稳定期启动子fic,bola和s60三个启动子为最终序列,获得不同质粒pfic-ca-pck-mdh,ps60-ca-pck-mdh,pbola-ca-pck-md,并将质粒分别转化至f0601菌株中,获得菌株m4、m5、m6。
[0055]
表1 fic,bola和s60三个启动子序列
[0056]
启动子序列(5
’‑3’
)fictgctctcccggcgtaacccggatttgccgcttatacttgtggcbolataagctgcaatggaaacggtaaaagcggctagtatttaaagggs60ttctgtcatattccctattagctgctatactttaaag
[0057]
表2下述实施例涉及到的引物
[0058]
引物序列(5
’‑3’
)csga fcaccatcaccatcacggatccatgaaacttttaaaagtagcagcaattgcsga rcgaccataacgatgtgcgcgctgccgccgccgccgctpck fataaggaggaataaaccatggggatgactgacttaaacaaactcgpck rtggcgccggtccaaaagcataagtcgacttaaggaggaattcmdh fcactgttgtagagatctgcattaaggaggaattcttatgamdh raaatttgttaccggcgaataagctggtaccatatgggaattcgaca fgacttaaggaggaattcttatgatggggaaaattgaaaaatttgca rtagagtcgggcattgtaacactgttgtagagatctgcattaaggaggaatt
[0059]
实施例1生物被膜杂合系统的构建及表征
[0060]
(1)过表达生物被膜杂合系统
[0061]
以大肠杆菌(escherichia coli)mg1655基因组为模板,设计引物csga f/csga r,扩增获得含有b0034rbs的csga基因,将该片段插入至经bamhi和saci酶切的petac质粒中,获得petac-csga质粒。
[0062]
(2)苯酚功能化修饰生物被膜杂合系统
[0063]
采用苯酚功能化修饰的方法对两种典型的光捕获纳米材料磷化铟(inp)和硫化镉(cds)以及大肠杆菌生物被膜csga进行了修饰(图1a),苯酚功能化修饰的方法可参考文献:10.1126/science.aat9777,具体步骤如下:
[0064]
1)将1mg inp和1mg cds分别与100mm单宁酸、100mm三氧化铁在tris缓冲液(ph 7.4)中混合1-3h,获得苯酚功能化修饰纳米材料;
[0065]
2)将步骤(1)中petac-csga质粒转化至大肠杆菌jm109,37℃,200rpm培养2h获得菌液,将菌液离心与50mm聚烯丙胺盐酸盐混合1-3h,获得功能化细胞;
[0066]
3)吸取5ml步骤1)中的苯酚功能化修饰纳米材料与5ml步骤2)中的功能化细胞混合1-3h,通过三氧化铁的激活构建了生物杂合系统。
[0067]
4)将步骤3)中的生物杂合系统进行纯化,获得cds-生物杂合系统和inp-生物杂合系统。
[0068]
结果如图1所示,(i)通过透射电镜确定,cds和inp纳米材料有效地附着在细胞外生物被膜上(图1b);(ii)通过x射线光电子能谱分析测定(xps),基于生物被膜的生物杂合系统水平的cds和inp纳米材料的定性元素组成分别为s、cd、in和p,含量分别为1.44、1.65、1.28和0.21%(图1c);(iii)采用icp-ms对生物被膜生物杂交体系中cd、inp纳米材料的元素组成进行定量分析,s、cd、in、p的含量分别提高了53.64、112.07、15.58、19.26%,表明cds纳米材料具有较高的生物被膜附着能力(图1d)。基于以上结果,cds纳米材料可以有效地形成基于生物被膜的cds-生物杂合系统。
[0069]
(3)cds-生物杂合系统的验证
[0070]
1)刚果红降解实验
[0071]
刚果红降解实验验证构建的m2(黑暗条件下)和m3菌株(光照条件下),结果如图2a-c所示,光照射下基于生物被膜的cds-生物杂合系统的电子转移,表明cds纳米材料组装后,产生电子可以降解刚果红,其中刚果红的降解率为37.26%。
[0072]
2)nadh浓度测定
[0073]
测定m3菌株的nadh浓度,大肠杆菌m3的nadh浓度比未组装生物被膜cds-生物杂合系统的菌株高45.6%(图2d-e)。综上所述,基于生物被膜的cds-生物杂交系统能够有效再生nadh用于生物制造。
[0074]
实施例2 cds-生物杂交系统在苹果酸合成中的应用
[0075]
(1)摇瓶发酵生产苹果酸
[0076]
摇瓶发酵的条件:将菌株接种于装有50ml发酵培养基的摇瓶中,ph为7.0,温度37℃,200rpm,初始接种od
600
为0.1,光照时间48-72h,发酵72h。
[0077]
构建了一株生产l-苹果酸的工程菌株m1,在其中过表达了l-苹果酸合成途径的ca、pck和mdh基因(图3a)。利用构建的cds-生物杂合系统进行光驱动的nadh再生,形成工程菌株m2(图3a)。然后,对工程菌株m1和m2的nadh代谢进行分析:(1)与工程菌株m1相比,工程菌株m2的nadh浓度和nadh/nad
+
比例分别降低了32%和39%(图3b);(2)在基于生物被膜的生物杂合系统中,工程菌株m2中cd和s的浓度分别为110.2μg/l和295.3μg/l(图4a);(3)工程菌株m2的l-苹果酸产量和生产强度分别增加到7.77g/l和0.11g/l/h,比工程菌株m1分别增加了27.38%和27.38%(图3c)。
[0078]
由此可见,将基于生物被膜的cds-生物杂交系统引入到工程菌株m1中,增加了接触表面,提高了cds和nadh浓度,从而提高l-苹果酸的产量。
[0079]
将不同的稳定期启动子与基于生物被膜的cds-生物杂交系统结合,得到工程菌株m4、工程菌株m5和工程菌株m6。光照条件下,工程菌株m6的cds、nadh浓度分别比黑暗条件下提高了90.28%(cd)、120.27%(s)和83.3%,丙酮酸/l-苹果酸比黑暗条件下降低了31%(图4b)。结果表明,光照条件下工程菌株m6的l-苹果酸浓度和生产强度分别提高到9.84g/l和0.14g/l/h(图4c)。
[0080]
(2)5l发酵罐发酵生产苹果酸
[0081]
将发酵体系扩大到5l发酵罐中,发酵培养基的装载量为3.5l,ph为7.0温度37℃,500rpm,初始接种od
600
为40,通气量1vvm,光照时间48-72h,发酵周期为72h。光照条件下工程菌株m6的l-苹果酸产量提高到45.93g/l(图4c)。
[0082]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
