一种多杀性巴氏杆菌毒素单克隆抗体及其阻断elisa试剂盒
技术领域
1.本发明涉及胸膜肺炎技术领域,具体为一种多杀性巴氏杆菌毒素单克隆抗体及其阻断elisa试剂盒。
背景技术:
2.猪进行性萎缩性鼻炎(progressive atrophic rhinitis,par)属于呼吸系统慢性传染性疾病,世界猪群约25%-50%受到感染;我国由于从国外引进种猪,多渠道将本病传入,造成本病广泛传播流行;其特征为鼻炎,颜面部变形,鼻甲骨尤其是鼻甲骨下卷曲发生萎缩和生长迟缓;其损害呼吸道的正常结构和功能,使猪体抵抗力降低,极易感染其他病原,引起呼吸系统综合征,增加猪的死淘率。
3.产毒素型多杀性巴氏杆菌(toxigenicpasteurellamultocida,t+pm)是一种两极着染的革兰氏阴性短杆菌,是畜禽一种重要的病原菌。多杀性巴氏杆菌为巴氏杆菌科巴氏杆菌属,是革兰氏阴性棒状杆菌;能引起牛、猪、家禽、兔等多种动物传染病,给养殖业造成了巨大损失,同时还可以感染人;产毒素型多杀性巴氏杆菌的toxa基因编码的可分泌的多杀性巴氏杆菌毒素(pasteurella multocida toxin,pmt)是诱发猪进行性萎缩性鼻炎的主要原因之一;多杀性巴氏杆菌毒素其n端具有细胞结合位点,c端是其催化位点,petersen和nielsen发现其c端是免疫原性的必要组成部分。
4.由于elisa操作简便,灵敏性高,而且一次实验可以检测出许多样本等特点,所以针对多杀性巴氏杆菌毒素蛋白及其抗体的检测是目前诊断猪进行性萎缩性鼻炎的重要手段。
5.现有的多杀性巴氏杆菌毒素蛋白及其抗体的检测在操作时,全蛋白易于降解,难以开发试剂盒,且检测方法敏感性和特异性之间存在矛盾,为此,我们提出一种多杀性巴氏杆菌毒素单克隆抗体及包含其的试剂盒。
技术实现要素:
6.鉴于上述和/或现有一种多杀性巴氏杆菌毒素单克隆抗体及其阻断elisa试剂盒中存在的问题,提出了本发明。
7.为解决上述技术问题,根据本发明的一个方面,本发明提供了一种分泌特异性结合多杀性巴氏杆菌毒素单克隆抗体的杂交瘤细胞株,所述杂交瘤细胞株的保藏编号为:cctcc no:c2021111。
8.所述多杀性巴氏杆菌毒素是由产毒素型多杀性巴氏杆菌的toxa基因分泌出的,所述多杀性巴氏杆菌毒素的编码氨基酸序列如seq id no:1所示,所述toxa基因的编码核苷酸序列如seq id no:2所示。
9.本发明还提供了一种特异性结合多杀性巴氏杆菌毒素的单克隆抗体,所述单克隆抗体由上述杂交瘤细胞株分泌产生。
10.本发明还提供了一种检测多杀性巴氏杆菌毒素的阻断elisa试剂盒,所述试剂盒
包括:包被酶标版,辣根过氧化物酶标记的单克隆抗体,所述包被酶标板以多杀性巴氏杆菌毒素c端截短蛋白作为包被抗原,所述单克隆抗体是针对所述多杀性巴氏杆菌毒素c端截短蛋白而制备的抗体;所述单克隆抗体为权利要求1所述的杂交瘤细胞株分泌产生;
11.所述多杀性巴氏杆菌毒素c端截短蛋白的氨基酸序列如seq id no:3所示。
12.优选的,所述试剂盒还包括选自血清稀释液、洗涤液、底物显色液、终止液、标准阳性血清、标准阴性血清中的一种或多种。
13.优选的,所述包被抗原的浓度为0.25μg/ml-2μg/ml。
14.本发明还提供了一种多杀性巴氏杆菌毒素c端截短蛋白,其氨基酸序列如seq id no:3所示,以及多杀性巴氏杆菌毒素c端截短蛋白制备多杀性巴氏杆菌毒素单克隆抗体中的应用。
15.与现有技术相比,本发明具有如下有益效果:
16.单克隆抗体因能够排除包被抗原中杂蛋白成分的干扰而具有良好的特异性,且由于多杀性巴氏杆菌毒素全蛋白不稳定和易降解的特性,采用截短表达的蛋白免疫小鼠制备单抗建立阻断elisa检测方法,解决了全蛋白易于降解,难以开发试剂盒的困境,同时通过单抗解决了检测方法敏感性和特异性之间的矛盾,并为最终疾病学诊断、流行病学调查以及形成诊断试剂盒提供可能。
17.生物保藏说明
18.杂交瘤细胞株3e3于2021年05月11日保藏于中国典型培养物保藏中心,地址为湖北省武汉市武昌区八一路299号武汉大学校内,保藏编号为cctcc no:c2021111。
附图说明
19.图1为本发明的sds-page检测rpmt-c端蛋白的表达及纯化效果图,图中各泳道为:m、预染maker,1、全菌,2、超裂后上清,3、超裂后沉淀,4、纯化后rpmt-c蛋白。
20.图2为本发明的western blot分析单抗3e3反应性图,图中各泳道为:m、预染maker,1、sp2/0上清,2、单抗3e3上清。
21.图3为本发明的sds-page分析纯化抗体图,图中各泳道为:m、预染maker,1、纯化抗体。
22.图4为本发明的标准阳性血清的western blot分析图,图中各泳道为:m、预染maker,1、标准阳性血清,2、空载阴性对照。
具体实施方式
23.下面结合具体实施例来进一步描述本发明,但实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
24.实施例1杂交瘤细胞株及其分泌的单克隆抗体的制备和鉴定
25.1材料和方法
26.1.1菌株、质粒、细胞及实验动物
27.pet32a-toxc质粒由实验室保存,用于表达pmt-c端截短蛋白;复苏保存于实验室
的骨髓瘤细胞sp2/0;细胞融合使用balb/c小鼠及饲养细胞提供的icr小鼠在南京青龙山动物中心订购。
28.其中,toxc基因的编码核苷酸序列如seq id no:4所示。
29.1.2主要实验试剂及耗材
30.购于ge公司的his标签1ml蛋白纯化预装柱;sds-page试剂盒购于雅酶公司;于gibco公司购入rpmi medium 1640 basic(1x);sigma公司购入弗氏完全佐剂(fca)、弗氏不完全佐剂(fia)、peg4000、hat media supplement、ht media supplement;science cell公司出品的fbs血清;购自碧云天公司的tmb显色液和hrp标记山羊抗鼠igg抗体;dmso、吐温-80购于南京翼飞雪生物科技公司;bca蛋白定量试剂盒由康为世纪公司出品;配制lb固体粉末于台湾生工购入;iptg、氨苄青霉素、nad辅酶粉末购于biosharp公司;proteintech公司出品单抗亚型鉴定试剂盒;costar公司购入细胞培养板;其他化学试剂由实验室现用现配,或纯度为分析纯的试剂。
31.1.3重组蛋白的表达及纯化
32.首先将保存于超低温冰柜中含有pet32a-toxc重组质粒的大肠杆菌进行复苏:将该菌三区划线于amp抗性的固体lb平板上37℃培养过夜,挑取单菌落接至3ml的带有氨苄抗性的液体lb中于37℃摇床摇8-12h左右,再按上述操作转接一次得到复苏的重组表达菌,此时可以自行冻存一些新鲜甘油菌便于后续使用。复苏后的菌种接于带有氨苄抗性的300ml的lb液体培养基中37℃摇床摇至od
450nm
值至0.6-0.8。加入iptg诱导(终浓度为1mmol/l),放置于37℃摇床中160r振荡培养,4h后离心富集菌体,经sds-page鉴定目标蛋白以上清形式表达后进行纯化。纯化时所需的试剂及步骤按照说明书和实验室保存的方法,使用ge的his标签的1ml预装镍柱对重组蛋白进行纯化。
33.纯化后再次经过sds-page鉴定纯化效果,若目标条带清晰且杂带较少则可作为免疫原。纯化后的蛋白使用bca法测定浓度后加入蛋白酶抑制剂,若浓度超过1μg/ml则使用50%灭菌后的的甘油稀释至浓度为1μg/ml或以下。
34.其中,rpmt-c端蛋白的氨基酸序列如seq id no:3所示。
35.1.4小鼠免疫
36.使用rpmt-c端截短蛋白皮下多点注射免疫6只balb/c小鼠,另一只作为阴性对照,将阴性对照小鼠尾尖采血分离血清后保存于-80℃冰箱中。其余6只小鼠采用皮下多点注射的方法进行免疫。首次免疫时佐剂使用fca,免疫小鼠的蛋白量为100μg/只。由于存在损耗所以最终使用的蛋白体积要加倍,同时加入与免疫原等体积的fca于匀浆机中进行乳化。乳化后用注射器在水中滴一滴,如果1min内不散开证明乳化成功,可以免疫小鼠。一共需要进行3次免疫,每次免疫间隔2周,除第一次采用fca与蛋白进行乳化,其余均使用等体积蛋白与fia乳化后免疫小鼠即可。三免10天后所有小鼠尾尖采血分离血清,按照倍比稀释法将血清加入已经包被重组蛋白的96孔板中,采用间接elisa方法检测小鼠血清中抗体的效价。选择效价最高且在1:10000以上的一只小鼠在细胞融合前3天进行冲击免疫,注射器吸取50μg的pmt-c端蛋白直接注射入小鼠腹腔,准备细胞融合。
37.1.5间接elisa方法抗体检测
38.1.5.1待检血清的准备
39.尾尖采血的6只小鼠,血液置于37℃温箱孵育30min,转入4℃冰箱中静置过夜,离
心机4000r离心5min吸取上层液体即为待测血清。检测过后如有剩余可转入-80℃冰箱中保存。
40.1.5.2抗原包被板的准备及血清效价测定
41.应用实验室已经建立好的方法,使用0.05mol/l的碳酸盐缓冲液(0.17g无水na2co3和0.28gnahco3加入100ml ddh2o),ph调至9.6后将抗原浓度调整为2μg/ml,使用排枪在每个elisa检测孔中加入100μl的抗原包被液,于37℃温箱中孵育2h后转入4℃冰箱过夜,取出后使用pbst清洗3遍,每次3min。随后每孔分别加入200μl5%的脱脂乳进行封闭,于37℃温箱中静置3h,再弃去脱脂乳,同样按照上述方式使用pbst洗板后拍干。此时可将板子密封放入-80℃中短期保存,检测时将板子拿出后恢复室温即可进行小鼠血清的孵育。效价检测时,将免疫后阳性小鼠血清、未经免疫的小鼠血清用pbst按1:100稀释后加入200μl于第一个孔中,其余每孔均先加入100μlpbst,从第一孔吸取混匀后的液体100μl加入第二个孔,以此类推倍比稀释至第12孔,置于温箱中孵育。1h后弃掉液体洗板,加入hrp标记山羊抗鼠igg抗体,此抗体按照1:250的稀释度用pbst稀释后加入酶标孔中,并于温箱孵育45min后清洗并拍干,100μltmb加入酶标孔进行显色,温箱中避光显色10min,此时去打开酶标仪调至od
450nm
准备读数,显色结束后加入50μl2m硫酸终止液后读数,当p/n值≥2.1即为阳性,血清判定阳性时其最高的稀释度为血清中抗体效价。
42.1.6细胞融合
43.1.6.1材料、仪器及设备、试剂的准备
44.材料:96孔细胞板、提前高压灭菌50ml离心管、纱布、高压灭菌杀鼠器材、10ml玻璃注射器、烧杯、玻璃平皿、封口膜。
45.仪器及设备:水浴锅、离心机、天平、37℃恒温箱。
46.试剂:75%乙醇、100ml纯rpmi 1640培养基(含1%双抗)、100ml hat培养基(1%双抗、2%hat、20%新生胎牛血清,rpmi 1640补至100ml)。
47.1.6.2准备饲养细胞
48.融合前一天取成熟健康的icr小鼠,断颈处死后,浸泡于75%乙醇内5min,置超净台灭菌的玻璃皿内。剖解板子使用75%乙醇消毒后,将其固定在板上,无菌条件下沿其腹中线剪开,钝性分开皮肤与腹膜,充分露出腹部;用无菌注射器吸取适量hat注入小鼠腹腔(注意避免穿入组织内脏),轻揉小鼠腹部后将冲洗过腹部的培养液吸出,并按照此步骤重复一次后补齐40mlhat培养液,充分混匀后加入96孔细胞培养板,100μl/孔,置37℃、5%co2温箱中过夜。第二天观察细胞板底部,如果澄清透明无浑浊,即可进行细胞融合;如果发生污染则按上述步骤重新准备饲养细胞。
49.1.6.3收集骨髓瘤细胞(sp2/0)细胞
50.融合前提前两星期复苏sp2/0细胞,根据细胞生长情况每天换液,并约三天进行一次传代培养,保证融合前有7瓶左右细胞,多余的细胞选择状态较好的可进行冻存。准备融合时,选择形态良好、呈对数生长的sp2/0细胞,用无血清的rpmi 1640洗涤后并吹落,移液至提前高压灭菌的50ml的离心管中,最后用无血清的rpmi 1640补足30ml,1000rpm,离心10min,弃上清,用10ml无血清的rpmi 1640重悬沉淀,放37℃的烧杯中水浴备用。
51.1.6.4收集免疫脾细胞
52.加强免疫后第3天,将免疫小鼠眼球采血并分离血清作为抗体阳性对照,分装后置
于-80℃冰箱中保存。断颈处死的小鼠置75%酒精中浸泡5min后腹部朝上,四肢用大头针固定于灭菌的杀鼠板上,无菌打开腹腔取出脾脏,置盛有5ml无血清的rpmi 1640培养基的玻璃皿中,轻柔洗涤,剥离脾上脂肪后,将其置于高压灭菌后的玻璃培养皿中的滤网里,用针管背部碾碎,使脾细胞充分释放,再用无血清rpmi 1640反复冲洗滤布网,滤液转移到50ml的离心管中,最后用无血清rpmi 1640补足30ml,1000rpm,离心10min,弃上清,用10ml无血清的rpmi 1640重悬沉淀,放入37℃的烧杯中水浴备用。
53.1.6.5细胞融合方法
54.(1)提前30min预热hat及rpmi 1640培养基;分别吸取准备好的脾细胞和sp2/0的细胞悬液,加入50ml离心管内,轻轻混匀。以无血清rpmi 1640将悬液体积补齐至30ml,离心机1000r/min工作10min,将上清尽量弃去。用手指轻柔敲击管底,并且轻轻在超净台边缘扣动底部,使沉淀细胞呈现疏松状态。将离心管放入37℃水浴的烧杯中备用。
55.(2)将含有1ml peg4000的1.5ml离心管置于40℃水浴锅中避光预热,用巴氏吸管吸取1ml的peg4000加入到离心管,边滴加边轻轻搅拌,peg4000平均在45s内加完,加完后轻轻搅拌1min,尽量使peg4000和细胞充分混合。再缓慢加入10ml预热的无血清rpmi 1640,准备四个灭菌小青瓶,分别装入1ml、2ml、3ml、4ml rpmi 1640:第1分钟前30s每2s加一滴,后30s每1s加一滴,第2分钟加入2ml,第3分钟加入3ml,直至加完10ml的1640培养液。于37℃培养箱静置作用10min,1000rpm/min,离心10min,弃上清。
56.(3)加入适量hat培养基,吹吸、重悬融合后的细胞,轻摇使沉淀细胞混合均匀后即可铺板子:第1、2块板子细胞浓度为2.5
×
106个/ml;第3、4块板子细胞浓度为2
×
106个/ml;第5、6块板子细胞浓度为1.5
×
106个/ml。将细胞板移至37℃的co2温箱中进行培养。次日观察板子有无污染现象,若发生污染则用1m naoh封闭该孔及周围4孔。
57.(4)将细胞板放置37℃、5%co2、饱和湿度温箱中培养5-7d后,于显微镜下观察细胞生长状况。并且及时记录每个孔生长细胞团的情况。融合第7-10天,观察孔内是否缺少营养液,若营养液不足,则用hat进行补液。由于未融合的脾细胞也会分泌抗体,所以为了避免假阳性孔干扰后续筛选,可于细胞孔中的细胞团大小约为细胞孔的1/10,或其直径约1-2mm时进行第一次全换液,全换液后第二天,即可对细胞上清抗体效价进行第一次检测。
58.1.6.6分泌抗体的杂交瘤细胞团筛选及亚克隆
59.细胞融合进行一次全换液后即可使用进行间接elisa方法筛选分泌抗体的杂交瘤细胞团。酶标96孔板使用纯化后的rpmt-c端截短蛋白包被,眼球采血分离出的阳性血清按照1:100稀释后做为阳性对照;阴性对照为sp2/0上清。酶标仪设置od
450nm
读数后,当p/n≥2.1时即可判定为阳性。每检测一次都需要对融合后的细胞孔应用hat选择培养基进行全换液,第二天可进行下一次间接elisa筛选克隆团,一般三次检测后均为阳性的克隆团即可判定为真阳性。真阳性孔最后要统一使用同一载体构建出的无关蛋白包被的板子进行无关蛋白筛选,当三次均与免疫原蛋白发生反应且与无关蛋白反应呈阴性的细胞团即可进行后续操作。通过有限稀释将阳性杂交瘤亚克隆至少三遍,并检测上清液。若阳性孔数目较多,则选择p/n数值较大且细胞生长状况较为良好的孔进行接下来的亚克隆操作。
60.本发明亚克隆采用有限稀释法进行操作,前一天饲养细胞的准备方法见1.6.2。当孔内克隆团大小约为整孔的1/4至1/2时,是亚克隆的最佳时期,一般需要进行三次亚克隆才能得到稳定分泌抗体的杂交瘤细胞株,每次亚克隆结束后细胞团长到1/4时吸取上清进
行检测,方法如本实施例的1.6.6分泌抗体的杂交瘤细胞团筛选及亚克隆。每次亚克隆均挑选单个细胞团的阳性孔,亚克隆结束的标志是所有亚克隆的细胞团均为阳性。
61.1.7单抗初步鉴定
62.1.7.1单抗的western blot特异性分析
63.使用实验室购买的蛋白胶试剂盒按照说明配制浓缩胶和12.5%分离胶,将纯化后的pmt-c端蛋白跑电泳:取40μl纯化后蛋白样品与10μl 5
×
loading buffer混匀后100℃水浴10min使蛋白变性;在浓缩胶上样区每孔加入20μl混合物,加两个孔,中间孔内加入预染蛋白marker;电压为时80v开始跑电泳,当样品开始到达分离胶层时可将电压调至120v;电泳结束后采用半干转印仪电压调至23v转印30min,使用丽春红染色转印膜验证转印是否成功后从中间剪开转印膜;准备一个盒子加入5%脱脂乳,对膜进行封闭,2h后使用pbst洗膜;此时将两膜分别加入单抗上清和sp2/0上清室温摇床进行孵育或放置4℃冰箱中过夜;pbst洗涤过后加入按照1:250稀释的hrp标记的羊抗鼠igg二抗室温慢摇孵育45min后洗涤即可曝光。
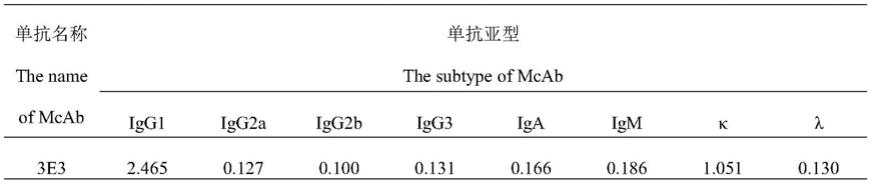
64.1.7.2单抗稳定性分析
65.对第一批制备出的单抗3e3进行稳定性分析,应用间接elisa(参考本实施例的1.5间接elisa方法抗体检测)测定前15代的单抗上清效价。
66.1.7.3单抗亚型鉴定分析
67.根据proteintech kmia-2试剂盒说明书进行操作,具体步骤如下:
68.(1)取3e3细胞上清10μl,1
×
pbst 990μl于1.5ml离心管中混匀后加入板孔中每孔50μl。
69.(2)检测板以50μl/孔的量加入羊抗鼠1
×
igg+iga+igm-hrp。轻轻敲击板架混均匀,室温避光反应1h,后用1
×
pbst洗涤并吸干水分
70.(3)现配的ab液100μl加入其中,避光显色15min
71.(4)终止液100μl终止反应
72.(5)酶标仪读数od
450nm
的数值或按照图例肉眼判定。
73.1.7.4相加实验方法的单抗抗原结合位点分析
74.采用1983年friguet等报告的叠加elisa操作方法来鉴定几株单抗是否针对同一抗原表位。首先采用倍比稀释法测定出9株单抗的饱和工作浓度。判定方法是:随着抗体浓度增加而酶标仪读数od
450nm
的值基本保持不变时,此时的单抗稀释度为饱和工作浓度;然后使用rpmt-c端蛋白包被的elisa板子,一抗为两种不同的mcab各50μl或待测的几种mcab 100μl,其与步骤与1.6间接elisa方法相同,最后显色终止使用酶标仪读数od
450nm
,ai=[2a1+2/(a1+a2)-1]
×
100%可用来计算叠加率:ai代表叠加率,a1+2为加入两种单抗的酶标孔od
450nm
数值,a1和a2表示只加入一种单抗的酶标孔od
450nm
值。判定几株单抗是否针对同一抗原表位的方法是计算得到的ai值是否大于50%。
[0075]
1.8单抗腹水的制备及酶标纯化
[0076]
1.8.1制备腹水
[0077]
选择单抗3e3免疫小鼠制备腹水,新购入的小鼠需要先在动物房饲喂一周左右,避免出现应激反应导致小鼠死亡。在腹腔注射细胞之前需要先使用经高压灭菌后的液体石蜡免疫小鼠使其产生免疫刺激,有利于腹水的产生,每只小鼠500μl,无菌注射器注入小鼠腹
腔,需提前一星期注射。此时可以传代单抗细胞,使其在免疫小鼠时恰好处于对数增长期。注射细胞前使用rpmi1640洗涤细胞两次,并将其细胞弯头吸管吹落后按每只小鼠注射0.5ml的细胞悬液重悬,使用3瓶细胞吹打重悬后的细胞悬液注射5只4周龄雌性balb/c小鼠。注射后每日观察小鼠,观察到其被毛凌乱、腹部
[0078]
胀大、触摸有波动感,此时约1-2周。可用12号针头刺破腹腔采集小鼠腹水,每只小鼠可采2-3次,收集的腹水1000rpm离心10min取上清,分装一部分进行elisa效价检测,其余放置-80℃冰箱保存。
[0079]
1.8.2腹水的纯化及hrp标记
[0080]
收集后的腹水送去生物公司进行纯化和辣根过氧化物酶标记,纯化后sds-page分析后应用间接elisa测定腹水效价。
[0081]
2结果
[0082]
2.1 rpmt-c端蛋白的表达及纯化
[0083]
rpmt-c端蛋白表达后的全菌及超裂后的上清、沉淀和纯化后的蛋白sds-page分析,结果见图1,蛋白大小为67kda。免疫小鼠、包被elisa检测板及后续建立阻断elisa方法均应用纯化后的rpmt-c端截短蛋白。
[0084]
2.2细胞融合、阳性杂交瘤细胞的筛选及亚克隆结果
[0085]
共制备两次单克隆抗体:第一次通过3次亚克隆筛选得到1株单抗,命名为3e3,上清效价为1:6400,经过预实验发现其有阻断效果后进行制备腹水等后续操作;第二次制备单抗时细胞融合率为90%,经过3次亚克隆得到8株单抗,分别命名为4h2、7a3、4h6、11b2、9g1、12f4、8g5和6a3。扩大培养至细胞瓶后第一代上清效价分别为1:12800、1:6400、1:12800、1:12800、1:3200、1:1600、1:800和1:6400。
[0086]
2.3单抗3e3的反应性鉴定
[0087]
由图2可知,单抗3e3上清可与rpmt-c端蛋白发生反应,特异性好,目的条带大小为67kda,同时阴性对照sp2/0上清与重组蛋白不发生特异性反应。
[0088]
2.4单抗3e3免疫球蛋白亚型鉴定
[0089]
亚型鉴定试剂盒鉴定结果表明单抗3e3属igg1、轻链为κ链,见表1。
[0090]
表1 3e3亚型鉴定结果
[0091][0092]
2.5单抗3e3稳定性
[0093]
对单抗3e3进行扩大培养和传代从而进行稳定性分析,选取第1、5、10、15代单抗使用间接elisa方法测定上清中抗体效价,结果表明3e3单抗前10代内稳定性良好,见表2。
[0094]
表2不同代次3e3单抗细胞培养上清效价
[0095][0096][0097]
2.6九株单抗抗原表位针对性
[0098]
应用叠加elisa方法检测后计算9株单抗相互叠加后的ai值,均小于50%,得到结果9株单抗针对同一抗原表位。
[0099]
2.7腹水效价检测及酶标纯化
[0100]
使用浓度为1μg/ml的纯化蛋白包被检测板,间接elisa方法测得纯化后抗体的效价》1:512000;经蛋白电泳鉴定抗体纯化后条带清晰,纯度》85%,表明抗体纯度较高。sds-page结果如图3所示。
[0101]
本实施例共制备两次单抗,得到9株杂交瘤细胞株,分别命名为3e3、4h2、7a3、4h6、11b2、9g1、12f4、8g5和6a3。体外扩大培养后初代上清效价分别为1:12800、1:12800、1:6400、1:12800、1:12800、1:3200、1:1600、1:800和1:6400。
[0102]
单抗3e3经预实验鉴定具有阻断效果,经过western blot分析后知rpmt-c端蛋白可与单抗上清发生特异性反应,不与sp2/0发生反应,表明特异性良好。3e3单抗在体外连续传代至10代时,抗体效价保持不变,能够比较稳定地分泌抗体。单抗亚类鉴定结果表明3e3属于igg1,轻链为κ链。
[0103]
应用单抗3e3免疫小鼠制备腹水,经纯化标记后制成酶标单抗,为建立多杀性巴氏杆菌毒素阻断elisa检测方法提供必要条件。
[0104]
实施例2多杀性巴氏杆菌毒素单抗阻断elisa检测方法的建立
[0105]
1材料和方法
[0106]
1.1实验动物及试剂
[0107]
2只2-3kg新西兰白兔;isa-15a佐剂;实验室中已经构建含质粒的pet32a-toxc的大肠杆菌;酶标抗体3e3;ge公司出品的1ml蛋白纯化预装柱;elisa检测板购于costar公司;tmb显色液购自碧云天生物公司;康为世纪公司购入bca检测试剂盒;其它化学试剂为国产分析纯。
[0108]
本实验室建立的间接elisa方法筛选出临床pmt标准阴性血清;制备的兔多克隆抗体作为标准阳性对照;以及实验室保存的参考阳性血清。
[0109]
1.2抗原蛋白与标准阳性血清的准备
[0110]
1.2.1抗原蛋白的准备
[0111]
将实验室保存的甘油菌复苏后诱导表达pmt-c端蛋白,使用sds-page鉴定诱导效果后进行纯化,再次使用sds-page鉴定纯效果。纯化后的蛋白抗原加入甘油及蛋白酶抑制剂,分装后冻存于超低温冰柜中用于包被检测板及制备标准阳性血清。具体操作见实施例1中的1.3重组蛋白的表达及纯化。
[0112]
1.2.2标准阳性血清的制备
[0113]
提前高压灭菌isa-15a佐剂,且免疫前耳缘静脉采血,分离得到阴性对照血清。每只兔子免疫500μg蛋白,并与isa-15a佐剂按比例充分混匀乳化后制成疫苗。共免疫3次,每次间隔2星期,三免7天后耳缘静脉采血,使用间接elisa检测方法测效价,如果效价较高则可心脏采血分离出血清即为标准阳性对照。
[0114]
1.3酶标单抗的准备
[0115]
用单抗3e3细胞免疫小鼠制备腹水后进行纯化及hrp标记,见实施例1的1.8单抗腹水的制备及酶标纯化。
[0116]
1.4阻断elisa术式
[0117]
将纯化的rpmt-c端蛋白用ph=9.6的碳酸盐,缓冲液稀释后加入酶标板,100μl/孔,37℃包被2h,用pbst加入酶标孔5min洗涤,共三次15min。后加入含有5%脱脂乳的pbst,200μl/孔,37℃温箱2h封闭,洗涤同上。加入pbst稀释的待检血清,100μl/孔,37℃作用1h,洗涤后加入pbst稀释的酶标单抗,100μl/孔,37℃作用1h,洗涤后加入tmb溶液,100μl/孔,37℃显色10min。加入2m硫酸终止液,50μl/孔,用酶标仪读取各孔od
450nm
值,阻断率的公式计算为=(阴性血清od
450nm
值-被检血清od
450nm
值)/阴性血清od
450nm
值
×
100%。
[0118]
1.5阻断elisa最佳反应条件的选择
[0119]
1.5.1包被抗原的浓度与血清最佳稀释比例的筛选
[0120]
采用方阵滴定法进行选择:横向将血清按照五个浓度梯度进行稀释,分别为1:1、1:5、1:10、1:50、1:100;纵向使用ph=9.6的碳酸盐包被液对纯化后的蛋白以2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml的浓度包被在elisa检测板中,血清稀释检测时要做一组重复。后续步骤按照阻断elisa术式进行操作,最后将板条放入酶标仪od
450nm
读数后用公式计算阻断率,pi值最高的即为后续包被抗原浓度和稀释血清的比例。
[0121]
1.5.2封闭液的选择
[0122]
根据本实施例的1.5.1包被抗原的浓度与血清最佳稀释比例的筛选确定的条件包被抗原以及稀释血清后放入37℃条件下孵育2h,pbst洗板后配制5%脱脂乳、0.5%bsa、1%bsa、2%bsa和2%明胶,每种封闭液设置三孔重复后进行后续实验并计算阻断率,计算平均值后选择最佳封闭液,及pi值最大时使用的封闭液。
[0123]
1.5.3封闭时间的选择
[0124]
根据上述筛选确定的封闭液包被检测板,按照1h、2h、3h的时间,每个时间段重复三个孔,置于37℃环境下。计算阳性血清的pi值,选择pi值最大的封闭时间即为最佳时间。
[0125]
1.5.4待测血清最佳孵育时间的筛选
[0126]
待测血清按照上述筛选出的最佳稀释度进行稀释,elisa检测板用确定好的抗原浓度包被和封闭后,稀释后血清加入elisa检测板中置于温箱分别孵育0.5h、1.0h、1.5h、2h,每个时间重复三组,计算pi值,选择pi值最大时候的血清作用时间即为最佳时间。
[0127]
1.5.5酶标单抗最佳作用浓度的选择
[0128]
将制备好的3e3 hrp-mcab用pbst分别按照1:500、1:1000、1:1500、1:2000的稀释度进行稀释并且作用于按上述筛选好条件包被的elisa检测板,重复三孔后计算阻断率,选择pi值最大时候的酶标单抗稀释度即为最佳浓度。
[0129]
1.5.6酶标单抗最佳孵育时间的选择
[0130]
按照上述确定好的最佳稀释度将酶标单抗进行稀释后,置于37℃温箱中分别孵育0.5h、1.0h、1.5h、2.0h,每个时间均需做三组重复,计算pi值,选择pi值最大时候的酶标单抗作用时间即为最佳时间。
[0131]
1.5.7 tmb显色液最佳作用时间的筛选
[0132]
使用tmb显色液与底物作用,时间分别为5min、10min、15min、20min,均置于37℃温箱中进行孵育后计算标准血清的pi值,可确定最佳显色时间。
[0133]
1.6阻断elisa临界值的确定
[0134]
按照实验室已经建立的pmt间接elisa检测方法经过数次筛选后得到50份阴性血清,按照本实施例的1.5阻断elisa最佳反应条件的选择确定的最佳阻断elisa反应条件进行阴性血清平均值(x)、标准差(sd)和阻断率(pi)的计算,当pi≥x+3sd,待测样品判定阳性;当pi《x+2sd,待测样品判定阴性;pi介于两者之间,血清检测结果可疑。
[0135]
1.7阻断elisa的重复性实验
[0136]
1.6.1批内重复实验
[0137]
控制包被elisa板条的蛋白为同一批次纯化所得,经过最佳条件包被封闭之后选取临床上阴性弱阳性和强阳性3种血清每种血清进行5次重复实验后计算出阻断率,根据pi值计算变异系数cv,由此可知批内重复性是否良好。
[0138]
1.7.2批间重复实验
[0139]
包被elisa板条的抗原为5个批次不同时间纯化得到的蛋白,经过最佳条件包被封闭后,在临床上筛选得到阴性弱阳性和强阳性3种血清均进行5次重复实验后计算出阻断率,根据pi值计算变异系数cv,由此可知该方法批间重复性是否良好。
[0140]
1.8阻断elisa的敏感性实验
[0141]
以上述筛选后确定的阻断elisa检测方法对临床74份pmt阳性血清进行检测,计算出使用阻断elisa方法检测血清后的判定结果,即为敏感性实验。
[0142]
1.9阻断elisa的特异性实验
[0143]
取实验室保存的猪圆环病毒、支气管败血性波氏杆菌、副猪嗜血杆菌、伪狂犬病毒、猪繁殖与呼吸综合征、猪瘟病毒、非洲猪瘟病毒猪阳性血清,应用阻断elisa方法进行检测,进行阴阳性的判定来确定该检测方法的特异性是否良好。
[0144]
1.10阻断elisa的应用
[0145]
选取实验室保存的华东六省一市部分猪场的血清共266份,应用阻断elisa检测方法对样本进行检测并计算阳性率。
[0146]
2结果
[0147]
2.1 rpmt-c端蛋白的诱导表达及纯化
[0148]
蛋白诱导表达及纯化后的sds-page分析如图1所示。
[0149]
2.2单抗3e3的纯化及酶标
[0150]
单抗3e3制备腹水酶标纯化后的sds-page分析如图3所示。
[0151]
2.3标准阳性血清的鉴定
[0152]
使用纯化后的rpmt-c端蛋白免疫白兔后分离血清制备多抗,即可作为标准阳性对照。western-blot对其进行分析,发现在67kda出有目的条带出现,而空载体对照中67kda处并无目的条带出现,证明多抗制备成功,可以用作标准阳性对照,如图4所示。
[0153]
2.4阻断elisa的最佳反应条件
[0154]
2.4.1包被抗原浓度与血清最佳稀释比例的筛选
[0155]
矩阵法滴定可以将抗原包被浓度与血清最佳稀释比例进行综合评定,由表3可得,pmt-c端蛋白的以2μg/ml包被elisa检测板,待检样品的稀释度是1:1时,pi值最大。
[0156]
表3包被抗原浓度与血清最佳稀释比例的筛选
[0157][0158]
2.4.2最佳封闭液的筛选
[0159]
当elisa板条使用2%的bsa封闭孵育时,pi值结果最优,如表4所示,因此该方法选择2%的bsa作为封闭液。
[0160]
表4最佳封闭液的筛选
[0161][0162]
2.4.3最佳封闭时间的筛选
[0163]
见表5经过实验可得,当封闭时间为3h时,经过计算pi值达到最优,所以选择3h为阻断elisa检测方法的封闭时间
[0164]
表5最佳封闭时间的筛选
[0165][0166]
2.4.4待测血清最佳作用时间的筛选
[0167]
如表6所示,当待测血清与elisa板条于37℃作用时间为30min,pi值最大,所以选择待测血清最佳作用时间为0.5h。
[0168]
表6待测血清最佳作用时间的筛选
[0169][0170]
2.4.5酶标单抗最佳作用浓度的筛选
[0171]
对酶标单抗进行不同比例的稀释后进行孵育,如表7可知,当酶标单抗稀释度为1:2000时,阻断率最大。
[0172]
表7酶标单抗最佳作用浓度的筛选
[0173][0174][0175]
2.4.6酶标单抗最佳作用时间的筛选
[0176]
对酶标单抗按照1:2000稀释度稀释后,以不同时间孵育在酶标板上,如表8可知,
当酶标单抗孵育时间为0.5h时,pi最大。
[0177]
表8酶标单抗最佳作用时间的筛选
[0178][0179]
2.4.7 tmb最佳作用时间的筛选
[0180]
如表9可得,当显色时间为10min和20min时,pi值基本相同,所以选择显色时间为10min为阻断elisa检测方法的最佳tmb作用时间。
[0181]
表9 tmb显色液最佳作用时间的筛选
[0182][0183]
2.5阻断elisa的临界值
[0184]
阻断elisa临界值判定的结果如表10,对临床50份已经确定为阴性的血清进行检测,根据公式计算得到阴性血清临界值为44.89%;阳性血清临界值51.51%;pi值介于二者之间时为可疑。
[0185]
表10阻断elisa临界值的结果
[0186]
[0187][0188]
2.6阻断elisa的重复性实验
[0189]
如表11、表12可得,批内与批间重复实验中变异系数均小于10%,表明实验的重复性较好。
[0190]
表11批内重复实验结果
[0191][0192]
表12批间重复实验结果
[0193][0194]
2.7阻断elisa的敏感性实验
[0195]
自临床中筛选得到74份阳性血清,用阻断elisa检测其阴阳性,有7份血清显示阴性或者可疑,重复检测结果不变,经过计算得知敏感性为90.5%。
[0196]
2.8阻断elisa的特异性实验
[0197]
用rpmt-c端蛋白包被酶标板,应用建立的阻断elisa检测方法对临床上几种参考的阳性血清进行检测,结果如表13,其他疾病的阳性血清均显示为阴性,证明该方法特异性优良。同时应用该方法检测临床上50份阴性血清,结果显示均为阴性,表明该方法相对特异性良好。
[0198]
表13阻断elisa的交叉反应实验结果
[0199][0200][0201]
2.9阻断elisa对临床血清样品的检测
[0202]
应用阻断elisa方法对华东六省一市部分猪场血清进行检测(表14),阳性率为
16.16%。其中福建省某猪场检测阳性率高达76.47%,就检测结果可知,所有地区均检测出阳性血清,可知各猪场均存在猪群t+pm感染。
[0203]
表14阻断elisa对临床部分样品的检测
[0204][0205]
本实施例已经成功建立了多杀性巴氏杆菌毒素阻断elisa检测方法,确定了阴性血清临界值为44.89%;阳性血清临界值为51.51%;44.89%《pi《51.51%时为可疑。elisa的灵敏度为90.5%,特异性优良。
[0206]
在重复性测试中,批内和批间变异系数均《10%。应用该方法对华东六省一市部分猪场血清进行检测,血清阳性检出率为16.16%。
[0207]
本发明实施例利用pmt特异性单克隆抗体建立了高效、灵敏的阻断elisa方法。
[0208]
本发明实施例建立了以rpmt-c端蛋白作为包被抗原,hrp-3e3单抗作为检测抗体的阻断elisa方法。确定本方法的判定标准,验证了敏感性和特异性,并证明该方法可用于临床检测。
[0209]
本发明的阻断elisa试剂盒,使用辣根过氧化物酶标记的多杀性巴氏杆菌毒素单克隆抗体作为阻断抗体,由于单克隆抗体具有非常良好的特异性,该试剂盒比以间接elisa方法具有更好的特异性。
[0210]
本发明的试剂盒用于检测多杀性巴氏杆菌毒素,具有高效、灵敏特异性和重复性均良好的优点,适合于在临床应用中进行推广,为猪进行性萎缩性鼻炎的快速检测提供可靠的技术手段。
[0211]
虽然在上文中已经参考实施方式对本发明进行了描述,然而在不脱离本发明的范围的情况下,可以对其进行各种改进并且可以用等效物替换其中的部件。尤其是,只要不存
在结构冲突,本发明所披露的实施方式中的各项特征均可通过任意方式相互结合起来使用,在本说明书中未对这些组合的情况进行穷举性的描述仅仅是出于省略篇幅和节约资源的考虑。因此,本发明并不局限于文中公开的特定实施方式,而是包括落入权利要求的范围内的所有技术方案。
