一种与稻瘟菌籼粳来源性状连锁的snp分子标记及其应用
技术领域
1.本发明涉及一种用于区分稻瘟菌来源的分子标记以应用,特别涉及一种与稻瘟菌籼粳来源性状连锁的snp分子标记及其应用,属于分子生物学领域。
背景技术:
2.稻瘟病是威胁全球水稻生产的重要病害,每年因为稻瘟病造成水稻的损失可以为 6000万人提供粮食。目前主栽的水稻一般分为籼稻和粳稻。在我国,黑龙江、辽宁等北方地区主栽粳稻,湖南、江苏等南方区为籼稻区。由于主栽稻籼、粳亚种的差异,造成了稻瘟菌对籼粳稻的侵染出现了分化。粳稻来源的稻瘟菌一般只能侵染粳稻,不能侵染籼稻;而籼稻来源的稻瘟菌既可以侵染籼稻也可以侵染粳稻。稻瘟菌遗传资源丰富,变异速度快,菌株多样性程度高,通过形态学观察是无法区分菌株的籼、粳寄主来源,只能根据的感病水稻的籼、粳亚型区分。但是,这种区分方式是以寄主发病为前提,已经造成了重要损失。因此,利用分子检测方法,对空气或者田间稻瘟菌侵染类型进行监测,为准确预测稻瘟菌侵染类型提供有效手段。
3.虽然稻瘟菌出现籼、粳寄主特异性,但是形成的籼、粳侵染菌株分类地位仍属于同一物种,遗传差异不明显,通过传统的分子标记如its,ssr等不能有效地进行区分。因此,利用全基因组测序的方式,对籼、粳稻瘟菌群体进行全基因组分析,筛选出特异性强的分子标记,有利于准确判断稻瘟菌的籼、粳寄主来源。
技术实现要素:
4.本发明的目的在于提供一种与籼、粳水稻来源性状连锁的snp分子标记及其应用,以解决上述背景技术中提出的问题。
5.为实现上述目的,本发明提供如下技术方案:本发明一方面是提供一种与稻瘟菌籼粳来源性状连锁的snp分子标记,其序列为seq id no.1。
6.进一步地,所述的seq id no.1所示序列自5'端起第1804位碱基为snp位点,所述的snp位点位于稻瘟菌基因组第2染色体8019142bp位核苷酸,所述的snp位点的碱基为a或g。
7.优选地,所述的snp分子标记所对应的特异性引物为:
8.正向引物:5
’‑
tctaaacacgtgcctctgacc-3’9.反向引物:5
’‑
tgcacccgttgaagtctgaa-3’。
10.本发明还保护区分稻瘟菌来源的方法,其包括以下步骤:
11.1)提取待检稻瘟菌dna,
12.2)利用上述所述的引物对步骤1)中的dna序列进行扩增,
13.3)对步骤2)得到的扩增产物进行测序,据snp位点的碱基可判断稻瘟菌来源,所述的snp位点碱基为a时,所检测的稻瘟菌来源为籼稻,snp位点的碱基为g时,所检测的稻瘟菌来源为粳稻。
14.本发明还保护利用上述方法鉴定稻瘟菌籼、粳来源的应用,所述的snp分子标记用于鉴定籼稻来源的稻瘟菌和粳稻来源的稻瘟菌。
15.本发明还保护用于鉴定稻瘟菌籼、粳来源的试剂盒,其特征在于,所述试剂盒包含上述所述的引物对。
16.与现有技术相比,本发明的有益效果是:
17.本发明可以通过该分子标记利用pcr技术检测快速鉴定来源籼型水稻或粳型水稻的稻瘟菌,所筛选的特异性引物对于快速区分稻瘟菌从籼、粳稻来源可进行良好分型,检测方法简单易行,准确率高(几乎100%)。本发明提供的分子标记物可以准确鉴定稻瘟菌的籼、粳稻寄主来源,为研究稻瘟菌寄主专化性机制、稻瘟病预测预报和水稻主栽品种布局提供方法依据。
附图说明
18.图1为本分子标记的位置图;
19.图2为来源不同籼粳水稻的稻瘟菌的序列测序结果的图。
具体实施方式
20.为了进一步理解本发明,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。如无特殊说明,本发明实施例中所涉及的试剂均为市售产品,均可以通过商业渠道购买获得。
21.实施例
22.一、snp分子标记的获得
23.利用二代基因组测序方法对采自云南粳稻和籼稻种植区的各10株稻瘟菌进行全基因组测序,将测序结果与稻瘟菌参考基因组70-15进行对比,获得菌株snp信息。对同一基因的编码区序列在不同菌株中非同义替换率和同义替换率的比值(dn/ds)进行了计算,筛选出 dn/ds》1的候选基因,使用应用分子进化程序包paml中的codeml程序对候选基因分析,发现基因mgg_12478受到强烈的籼、粳分化正选择压力。将该基因序列在测序菌株进一步比较发现,对候选基因在籼、粳来源的稻瘟菌群体中进行比对发现,该基因所在的第2染色体 8019142bp位的碱基为a时,所检测的稻瘟菌来源为籼稻;而该基因所在的第2染色体 8019142bp位的碱基为为g时,所检测的稻瘟菌来源为粳稻。
24.二、验证分子标记区分稻瘟菌籼粳来源
25.1、籼粳水稻种植区稻瘟菌的分离、培养
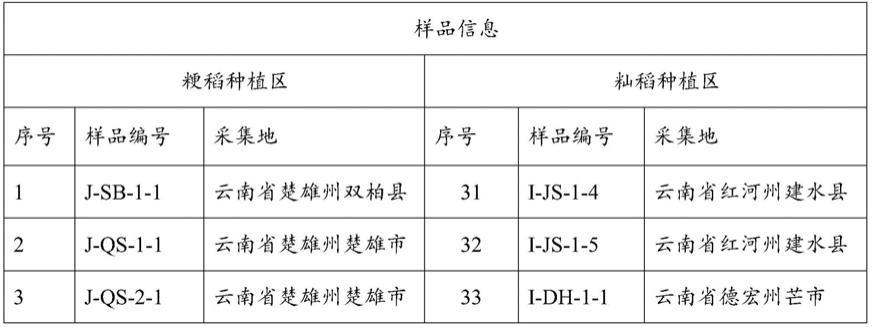
26.采集籼、粳水稻种植区的稻瘟病发病叶片,保湿黑暗培养24小时后,将叶片病斑部位孢子涂在2%水琼脂培养基(琼脂2g,蒸馏水100ml)。在显微镜下使用接种针挑取单胞置于新的pda培养基(马铃薯200g,葡萄糖20g,琼脂15g,蒸馏水1000ml)。将单胞培养24小时后,在显微镜下观察孢子是否萌发,培养基是否污染,萌发且没有被污染的孢子再培养7天,用于菌株的dna提取。共获得53个来源不同籼、粳稻病斑的稻瘟菌,具体信息见表1。
27.表1稻瘟菌样品采集信息
28.[0029][0030]
[0031]
2、稻瘟菌dna的提取
[0032]
使用灭菌的牙签单孢分离的稻瘟菌菌丝转移至含有石英砂的1.5ml离心管中,使用研钵棒将菌丝组织细胞磨碎。在离心管中加入500μl 1%ctab提取液,充分震荡后,置于 65℃水浴锅中,水浴1小时。水浴完成后,静置至室温,加入500μl氯仿异戊醇混合液(体积比:25:1),震荡混匀后,12000rpm离心10分钟后,吸200μl上清液移至新的1.5ml 离心管中,加入200μl异丙醇,震荡混匀后,离心2分钟,转速为12000rpm。离心完成后,弃上清,加入75%乙醇溶液,12000rpm离心2分钟后,弃上清,再加入75%乙醇溶液12000rpm离心2分钟后,弃上清。将含有dna的离心管放在超净工作台上,吹无菌风。待离心管完全干燥后,加入50μl超纯水,溶解dna,保存在4℃冰箱,用于后续目的片段扩增。
[0033]
3、序列的扩增
[0034]
设计特异性引物(正向引物:5
’‑
cttcaggtgccacacgggcg-3’;反向引物:5
’ꢀ‑
ttcgcttgaatgtggaggct-3’),其系列如seq id no.2和seq id no.3所示,利用pcr方法,扩增含有本发明分子标记物序列的片段。pcr反应液成分如下:
[0035][0036][0037]
4、扩增片段的测序
[0038]
使用sanger测序方法对扩增片段进行测序。测序结果中,结果表明,当snp标记的 snp位点的碱基为a时,包含该snp标记的稻瘟菌来源为籼稻;而当snp标记的snp位点的碱基
为g时,包含该snp标记的稻瘟菌来源为粳稻。所述的测序结果见表2和图2。
[0039]
表2检测验证样品测序结果
[0040]
[0041][0042]
结果发现:利用本发明分子标记和特异性引物鉴定60个样品的稻瘟病菌籼粳来源与采集地所种植的水稻籼粳一致,鉴定成功率达100%。
