与猪肌肉滴水损失性状关联的snp分子标记及其应用
技术领域
1.本技术涉及猪肌肉滴水损失分子标记技术领域,尤其涉及与猪肌肉滴水损失性状关联的snp分子标记及其应用。
背景技术:
2.猪肉的持水力(whc,water holding capacity)是指当肌肉受到如加压、切碎、加热、冷冻、贮存、加工等外力作用时,对其组织内水分的保持能力或向其中添加水分时的水合能力。猪肉的持水力是衡量其品质和经济价值的一项重要指标。如果肌肉的持水力差,从家畜屠宰后到肉被烹饪前的一段时间内,肉会因失水而导致失重,造成经济损失。
3.现有技术常用滴水损失(dl,drip loss)度量持水力,实质是指在不施加任何外力,只受重力作用下,蛋白质系统的液体损失量,或称贮存损失和自由滴水。dl测定值与持水力呈负相关,即滴水损失越大,则肌肉的系水力越差,滴水损失越小,则肌肉系水力越好。滴水损失能较好地模拟鲜肉在自然吊挂以及贮存销售过程中水分的流失状况,更能反应生产过程中水分的流失状况。
4.现有技术中已经发现了mamstr基因rs337473375位点、ryr1基因g.1843c》t位点和phkg1基因的rs697732005位点是影响苏淮猪肉滴水损失的候选基因位点,可作为降低苏淮猪肉滴水损失的潜在分子标记。另外,有文献公开,fastkd2及mdh1b基因进行cdna测序发现两个错义突变位点,其中fastkd2中错义突变snp g.6742g》a的次等位基因频率为0.4,它与糖原含量、滴水损失关联分析所得p值分别为4.47
×
10-4
、5.37
×
10-4
,其亦可以作为种猪肉质选育的一个分子标记。
5.由此可见,滴水损失性状关联所涉及基因庞杂,继续深入研究和探索与其相关联的基因及多态性位点仍然具有十分现实的意义。
技术实现要素:
6.有鉴于此,本技术的目的在于至少提供一种有别现有技术的不同基因或位点的分子标记,以为丰富和探索猪滴水损失性状关联的基因以及为高质量肉质猪品系选育提供帮助。
7.第一方面,本技术实施例公开了一种大白猪肌肉滴水损失关联的snp分子标记,所述snp分子标记为猪基因hoxa5内含子变体多态性核苷酸位点rs81470247,该位点上下游100bp的核苷酸序列如seq id no.1所示,该序列的第101位处的碱基是t或g,导致多态性。
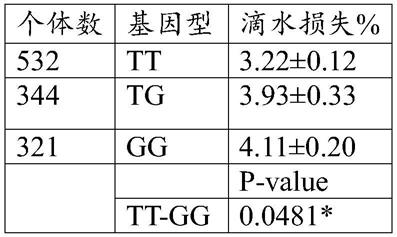
8.在本技术实施例中,基因型为tt的个体肌肉滴水损失比例显著低于基因型tg和gg的个体。
9.第二方面,本技术实施例公开了用于pcr扩增第一方面的snp分子标记相关序列的引物对,具有如seq id no.2~3所示的核苷酸序列。
10.第三方面,本技术实施例公开了一种检测与大白猪肌肉滴水损失性状相关snp分子标记的方法,包括pcr扩增seq id no.1所示的序列,并对扩增产物进行测序,判断序列第
101位碱基处的多态性。
11.具体的实施例中,所述方法包括如下步骤:
12.取大白猪的组织样品,并提取总dna;
13.用已提取的总dna为模板,使用如seq id no.2~3所示的引物进行pcr扩增;
14.对所述扩增的产物进行测序,根据测序结果,判读在seq id no.1所示序列第101位的t/g多态性。
15.第四方面,本技术实施例公开了一种筛选低肌肉滴水损失的大白猪品系的方法,包括检测猪基因hoxa5内含子变体多态性核苷酸位点rs81470247的基因型,选育基因型为tt的个体为种猪。
16.第五方面,本技术实施例公开了第一方面的snp分子标记、或第二方面的引物对在大白猪低肌肉滴水损失品系育种、优质猪肉选育或含量检测中的应用。
17.与现有技术相比,本技术至少具有以下有益效果:
18.本技术实施例发现了与大白猪肌肉滴水损失相关联的snp位点,开发了用于该位点的引物对;并以此建立了通过鉴定该snp标记来筛选低滴水损失的大白猪品系的方法,为选育低滴水损失大白猪品系、优质猪肉选育或含量检测提供帮助,具有重要的食用价值、经济效益与社会价值。
附图说明
19.图1为本技术实施例提供的与大白猪肌肉滴水损失性状相关联分子标记的曼哈顿图;图中,水平线以上代表有关联的标记,由此说明,该分子标记位于大白猪第18号染色体上。
20.图2为本请实施例提供的大白猪基因组dna的凝胶电泳图,m泳道表示10000bp marker分子量标准,1、2泳道表示提取的基因组dna,其中,10000bp marker分子量条带,从上到下依次为10000bp、7000bp、4000bp、2000bp、1000bp、500bp、200bp。
21.图3为本请实施例提供的所筛选的分子标记所在dna片段的凝胶电泳图,m泳道表示1000bp marker分子量标准,1-3泳道表示不同退火温度所扩增的dna产物,退火温度依次为:55℃、58℃、60℃。其中,1000bp marker分子量条带,从上到下依次为1000bp、700bp、500bp、400bp、300bp、200bp、100bp。
22.图4为本请实施例提供的snp突变位点的序列比对分型图,其中箭头处表示突变位点。
具体实施方式
23.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
24.一、试验样品采集
25.实验猪群来自湖北某种猪场的1197头纯种大白猪公猪(已阉割,体重为90kg左右)。猪群自由采食、饮水,整个饲喂方式、饲养条件等始终保持一致,为常规方法。
26.在屠宰前,采集所有试验猪的耳组织样品,放入75%乙醇中保存,为提取猪基因组
dna备用,具体方法参照北京天根生化技术有限公司生产的基因组dna试剂盒提供的说明书。
27.屠宰完后,从胸、腰椎间砍断脊柱与眼肌。然后切取左半胴体背最长肌为肉样,用于肌肉品质测定。
28.二、猪背最长肌滴水损失测定
29.猪宰后2h以内,切取厚约8cm肉块,剔除肉块外周肌膜,顺肉块纤维走向修整成4个大小为2
×2×
2cm3的试样;将测定管编号,放入试管架中;称量试样放入前的质量记为m1;将测定管2~4℃放置48h,取出试样,用滤纸轻轻吸干表层残留液体,称量试样放入后的质量记为m2;同一样品测定4个试样,用平均值表述测定结果。
30.三、猪基因组dna的提取与检测
31.本试验采用北京天根生化技术有限公司生产的基因组dna试剂盒(tianamp genomic dna kit)从猪耳组织中提取猪基因组dna,具体操作步骤如下:
32.1)用酒精消毒后的眼科手术剪,将猪耳样剪成糊状,加200μl缓冲液ga,振荡至彻底悬浮。
33.2)加入20μl蛋白酶k溶液,混匀,置于56℃水浴锅消化过夜。
34.3)加入200μl缓冲液gb,充分颠倒混匀,70℃放置10分钟,待溶液变清亮,短暂离心以去除管盖内壁的水珠。
35.4)加入200μl无水乙醇,充分振荡混匀15s,此时可能会出现絮状沉淀,短暂离心以去除管盖内壁的水珠。
36.5)将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12000rpm离心30s,倒掉废液,将吸附柱cb3放回收集管中。
37.6)向吸附柱cb3中加入500μl缓冲液gd,12000rpm离心30s,倒掉废液,将吸附柱cb3放入收集管中。
38.7)向吸附柱cb3中加入600μl漂洗液pw,12000rpm离心30s,倒掉废液,将吸附柱cb3放入收集管中。
39.8)重复操作步骤7。
40.9)将吸附柱cb3放回收集管中,12000rpm离心2min,倒掉废液,将吸附柱cb3置于室温放置数分钟,彻底晾干吸附材料中残余的漂洗液。
41.10)将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200μl洗脱缓冲液te,室温放置2~5min,12000rpm离心2min,将溶液收集到离心管中。
42.11)取2μl上一步所得溶液dna溶液和1μl加样缓冲液混匀,上样在1.2%的琼脂糖凝胶,120v电压电泳20min左右,紫外灯下观测电泳结果并拍照,以判断dna的完整性。
43.12)用nanodrop 2000核酸蛋白分析仪(thermo fisher scientific,usa)对提取后的dna进行质量检测,a260/a280的比值在1.7~2.1之间,a260/a230在1.8~2.2之间被判定为合格。对合格的dna进行浓度测定,然后将浓度统一稀释至200ng/μl,放入-20℃的冰箱存放。不合格的dna样品则需要重新提取。取50-100ng,提取后的dna进行2%琼脂糖凝胶电泳检测,成像仪下观察结果,条带集中且明亮认为提取效果很好,电泳图见图2。
44.四、snp芯片基因型判定及基因型数据的质控
45.将1197头大白猪猪耳样中提取的基因组dna样品在illumina公司研制的
porcinesnp60 beadchip 6全基因组芯片上杂交。该芯片中包含61565个snp位点。采用plink软件对所有个体的原始基因型数据进行质控检验,以snp基因型检出率(snp call rate)》90%、最小等位基因频率(minor allele frequency,maf)》0.01、哈代-温伯格平衡(hardy-weinberg equilibrium,hwe)检验的p值《10-6
以及样本检出率(sample call rate)》90%等指标为标准。
46.五、数据整理与分析
47.1)表型数据分析
48.利用r统计分析软件,对猪肌肉滴水损失测定值进行描述性统计分析,包括计算该性状的平均值、标准差、最大值和最小值。
49.2)全基因组关联分析
50.采用plink软件,进行gwas分析。发明人运用下述混合模型分析数据。
51.模型为:yij=μ+gi+εij
52.其中,yij为处理后的性状值;μ为每个性状的均值;gi为基因型效应;εij为随机效应。
53.3)检验snp与性状关联的显著性。
54.当某个snp符合p《10-4
条件时,表示snp与性状关联程度达到了显著水平。
55.4)snp注释
56.根据芯片snp信息,在ensembl网站(www.ensembl.org)的sus scrofa buid 11.1数据库中,运用variant effect predictor工具,注释该snp,即确定snp位点所在染色体及其在染色体上的物理位置,并由此确定这些显著snps在ensembl数据库中已知基因的内部还是侧翼区域内。然后利用生物信息学方法,根据ensembl、ncbi(www.ncbi.nlm.nih.gov)、david
57.(david.abcc.ncifcrf.gov)等提供的基因结构、基因类型、基因功能和通路等信息,对目标区域内的基因进行功能注释。最后通过qtldb(cn.animalgenome.org/cgi-bin/qtldb/index)网站检索该位点是否落在已报道的与肉质性状有关的qtls中,进一步确定与大白猪肌肉滴水损失相关联的snps。
58.六、结果分析
59.如图1,通过曼哈顿图可以看出,该snp位于18号染色体上,为探讨影响猪肌肉滴水损失的因素及其进一步应用与提高肉质品质提供了新的遗传基础。
60.表1
[0061][0062]
[0063]
进一步对第18号染色体猪基因hoxa5内含子变体多态性rs81470247(asga0080065)基因型与大白猪肌肉滴水损失性状相关联分子标记进行研究,结果如表1所示。表1中,其中,注:p<0.05(*)为差异显著;p<0.01(**)为差异极显著。结果表明在1197个个体中tt基因型有532个,tg基因型有344个,gg基因型有321个。对于大白猪肌肉滴水损失性状,基因型为tg的个体滴水损失极显著高于tt基因型个体,基因型为gg的个体滴水损失显著高于tt基因型个体,基因型tg的个体滴水损失与gg个体间无显著差异。由此说明,t是有利于大白猪肌肉滴水损失的等位基因,并且说明猪基因hoxa5内含子变体多态性rs81470247(asga0080065)位点存在与猪滴水损失性状关联的snp位点。
[0064]
七、该snp位点的检测
[0065]
为此,本技术实施例还公开了检测与大白猪肌内脂肪含量相关联的snp分子标记的方法,所述方法包括以下步骤提取待测猪基因组dna,对该dna样本进行pcr扩增,并对pcr扩增产物进行测序,根据测序结果判读猪seq id no.1所示序列中第101位的核苷酸位点的多态性。
[0066]
其中,pcr扩增过程具体为:
[0067]
用已提取的dna为模板,根据所设计的引物,进行pcr扩增:取dna模板1μl、seq id no.2和seq id no.3所示的引物各0.5μl、pcr mix试剂10μl(2
×
m5 taq hifi pcr mix,mei5bio);设置pcr扩增体系:94℃,3min;30cycles(94℃,25s;55~60℃,25s;72℃,10s);72℃,5min;4℃,∞;
[0068]
pcr产物在2%琼脂糖凝胶中电泳检测,扩增的目的片段大小约585bp,电泳图见图3,将剩余的扩增产物进行测序,测序结果用snapgene软件与genbank中猪的相关基因片段进行序列比对、分析,判读rs81470247(asga0080065)位点的基因型,基因分型峰图见图4,由此表明该snp分子标记及引物序列可检测出tt、tt或tg基因型。
[0069]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
