1.本发明涉及牦牛育种技术领域,具体地,涉及一种评估、检测和/预测耗牛的牛肉品质性状的方法。
背景技术:
2.牦牛属于大型反刍动物,体格高大、被毛厚密,心肺功能发达,抗逆性强,是唯一起源于青藏高原且在高海拔地区繁衍至今的珍稀牛种。具有高海拔地区适应能力强、耐粗饲、抗寒耐劳等优良特性。与普通黄牛肉相比,牦牛肉的蛋白质含量高达22.52%,脂肪含量约为3.15%,且矿物质元素含量丰富,氨基酸结构比例更与人体相近,有着较高的营养价值与经济价值。截至2019年全世界牦牛总数量约为1700万头,其中中国牦牛存栏数为1600多万头,占90%以上,主要分布于青海,四川,西藏等地区。牦牛肉的高经济价值,改善了人们的生活环境与膳食结构,因此推动牦牛产业的发展,对加强经济建设有着重要意义。单核苷酸多态性(single nucleotide polymorphism,snp)是基因组水平上单个核苷酸变异所导致的dna碱基序列的多态性,可用于快速基因型分型,是研究遗传育种相关的分子标记常用的技术之一。
3.动物屠宰后由于机体组织细胞中糖酵解速度加快,造成乳酸含量迅速积累,导致肌肉组织的ph值改变。肌肉组织的ph值可直接影响肉质性状,例如牛肉的嫩度、肉色、系水力等相关指标,因此,宰后的ph值是衡量肉质性状的重要指标。宰前牛肉多为中性ph值,随着宰后时间的增加,ph值下降,从而导致肉色变差,系水力下降,肉品质降低。宰后肌肉若能较长时间维持较高的ph值,则说明肌肉嫩度高,肉用品质好。对于相关的肉品质性状,例如背膘厚,其直接与动物机体脂肪的蓄积能力有关,脂肪积累多,背膘脂肪含量高,脂肪累积量低,瘦肉率高,即背膘脂肪含量低。所以一般来说,背膘厚不低于3mm较为理想。
4.酰基辅酶a硫脂酶(acyl-coa thioeaterase,acot)是一种水解酶,可催化酯酰辅酶a水解成自由脂肪酸和辅酶a,广泛存在于哺乳动物组织中。目前已知的acot家族成员有15个家族成员,根据酶的相对分子质量大致被分为ⅰ型和ⅱ型,两种类型的acot无结构相似性和序列同源性,因此被称为类似物而非同系物。ⅰ型和ⅱ型acot均含有保守的催化三联体氨基酸序列,该序列在催化反应和调节酶活性中发挥重要作用。酰基辅酶a硫脂酶12(acyl-coathioeaterase 12,acot12)是acot家族ⅱ型酶成员之一,主要在肝、肾和小肠中表达。acot12基因相关的研究主要集中在小鼠、大鼠和人上,有研究表明(t m,f i,y n,et al.physiological changes in the activities of extramitochondrial acetyl-coa hydrolase in the liver of rats under various metabolic conditions[j].european journal of biochemistry/febs,1985,152(2):331-336.),在大鼠中饥饿和过氧化物酶体增值无在内的代谢刺激可诱导acot12的表达,再次喂食和施加胰岛素可降低acot12的表达。而acot12基因与牦牛相关的研究未见报道。
技术实现要素:
[0005]
本发明的目的是为了克服现有技术的上述不足,提供一种评估、检测和/预测耗牛的牛肉品质性状的方法。
[0006]
本发明的第一个目的是提供一种评估、检测和/预测耗牛的牛肉品质性状的试剂。
[0007]
本发明的第二个目的是提供另一种评估、检测和/预测耗牛的牛肉品质性状的试剂。
[0008]
本发明的第三个目的是提供所述的试剂在评估、检测和/预测耗牛的牛肉品质性状中的应用。
[0009]
本发明的第四个目的是提供一种评估、检测和/预测耗牛的牛肉品质性状的方法。
[0010]
本发明的第五个目的是提供另一种评估、检测和/预测耗牛的牛肉品质性状的方法。
[0011]
本发明的第六个目的是提供所述的试剂在制备评估、检测和/预测耗牛的牛肉品质性状的试剂盒中的应用。
[0012]
本发明的第七个目的是提供一种评估、检测和/预测耗牛的牛肉品质性状的试剂盒。
[0013]
本发明的第八个目的是提供所述试剂、所述另一试剂、所述方法、所述另一方法、和所述的试剂盒的任意一个或几个在耗牛的牛肉品质性状育种中的应用。
[0014]
为了实现上述目的,本发明是通过以下方案予以实现的:
[0015]
本发明对102头四川牦牛acot12基因的多态性进行研究,使用haploview4.2软件对acot12基因的多态性位点进行连锁不平衡分析,并通过spss 23.0软件分析acot12基因的snps位点及其单倍型与肉品质性状的相关性。发现了四川牦牛acot12基因的外显子1上共存在3个snps位点,分别为e1-285 t》c、e1-603t》a、e1-675 c》g,其中e1-603t》a、e1-675 c》g位点分别与ph
45min
值、背膘厚性状显著相关(p《0.05),说明以上2个snps可作为四川牦牛宰后ph
45min
和背膘厚性状的相关分子标记;h2h2单倍型组合的宰后ph
45min
值显著高于其余h1h4单倍型组合,因此可作为四川牦牛宰后ph
45min
值性状的最优单倍型组合,为未来优质肉牛早期选育提供分子理论依据。
[0016]
因此本发明要求保护以下内容:
[0017]
一种评估、检测和/预测耗牛的牛肉品质性状的试剂,所述试剂检测snp位点1、snp位点2和snp位点3的基因型:
[0018]
snp位点1位于nc_037334.1:81354300,即ars-ucd1.2版牛基因组的第7染色体的第81354300位,snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位;
[0019]
snp位点1的基因型为tt、snp位点2的基因型为aa、且snp位点3的基因型为cc的个体的ph
45min
值显著高于snp位点1的基因型为tc、snp位点2的基因型为tt且snp位点3的基因型为cc的个体。
[0020]
以及,一种评估、检测和/预测耗牛的牛肉品质性状的试剂,所述试剂检测snp位点2和/或snp位点3的基因型:
[0021]
snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的
第81353982位,tt基因型个体的ph 45min
值显著低于ta、aa基因型个体;
[0022]
snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位,cg基因型个体的背膘厚显著高于cc基因型个体。
[0023]
优选地,述试剂为核苷酸序列如seq id no:1~2所示的引物。
[0024]
上游引物f:5
′‑
atgggaggagtgattgc-3
′
(seq id no:1),
[0025]
下游引物r:5
′‑
cctgacttctgccttactga-3
′
(seq id no:2)。
[0026]
还要求保护所述的试剂在评估、检测和/预测耗牛的牛肉品质性状中的应用。
[0027]
以及,一种评估、检测和/预测耗牛的牛肉品质性状中的方法,检测snp位点1、snp位点2和snp位点3的基因的基因型,
[0028]
snp位点1位于nc_037334.1:81354300,即ars-ucd1.2版牛基因组的第7染色体的第81354300位,snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位;
[0029]
snp位点1的基因型为tt、snp位点2的基因型为aa、且snp位点3的基因型为cc的个体的ph
45min
值显著高于snp位点1的基因型为tc、snp位点2的基因型为tt且snp位点3的基因型为cc的个体。
[0030]
以及,一种评估、检测和/预测耗牛的牛肉品质性状中的方法,检测snp位点2和/或snp位点3;
[0031]
snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,tt基因型个体的ph 45min
值显著低于ta、aa基因型个体;
[0032]
snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位,cg基因型个体的背膘厚显著高于cc基因型个体。
[0033]
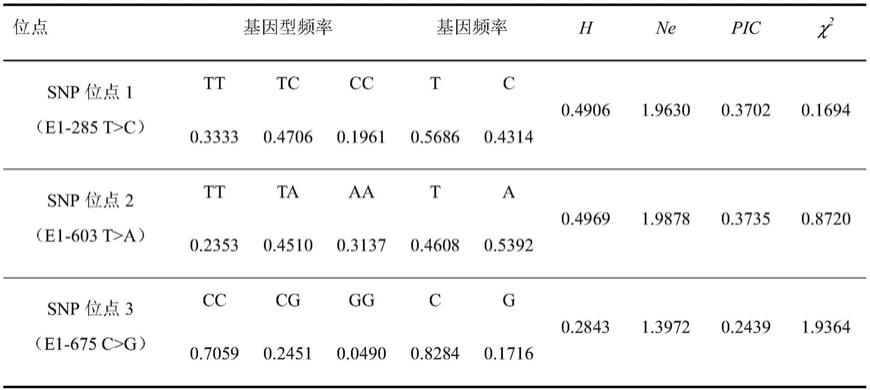
优选地,使用核苷酸序列如seq id no:1~2所示的引物检测。
[0034]
本发明要求保护所述的试剂在制备评估、检测和/预测耗牛的牛肉品质性状的试剂盒中的应用。
[0035]
以及,一种评估、检测和/预测耗牛的牛肉品质性状的试剂盒,含有以上任一所述试剂。
[0036]
优选地,所述试剂为核苷酸序列如seq id no:1~2所示的引物。
[0037]
更优选地,所述试剂盒还含有taq pcr mix和ddh2o。
[0038]
所述试剂盒的使用方法为:
[0039]
pcr扩增体系(总体积为20μl):taq pcr mix 10μl,核苷酸序列如seq id no:1~2所示的引物各0.5μl,dna模板2μl,ddh2o 7μl。
[0040]
pcr扩增程序:95℃预变性5min;95℃变性30s,52.6℃退火30s,72℃延伸1min,共35个循环;72℃再延伸5min。
[0041]
所述试剂、所述另一试剂、所述方法、所述另一方法、和所述的试剂盒中的任意一个或几个在耗牛的牛肉品质性状育种中的应用,也属于本发明的保护范围。
[0042]
优选地,所述耗牛为四川耗牛。
[0043]
与现有技术相比,本发明具有以下有益效果:
[0044]
本发明发现了与牦牛的肉质性状相关的分子标记snp位点的组合,并发现其基因
型与ph
45min
值、背膘厚性状显著相关,建立了一种评估、检测和/预测耗牛的牛肉品质性状的方法,为优质肉牛的早期选育提供理论依据,为构建高品质肉质性状的核心牛群奠定基础。
附图说明
[0045]
图1为四川牦牛acot12基因的pcr扩增结果。
[0046]
图2为acot12基因e1-285 t》c位点3种基因型的测序图谱。
[0047]
图3为acot12基因e1-603 t》a位点3种基因型的测序图谱
[0048]
图4为acot12基因e1-675 c》g位点3种基因型的测序图谱。
[0049]
图5为acot12基因的四川牦牛群体snps位点连锁反应,图a为3个snps位点的连锁不平衡的热图(格子中数值为r2值);图b为5种单倍型的频率。
具体实施方式
[0050]
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
[0051]
1、试验样品
[0052]
本试验中所选用的102头四川牦牛,在相同的饲养条件下饲养于四川阿坝州某牛场,收集每头牛相同部位的颈静脉血液经抗凝剂处理后,于-80℃冰箱中保存。
[0053]
2、主要试剂
[0054]
血液基因组dna提取试剂盒,购自北京天根生化科技有限公司;green taq pcr mix、tae buffer,购自生工生物有限公司;dl-2 000marker,购自北京宝日医生物技术有限公司;琼脂糖,购自北京鼎国生物技术有限公司;dnaloading buffer、核酸染色剂,购自meilunbio公司。
[0055]
3、主要仪器
[0056]
pcr扩增仪,购自bio-rad公司;电子天平,购自梅特勒-托利多国际贸易(上海)有限公司;电泳仪,购自北京六一生物科技有限公司;凝胶成像分析仪,购自广州誉维生物科技仪器有限公司;微量分光光度计,购自thermo公司。
[0057]
实施例1四川牦牛acot12基因snp位点的扩增
[0058]
一、实验样本
[0059]
实施例1的102头四川牦牛来自于四川省阿坝州某牛场,采集了同一环境、相同饲养条件、同一时期的健康牦牛血液样品于-20℃保存,用于提取血液基因组dna,收集相关肉品质性状数据并进行分析。
[0060]
二、实验方法
[0061]
1、dna提取
[0062]
按说明书使用血液基因组dna提取试剂盒提取四川牦牛血液样本dna,使用微量分光光度计检测dna的浓度和纯度,通过琼脂糖凝胶电泳检测dna的质量。
[0063]
2、引物设计
[0064]
根据ensembl中公布的牛acot12基因序列(ensbtat00000014753.6),设计了1对特
异性扩增引物,并由生工生物工程(上海)股份有限公司合成。
[0065]
特异性扩增引物的序列如下所示:
[0066]
上游引物f:5
′‑
atgggaggagtgattgc-3
′
(seq id no:1),
[0067]
下游引物r:5
′‑
cctgacttctgccttactga-3
′
(seq id no:2)。
[0068]
3、pcr扩增及产物测序
[0069]
以提取的102头四川牦牛血液dna为模板分别进行pcr扩增。
[0070]
其中,pcr扩增体系(总体积为20μl):taq pcr mix 10μl,上下游引物各0.5μl,dna模板2μl,ddh2o 7μl。
[0071]
pcr扩增程序:95℃预变性5min;95℃变性30s,52.6℃退火30s,72℃延伸1min,共35个循环;72℃再延伸5min。
[0072]
pcr扩增产物经1.5%琼脂糖凝胶电泳检测并确认目的条带正确后,送生工生物工程(上海)股份有限公司测序。
[0073]
三、实验结果
[0074]
pcr扩增结果如图1。扩增产物大小为845bp,电泳条带明亮、清晰,无引物二聚体、抹带和非特异性扩增条带,可用于后续的测序试验。
[0075]
采用seqman软件观察测序结果,发现了重叠峰,在acot12基因的外显子1上共发现3个snps位点,分别为:
[0076]
snp位点1(e1-285 t》c)位于nc_037334.1:81354300,即ars-ucd1.2版牛基因组的第7染色体的第81354300位;
[0077]
snp位点2(e1-603 t》a)位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位;
[0078]
snp位点3(e1-675c》g)位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位;
[0079]
不同基因型测序图谱如图2到图4所示。
[0080]
实施例2 acot12基因3个snps位点的群体遗传特性
[0081]
一、实验方法
[0082]
对实施例1获得的所有的102头四川牦牛测序结果进行分析,使用popgene 32软件计算等位基因的基因频率、基因型频率、遗传杂合度(h)、有效等位基因数(ne);使用pic 0.6软件计算多态信息含量(pic)。
[0083]
二、实验结果
[0084]
acot12基因3个snps位点的群体遗传特性如表1。由表1可以看出snp位点1(e1-285 t》c)、snp位点2(e1-603 t》a)、snp位点3(e1-675 c》g)中优势基因型分别为tc、ta、cc,优势等位基因分别为t、a、c,频率均大于0.5。
[0085]
snp位点1(e1-285 t》c)、snp位点2(e1-603 t》a)位点的遗传杂合度(h)和多态信息含量(pic)均处于0.25~0.50之间,表明以上位点呈现为中度多态。χ2检验说明,3个snps位点在四川牦牛群体中均处于hardy-weinberg平衡状态(p》0.05)。
[0086]
表1 acot12基因3个snps的群体遗传特性分析结果
[0087][0088]
注:χ2值表示未达到显著水平(p》0.05),χ
20
.05(df=2)=5.99,χ
20.01
(df=2)=9.21。
[0089]
实施例3 acot12基因snps与四川牦牛肉品质性状的相关分析
[0090]
一、实验方法
[0091]
对实施例1的102头四川牦牛,按照如下方法进行肉质相关性状的检测:
[0092]
(1)背膘厚:测量位置约在牛的第十二、十三肋骨间脂肪处,也即在眼肌长度约四分之三处。用标尺测量三次,取平均值并记录。
[0093]
(2)ph值:将四川牦牛屠宰后的里脊置于4℃冰箱进行保存,在45min和24h时,分别用ph计测定里脊的ph值。每个样品进行三次测定,取平均值并记录。
[0094]
(3)肉色:将屠宰后的肌肉样品置于4℃冰箱进行保存,在宰后约24h用色度仪测量背最长肌的肉色指标,包括其肉的亮度(l*)、红度(a*)和黄度(b*)。每个样品测量三次并取平均值后进行计算。
[0095]
使用spss 23.0软件的单因素方差中的多重比较对四川牦牛肉品质性状和基因型间的关系进行差异显著性检验,以p《0.05作为差异显著性的判断标准。试验数据用“平均值
±
标准误”表示。
[0096]
二、实验结果
[0097]
acot12基因3个snps与四川牦牛肉品质性状的相关分析如表2。由表2可以看出snp2(e1-603 t》a)位点的tt基因型个体的ph 45min
值显著低于ta、aa基因型个体(p《0.05),snp3(e1-675 c》g)位点的cg基因型个体的背膘厚显著高于cc基因型个体(p《0.05),3个snps位点的不同基因型与ph
24h
、肉色(l*,a*,b*)均无显著相关性(p》0.05)。
[0098]
表2 acot12基因3个snps位点与四川牦牛肉品质性状相关性分析
[0099]
[0100]
实施例4 acot12基因单倍型与四川牦牛肉品质的相关性分析
[0101]
一、实验分法
[0102]
使用haploview 4.2软件对acot12基因的3个snps的基因型与实施例3检测的相关肉品质性状进行连锁不平衡分析。
[0103]
二、实验结果
[0104]
结果如图5和图3所示,由图5可知:3个snps位点存在强连锁遗传,并构成了一个结构域,图5a表示snps位点之间的连锁程度,数值为d’值,常用来度量连锁不平衡;图5b代表3个位点之间组成的5种单倍型的频率,共组成15种单倍型组合,其中7种单倍型组合具有生物学统计意义(个体数n≥3),分别为h1h1(snp位点1到snp位点3的基因型分别为:cc、tt和cc)、h1h2(snp位点1到snp位点3的基因型分别为:tc、ta和cc)、h1h3(snp位点1到snp位点3的基因型分别为:tc、ta、cg)、h1h4(snp位点1到3的基因型分别为:tc、tt和cc)、h2h2(snp位点1到snp位点3的基因型分别为:tt、aa和cc)、h2h3(snp位点1到snp位点3的基因型分别为:tt、aa和cg)、h3h3(snp位点1到snp位点3的基因型分别为:tt、aa和gg)。
[0105]
由表3可知:h2h2单倍型组合的ph
45min
值显著高于h1h4(p《0.05),其它单倍型组合与背膘厚、ph
24h
值和肉色无显著差异(p》0.05)。
[0106]
表3四川牦牛acot12基因的单倍型与肉品质的相关性分析结果
[0107][0108]
注:同列同一指标中标有字母完全不同者表示差异显著(p《0.05);标相同字母者表示差异不显著(p》0.05)。
[0109]
实施例5一种评估、检测和/预测耗牛的牛肉品质性状的试剂盒
[0110]
一、组成
[0111]
核苷酸序列如seq id no:1~2所示的引物、taq pcr mix和ddh2o。
[0112]
二、使用方法
[0113]
1、提取待测样本的dna
[0114]
2、进行pcr反应
[0115]
pcr扩增体系(总体积为20μl):taq pcr mix 10μl,核苷酸序列如seq id no:1~2所示的引物各0.5μl,dna模板2μl,ddh2o 7μl。
[0116]
pcr扩增程序:95℃预变性5min;95℃变性30s,52.6℃退火30s,72℃延伸1min,共35个循环;72℃再延伸5min。
[0117]
pcr扩增产物经1.5%琼脂糖凝胶电泳检测并确认目的条带正确后,进行测序。
[0118]
三、结果判断
[0119]
snp位点1位于nc_037334.1:81354300,即ars-ucd1.2版牛基因组的第7染色体的第81354300位,snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位;
[0120]
snp位点1的基因型为tt、snp位点2的基因型为aa、且snp位点3的基因型为cc的个体的ph
45min
值显著高于snp位点1的基因型为tc、snp位点2的基因型为tt且snp位点3的基因型为cc的个体;
[0121]
snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,tt基因型个体的ph 45min
值显著低于ta、aa基因型个体;
[0122]
snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位,cg基因型个体的背膘厚显著高于cc基因型个体。
[0123]
实施例6一种评估、检测和/预测耗牛的牛肉品质性状的方法
[0124]
1、提取待测样本的dna
[0125]
2、进行pcr反应
[0126]
pcr扩增体系(总体积为20μl):taq pcr mix 10μl,核苷酸序列如seq id no:1~2所示的引物各0.5μl,dna模板2μl,ddh2o 7μl。
[0127]
pcr扩增程序:95℃预变性5min;95℃变性30s,52.6℃退火30s,72℃延伸1min,共35个循环;72℃再延伸5min。
[0128]
pcr扩增产物经1.5%琼脂糖凝胶电泳检测并确认目的条带正确后,进行测序。
[0129]
3、结果判断
[0130]
snp位点1位于nc_037334.1:81354300,即ars-ucd1.2版牛基因组的第7染色体的第81354300位,snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位;
[0131]
snp位点1的基因型为tt、snp位点2的基因型为aa、且snp位点3的基因型为cc的个体的ph
45min
值显著高于snp位点1的基因型为tc、snp位点2的基因型为tt且snp位点3的基因型为cc的个体;
[0132]
snp位点2位于nc_037334.1:81353982,即ars-ucd1.2版牛基因组的第7染色体的第81353982位,tt基因型个体的ph 45min
值显著低于ta、aa基因型个体;snp位点3位于nc_037334.1:81353910,即ars-ucd1.2版牛基因组的第7染色体的第81353910位,cg基因型个
体的背膘厚显著高于cc基因型个体。
[0133]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
