钆塞酸二钠异构体的分离及其在作为mr成像对比剂中的应用
技术领域
1.本发明涉及一种钆塞酸二钠异构体的分离及其在作为mr成像对比剂中的应用,属于核共振对比剂技术领域。
背景技术:
2.钆塞酸二钠(gd-eob-dtpa,商品名:普美显),是肝脏特异性对比剂,通过在钆喷酸葡甲胺盐(gd-dtpa)分子结构上增加脂溶性基团(eob)而得到,其分子结构同时具有亲水性和亲脂性,从而具有肝、肾双通路排泄的特征。gd-eob-dtpa 能够被肝细胞基底外侧膜内的有机阴离子转运蛋白(organic anion transportingpeptides,oatps)特异性摄取进入肝细胞内,并通过胆道系统以药物原型随粪便排出体外。gd-eob-dtpa存在两类非对映异构体gd-a和gd-b,它们在25~120℃和 ph值5~9范围内以较为恒定的比例存在(65%:35%)。
3.然而有研究报道肾功能衰竭的患者钆塞酸二钠的半期会延长至10倍左右,导致钆剂在体内沉积和引发肾源性系统性纤维化(nsf)的风险随之大增,这个现象提示钆塞酸二钠并不是理想中高效的肝、肾双通道排泄对比剂,纠其原因可能和钆塞酸二钠含a、b两类非对映异构体有关。因此,有必要对钆塞酸二钠的两类非对映异构体的成像效果进行研究。
技术实现要素:
4.本发明的目的是提供钆塞酸二钠非对映异构体a(gd-a)的分离纯化、长期存放条件以及其在作为mr成像对比剂的应用。
5.钆塞酸二钠的两类非对映异构体(gd-a和gd-b)在常温下异构化平衡比例为 65%:35%,但是纯化后的gd-a即开始向gd-b转化,因此关键是如何将纯化后的 gd-a长期保持纯度不转化为gd-b。
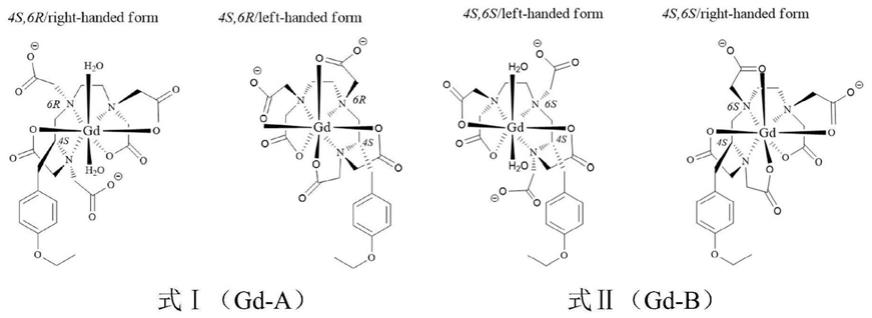
6.本发明涉及的非对映异构体gd-a和gd-b均存在手性异构,其结构式分别如式ⅰ(4s 6r手性异构)和式ⅱ(4s 6s手性异构)所示:
[0007][0008]
本发明首先提供了钆塞酸二钠非对映异构体a的分离方法,包括如下步骤:
[0009]
s1、采用反相hplc分离钆塞酸二钠,得到含有钆塞酸二钠非对映异构体a的洗脱液;
[0010]
s2、对所述含有钆塞酸二钠非对映异构体a的洗脱液进行浓缩,得到含有钆塞酸二钠异构体a的浓缩液;
[0011]
s3、所述含有钆塞酸二钠异构体非对映a的浓缩液经低温冻结后进行冷冻干燥,得到白色固体粉末状的钆塞酸二钠非对映异构体a,并储存于真空玻璃瓶中;
[0012]
上述的分离方法中,所述含有钆塞酸二钠非对映异构体a的洗脱液和所述含有钆塞酸二钠非对映异构体a的浓缩液均储存于-20℃~0℃的低温冷冻环境中,如可存储于低温冰箱冷冻层中。
[0013]
上述的分离方法中,所述含有钆塞酸二钠非对映异构体a的洗脱液和所述含有钆塞酸二钠非对映异构体a的浓缩液中钆塞酸二钠非对映异构体a的纯度均大于 99%,采用反相hplc的方式检测纯度,可在如下条件下进行:流动相为纯甲醇或乙腈和0.01mol
·
l-1
磷酸盐缓冲液(5~25%:75~95%),速率0.5~1ml/s,柱箱温度 35~45℃,检测波长226nm,进样量为10~15μl,gd-a出峰时间约在20mins、gd-b 出峰时间在21mins左右。
[0014]
上述的分离方法中,步骤s1中,所述反相hplc的检测条件如下:
[0015]
洗脱液为:甲醇或乙腈与碳酸氢铵缓冲液,体积比为5~30%:70~95%,流速为 0.8~1.5ml/s,温度为25~30℃,吸收波长为226nm,进样量为90~100μl,一针时间为 60
±
3mins。
[0016]
上述的分离方法中,步骤s2中,采用氮吹的方式进行浓缩;
[0017]
在氮吹过程中可每隔3小时采用反相hplc检测其纯度、ph计检测确保溶液为弱碱性;由于甲醇挥发性强,部分碳酸氢铵可生成氨气、二氧化碳,此过程使gd
‑ꢀ
a、gd-b作为溶质的比例更大;同时氮气创造了一个相对低温的环境,氮气作为惰性气体不易与物质发生反应,对药物的浓缩过程起到了保护作用;
[0018]
所述方法还包括对所述含有钆塞酸二钠非对映异构体a的浓缩液使用滤过膜滤过的步骤,去除氮吹过程中进入液体的杂质。
[0019]
上述的分离方法中,步骤s3中,将所述含有钆塞酸二钠非对映异构体a的浓缩液移入玻璃瓶中后进行所述低温冻结,密封所述玻璃瓶并使其处于半密封环境中,可采用西林瓶,采用胶塞封口实现半密封环境;
[0020]
所述低温冻结的温度为-20℃~0℃,时间为4~6h。
[0021]
上述的分离方法中,步骤s3中,在冷冻干燥机中进行所述冷冻干燥;
[0022]
在进行所述冷冻干燥之前,所述冷冻干燥机进行预冷,可在-60℃的条件下进行预冷;
[0023]
在所述预冷之前,对所述冷冻干燥机的各部件进行彻底的清洁,以便保持设备的良好状态以及适宜条件,不同零部件采用乙醇、生理盐水等清洗;同时检查真空泵及玻璃罩的气密性、以及冷冻干燥主机与真空泵之间连接处的密封性;
[0024]
做好所有准备工作后,将已冻实装有gd-a的玻璃瓶迅速移动到所述冷冻干燥机的托盘上,以保证冷冻干燥的效果;
[0025]
所述冷冻干燥的温度为-70℃~-60℃,时间为48~72h,得到真空玻璃瓶装的白色固体粉末。
[0026]
本发明方法分离得到的gd-a固态粉末的纯度在99%以上,可以在真空条件下长期保存,使用时采用生理盐水或纯水溶解。
[0027]
经本发明实验发现,gd-a较gd-b的成像效率更高、在兔和犬体内半衰期更短,进一步降低了钆在体内沉积的风险,因此纯化gd-a有潜在的临床应用价值。
[0028]
gd-a是一种新型高效的mr肝脏特异性对比剂,较钆塞酸二钠(ab混合物) 具有更高的成像效率和更短的半衰期,用gd-a替代钆塞酸二钠能够提高成像效果和降低肾源性系统性纤维化(nsf)的风险。
附图说明
[0029]
图1为普美显两个异构体gd-a和gd-b分离示意图。
[0030]
图2为真空玻璃瓶装的白色固体粉末gd-a和gd-b的实物图。
[0031]
图3为本发明分离纯化后的gd-a和gd-b的mr成像效果。
[0032]
图4为本发明实施例2中动物实验的流程图。
[0033]
图5(a)为本发明实施例2中血药浓度指数衰减曲线拟合,图5(b)为gd-a 和gd-b的mri信号强度-时间曲线。
[0034]
图6(a)为本发明实施例2动物实验中注射gd-a和gd-b后肝脏信号强度达峰时间,图6(b)为实施例2动物实验注射gd-a和gd-b后肝脏信号强度峰值,图6 (c)为实施例2动物实验注射gd-a和gd-b后的血浆清除率,图6(d)为实施例2 动物实验注射gd-a和gd-b后的半衰期,图6(e)为实施例2动物实验注射gd-a 和gd-b后兔肝脏信号强度以及兔胆囊内是否有对比剂填充。
[0035]
图7(a)为本发明实施例3动物实验注射gd-a和gd-b后比格犬胆囊内是否出现对比剂以及比格犬肝脏强化幅度,图7(b)为实施例3动物实验注射gd-a和gd
‑ꢀ
b的mri信号强度-时间曲线,图7(c)为本发明实施例3中血药浓度指数衰减曲线拟合。
[0036]
图8(a)为本发明实施例3动物实验注射gd-a和gd-b的血浆清除率,图8 (b)为实施例3动物实验注射gd-a和gd-b的半衰期,图8(c)为实施例3动物实验注射gd-a和gd-b后比格犬肝脏出现信号强度峰值时间,图8(d)为实施例3动物实验注射gd-a和gd-b后比格犬肝脏信号强度峰值。
具体实施方式
[0037]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0038]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0039]
标准曲线溶液的制备:取一定量的普美显原液,分别通过加超纯水,获得浓度为原溶液的1/500、1/800、1/1000、1/1500、1/2000、1/3000浓度的稀释液(标记为标准溶液1~6);再利用反相高效液相色谱仪(hplc),走样后制成溶液样本标准曲线计算式。
[0040]
实施例1、gd-a和gd-b的分离纯化及稳定性
[0041]
1、普美显两类非对映异构体(gd-a、gd-b)的分离纯化
[0042]
1)、将反相液相色谱仪(laballiance液相色谱,lc)设置为有机相(纯甲醇):无机相(碳酸氢铵稀释液)=15%:85%后启动,等30mins基线平衡后,将100μl普美显溶液装入微量进样器中,去除微量进样器中的气泡,快速注入液相色谱柱 (allsphere ods-2)中,待28mins左右gd-a峰开始出现后,用标记好的50ml离心管盛装至gd-a峰下降一半处;待gd-b上升峰出现一半时再用标记好的50ml离心管收取,如此重复进样,得到大批量gd-a与gd-b
(图1);每一次取到分离好的纯 gd-a、gd-b均由反相高效液相色谱仪(岛津高效液相色谱仪,hplc)确认各自纯度均在99%以上,集中分隔存放于低温冰箱冷冻层。
[0043]
其中,反相lc色谱条件,甲醇:碳酸氢铵缓冲液=15%:85%,流速=1ml/s,温度=25~30℃,吸收波长=226nm,进样量为100μl,一针时间60mins;反相hplc色谱条件,流动相为纯甲醇和0.01mol
·
l-1磷酸盐缓冲液(25%:75%),速率0.5ml/s,柱箱温度40℃,检测波长226nm,进样量为10μl,gd-a出峰时间约在20mins、gd
‑ꢀ
b出峰时间在21mins左右。
[0044]
2)随后在实验室分批次开始氮吹浓缩,环境温度为常温25℃,将gd-a、gd-b 先后分开、分别装入特制的大容积玻璃器皿中,将大容积器皿固定好,放于装有水的泡沫箱中(避免氮吹时器皿中液体结冰),打开氮气罐的流量计和输气管,然后通过调节流量大小输送氮气,随着液面的下降调整氮气罐的流量计和输气管;在氮吹过程中每隔3小时用反相hplc检测其纯度、ph计检测确保溶液为弱碱性;由于甲醇挥发性强,部分碳酸氢铵可生成氨气、二氧化碳,此过程使gd-a、gd-b作为溶质的比例更大;同时氮气创造了一个相对低温的环境,氮气作为惰性气体不易与物质发生反应,对药物的浓缩过程起到了保护作用。将通过氮吹浓缩的gd-a、gd-b分别合装在 100ml的离心管中。再次用反相hplc测量其纯度及浓度,待确认纯度》99%后,将其用滤过膜滤过,去除氮吹过程中进入液体的杂质,分别得到较高浓度的纯gd-a溶液100ml、纯gd-b溶液60ml(氮吹浓缩程度不同),再次放入冰箱冷冻层储存。
[0045]
3)将西林瓶逐一消毒后,用1000μl的移液枪向每个容量为3ml的西林瓶内注入 2ml的浓缩gd-a溶液,再将胶塞分别套在西林瓶上,形成半密封环境,把处理好的 gd-a玻璃瓶放入低温冷冻冰箱,待4小时且完全冻结实后,才可进行冷冻干燥实验;使用vfd-1000a冷冻干燥机以前,对其各部件进行彻底的清洁,以便保持设备的良好状态以及适宜条件,不同零部件使用乙醇、生理盐水等清洗;同时检查真空泵及玻璃罩的气密性、以及冷冻干燥主机与真空泵之间连接处的密封性,在使用机器前先进行预冻,把温度设置在-60℃的条件。做好所有准备工作后,将已冻实的gd-a玻璃瓶迅速移动到冷冻干燥机的托盘上,以保证冷冻干燥的效果。运行机器后等待72 小时,最后得到真空玻璃瓶装的白色固体粉末gd-a。获取gd-b固态粉末方法同gd
‑ꢀ
a(图2)。
[0046]
2、gd-a和gd-b固态粉末的纯度
[0047]
分别取一瓶上述获得gd-a和gd-b固态粉末,利用超纯水作为溶剂,反相 hplc检测,证实获得的gd-a和gd-b固态粉末的纯度均在99%以上,满足检测药物稳定性和动物实验的要求。
[0048]
3、gd-a和gd-b固态粉末的稳定性
[0049]
分别将这两种异构体真空固态粉末各取4瓶,标记好,分别置于常温(25℃)、低温(低温冰箱冷冻层,-20℃),高温(恒温箱,50℃、80℃)四个不同干燥条件下,均放置2月以上;取出后,用5ml注射器针头将其真空环境破坏,再用1000μl 量程的移液枪向其中加入1ml超纯水,将因破坏真空环境而吸壁的固态粉末充分振荡融化、混匀,再通过反相hplc检测在不同温度条件下gd-a、gd-b的纯度随时间的变化,结果如表1所示。
[0050]
可以看出,对上述gd-eob-dtpa分离得到纯度在99%以上gd-a和gd-b固态粉末,在真空玻璃瓶中保存两个月(60天),在常温(25℃),低温(-20℃),高温 (50℃、80℃)不同条件下gd-a的纯度分别为:99%,99%,98%,95%;gd-b的纯度分别为99%、99%、97%、94%
(表1),因此本发明冷冻干燥后以固态粉末存在状态的gd-a可以在真空、室温的环境下长期保存,为临床应用提供了可能性和便利性,使用时用生理盐水溶解即可。现有的商品药普美显(a、b混合物)为水溶液形式存在,如果纯化后的gd-a仍然以水溶液形式保存,会缓慢转变为a、b混合物,临床使用价值就会下降。
[0051]
表1 gd-a、gd-b在4种温度下放置2月以上后的纯度(25℃下二者纯度均为 99%)
[0052][0053]
4、纯gd-a和纯gd-b的磁共振成像能力
[0054]
依据获得浓缩后液态gd-a和gd-b的浓度制作5个普美显原液的浓度梯度(gd
‑ꢀ
a、gd-b各自浓度值包括在内)。为了避免纯gd-a和纯gd-b二者出现污染,分批次将二者与5个浓度梯度普美显原液置于水膜中进行核磁共振扫描,结果如图3所示,可以看出,分离后的gd-a和gd-b均可以获得很好的mr成像效果。
[0055]
实施例2、gd-a、gd-b的mr成像及药动学动物实验(兔)
[0056]
1、动物实验:在确定gd-a和gd-b均具有mri显影作用后,选取新西兰大白兔雄性12只,饲养2周,待确认健康后,随机分为a、b两组,每组各6只,分别进行gd-a和gd-b的mr成像及药物代谢动力学研究(流程图如图4所示)。
[0057]
1.1生物样本标准溶液的配置,取一定量普美显原液,将其稀释至原液的1/200、 1/250、1/300、1/400、1/600、1/1000,取20μl各稀释液与180μl兔血浆放入标记好的 1.5ml离心管中,充分混匀后,再各加入600μl纯甲醇,标记为兔血标准溶液1~6,用漩涡混合器将其充分振荡、混匀,再放入高速离心机中(14000rpm,2mins),离心后,利用反相hplc制成生物样本标准曲线的计算式。
[0058]
1.2实验前将兔禁食12h并称其体重以便计算麻醉药的用量:0.1ml的2%的戊巴比妥钠
×
体重(kg)。所有mri检查均使用西门子(siemens)skyra 3.0tmri成像仪,在兔一侧耳缘静脉放置y型留置针,采用2%的戊巴比妥钠溶液将兔麻醉,确认兔子已麻醉后,将其结实,仰卧位放置于实验板,再放置于扫描床上,用束腹带抑制兔的呼吸,再使用人用8通道腹部专用线圈,定位于兔腹部肝脏位置,先行常规 t1wi扫描、定位,而后进行t1wi动态增强扫描2mins时,从留置管的另一入口对 a组每只兔子注射gd-a剂量约104250μg,b组每只兔子注射gd-b剂量约 104250μg。注射药物后立即向留置管内注射5ml生理盐水快速冲洗管内造影剂残余,在注入药物的同时记下打药开始与结束时间,打药时间控制在8s以内,然后继续动态无间隔扫描15mins。在给药以后,动态监测其动脉血中药物浓度的变化,分别抽取打药后20~70分钟以内4次血液(20mins,35mins,50mins,70mins),每次抽 0.5~1ml兔血。抽取兔血后立即置于标记好的真空肝素锂抗凝管中防止凝固,再利用台式低速离心机td4c(4000rmp,7mins)离心,将血液样本的血浆与血细胞分离,用200μl量程的移液枪吸取上层血浆并放入冰箱冷藏区,用反相hplc测量每只兔不同时间点血样的gd-a、gd-b浓度及各自纯度(t1wi:tr=4.98ms,te=2.31ms,反转角=15
°
,fov=189mm
×
220mm,层厚=3.0mm,层间距=26mm,相位编码方向为左右)。
[0059]
以血液采样时间为横坐标、分别以a、b两组各实验兔的血浆药物浓度为纵坐标,利
用excel绘制各组相应的点。利用excel的曲线拟合功能,可得出a、b两组实验兔的指数曲线。利用积分法计算动态监测采样期间分别注入纯gd-a、纯gd-b 的a、b两组曲线下的面积(图5(a))。由此计算a、b两组gd-a和gd-b的血浆清除率(cl-a、cl-b)和半衰期(t1/2a、t1/2b)。
[0060]
1.3mr成像的评估是由两名高年资医师采用双盲法完成,测量时避开胆管和血管,尽量选择肝脏显示较好层面的同一肝叶区域测量肝脏信号强度(signalintensity,si)放置面积相同的感兴趣区(region of interest,roi),分别测量平扫和增强数据,通过excel软件生成信号强度-时间曲线(图5(b)。由此测得mr信号达峰时间(tpeaka、tpeakb)和信号强度峰值(sipeaka、sipeakb)。
[0061]
2、统计学分析
[0062]
统计学软件采用spss 22.0对gd-a和gd-b之间的mr成像指标(tpeaka、 tpeakb和sipeaka、sipeakb)及药动学(cl-a、cl-b和t1/2a、t1/2b)采用 kolmogorov-smirnov方法进行正态性检验、levene方法进行方差齐性检验。差别采用独立样本资料的student's t-test或秩和检验,具体采取何种统计学检验方式是由计量资料是否呈正态分布来确定,p<0.05认为差别有统计学意义。
[0063]
经静脉团注gd-a、gd-b后,磁共振t1wi动态成像肝脏实质达到峰值的时间 tpeaka、tpeakb分别3.49
±
0.99min和11.5
±
2.03min,两者的差别具有统计学意义(p 《0.001),肝脏实质的峰值信号强度sipeaka、sipeakb分别为:825.7
±
92.9和 714.5
±
78.8,p=0.049。gd-a和gd-b的cla、clb分别为25.41
±
5.174ml/min和6.734
±
1.834ml/min,p《0.001;半衰期t1/2a、t1/2b分别为22.91
±
3.42min和 35.27
±
4.31min,p《0.001(图6(a)、图6(b)、图6(c)、图6(d)和图6(e)、表 2)。
[0064]
表2 gd-a和gd-b的mr及药动学指标
[0065][0066]
实施例3、gd-a、gd-b的mr成像及药动学动物实验(比格犬)
[0067]
一、动物实验
[0068]
1、实验动物:医学伦理委员会的批准后,采用2~3岁雄性成年比格犬20条,体重10~12kg。正常饲养2周后,随机分为a、b两组(n=6),禁食6小时,麻醉、固定后,a组gd-a静脉给药(0.05mmol/kg),b组gd-b静脉给药(0.05mmol/kg),同步启动mr扫描,通过髂动脉预置管定时抽取血样(2ml/次),进行血药浓度动态监测。
[0069]
2、mr扫描方案:mri扫描采用3.0t mri扫描仪(magnetom skyra,siemenshealthcare,erlangen,germany),检查前动物禁食6小时,氯胺酮(8mg/kg体重)、地西泮(0.5mg/kg体重)进行基础麻醉,丙泊酚注射液[0.8mg/(kg*h)]进行维持麻醉。待动物麻醉后利用袋装氧气低流量给氧,来降低呼吸频率和幅度。采用18通道体部矩阵线圈及内置检查床板脊柱矩阵线圈。静脉团注gd-a或者gd-b后进行间隔 30s的t1wi的动态增强至30min。
[0070]
3、图像分析及后处理:将所有获得的图像数据传输到工作站(siemenssyngo)。选择近肝门部,肝脏面积较大、伪影较小的层面测量t1wi信号强度 (signal-intensity),绘制时间-信号强度曲线(time-intensity curve,tic),由该曲线确定肝脏t1wi信号峰值出现的时间(t
peak
)、峰值信号强度(si
peak
)。
[0071]
4、药物浓度监测及药动学分析:mr扫描前在受试动物的一侧髂动脉预置导管。静脉团注0.05mmol/kg异构体药物(gd-a或gd-b),进行mr扫描的同时启动血浆药物浓度的同步监测:在静脉团注药物后20min、30min、50min、70min各抽取血样2ml,考虑到犬体型稍大,血液循环和代谢会略慢、药物代谢的第一阶段(细胞外容积分布期)也会略长,增加90min、120min血液采样,也是各抽取血样2ml。上述血液样本经由髂动脉导管抽取,血样置入抗凝
管,低速离心机以1500g离心15 分钟,分离得到的血浆用于hplc测量异构体药物(gd-a或gd-b)的血浆浓度。
[0072]
在excel中建立采样时间和血浆药物浓度的散点图,用增加趋势线功能得到浓度衰减的指数函数(拟合曲线),依据药物代谢一级动力学原理进一步计算出药物的半衰期,并对该指数函数求积分得到浓度曲线下的面积,以药物的静脉给药量除以浓度曲线下的面积得到异构体药物的血浆清除率。
[0073]
二、统计学分析
[0074]
统计学软件采用spss 22.0对各指标进行分析。采用kolmogorov
‑ꢀ
smirnov方法进行正态性检验、levene方法进行方差齐性检验。符合正态分布的计量资料用均数
±
标准差表示。gd-a和gd-b之间的mr成像指标(肝脏达到峰值时间、信号强度)及药动学(血浆清除率和半衰期)差别采用student's t-test或秩和检验 (n=4),具体采取何种统计学检验方式依据资料是否呈正态分布来确定,p<0.05认为差别有统计学意义。
[0075]
三、结果
[0076]
通过对a、b两组比格犬注射gd-a和gd-b后的肝脏mr图像可以直观的看到,注射gd-a后肝脏信号强度明显高于注射gd-b,并且在大约10min时可看到胆囊内出现对比剂,但是注射gd-b比格犬胆囊内未见明显对比剂填充(图7(a));建立mr信号强度-时间曲线后发现注射gd-a、gd-b单体后,比格犬肝脏均可出现类似于细胞外对比剂肝脏信号强度上升的趋势,而注射gd-a后可继续上升,gd-b则是呈平缓趋势(图7(b))a、b两组血浆药物浓度检测的拟合曲线表明gd-a血浆清除率更大,半衰期更短(图7(c))。a组血浆清除率(65.25
±
2.17ml/min)与b组之间的血浆清除率(14.93
±
0.99ml/min)差异具有统计学意义(p<0.0001);a组t1/2 (27.38
±
0.59min)与b组t1/2(39.05
±
0.66)之间差异有统计学意义(p<0.0001); a、b两组之间的tpeak和sipeak分别为8.50
±
1.08min、13.88
±
1.11min,858.0
±
56.82、548.0
±
65.01均具有统计学意义(p<0.001)(图8(a)-图8(d))。
[0077]
由上述实验可以看出,gd-a较gd-b有更短的半衰期,可减低钆沉积在体内的风险。gd-a较gd-b有更好的mr成像效果,是钆塞酸二钠mr成像肝胆期的主要信号源。gd-a是新型高效的mr肝脏特异性对比剂,较钆塞酸二钠(ab混合物) 具有更高的成像效率和更短的半衰期,用gd-a替代钆塞酸二钠能够提高成像效果和降低肾源性系统性纤维化(nsf)的风险。
