psmd14在系膜增生性肾小球肾炎中的应用
技术领域
1.本技术涉及肾病技术领域,尤其是涉及psmd14在系膜增生性肾小球肾炎中的应用。
背景技术:
2.系膜增生性肾小球肾炎(mspgn)以系膜细胞弥漫性增殖和系膜基质沉积为特征,可能导致肾间质纤维化、不可逆的进行性肾小球硬化和终末期肾病(esrd)。作为一种原发性慢性肾炎,mspgn是慢性肾脏疾病、慢性肾衰竭和尿毒症的主要病因。然而,mspgn的治疗选择有限,药物干预抑制肾小球系膜细胞增殖和基质积累是延缓疾病进展的主要选择。
3.转化生长因子(tgf-β)信号通路是在大多数慢性肾病中驱动肾纤维化的主要因素。抑制tgf-β同种型tgf-β1或其下游信号通路,能够大幅限制多种疾病模型中由tgf-β1过表达引起的肾纤维化。因此,在当前治疗选择有限的情况下,有必要尝试从tgf-β信号通路出发,寻找诊疗系膜增生性肾小球肾炎的特异性靶点。
技术实现要素:
4.本技术旨在至少解决现有技术中存在的技术问题之一。为此,本技术提出一种能够诊疗系膜增生性肾小球肾炎的特异性靶点,基于这一靶点psmd14,提出其在系膜增生性肾小球肾炎的诊断产品或治疗产品中的应用。
5.本技术的第一方面,提供定量检测样品中psmd14的试剂在在制备系膜增生性肾小球肾炎的诊断产品中的应用。
6.根据本技术实施例的应用,至少具有如下有益效果:
7.申请人在细胞与动物模型试验过程中发现,psmd14是促进系膜增生性肾小球肾炎的主要作用靶点,在mspgn疾病患者的样本中具有良好的敏感性和特异性。因此,psmd14可以作为诊断系膜增生性肾小球肾炎的特异性靶点,通过定量其水平的试剂对受试者是否患有系膜增生性肾小球肾炎进行检测。
8.其中,psmd14(proteasome 26s subunit,non-atpase 14,蛋白酶体26s亚基非atpase 14,gene id:10213)编码26s蛋白酶体的一个亚基组成部分。26s蛋白酶体是一种大型多蛋白复合物,可催化泛素化细胞内蛋白的降解。而该基因所编码的是26s蛋白酶体的19s调节帽复合物的组成部分,能够介导底物去泛素化。
9.在本技术的一些实施方式中,样品选自组织、血液中的任一种。其中,组织包括但不限于取自受试者的新鲜组织样品、福尔马林固定后的组织样品或石蜡包埋组织样品,而血液包括但不限于取自受试者的外周血样品。
10.在本技术的一些实施方式中,样品选自血液的胞外囊泡。
11.在本技术的一些实施方式中,试剂在基因水平或蛋白水平上定量检测psmd14。在基因水平上定量检测psmd14的试剂通过以下方法进行,具体包括但不限于聚合酶链反应(pcr)、等温扩增反应(如环介导等温扩增lamp、重组酶聚合酶扩增rpa等)、探针杂交技术、
rna印迹等方法。在蛋白水平上定量检测psmd14蛋白的试剂通过以下方法进行,包括但不限于酶联免疫反应(elisa)、放射免疫反应(ira)、免疫组化染色、蛋白质印记、电泳、液相色谱-质谱/质谱(lc-ms/ms)等。
12.在本技术的一些实施方式中,在基因水平上定量检测psmd14的试剂选自引物、探针和基因芯片。其中,引物是指能够特异性扩增psmd14基因的引物,探针是指能够特异性识别psmd14基因或者该基因转录本的探针,基因芯片是指在基底材料(具体包括但不限于聚合物如尼龙膜、硝酸纤维素膜,以及玻璃等)上固定有前述的探针的阵列所形成的复合结构。
13.在本技术的一些实施方式中,在蛋白水平上定量检测psmd14的试剂为抗体。其中,抗体是指能够特异性识别golt1b蛋白的抗体,包括但不限于单克隆抗体、多克隆抗体。
14.本技术的第二方面,提供psmd14的抑制剂在制备预防和/或治疗系膜增生性肾小球肾炎的产品中的应用。
15.根据本技术实施例的应用,至少具有如下有益效果:
16.申请人在实验过程中发现,mspgn小鼠与细胞模型的psmd14的表达明显升高,而敲低表达psmd14可阻断mspgn的系膜细胞的活性以及tgf-β信号通路诱导的mspgn进展,同时过表达psmd14则会造成细胞模型的增殖活性增强、凋亡下降。因此,psmd14的抑制剂可以通过靶向psmd14这一促进mspgn发展的特异性靶点来治疗系膜增生性肾小球肾炎。
17.其中,抑制剂是指能够抑制psmd14表达、功能或其活性的试剂,包括但不限于抗psmd14抗体、shrna、sirna、dsrna、mirna等。
18.在本技术的一些实施方式中,抑制剂为shrna。
19.在本技术的一些实施方式中,shrna的正义链和反义链的核苷酸序列分别如seq id no.1和seq id no.2所示:sense(5'-3'):cccgccauuuauuggugttcc(seq id no.1);antisense(5'-3'):cccguuucttuucaattgcgg(seq id no.2)。
20.本技术的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本技术的实践了解到。
附图说明
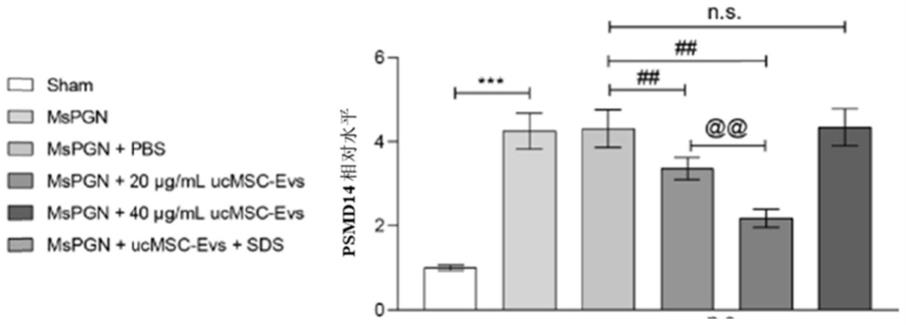
21.图1是本技术的实施例1中不同给药方式处理后的小鼠模型的psmd14的核酸检测结果,其中,横坐标从左到右分别表示假手术组、模型组、阴性对照组、低浓度胞外囊泡组、高浓度胞外囊泡组和sds组,纵坐标表示psmd14相对于内参gapdh的相对水平。n.s.表示两者无显著性差异,*/#/@表示p小于0.05,**/##/@@表示p小于0.01,***/###/@@@表示p小于0.001,下列其它图中涉及的表示相同含义。
22.图2是本技术的实施例1中不同给药方式处理后的小鼠模型的psmd14的western blot检测结果,其中,a为电泳结果,b为psmd14的相对水平结果,a和b中的横坐标从左到右分别表示假手术组、模型组、阴性对照组、低浓度胞外囊泡组、高浓度胞外囊泡组和sds组,而b中的纵坐标表示psmd14相对于内参gapdh的蛋白的相对水平。
23.图3是本技术的实施例2中不同分组处理方式后的细胞模型的psmd14的核酸检测结果,其中,pdgf-bb和pdgf-dd不同建模方式的横坐标从左到右分别表示假手术组、模型组、阴性对照组、低浓度胞外囊泡组、高浓度胞外囊泡组和sds组,纵坐标表示psmd14相对于
内参gapdh的相对水平。
24.图4是本技术的实施例2中不同分组处理方式后的细胞模型的psmd14的western blot检测结果,a为电泳结果,b为psmd14的相对水平结果,a和b中的横坐标从左到右分别表示假手术组、模型组、阴性对照组、低浓度胞外囊泡组、高浓度胞外囊泡组和sds组,而b中的纵坐标表示psmd14相对于内参gapdh的蛋白的相对水平。
25.图5是本技术的实施例3中抑制剂敲低psmd14后细胞模型的增殖和凋亡的检测结果的对比。其中,a为细胞增殖情况的比较结果,浅色为scr组(scr),深色为敲低组(shpsmd14),b为pdgf-bb诱导得到的细胞模型敲低后随时间变化的增殖情况,上方折线为scr组,下方折线为敲低组,c为细胞凋亡情况的比较结果。
26.图6是本技术的实施例3中抑制剂敲低psmd14后细胞模型去泛素化实验的western blot结果。
27.图7是本技术的实施例3中抑制剂敲低psmd14后细胞模型信号通路变化的结果。其中,a是tgf-β信号通路的分子表达的western blot结果,b和c分别是pdgf-bb和pdgf-dd诱导模型中的信号通路分子表达水平变化的具体结果。
28.图8是本技术的实施例4中过表达psmd14后细胞模型的增殖和凋亡的检测结果的对比。其中,a为细胞增殖情况的比较结果,浅色为对照组(ucevs+oe-nc),深色为过表达组(ucevs+oe-psmd14);b为pdgf-bb诱导得到的细胞模型敲低后随时间变化的增殖情况;上方折线为过表达组,下方折线为对照组,c为细胞凋亡情况的比较结果。
29.图9是本技术的实施例4中过表达psmd14后细胞模型信号通路变化的结果。其中,a是tgf-β信号通路的分子表达的western blot结果,b和c分别是pdgf-bb和pdgf-dd诱导模型中的信号通路分子表达水平变化的具体结果。
30.图10是本技术的实施例4中过表达psmd14的细胞模型去泛素化实验的western blot结果。
31.图11是本技术的实施例5中大样本数量下,mspgn小鼠模型检测psmd14的表达水平的结果,图中左侧为mspgn组的检测值,右侧为对照组的检测值。
32.图12是本技术的实施例5中psmd14表达水平与mspgn的病理进展的相关性的柱状图。其中,横坐标表示mspgn的病理进展程度,纵坐标表示不同psmd14表达水平的样本所占的比例,每一条柱子从上到下分别是高水平、中水平和低水平。三种病理进展程度之间样本psmd14表达水平比例值的卡方检验的p值为0。
具体实施方式
33.以下将结合实施例对本技术的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本技术的目的、特征和效果。显然,所描述的实施例只是本技术的一部分实施例,而不是全部实施例,基于本技术的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本技术保护的范围。
34.下面详细描述本技术的实施例,描述的实施例是示例性的,仅用于解释本技术,而不能理解为对本技术的限制。
35.在本技术的描述中,若干的含义是一个以上,多个的含义是两个以上,大于、小于、超过等理解为不包括本数,以上、以下、以内等理解为包括本数。如果有描述到第一、第二只
是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
36.本技术的描述中,参考术语“一个实施例”、“一些实施例”、“示意性实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本技术的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
37.实施例1:psmd14在mspgn动物模型中的表达
38.1.1ucmsc(脐带间充质干细胞)的分离提取
39.取足月妊娠剖宫产健康胎儿脐带,用pbs充分冲洗后,剪碎放到0.1%ⅳ胶原酶中,37℃无菌环境下消化30分钟后终止消化。离心后转入dmem培养液继续培养三天。向其中加入胰酶消化,终止消化后细胞筛过滤,将含细胞的滤液离心,重悬细胞并接种在培养瓶中培养,生长至80%~90%时传代,传至第三代后备用。
40.1.2ucmsc-evs的分离
41.ucmsc生长至50%~60%时替换为不含胞外囊泡的胎牛血清的完全培养基培养36h,收集上清,1500g 4℃离心25分钟去除细胞碎片,随后导入超离管11800g 4℃离心2小时后弃上清,重悬得到富含ucmsc-evs的悬液,并对收集到的ucmsc-evs进行鉴定。
42.1.3动物分组处理
43.mspgn模型建立方法:尾静脉注射1ml/100g抗胸腺细胞血清,1次/周,共注射4次。将36只雄性小鼠随机分为6组:假手术组(sham)、模型组(mspgn)、阴性对照组(mspgn+pbs)、低浓度胞外囊泡组(mspgn+20μg/ml ucmsc-evs)、高浓度胞外囊泡组(mspgn+40μg/ml ucmsc-evs)和sds组(mspgn+ucmsc-evs+sds),每组8只。阴性对照组经尾静脉注射500μl pbs缓冲液,低浓度胞外囊泡组、高浓度胞外囊泡组和sds组分别注射20μg/ml ucmsc-evs的pbs缓冲液、40μg/ml ucmsc-evs的pbs缓冲液和40μg/ml ucmsc-evs+sds的pbs缓冲液。
44.1.4表达检测
45.给药24小时后,将小鼠麻醉处死并立即分离肾脏,取肾脏组织trizol法提取总dna,以gapdh为内参,pcr测定psmd14的相对表达量。另取肾脏组织western blot检测蛋白表达。
46.结果如图1和图2所示,图1是pcr结果,图2是western blot结果。从图中可以看出,相比于假手术组,模型组的psmd14存在显著上调,而在经过间充质干细胞的胞外囊泡处理后,psmd14存在显著的下调表达,且有明显的剂量依赖性。相比之下,sds组中由于十二烷基硫酸钠破坏了囊泡,导致无法有效作用,使得sds组与阴性对照组之间无显著差异。
47.实施例2:psmd14在mspgn细胞模型中的表达
48.2.1细胞增殖模型构建
49.肾小球系膜细胞(mcs)用含10%fbs的1640培养基在37℃/5%co2培养箱中培养,胰酶消化传代。用含2%fbs的1640培养基培养16小时后,加入50ng/ml的血小板源性生长因子-bb(pdgf-bb)或血小板源性生长因子-dd(pdgf-dd)培养24小时诱导细胞增殖。
50.2.2细胞分组处理
51.将细胞分为5组:假手术组(pbs)、阴性对照组(0μg/ml)、低浓度胞外囊泡组(20μg/
ml)、高浓度胞外囊泡组(40μg/ml)和sds组(sds+40μg/ml)。假手术组在诱导细胞增殖过程中采用pbs缓冲液代替pdgf-bb/pdgf-dd,阴性对照组、低浓度胞外囊泡组、高浓度胞外囊泡组和sds组细胞在诱导处理后分别与0μg/ml ucmsc-evs、20μg/ml ucmsc-evs、40μg/ml ucmsc-evs、40μg/ml ucmsc-evs+sds的pbs缓冲液混合处理。
52.2.3表达检测
53.取2.2中处理后的细胞,提取总dna,pcr以gapdh为内参,测定psmd14的相对表达量。另取处理后的细胞western blot检测蛋白表达。
54.结果如图3和4所示,图3是pcr结果,图4是western blot结果。从图中可以看出,相比于假手术组,阴性对照组的psmd14存在显著上调,而在经过间充质干细胞的胞外囊泡处理后,psmd14存在显著的下调表达,并具有一定的剂量依赖性。相比之下,sds组中由于十二烷基硫酸钠破坏了囊泡,导致无法有效作用,使得sds组与阴性对照组之间无显著差异。
55.综合实施例1和实施例2的结果可以看出,mspgn小鼠与细胞模型的psmd14的表达明显升高。
56.实施例3:敲低实验
57.3.1敲低细胞
58.分别取psmd14抑制剂(shpsmd14)及其scrambled阴性对照(scr),根据说明书操作要求转染到ucmscs中,转染24小时后提取ucmsc-evs。用提取到的ucmsc-evs处理pdgf-bb和pdgf-dd诱导的mcs(参考实施例2)。
59.3.2检测
60.分别使用edu细胞增殖检测试剂盒检测mcs的细胞增殖情况,ao/eb染色检测mcs的细胞凋亡情况,结果如图5所示,从图中可以看出,敲低psmd14后,系膜细胞的增殖活性明显受到抑制,而凋亡明显上升。
61.将flag-tgfbr1和ha-ubiquitin质粒共转染hek283,收集并纯化得到泛素化修饰的tgfbr1蛋白,取mcs与泛素化修饰的tgfbr1蛋白在含有10μm atp的条件下37℃反应过夜,反应结束后免疫印记分析。结果如图6所示,从图中可以看出,相比于阴性对照,敲低psmd14后,pdgf诱导的泛素化明显增加。
62.免疫印记分析不同诱导和敲低方式下模型细胞的tgf-β1、磷酸化smad2/smad3的表达,结果如图7所示,从图中可以看出,在pdgf-bb/dd两种诱导条件下的模型细胞在敲低psmd14后,三者的相对水平都显著下降,表明敲低psmd14会使tgf-β1表达和smad2/smad3磷酸化受到明显抑制。
63.实施例4:过表达实验
64.取psmd14的过表达质粒和空载体转入ucmscs中,转染24小时后提取ucmsc-evs。用提取到的ucmsc-evs处理pdgf-bb和pdgf-dd诱导的mcs,得到过表达组(ucevs+oe-psmd14)和对照组(ucevs+oe-nc)。参考实施例3检测其增殖凋亡情况以及tgf-β1、磷酸化smad2/smad3(phos-smad2/3)的表达,结果如图8和图9所示,从图8中可以看出,在间充质细胞中过表达psmd14后,mspgn细胞模型的增殖活性增强,凋亡下降。从图9可以看出,在pdgf-bb/dd两种诱导条件下的模型细胞在过表达psmd14后,tgf-β1、磷酸化smad2/smad3的表达水平都出现了显著的上升,表明过表达psmd14会使tgf-β1表达和smad2/smad3磷酸化受到明显促进,tgf-β信号通路的分子表达明显上升。
65.另外,参考实施例3取过表达psmd14的mcs与泛素化修饰的tgfbr1蛋白在含有10μmatp的条件下37℃反应过夜,反应结束后免疫印记分析。结果如图10所示,从图中可以看出,过表达psmd14后可以抑制tgfbr1在细胞中的泛素化。
66.实施例5:psmd14的诊断价值
67.按照实施例1中的方法诱导mspgn模型小鼠25例,并取正常小鼠25例,麻醉处死后取鼠肾组织提取总dna,pcr检测上述psmd14的相对水平,结果如图11所示,从图中可以看出,模型小鼠和正常小鼠中psmd14的表达水平存在显著差异。该结果表明psmd14在mspgn中具有较强的敏感性。
68.取50例mspgn患者的肾脏穿刺的病理活检样本,pcr检测psmd14的表达水平,根据psmd14的表达水平,应用spss实现三分位数分组,将mspgn患者分成三组(高表达组、中表达组、低表达组),并与mspgn的病理进展进行关联,mspgn的病理分型分为轻度、中度、重度。结果如图12所示,从图中可以看出,随着mspgn的疾病进展,低水平表达组所占比例减少,高水平表达所占比例增加,说明psmd14的表达与mspgn的病理进展呈正相关的关系,卡方检验p=0,表明psmd14在mspgn疾病中具有良好的特异性。
69.综合上述结果以及现有技术中的其它报道,psmd14可能通过去泛素化以维持tgf-β受体的稳定性,进而促进mspgn疾病的进展,如纤维化。因此,可以将psmd14作为治疗mspgn的靶点。
70.上面结合实施例对本技术作了详细说明,但是本技术不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本技术宗旨的前提下作出各种变化。此外,在不冲突的情况下,本技术的实施例及实施例中的特征可以相互组合。
