一种重组状态人源mmp-7蛋白的表达方法及应用
技术领域
1.本发明属于哺乳动物细胞重组蛋白表达技术领域,尤其涉及一种重组状态人源mmp-7蛋白的表达方法及应用。
背景技术:
2.基质金属蛋白酶(mmps)是主要分解细胞外基质成分的蛋白酶,其是一个大家族,各成员之间具有相似的结构及一定的底物特异性。基质溶解素(mmp-7)作为mmps家族成员之一,不仅参与细胞外基质(ecm)、基底膜(bm)降解及细胞表面非基质蛋白分子外功能区脱落,而且还参与肿瘤血管形成及肿瘤细胞凋亡等过程。mmp-7与肺癌细胞的增殖、侵袭、转移、对抗癌化疗药物耐药性及不良预后有密切关系,有助于在肺癌预防、早期诊断及治疗等方面发挥重要作用。此外,基质溶解素(mmp-7)还被确定为肺纤维化的介质和潜在的治疗靶点。
3.现有技术缺点:
4.通常情况下,该蛋白的表达仍以原核表达为主。但是,原核表达容易产生包涵体或者表达的可溶蛋白没有活性。哺乳动物细胞表达也会存在表达在细胞内不分泌的问题,或者蛋白的表达量较少,无法满足后续实验需求。
技术实现要素:
5.针对现有技术存在的问题,本发明提供了一种重组状态人源mmp-7蛋白的表达方法及应用,目的在于解决现有技术中的一部分问题或至少缓解现有技术中的一部分问题。
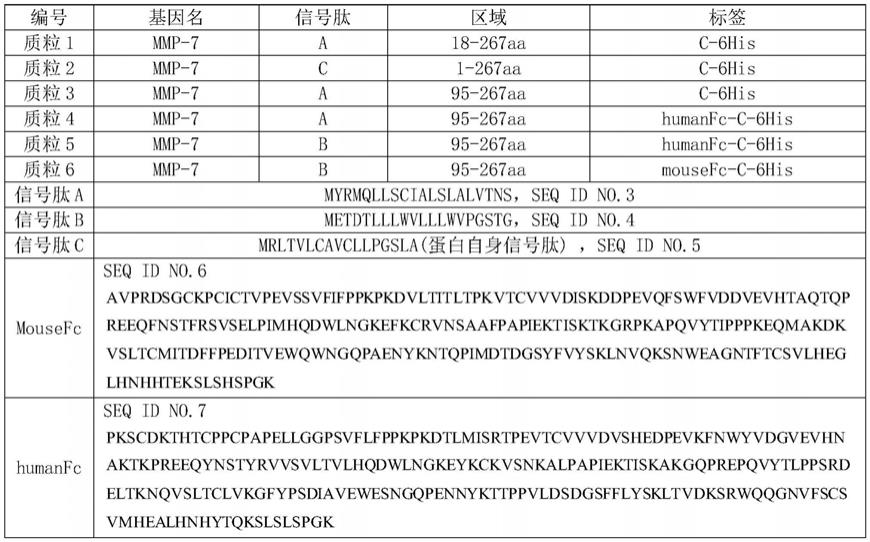
6.本发明是这样实现的,一种重组状态人源mmp-7蛋白的表达质粒,包括能够依次编码信号肽和表达区域的dna序列,所述信号肽和表达区域的氨基酸序列包括以下两种组合中的任一种:
7.a:如seq id no.3所示信号肽+seq id no.2所示氨基酸序列中的第95-267aa;
8.b:如seq id no.4所示信号肽+seq id no.2所示氨基酸序列中的第95-267aa;
9.所述dna序列的c端添加humanfc-c-6his标签或mousefc-c-6his标签;
10.所述mousefc的氨基酸序列如seq id no.6所示;所述humanfc的氨基酸序列如seq id no.7所示。
11.进一步地,编码seq id no.2所示氨基酸序列中的第95-267aa位的核苷酸序列如seq id no.9所示。
12.进一步地,所述表达质粒包括能够编码如seq id no.4所示信号肽+seq id no.2所示氨基酸序列中的第95-267aa的dna序列,所述dna序列的c端添加humanfc-c-6his标签。
13.本发明还提供了一种重组状态人源mmp-7蛋白的表达方法,包括:将如上述的重组状态人源mmp-7蛋白的表达质粒构建至哺乳动物表达载体中,利用哺乳动物细胞真核系统表达目标蛋白。
14.进一步地,所述哺乳动物细胞包括hek293f细胞或expi293f细胞。
15.进一步地,目标蛋白表达后,利用ni纯化柱对带有his-tag标签的蛋白进行纯化。
16.进一步地,细胞转染时采用瞬时转染方式。
17.进一步地,转染过程中,细胞密度为2.6e6/ml。
18.本发明还提供了如述的重组状态人源mmp-7蛋白的表达质粒或表达方法在制备重组状态人源mmp-7蛋白中的应用。
19.综上所述,本发明的优点及积极效果为:
20.本发明中对人源mmp-7重组蛋白设计了3个信号肽和3种标签的组合搭配,最终在信号肽b和humanfc-c-6his标签、信号肽b和mousefc-c-6his标签的共同存在的条件下实现了蛋白的分泌表达。其中信号肽b和humanfc-c-6his标签组合搭配蛋白表达量更佳,经过wb验证及亲和纯化成功获取了mmp-7重组蛋白,表达量约为24.53mg/1000ml cells,后续可优化转染表达工艺从而实现更高的表达量。
附图说明
21.图1是跨膜结构域分析;
22.图2是翻译后修饰分析;
23.图3是三级结构预测;
24.图4是二级结构预测;
25.图5是pcr电泳图;
26.图6是细胞转染效果数据;
27.图7是wb电泳图;
28.图8是蛋白纯化效果图。
具体实施方式
29.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
30.根据本技术包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
31.为了更好地理解本发明而不是限制本发明的范围,在本技术中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。本发明中,“约”指给定值或范围的10%以内,优选为5%以内。
32.本发明下述各实施例中未特别限定温度时,则均为常温条件。常温是指四季中自然室温条件,不进行额外的冷却或加热处理,一般常温控制在10~30℃,最好是15~25℃。
33.本发明中涉及的基因、蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、植物)中产生。
34.本发明披露了一种重组状态人源mmp-7蛋白的表达方法及应用。mmp-7的核苷酸序列如seq id no.1所示,氨基酸序列如seq id no.2所示。本发明中对蛋白可表达性、翻译后修饰、三级结构和二级结构进行分析预测,分析预测结果如图1-4所示。
35.本发明同时提供多种蛋白和抗体的信号肽搭配不同的人源、鼠源和兔源免疫球蛋白fc区域,从而实现该蛋白的分泌表达。针对本发明实现的分泌蛋白的获取,从而在进行其他分泌蛋白的表达时提供了信号肽和标签使用的参考依据。下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述。
36.实施例
37.一、质粒构建
38.1、基因克隆构建
39.目标全长蛋白1-17为信号肽,18-94aa为前导肽活性形式,95-267aa为最终稳定形式。本发明本实施例中将其构建到哺乳动物表达载体中,使用293哺乳动物细胞真核系统表达蛋白。
40.本发明中构建多个不同组合形式的表达质粒如下,且都测序验证正确:
[0041][0042]
18-267aa的核苷酸序列如seq id no.8所示,95-267aa的核苷酸序列如seq id no.9所示。
[0043]
考虑到蛋白后期需要纯化,故在目的基因序列c端添加6his标签,使用primer5进行引物设计,序列如下:
[0044]
primer namesequence5
′‑3′
plasmid 1-fcttgtgactaactctctgccgctgcctcaggaggcgggaggplasmid 1-rtcattactaaccggtctcgagtcagtgatggtgatggtgatgtttctttcttgaattacttctctttcplasmid 2-fatccagcctccggactctagaatgcgactcaccgtgctgtgtgctgtg
plasmid 2-rtcattactaaccggtctcgagtcagtgatggtgatggtgatgtttctttcttgaattacttctctttcplasmid 3-fcttgtgactaactctgaattctactcactatttccaaatagcccaaplasmid 3-rtcattactaaccggtctcgagtcagtgatggtgatggtgatgtttctttcttgaattacttctctttcplasmid 4-fcttgtgactaactctgaattctactcactatttccaaatagcccaaplasmid 4-rggaagtacagattctcctcgagtttctttcttgaattactplasmid 5-ftgccaggctctaccggctactcactatttccaaatagcccaaplasmid 5-rggaagtacagattctcctcgagtttctttcttgaattactplasmid 6-ftgccaggctctaccggctactcactatttccaaatagcccaaplasmid 6-rttatcatcgtcgtcggctttctttcttgaattact
[0045]
2、目的片段的扩增
[0046]
(1)pcr体系(50ul)(武汉爱博泰克生物科技有限公司官网货号:rk20705):
[0047][0048][0049]
(2)pcr扩增反应程序:
[0050][0051]
(3)pcr产物电泳结果如图5所示。利用市场购买的dna回收试剂盒进行pcr产物回收,本实施例中所用试剂盒为康为世纪琼脂糖凝胶dna回收试剂盒,也可以使用本领域中的其他回收试剂盒或试剂等。
[0052]
3、同源重组和转化
[0053]
(1)同源重组(武汉爱博泰克生物科技有限公司官网货号:rm20523)
[0054]
目的片段2ulpcdna3.1(invitrogen)(酶切后)3ul2x multif seamless assembly mix5ul
[0055]
注:目的片段与载体比例根据回收后的浓度决定,摩尔比范围:3:1~10:1
[0056]
(2)转化感受态细胞
[0057]
a.取预冷好的1.5mlep管,放在冰盒上,每管分装100ul-120uldh5
ɑ
感受态(感受态在-80℃冰箱中取,放在冰中融化),加入10ul重组产物(预冷效果更佳)并轻柔的吸打搅拌,加好后冰上放置30min。(此过程在超净台中进行)
[0058]
b.42℃热水浴90s(严格控制时间)
[0059]
c.冰上5min
[0060]
d.加入800ul无抗lb/sob培养基(此过程在超净台中进行)
[0061]
e.37℃,220rmp摇床中复苏45min(严格控制时间)
[0062]
f.5000rmp离心3min,集菌。
[0063]
g.倒掉上清液,留大概200ul菌液,用移液器吸打混匀后加入相应抗性的平板中,倒入4-6颗玻璃珠,轻晃平板将菌液涂布均匀,倒掉玻璃珠,将平板倒置放在37℃培养箱过夜培养。(此过程在超净台中进行)
[0064]
4、菌液pcr鉴定
[0065]
(1)菌落pcr鉴定:20ul体系(武汉爱博泰克生物科技有限公司官网:货号:rk20605)
[0066][0067]
pcr仪扩增反应程序:
[0068]
95℃/5min,(95℃/30s,58℃/30s,68℃/1min)35cycle,68℃/5min
→
4℃∞
[0069]
5、测序
[0070]
挑选正确的阳性克隆采用载体通用引物进行测序验证,测序正确后的表达质粒进行后续的蛋白表达。
[0071]
二、瞬时转染
[0072]
真核细胞hek293f分为瞬时转染和稳定转染。瞬时转染质粒dna进入细胞后不被整合到染色体中,以游离状态表达外源基因。瞬时转染周期短,能够快速获得目的蛋白,能够应用于研发阶段的摸索和大规模高通量筛选蛋白。
[0073]
expi293f(人肾胚上皮细胞)作为哺乳动物细胞高密度表达系统,被广泛应用于表达重组dna蛋白等生物制品的研究开发和规模化生产。
[0074]
1、质粒dna列表
[0075]
编号基因名信号肽区域标签质粒浓度(ng/ul)质粒1mmp-7a18-267aac-6his1100质粒2mmp-7c1-267aac-6his1129质粒3mmp-7a95-267aac-6his1089质粒4mmp-7a95-267aahumanfc-c-6his1290质粒5mmp-7b95-267aahumanfc-c-6his1000质粒6mmp-7b95-267aamousefc-c-6his1200
[0076]
2、细胞转染
[0077]
(1)在培养基中转染前一天以1.3e6细胞/ml分离细胞,细胞体积27ml;
[0078]
(2)在转染之前,将所有试剂置于室温下;
[0079]
(3)转染前,将细胞密度调节到2.6e6/ml;
[0080]
(4)在无菌试管中用1.5ml opti-mem稀释总质粒dna(ug)30ug;
[0081]
(5)将90ul pei(1mg/ml,ph7.1)加入稀释的1.5ml opti-mem中,混匀静置5min;
[0082]
(6)将pei的混合溶液加入到dna的混合溶液中,翻转或移液混合(混匀的过程要求缓慢进行);
[0083]
(7)在室温下孵育20分钟(不要超过);
[0084]
(8)将dna/pei混合物加入细胞中,通过轻轻旋转将它们充分混合,混合后细胞总体积30ml;
[0085]
(9)转染后16-20小时第一次补料1.5ml,96小时后测活率及密度;
[0086]
(10)收获转染后的细胞,收集上清液添加10mm aebsf进行亲和纯化。
[0087]
3、wb验证表达
[0088]
(1)、样品制备:
[0089]
1)取hek293f转染后细胞100ul 3000r/min离心10min;
[0090]
2)离心后取上清20ul加20ul 2*loading buffer制样,97℃加热10min,命名为上清(supernatant);
[0091]
3)沉淀使用100ul pbs进行悬浮后20ul加20ul 2*loading buffer制样,97℃加热10min,命名为细胞(cell);
[0092]
(2)、wb检测
[0093]
1)取上样5ul进行sds-page电泳:根据目的蛋白的分子量的大小选择合适的分离胶浓度。电泳采用恒压模式,5%浓缩胶80v,当marker开始分离大约25min,调至120v,溴酚蓝至分离胶底部终止电泳;
[0094]
2)转膜:组装顺序:转膜夹黑色面(负极)-海绵垫-3层滤纸-胶-膜-3层滤纸-海绵垫-红色面(正极)。转膜时间:200ma、90-180min;
[0095]
3)封闭:转膜完成后标记并洗去转膜液(tbst、5minx2次);清洗干净的膜放入盛有3%脱脂牛奶(tbst配制)的容器中,室温封闭60-90min;
[0096]
4)6his-tag一抗孵育:封闭完成后,倒掉封闭液。加入用3%脱脂牛奶(tbst配制)1:7000稀释的一抗溶液,摇床上平缓摇动,室温孵育2h或4℃孵育过夜(4℃孵育后需室温再孵育15-30min)。一抗孵育完成后,倒掉一抗溶液;用tbst漂洗膜4次,每次5min;
[0097]
5)二抗孵育:一抗孵育完成前,将对应一抗种属的酶标二抗1:5000稀释到实验需要的量(tbst稀释)。将清洗好的膜放入盛有二抗溶液的容器中,摇床上缓慢摇动,于室温孵育60-80min。二抗孵育完成后,倒掉二抗溶液;用tbst漂洗膜4次,每次5min;
[0098]
6)曝光:用镊子将膜从tbst中取出,适当控干,置于凝胶托盘。用ecl solutionⅰ和solutionⅱ等体积混合,均匀加至膜上,完全覆盖。底物与膜反应约30s,置于化学发光成像系统仪。设置的曝光时间为3s;10s;30s;60s;120s。
[0099]
wb检测目的包括:蛋白表达大小是否正确;与高表达样本比较,获取蛋白表达量高/低信息;对于wb中无条带的项目,通过强曝光,如果可以出来条带判定为低表达,无条带的判断为无表达。
[0100]
4、结果分析
[0101]
(1)、细胞转染后分析结果如图6所示。
[0102]
(2)、wb验证结果如下表及图7:
[0103]
编号基因名信号肽区域标签wb验证结果质粒1mmp-7a18-267aac-6his胞内表达质粒2mmp-7c1-267aac-6his胞内表达质粒3mmp-7a95-267aac-6his胞内表达质粒4mmp-7a95-267aahumanfc-c-6his胞内外均有表达,主要在胞内表达质粒5mmp-7b95-267aahumanfc-c-6his胞内外均有表达质粒6mmp-7b95-267aamousefc-c-6his胞内外均有表达
[0104]
5、细胞上清纯化
[0105]
将wb验证质粒4、质粒5、质粒6有分泌表达的细胞上清进行亲和纯化
[0106]
(1)、his纯化流程
[0107]
1)实验材料
[0108]
纯化柱polv-prep@chromatographycolumns:bio-rad731-1550;ni bestarose ff(上海博格隆)。
[0109]
(2)、操作流程
[0110]
1)孵育
[0111]
取出灭菌的10ml纯化柱管,用无内毒素水冲洗柱管1-2次。从4℃冰箱取出ni-ida亲和纯化基质,用移液器吸取0.5ml基质加入纯化柱管中,待乙醇流完后(商品化基质用20%乙醇保存),用无内毒素水清洗6个柱体积。柱体积是指纯化柱中基质的体积,而非柱管的体积。用binding buffer平衡填料6个柱体积。将平衡好的基质加入上清管中,用封口膜封口,置于旋转培养器上,20rpm,4℃,4hr-过夜。
[0112]
2)流穿
[0113]
孵育结束后,将离心管配平离心,600rpm,10min,4℃。将离心后的上清倒入新的离心管中,即为流穿。同时留约5ml的上清用于悬浮基质,将基质转移至纯化柱管中,待流穿流完(此次流穿不用收集)。
[0114]
3)洗脱与洗杂
[0115]
a.向纯化柱管中加入3ml washing buffer洗柱,洗下基质中的杂蛋白。重力流,流出液用灭菌的5ml ep管收集,ep管需要插在冰上保持低温。流完后用g250检测(取100ul g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续加入3ml washing buffer洗柱,直到g250不变蓝,结束washing buffer预洗脱。
[0116]
b.加入0.5ml elution buffer 1洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温。流完后用g250检测(取100ul g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer 1预洗脱。
[0117]
c.加入0.5ml elution buffer 2洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温。流完后用g250检测(取100ul g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer洗脱。
[0118]
d.加入0.5ml elution buffer3洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温。流完后用g250检测(取100ul g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer洗脱。
[0119]
e.加入0.5ml elution buffer4洗柱,洗下与基质结合的蛋白。重力流,流出液用1.5ml无内毒素的ep管收集,收集管需放置在冰盒上保持低温。流完后用g250检测(取100ul g250于96孔板中,加入10μl正在滴出的洗脱液),如果g250变蓝,继续洗脱,直到g250不变蓝,结束elution buffer洗脱。
[0120]
f.将上面收集的流穿与洗脱液制样,一般为6*制样,即20ul蛋白+5ul 6*loading,进行sds-page电泳。
[0121]
4)his-tag标签纯化用缓冲液
[0122]
缓冲液名称成分binding buffer20mm tris-hcl,250mm nacl,10mm imidazole,10%glycero ph 8.0elution buffer120mm tris-hcl,250mm nacl,40mm imidazole,10%glycero ph 8.0elution buffer220mm tris-hcl,250mm nacl,80mm imidazole,10%glycero ph 8.0elution buffer320mm tris-hcl,250mm nacl,250mm imidazole,10%glycero ph 8.0elution buffer420mm tris-hcl,250mm nacl,500mm imidazole,10%glycero ph 8.0
[0123]
5)结果如图8所示
[0124]
质粒4mmp-7a 95-267aa humanfc-c-6his纯化到蛋白浓度较低,表达量约为2.51mg/1000ml cells。
[0125]
质粒5mmp-7b 95-267aa humanfc-c-6his纯化到蛋白,蛋白纯度高,表达量约为24.53mg/1000ml cells。
[0126]
质粒6mmp-7b 95-267aa mousefc-c-6his纯化到蛋白,蛋白纯度高,表达量约为10.2mg/1000ml cells。
[0127]
三、实验结论
[0128]
本发明中对人源mmp-7重组蛋白设计了3个信号肽和3种标签的组合搭配,最终在信号肽b和humanfc-c-6his标签、信号肽b和mousefc-c-6his标签的共同存在的条件下实现了蛋白的分泌表达。其中信号肽b和humanfc-c-6his标签组合搭配蛋白表达量更佳,经过wb验证及亲和纯化成功获取了mmp-7重组蛋白,表达量约为24.53mg/1000ml cells,后续可优化转染表达工艺从而实现更高的表达量。
[0129]
由于基质金属蛋白酶(mmp)是一类锌依赖性内肽酶,可降解细胞外基质(ecm)的成分。mmp7主要由粘膜上皮细胞产生,能够降解各种ecm蛋白,包括蛋白聚糖、纤连蛋白、弹性蛋白和酪蛋白,导致蛋白的实际大小与理论大小存在一定差异。
[0130]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
