一种用于生产重组人il-1ra的工程菌株及制备方法和应用
技术领域
1.本发明涉及基因工程技术领域,具体领域为一种生产重组人白介素1受体拮抗剂的工程菌株及制备方法。
背景技术:
2.1985年,arend等人发现了第一个具有天然拮抗作用的蛋白质,它可以拮抗白细胞介素1(以下简称:il-1)生物学活性的蛋白质,被命名为白细胞介素-1受体拮抗剂(以下简称:il-1ra)。
3.作为白细胞介素-1家族(以下简称:il-1家族)、白细胞介素-1亚家族(以下简称:il-1亚家族)成员之一,il-1ra通过与白细胞介素1受体(以下简称:il-1r)紧密结合,阻断il-1(包括白细胞介素-1α(以下简称:il-1α)和白细胞介素-1β(以下简称:il-1β))与il-1r的结合,从而阻断il-1产生生物学作用,是人体内一个重要的免疫调节因子。
4.il-1在体内发挥着重要的生物学作用,包括:调节免疫反应,诱导炎症反应,调控细胞增殖和分化,调节造血或神经系统和心脏的发育,调节细胞因子分泌,信号转导相关等等。同时il-1家族因子也参与了多种疾病的发病机理,由于il-1α和il-1β功能多样性,其生物活性受到严格调控。在正常情况下,il-1α和il-1β都以低水平表达,转录和翻译水平需要诱导,加工和分泌需要调节,并且该调节步骤的丧失il-1α和il-1β高表达,会导致以发热、皮疹和关节炎为特征的综合征。很多疾病的发生发展都与il-1α和il-1β过渡表达有关,因此通过il-1ra对il-1α和il-1β的拮抗作用,有望治疗/辅助治疗相关疾病,或减轻相关疾病症状。
5.目前包括:(1)眼科:非感染性炎症眼部炎症、干眼病、过敏性结膜炎等;(2)肺脏:各种原因引起的哮喘、慢性阻塞性肺病;(3)肝脏:病毒性肝炎、各种原因的肝损伤(酒精、药物、化学),肝纤维化等;(4)心脏:心肌炎、粥样动脉硬化;(5)神经系统:中风、阿兹海默症、神经炎症;(6)免疫系统:风湿性关节炎、痛风(7)器官移植术后的免疫排斥反应;(8)糖尿病并发症;(9)皮肤疾病。
6.针对il-1靶点目前有两种药物上市分别是:(1)安进公司的阿那白滞素 (anakinra),商品名:kineret,主要成分:重组人il-1ra;(2)诺华公司的卡那单抗(canakinumab),商品名:ilaris ,主要成分:il-1β单克隆抗体。
7.由于,il-1α和il-1β在具体的生物学功能上是存在一些差别的,如:
第一, il-1α通常与其所产生的细胞质膜关系较大,因此只能局部起作用,而il-1β可以全身分泌并循环作用;第二, il-1α表达比较普遍,主要在上皮细胞、角化细胞和内皮细胞中表达,也可以在骨髓细胞表达,il-1β主要由单核细胞和巨噬细胞产生;第三, il-1α在不同部位被各种蛋白酶(包括钙蛋白酶,颗粒酶b和炎性蛋白酶)加工以达到全部活性,相比之下,il-1β主要由先天性免疫细胞在炎性损伤中表达。il-1β前体的细胞内加工依赖于半胱天冬酶-1。
8.第四, 两个基因在发育过程中和对环境的反应是有差别调控,这在免疫反应中导致了这些细胞因子的不同功能。
9.第五, il-1α的前域具有核定位序列,有固有的转录反式激活活性,其通过与组蛋白乙酰转移酶的相互作用而增强,并可影响基因表达模式和细胞存活。
10.因此,对于局部部位的疾病,如但不限于:眼科疾病(非感染性炎症、干眼症、角膜移植后的抗排异反应,减轻眼科手术后的炎症反应,眼部烧伤后炎症反应、前节葡萄膜炎)、耳鼻喉疾病、肺部疾病、关节炎、痛风等等,以及心血管相关疾病等疾病的应用上,rhil-1ra具有比rhil-1β单克隆抗体更好的优势。
11.体外il-1ra 的量必须是 il-1 的 10~100 倍, 才能抑制50%的il-1生物作用。il-1ra的生物半衰期较短,在体内很快被代谢,il-1ra在体内的量需要达到il-1的100~1000倍才能完全抑制il-1的作用。因此,rhil-1ra作为药物治疗时,一次使用的剂量较大,需要较大的生产规模。
12.除此之外,目前现有的工程菌株均为科研级别,大多存在以下两点不足:1.多数的il-1ra的原核表达载体多数载体是以氨苄青霉素(β-内酰胺类抗生素的一种)作为选择剂。2010版《中华人民共和国药典》中明确规定,细胞制备过程中不得使用青霉素或β-内酰胺(β-lactam)类抗生素。因此,具有氨苄青霉素抗性的载体和工程菌株不能满足药品生产的需要;2.异丙基-β-d-硫代半乳糖苷(iptg)作为蛋白表达的诱导剂,iptg价格昂贵,增加生产成本;对大肠杆菌有毒性,影响发酵过程菌体产量;且对人体也具有毒性,若不能完全去除,将影响药物的安全性。尽管现在有人研究使用乳糖等作为iptg的代替物,然而工艺条件控制及表达量均不如iptg理想。
13.基于以上原因,首要需要解决的问题,就是需要一种可以不使用iptg诱导,不用青霉素或β-内酰胺(β-lactam)类抗生素生产,可适用于大规模工业生产的,高表达工程菌株。
技术实现要素:
14.本发明的目的在于提供一种用于生产重组人il-1ra的工程菌株及制备方法和应用。本发明的工程菌株具有表达量高、生产过程中不引入诱导剂、发酵工艺便捷、生产成本低等特点,同时符合《中华人名共和国药典》等相关要求,适用于大规模工艺生产,可用于科研试剂、诊断试剂、药品等生产用原材料。
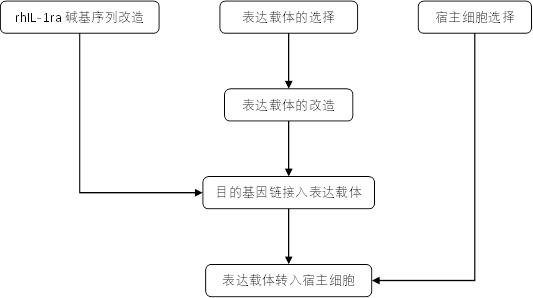
15.为实现上述目的,本发明提供如下技术方案:结合图1所示,一种用于生产重组人il-1ra的工程菌株的制备方法,包括以下步骤:
1、il-1ra碱基序列的改造蛋白在翻译的过程中,需要密码子。密码子总共有64,对应20种氨基酸。因此普遍存在着多个密码子对应同一种氨基酸的现象,甚至最多有6种密码子对应同一个氨基酸。不同的物种之间,对密码子的利用并不是一样的,种属之间的关系越远,密码子利用的差距越大,甚至还会发生缺少某种密码子而无法表达蛋白的情况。人与大肠杆菌之间的种属差距甚远,这也是造成很多重组蛋白表达量低的重要原因。
16.本发明的第一步就是针对人的il-1ra碱基序列进行改造,使之更适合在大肠杆菌中表达。il-1ra全长534bp,如seq id no:6所示,前75个为信号肽。
17.在一些实施方案中,会在去掉信号肽的同时添加起始密码子atg,该方案的序列如seq id no:1所示。
18.经过对序列的分析,得出如表1所示的可改造的碱基位点(表1所采用的序列带有信号肽)。例如,6a》t/c代表第六位碱基a,突变为t或者c。
19.表1在一些实施方案中,不添加起始密码子atg,列突变位点的基因序列编号减3,如:6a》t/c,则为3a》t/c。
20.在一些实施方案中,保留前75个碱基的信号肽。在这个方案中,突变位点的基因序
列号加72,如:6a》t/c,则为78a》t/c。
21.在不同的实施方案中,突变的位点为上表1中112位点中的至少一个。
22.在一些实施方案中,由于突变位点较少且集中,采用pcr点突变的方式获得全基因序列。
23.而在一些实施方案中,由于突变的位点较多且分散,采用全序列合成的方式获得全基因序列。
24.在一些实施方案中,为使目的基因可以连接在载体上,在目的基因的5’端和3’端添加限定内切酶的酶切位点。
25.在一些实施方案中,根据目的不同,在改造后的序列中添加标签、接头序列以及融合蛋白,如:6
×
his,gst、mbp、flag、sumo、c-myc等等。
26.2、载体的选择及改造以大肠杆菌为宿主细胞的原核表达,是重组蛋白在工业生产上最常用的方法之一:其优点在于能够短时间内获得基因表达产物,而且所需的成本相对比较低廉。蛋白表达量大,工艺放大容易。可用于大规模重组蛋白的生产。
27.目前常用的原核表达载体,通常具有如下两点不足:(1)原核表达载体表达蛋白的过程需要进行诱导,通常是使用诱导剂,包括异丙基-β-d-硫代半乳糖苷(iptg)、乳糖等。iptg价格昂贵,增加生产成本;对大肠杆菌有毒性,影响发酵过程菌体产量;且对人体也具有毒性,若不能完全去除,将影响药物的安全性。尽管现在有人研究使用乳糖等作为iptg的代替物,然而工艺条件控制及表达量均不如iptg理想。如能使用不需要诱导剂的表达系统,将大大提高蛋白产量,成品安全性,降低生产成本。
28.(2)多数的原核表达载体多数载体是以氨苄青霉素(β-内酰胺类抗生素的一种)作为选择剂。2010版《中华人民共和国药典》中明确规定,细胞制备过程中不得使用青霉素或β-内酰胺(β-lactam)类抗生素。因此,具有氨苄青霉素抗性的载体和工程菌株不能满足药品生产的需要;基于以上原因,首要需要解决的问题,就是需要一种可以不使用iptg诱导,不用青霉素或β-内酰胺(β-lactam)类抗生素生产,可适用于大规模工业生产的、高表达工程菌株。
29.为此,选用大肠杆菌载体pkpl-3a(该载体由北京大学医学部赠予)进行改造。该载体含有pl启动子,为温控表达载体。该表达载体携带目的基因诱导表达时,通过调节培养温度表达可控制蛋白的表达,不需要添加诱导剂,成本低,无毒无副作用。但原pkpl3a载体所携带的抗生素抗性为氨苄青霉素,不符合在现行的《中华人民共和国药典》中“生产过程中不可以使用青霉素及大环内酯类抗生素”的相关规定,因此需要先对pkpl3a载体进行抗性改造。改造过程分为三步:(1)将pkpl-3a载体上的氨苄青霉素抗性基因从载体上切下来(2)获得卡那霉素抗性基因(3)将卡那霉素抗性基因链接入pkpl-3a载体,获得抗性载体,命名为pkpl-3k。
30.3、构建rhil-1ra表达质粒以未改造的rhil-1ra的基因序列或者以步骤(1)改造获得的rhil-1ra的基因序列,连接到步骤(2)获得的构建好的空载体上。
31.上述步骤的产物用t4连接酶等具有连接作用的dna连接酶进行连接。
32.反应体系:10x连接缓冲液2μl、dna连接酶1-2μl、载体片段1-2μl,pcr反应产物片段1-2μl,双蒸水补足体积至20μl。
33.反应条件:35-40℃水浴保温2-4小时。
34.连接产物可以直接转入感受态细胞,构建工程菌株。
35.4、构建工程菌株及表达选用pop2136菌株作为表达蛋白的宿主菌株,该菌株含有ci857基因,编码对温度较为敏感的
ힴ
阻遏蛋白。低温条件下,
ힴ
阻遏蛋白的存在,目的蛋白的表达被抑制。当温度升到42℃,
ힴ
阻遏蛋白失活,载体上的目的蛋白可以顺利表达。
36.将步骤(3)的连接产物转化感受态细菌pop2136,涂布在含50mg/ml卡那霉素的lb培养琼脂平板上进行卡那抗性克隆的筛选。提取质粒,进行全基因测序。通过sds-page检测、weastblot检测、n端测序等检测手段对工程菌株表达产物进行鉴定。
37.与现有技术相比,本发明的有益效果是:采用本发明方法构建的工程菌株表达量超过20-40%,且无支原体、衣原体感染,不使用青霉素或大环内酯类抗生素,不使用iptg作为诱导剂,符合药品生产的要求,符合大规模、工业化生产蛋白的需求。
38.iptg价格十分昂贵,大规模生产成本很高;同时iptg对人体具有毒性,大量添加时还应考虑在后续工艺将其去除,增加了生产及检测成本。而本发明方法不使用iptg,减少了后续纯化压力,提高了药品质量及安全性,同时节约了生产成本。
附图说明
39.图1为本发明制备方法的工艺流程图。
40.图2为pkpl-3k-rhil-1ra载体示意图。
41.图3为pkpl-3k-rhil-1ra质粒酶切1% tbe agarose dna凝胶电泳图。其中,1:dna marker1(分子标记1),2:na marker2(分子标记2),3: 经sall+kpnl双酶切,4: 经sall+hindlll双酶切,5: pkpl-3k-rhll-1ra载体链接产物。
42.图4为hil-1ra全菌诱导表达page电泳结果(12%page还原电泳)。
43.其中,1:实施例1 中的克隆1工程菌株诱导表达后;2:实施例1的中的克隆1工程菌株诱导表达前;3:实施例1 中的克隆2工程菌株诱导表达后。4:实施例1中的克隆2的工程菌株诱导表达前;5:实施例2中的克隆1的工程菌株诱导表达后;6:实施例2中的克隆1的工程菌株诱导表达前;7:实施例2中的克隆2的工程菌株诱导表达前;8:实施案例2中的克隆2的工程菌株诱导表达后;m:蛋白质标记maker。
44.图5为重组rhil-1ra表达产物的western blot 结果。其中,1: 实施例1;2:实施例2;m:彩色预染蛋白分子量标准。
45.电泳条件:12% page还原电泳;一抗:paa223hu06[uscn],白介素1受体拮抗剂(il1ra)多克隆抗体(武汉优尔生公司)。
[0046]
图6和图7为n/c-端二级质谱图。
具体实施方式
[0047]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完
整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0048]
实施例1 工程菌的构建及诱导表达目的蛋白1、il-1ra碱基序列设计选择了原基因序列作为进行载体构建。
[0049]
以pma刺激的人外周血cdna文库为模板,进行pcr扩增。合成的hil-1ra引物,序列如seq id no:4-5所示。
[0050]
上游引物为: 5'-cgaccctctgggagaaaatcc-3';下游引物为: 5'-cttaagcttactcgtcctcctggaagtgg-3';pcr体系为:10xte缓冲液2μl;dna聚合酶1-2μl;dntp 1-2μl;引物1-2μl;模板dna 1-2μl;双蒸水补足体积至20μl。
[0051]
taq dna聚合酶,热循环条件:90℃-95℃ 3-5min,1个循环;90℃-95℃ 1min-2min,40℃-60℃ 2min-3min,70℃-75℃ 3min-4min,30-35个循环;70℃-75℃ 10-20min,1个循环。利用美国 promega 公司的magic cr 纯化试剂盒纯化il-1ra pcr 产物。
[0052]
2、载体改造1)将pkpl-3a载体上的氨苄青霉素抗性基因从载体上切下来使用双酶切技术将pkpl-3a载体上的氨苄青霉素抗性基因从载体上切下来,限定性内切酶选用sspi和bgl酶。
[0053]
反应条件:10x限定性内切酶缓冲液 2μl、sspi 酶1-2μl、bgl酶1-2μl、pkpl-3a载体1-2μl、双蒸水补足体积至20μl。35-40℃水浴保温2-4小时。
[0054]
0.8%的琼脂糖凝胶电泳,254nm处切胶回收dna片段。
[0055]
2)获得卡那霉素抗性基因kan f:gatcctaggatatcgaaaaaggaagagtatgagccatattcaacgggkan r:gatcctaggccggaagggcttagaaaaactcatcgagcatc用含有kana抗性的质粒(pet30a、pet28a等)作为模板,用引物kan f、kan r(如seq id no:2-3所示)进行pcr。
[0056]
pcr反应体系:10xte缓冲液 2μl;dna聚合酶 1-2μl;dntp 1-2μl;引物1-2μl;模板dna 1-2μl;双蒸水补足体积至 20μl。
[0057]
pcr反应条件: taq dna聚合酶,热循环条件:90℃-95℃ 3-5min,1个循环;90℃-95℃ 1min-2min,40℃-60℃ 2min-3min,70℃-75℃ 3min-4min,30-35个循环;70℃-75℃ 10-20min,1个循环。0.8%的琼脂糖凝胶电泳,254nm处切胶回收dna片段。
[0058]
pcr产物经ecorv和bgli双酶切处理:10x限定性内切酶缓冲液 2μl、ecorv 酶1-2μl、bgl酶1-2μl、pkpl-3a载体1-2μl、双蒸水补足体积至20μl。35-40℃水浴保温2-4小时。0.8%的琼脂糖凝胶电泳,254nm处切胶回收dna片段,获得卡那霉素抗性基因。
[0059]
3)将卡那霉素抗性基因链接入pkpl-3a载体,获得抗性载体,命名为pkpl-3k。
[0060]
上述步骤的产物用t4连接酶等具有连接作用的dna连接酶进行连接。
[0061]
反应体系:10x连接缓冲液2μl、dna连接酶1-2μl、载体片段1-2μl,pcr反应产物片
段1-2μl,双蒸水补足体积至20μl。
[0062]
反应条件:35-40℃水浴保温2-4小时。
[0063]
将连接产物转化感受态细菌(包括但不限于 dh5α,top10,bl21,pop2136,涂布在含50mg/ml卡那霉素的lb培养琼脂平板上进行卡那抗性克隆的筛选。提取质粒,进行全基因测序,将携带基因序列正确的载体的菌株保留。
[0064]
3、构建pkpl-3k-rhil-1ra载体使用rhil-ra的pcr产物用klenow处理,再用 hind iii酶切,处理后的pcr产物,用限定性内切酶hand iii对载体和合成的dna序列进行酶切(如图2所示):a)在两支ep管中分别加入1μg pkpl-3k载体和合成好的1μg il-1ra dna;b)加入10
×
tae缓冲液2μl,hindiii酶液1μl,重蒸水补足体积20μl;c)37℃孵育2-3h,后每管加入0.1mol/ledta(ph 8.0)混匀,停止反应。
[0065]
d)0.8%琼脂糖凝胶电泳,切胶回收酶切后的pkpl-3k载体和il-1ra dna序列;e)在ep管中加入酶切后的pkpl-3k载体100ng、il-1ra dna序列25ng,t4连接酶1μl、5
×
rlb 4μl、双蒸水不足体积至20μl;16℃孵育1h;f)0.8%琼脂糖凝胶电泳,切胶回收链接好的pkpl-3k-rhil-1ra载体;如图3所示。
[0066]
4、将载体转入宿主细胞a)取pop2136的感受态细胞,加入pkpl-3k-rhil-1ra载体1μl,4℃冰浴30min,42℃水浴90s,4℃冰浴5min;b)加入800μllb培养基(不含抗生素),37℃培养45min。
[0067]
c)4℃ 5000rpm离心3min,弃上清。
[0068]
d)加入200μl lb培养基重悬,涂布于lb平板(含卡那霉素),37℃倒置培养12~16h。
[0069]
e)挑取单菌落,加入1ml lb(含卡那霉素)的培养基,37℃培养12h。
[0070]
f)加入500μl 50%无菌甘油,-70℃中保存,即得原始工程菌株。
[0071]
5、工程菌株诱导表达目的蛋白a)取出菌株1ml,加1ml lb培养基(含卡那霉素)30℃活化2h;b)接种于100ml锥形瓶,其中:含20mllb培养基(含卡那霉素),30℃培养6-8h,至od值:0.4~0.8,留取1ml培养液做对照,剩余培养液升温至42摄氏度进行诱导培养,4h。
[0072]
c)4℃ 5000rpm离心3min,弃上清。
[0073]
d)10ml pbs重悬后,4℃ 5000rpm离心3min,弃上清;重复三次;e)-20℃冻存,37℃融化,反复三次。
[0074]
f)超声破碎后,4℃ 5000rpm离心3min,分别保留上清和沉淀。
[0075]
g)15%浓度的sds-page,检测蛋白表达情况,如图4所示。
[0076]
经表达鉴定,该菌株为包涵体表达,表达量约20-30%。
[0077]
①
表达载体及目的基因的基因序列鉴定;对载体测序,经鉴定其载体序列、il-1ra目的基因序列与设计一致。
[0078]
②
目的蛋白免疫源性鉴定采用western blot法鉴定目的蛋白。
[0079]
a)15% sds-page电泳后,转移蛋白至硝酸纤维素(nc)膜;b)封闭液封闭,室温孵育1-2h;
c)鼠抗人il-1ra单克隆抗体(溶于5%脱脂奶粉中)室温孵育1-2h;d)ap标记的兔抗鼠二抗,室温孵育1-2h;e)加入底物,显色。
[0080]
经检测,目标条带位置成阳性反应,如图5所示。
[0081]
③
目的蛋白序列鉴定a)15% sds-page电泳后,转移蛋白至硝酸纤维素(nc);b)丽春红染色后裁剪目的蛋白部分的条带,干燥后,送协和检验所检验;质谱数据经过数据库检索,检索到蛋白的n端为第26位氨基酸,c端完整,n/c-端肽段的二级质谱如图6-7所示。
[0082]
经测序,目的蛋白n端序列与il-1ra氨基酸序列吻合。
[0083]
实施例21、基因序列改造选取如下突变位点进行基因改造:5’去掉起始密码子:atg;3’端添加序列:gcttagg,与尾部形成handiii 的酶切位点。
[0084]
形成新的序列如seq id no:7所示。
[0085]
因突变位点较多,采取全基因合成的方式获得基因序列。
[0086]
2、载体改造,构建pkpl-3k-rhil-1ra载体,将载体转入宿主细胞和工程菌株诱导表达目的蛋白,与实施例1相同。
[0087]
通过对菌株及表达产物进行鉴定,结果如下:westen blot鉴定,该表达产物,可以与il-1ra抗体结合,符合免疫学特征。
[0088]
n端测序结果显示,改造后的经基酸序列与原氨基酸一致,符合预期要求。
[0089]
在表达量上,经过基因序列优化改造之后,该基因序列更适合大肠杆菌的系统的表达。表达量提高了约10%。
[0090]
通过对不同的位点进行核酸序列的优化,蛋白表达均有不同程度的提高,整体优于天然序列。
[0091]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
