sporothermodurans。
9.本发明提供一种表达载体,所述载体以phy系列载体为出发载体,所述载体携带seq id no.2所示的核苷酸序列,或表达氨基酸序列如seq id n0.1所示的4,6-α-葡萄糖基转移酶gtfc。
10.在一种实施方式中,所述phy系列载体为phy300plk。
11.本发明提供一种生产4,6-α-葡萄糖基转移酶gtfc的方法,是将所述重组菌接种至含有80~120ug/ml卡那霉素的lb中在35~39℃、200~220rpm,培养8~10h得到培养液,然后将培养液以培养基体积的5~10%的接种量接种到tb培养基中,先在35~39℃、200~220rpm,培养1.5~3h,当菌体达到一定浓度时,再进行摇瓶诱导发酵得到发酵液,发酵液经高压匀浆破碎后离心,上清即为4,6-α-葡萄糖基转移酶gtfc。
12.在一种实施方式中,所述菌体od
600
在0.5~1.0时进行摇瓶发酵。
13.在一种实施方式中,所述摇瓶发酵的条件为30~35℃、200~220rpm进行摇瓶诱导发酵45~50h。
14.本发明提供了一种制备抗消化型低热量α-葡聚糖的方法,所述方法是以淀粉、淀粉衍生物或含有淀粉的物质为底物,应用氨基酸序列如seq id no.1所示的4,6-α-葡萄糖基转移酶进行酶法转化。
15.在一种实施方式中,所述淀粉包括玉米淀粉、小麦淀粉、大米淀粉、绿豆淀粉、豌豆淀粉、木薯淀粉、马铃薯淀粉和/或红薯淀粉;所述淀粉衍生物包括麦芽糊精、糊精、可溶性淀粉;所述含有淀粉的物质包括大米蛋白肽。
16.在一种实施方式中,先将淀粉、淀粉衍生物或含有淀粉的物质在高温下糊化,制得糊化液,再将糊化液中添加普鲁兰酶,得到反应液,再向反应液中加入氨基酸序列如seq id no.1所示的4,6-α-葡萄糖基转移酶进行反应,反应结束后得到含有α-葡聚糖的反应液。
17.在一种实施方式中,将所述淀粉、淀粉衍生物或含有淀粉的物质配制成质量体积比为15%~25%的悬浊液,在60~80℃下糊化得到糊化液。
18.在一种实施方式中,向糊化液中添加10~80u/g底物的普鲁兰酶,在ph值5.0~7.5、35~40℃下反应20~24h。
19.在一种实施方式中,向利用普鲁兰酶处理过的反应液中添加2500~5000u/g底物的4,6-α-葡萄糖基转移酶。
20.在一种实施方式中,将加入了4,6-α-葡萄糖基转移酶的反应液在ph值5.0~7.5、35~40℃下反应20~24h。
21.本发明提供了4,6-α-葡萄糖基转移酶在制备抗消化型低热量α-葡聚糖和/或含有α-1,6糖苷键的α-葡聚糖中的应用,所述4,6-α-葡萄糖基转移酶的氨基酸序列如seq id no.1所示。
22.本发明提供了含有核苷酸序列如seq id no.2所示的4,6-α-葡萄糖基转移酶的编码基因的表达载体、或表达氨基酸序列如seq id no.1所示的4,6-α-葡萄糖基转移酶的宿主细胞在制备含有抗消化型低热量α-葡聚糖和/或含有α-1,6糖苷键的α-葡聚糖的产品中的应用。
23.在一种实施方式中,所述表达载体包括但不限于pet系列、duet系列、pgex系列、phy300、phy300plk、ppic3k或ppic9k系列载体;所述宿主细胞包括但不限于枯草芽孢杆菌、
大肠杆菌、毕赤酵母或酿酒酵母。
24.本发明的有益效果:
25.本发明的方法以淀粉或含淀粉体系为底物,经高温糊化、同时添加普鲁兰酶脱支后,向反应液中添加bacillus sporothermodurans 4,6-α-葡萄糖基转移酶gtfc进行反应合成一种富含79%α,1-6糖苷键比例的α-葡聚糖,这种α-葡聚糖产物在体外消化模拟实验中表现出低葡萄糖量释放的抗消化能力,这种性质可以满足食品、保健品或化妆品等领域中对低能量抗水解能力的需求。
附图说明
26.图1为4,6-α-葡萄糖基转移酶gtfc最适温度。
27.图2为4,6-α-葡萄糖基转移酶gtfc最适ph。
28.图3为4,6-α-葡萄糖基转移酶gtfc底物特异性,m表示标品,纵向的g1~g7分别表示标准样品的葡萄糖以及麦芽二糖到麦芽七糖;横向的g1~g7分别表示葡萄糖以及麦芽二糖到麦芽七糖,s表示蔗糖,g2'表示异麦芽二糖、g3'表示异麦芽三糖、n表示黑曲霉二糖、p表示潘糖,pol表示多糖聚合物。
29.图4为4,6-α-葡萄糖基转移酶gtfc产物特异性;表示核磁共振一维氢谱1hnmr。
30.图5为4,6-α-葡萄糖基转移酶gtfc产物特异性;表示高效凝胶过滤色谱hpgfc。
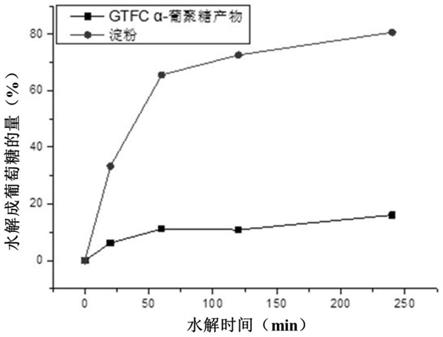
31.图6为4,6-α-葡萄糖基转移酶gtfcα-葡聚糖产物体外消化模拟葡萄糖水解曲线。
具体实施方式
32.下面结合具体实施方式对本发明的技术方案做进一步说明,但本发明所保护范围不局限于此。
33.实施例中所述的培养基配方如下:
34.lb培养基(g/l):蛋白胨10,酵母提取物5,nacl 10。
35.tb培养基(g/l):蛋白胨10,酵母粉24,甘油5,k2hpo4.3h2o 16.43,kh2po
4 2.31。
36.rm培养基(g/l):酵母提取物5.0,胰蛋白胨10.0,nacl 10.0,山梨醇90.0,甘露醇70.0。
37.实施例中所述的耐高温普鲁兰酶均购自山东隆科特酶制剂有限公司,酶活为2000u/ml。
38.胶回收试剂盒购自天根生化科技(北京)有限公司,质粒提取试剂盒购自天根生化科技(北京)有限公司。
39.酶活的定义及测定方法:
40.用碘法测定4,6-α-葡萄糖基转移酶的突变体总酶活:1g/l直链淀粉母液:40mg的直链淀粉加入2ml的蒸馏水充分润湿,加入2ml的2m的naoh溶液,漩涡振荡充分溶解;用时取500μl的直链淀粉母液加250μl的2m的hci溶液,然后加入3250μl的磷酸-柠檬酸缓冲液(ph7.0)配成0.125%的底物。
41.鲁戈碘液:0.26g碘与2.60g碘化钾溶于10ml的容量瓶中(提前3天配制,确保碘完全溶解);用时取100μl的鲁戈碘液,加入50μl的2m的hcl溶液然后补水到26ml配成碘显色液。
42.反应时,取200μl的底物于1.5ml离心管中,35℃温浴10min。加入200μl的4,6-α-葡萄糖基转移酶酶液35℃反应10min,反应结束后取200μl反应液加入到3800μl的碘显色液中显示5min,分光光度计测定660nm下的吸光度。对照用缓冲液代替酶液,空白取200μl的缓冲液加入到3800μl的碘显色液中显示5min。
43.一个相对酶活单位定义为,单位时间吸光值下降一个百分点为一个酶活单位。
44.酶活计算公式:
45.酶活(u/ml)=[100
×
稀释倍数
×
(a
对照-a
实验
)]/[10minх0.1mlх(a
对照-a
空白
)]。
[0046]
薄层色谱(tlc)检测方法:在tlc silica gel 60f254,aluminium sheets 20x 20cm上进行薄层色谱(tlc)分析,选择正丁醇:乙酸:水(2:1:1,v/v)的溶剂系统作为展开剂。将20-30μg的反应混合物和混合标样(g1-g7)分别点样在tlc板上,然后将板在展开剂中运行8-10h。当展开剂靠近tlc薄板顶部时取出自然干燥,重复此过程两次以完全分离g1-g7。喷上5%硫酸乙醇显色液,然后在95℃加热10-30分钟后观察斑点。
[0047]
实施例1:重组质粒phy300plk-gtfc的构建
[0048]
化学合成核苷酸序列如seq id no.2所示的目的基因4,6-α-葡萄糖基转移酶基因(gtfc)
[0049]
片段,构建重组质粒phy300plk-gtfc。具体步骤如下:
[0050]
pcr引物:d-f和d-r,下划线处分别为限制性酶nde i酶和bamh i酶的酶切位点。
[0051]
d-f:ccatggggtacacgagcaatacaaatc,seq id no.3;
[0052]
d-r:aagcttacttaacggtaaccgtaaactt,seq id no.4。
[0053]
pcr体系为:20μm引物d-f和d-r各0.5μl,dntpmix 4μl,5xps buffer 10μl,2.5u/μl的primestar聚合酶0.5μl,模板0.5μl,加双蒸水补齐50μl。
[0054]
pcr条件:94℃预变性4min;98℃变性10s,55℃退火10s,72℃延伸4min,30个循环。
[0055]
将pcr产物进行胶回收、加a纯化后与克隆载体pmd18t于16℃连接过夜,转化e.coli jm109,涂布在含有氨苄(100μg/ml)抗性的lb平板,37℃培养10-12h,挑取转化子,提取重组质粒并双酶切验证,然后对验证正确的重组质粒测定dna序列,阳性克隆子即pmd18t-gtfc-jm109。
[0056]
酶切回收目的基因,将其与表达载体phy300plk进行双酶切,并于16℃连接过夜,转化e.coli jm109,涂布含有卡那霉素(100μg/ml)抗性的lb平板,37℃培养10-12h,挑取转化子,提取重组质粒并双酶切验证,然后对验证正确的重组质粒测定dna序列,阳性克隆子即phy300plk-gtfc。
[0057]
实施例2:重组质粒phy300plk-gtfc的枯草芽孢杆菌转化
[0058]
将重组质粒phy300plk-gtfc转化到提前制备好的bacillus subtilis cctcc no:m2016536感受态中,得到基因工程菌bacillus subtilis cctccm 2016536(phy300plk-gtfc),涂布含卡那霉素(100μg/ml)抗性的lb平板上,经37℃培养10-12h。挑选单菌落至含卡那霉素(100μg/ml)抗性的10ml液体lb培养基中,37℃培养8h,保存甘油管,贮存于-80℃冰箱。测序验证正确后进行摇瓶发酵产酶。
[0059]
实施例3:摇瓶发酵产酶
[0060]
将实施例2中得到的重组枯草芽孢杆菌菌株接种于lb培养基中,在37℃下培养8h后,以5%接种量转接至50ml tb发酵培养基中,先放至37℃、200rpm恒温培养1-2h,在菌体
od
600
在0.5-1.0时转至33℃、200rpm进行摇瓶诱导发酵48h。发酵结束后,将发酵液经超声破碎后离心,上清即为重组枯草芽孢杆菌所产的4,6-α-葡萄糖基转移酶酶液。
[0061]
测定酶液酶活,经测定,4,6-α-葡萄糖基转移酶gtfc酶活为436.1u/ml。
[0062]
最适ph和最适温度测定:在37℃下测定gtfc最适ph,范围从ph4.0-10.0,其中ph4.0-8.0选择磷酸柠檬酸缓冲液,ph8.0-9.0选择tris-hcl缓冲液,ph9.0-10.0选择gla-naoh缓冲液;最适温度在ph7.0下测定,范围25℃-50℃。
[0063]
在上述条件下,测得gtfc酶最适ph和最适温度分别为ph 7.0,40℃(见图1和图2)。
[0064]
实施例4:4,6-α-葡萄糖基转移酶gtfc底物特异性研究
[0065]
用25mm庶糖、黑曲莓糖、潘糖、异麦芽糖、异麦芽三糖、葡萄糖和具有不同聚合度(g2-g7)的麦芽低聚糖单独温育纯化的bacillus sporothermoduransctfc酶。所有反应均在ph7.0的磷酸-柠檬酸缓冲液缓冲液中进行(含1mm cacl)。在37℃下进行10小时后将样品加热至100℃10min终止反应。最后用薄层色谱(tlc)检测反应的进行情况。
[0066]
在上述条件下检测到gtfc不能利用单独的异麦芽二糖、异麦芽三糖、蔗糖、黑曲霉二糖、潘糖、葡萄糖底物,当底物聚合度为麦芽二糖及以上时,gtfc能够进行转苷/歧化反应(见图3)。
[0067]
实施例5:4,6-α-葡萄糖基转移酶gtfc的酶转化抗消化型低热量α-葡聚糖制备中的应用。
[0068]
包括如下步骤:
[0069]
(1)将淀粉加水调成20%的悬浊液,升温至60-80℃糊化,冷却至37℃,调节ph值7.0
±
0.5,同时添加普鲁兰酶30-50u/g底物(淀粉)和4,6-α-葡萄糖基转移酶2500-5000u/g底物(淀粉),放入恒温式水浴摇床,37℃反应24h;
[0070]
(2)反应结束后95℃,20min灭酶;
[0071]
将反应产物冷却后8000rpm离心20min取上清,0.45μm滤膜过滤后喷雾干燥,最终得到淡
[0072]
(3)黄色粉末α-葡聚糖成品。
[0073]
实施例6:4,6-α-葡萄糖基转移酶gtfcα-葡聚糖产物nmr光谱分析
[0074]
将40mg bacillus sporothermoduransctfc产物与500μl d2o(99.9原子%d)混合,超声处理5分钟以完全溶解样品。在avance iii 400mhz数字nmr光谱仪(bruker biospin international ag)上记录样品的一维1h和13c核磁共振(nmr)光谱,温度为60℃。将三甲基甲硅烷基丙酸(tmsp 0.03%)溶解在样品中作为内标,以校准化学位移(δ)并通过在δ5.38和δ4.99处的信号峰面积的积分来估计α-1,4和α-1,6键的百分比。
[0075]
在上述条件下检测到gtfc产物的α-1,4和α-1,6键的百分比为21%:79%(见图4)。
[0076]
该产物是一种连续α-1,6键连接的线性α-葡聚糖,具有高α-1,6键比例。
[0077]
实施例7:4,6-α-葡萄糖基转移酶gtfcα-葡聚糖产物分子量测定
[0078]
采用高效凝胶过滤色谱法(hpgfc)来确定产物的分子量。使用配备有2414示差折光检测器的waters 1525高性能液相色谱系统进行hpgfc分析,并用empower3工作站记录和处理色谱数据。使用ultrahydrogel tm linear(300mm
×
7.8mm,内径
×
2)凝胶过滤柱进行分离,柱温为45℃。以0.9ml/min的流速注入50μl的样品,并以0.1m nano3作为流动相。从购买的dextran标准溶液(180da,2700da,9750da,36800da和135350da)用
作标准溶液。
[0079]
在上述条件下检测到gtfc产物的平均分子量为5383da(见图5)。
[0080]
实施例8:体外消化模拟实验测定α-葡聚糖的抗水解能力
[0081]
混合水解酶的配置:称取2g的猪胰酶,加人24ml的蒸馏水悬浮,用漩涡振荡器4℃振荡10min充分混匀,离心后(1500
×
g,10min)吸取20ml上清液,加入0.4ml的葡萄糖苷酶以及3.6ml的蒸馏水,充分混匀即得混合水解酶。
[0082]
将用4,6-α-葡萄糖基转移酶gtfc制备的α-葡聚糖产物以及淀粉底物分别配成4%(w/v)浓度,取1ml于5ml离心管中37℃温浴10min,加入1ml的混合水解酶于37℃下温浴,分别在0min、20min、60min、120min、240min时取0.1ml的反应液加入到0.3ml的90%乙醇溶液中终止反应,离心(10000
×
g,10min)取上清液god法测定葡萄糖含量。分别计算酶转化产物和淀粉底物在混合水解酶的水解作用下0min、20min、60min、120min、240min的葡萄糖转化率。
[0083]
与淀粉相比,经过gtfc酶转化后的产物其对混合水解酶的抗消化能力明显提高(图6),在水解酶作用下0-240min之内极其缓慢的速率被水解,240min后只有16%的成分被水解成葡萄糖,而底物淀粉则被快速水解,60min之内就有66%的成分被水解成葡萄糖,240min后80%的成分被水解成葡萄糖。gtfc的α-葡聚糖产物具有抗消化且低量释放葡萄糖的性质,这种性质是由其高比例的α-1,6键决定的,这种α-1,6键在人体肠道中比较难被水解酶水解,因此具有低热量的特性。
[0084]
可以被用来添加到低热量食品饮料中,食用后既可以增加饱腹感,又可以防止血糖短时间快速上升,减少热量的摄入,并且还有相当一部分未被人体消化吸收的成分可以到达结肠供益生菌生长繁殖。
[0085]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
