1.本发明涉及生物技术领域,尤其是涉及一种福式志贺氏菌特异基因的引物组及其应用。
背景技术:
2.痢疾或细菌性痢疾是通过粪-口途径感染的急性感染性腹泻,以其高发病率(36.4/1000)和高死亡率(2.9/10万)威胁着全球的公共卫生系统。据估计,由志贺菌属细菌引起的志贺氏细菌性痢疾每年在全球引起1.65亿人感染,五岁以下的幼儿占比较高。志贺菌属细菌根据抗原结构的不同分为痢疾志贺氏菌、福式志贺氏菌、鲍氏志贺氏菌和宋内志贺氏菌4种,分别对应于a、b、c和d亚群。研究发现,福式志贺氏菌感染的死亡率显著高于其它三种,约60%的细菌性痢疾是由福式志贺氏菌引起的。
3.目前,病原菌的检测主要依靠常规的细菌学培养方法、免疫学方法、核酸探针技术、pcr等。细菌学培养方法需经富集培养、选择性分离、形态特征观察、生理生化反应、血清学鉴定等过程,一般需4-7天,操作繁琐、费时耗力,并且存在敏感性低、特异性差、无法检测受损菌及死菌等缺陷;免疫学方法易污染,交叉反应比较严重,存在假阳性多、灵敏度偏低等问题;核酸探针检测技术最大的优点是特异性强,但也存在灵敏度不够高、检测一种菌就需制备一种探针等缺陷。常规pcr方法检测的灵敏度和特异性都能有所保障,但其检测时间长,需要昂贵的pcr控温仪器等配套仪器,不能很好地用于床旁检测(poct)。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供一种福式志贺氏菌特异基因的引物组及其应用,该福式志贺氏菌特异基因的引物组能够简便、可视化、快速、准确地对福式志贺氏菌进行检测,具有灵敏度高、特异性好等优势。
6.本发明提供一种福式志贺氏菌特异基因的引物组,包括seqidno:1所示的外引物f3和seqidno:2所示的外引物b3,具体如下:
7.外引物f3:tgttggcgcatctgatgg(seqidno:1);
8.外引物b3:gccaatctcttcggaggc(seqidno:2)。
9.进一步地,本发明的福式志贺氏菌特异基因的引物组还包括seqidno:3所示的内引物fip和seqidno:4所示的内引物bip,具体如下:
10.内引物fip:
11.cgctgaagtactgctctccgcttttagagccacgactatgctgt(seqidno:3);
12.内引物bip:
13.ctggtgacaataacccggaccattttaggaggatcctgctcaagc(seqidno:4)。
14.本发明还提供上述福式志贺氏菌特异基因的引物组在福式志贺氏菌检测中的应用。
15.本发明还提供一种福式志贺氏菌检测试剂盒,包括上述福式志贺氏菌特异基因的引物组。
16.在一实施方式中,福式志贺氏菌检测试剂盒包括:外引物f3、外引物 b3、2
×
pcr mix和去核酸酶水。
17.在另一实施方式中,福式志贺氏菌检测试剂盒包括:外引物f3、外引物b3、内引物fip、内引物bip、lamp 2
×
master mix和去核酸酶水。
18.本发明提供一种福式志贺氏菌检测方法,采用上述外引物f3、外引物 b3进行pcr检测或者采用上述外引物f3、外引物b3、内引物fip、内引物bip进行lamp检测。
19.具体地,pcr检测体系为:2
×
pcr mix 12.5μl,10μm的外引物f3 和外引物b3各1.0μl,模板dna 1.0μl,加去核酸酶水补足25μl。pcr 检测条件为:94℃预变性5分钟;94℃变性30秒,58℃退火30秒,72℃延伸30秒,30个循环;最后72℃延伸7分钟。
20.具体地,lamp检测体系为:lamp 2
×
master mix 12.5μl,内引物fip 和内引物bip各1.6μm,外引物b3和外引物f3各0.2μm,模板dna 1.0 μl,加去核酸酶水补足25μl。lamp检测体系为:65℃扩增30分钟。
21.上述lamp(环介导等温扩增)检测方法是一种新的核酸扩增方法,其特点是根据一个目的基因或序列的6个区域设计4条引物,从而能够极大地保证扩增的特异性。同时,由于扩增反应是在60-72℃的恒定温度条件下用链置换dna聚合酶进行的,15-60分钟即可完成扩增。上述扩增过程产生大量的花椰菜状dna主产物,同时产生焦磷酸镁和氢离子等副产物。扩增产物可以通过琼脂糖凝胶电泳进行检测;为了克服气溶胶污染,lamp 结果还可以通过荧光信号、浊度甚至肉眼进行检测。上述lamp检测方法具有不依赖于仪器、扩增速度快、特异性强、耐受抑制剂等优势。
22.本发明利用生物信息学寻找出福式志贺氏菌特异基因,并针对其设计 lamp引物组,建立了福式志贺氏菌的lamp可视化检测方法,实现了简便、可视化、快速、准确的检测出福式志贺氏菌的目的。
23.相比于pcr等变温扩增技术,本发明采用的lamp技术可以恒温进行,不依赖于仪器,用时更短,更有利于poct;相比于pcr等基于一对引物进行的病原体核酸检测技术,本发明采用的lamp技术是针对靶标的6个序列所设计4条引物,准确度更高;同时,本发明采用的可视化lamp技术通过氢离子变化反映扩增反应是否进行,能通过肉眼对扩增结果进行观察,阳性扩增和阴性扩增结果区分明显,扩增结果判读更简单明了且不会造成环境气溶胶污染。
24.本发明的方法能够改善常规病原体pcr核酸扩增检测易污染、耗时长、仪器依赖严重等缺陷,通过将lamp的高效、特异扩增与酚红ph指示剂结合在一起,以福式志贺氏菌为检测对象,构建了一管式、无污染、方便、快捷、准确、灵敏的检测方法,具有灵敏度高、特异性好等显著优势。
附图说明
25.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前
提下,还可以根据这些附图获得其他的附图。
26.图1为pcr鉴定体系的特异性检测结果;
27.图2为pcr鉴定体系的灵敏度检测结果;
28.图3为lamp优化体系可视化结果;
29.图4为lamp优化体系琼脂糖凝胶电泳结果;
30.图5为lamp鉴定体系的特异性检测可视化结果;
31.图6为lamp鉴定体系的特异性检测琼脂糖凝胶电泳结果;
32.图7为lamp鉴定体系的灵敏度检测可视化结果;
33.图8为lamp鉴定体系的灵敏度检测琼脂糖凝胶电泳结果。
具体实施方式
34.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
35.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也包括复数形式,此外,还应当理解的是,当在本说明中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
36.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.实施例1特异性靶基因筛选及引物设计
38.1.1本地blast分析
39.从ncbi(http://www.ncbi.nlm.nih.gov/genome/)中下载福式志贺氏菌全基因组序列,对本地的核酸数据库进行本地blast检索,获取得到菌种各序列片段与数据库的比对结果。
40.1.2blast重确认
41.使用在线blast功能,使用2种策略确认其菌种特异性和菌种鉴定可用性。一种策略为blast时排除目的菌种,结果显示无任何相似序列者为目的菌种特异基因;第二种策略为blast时选择在目的菌种内进行检索,结果返回大量相似序列者是目的菌种的不同菌株共有序列。结合两种策略,最终找出符合两种策略标准的目的基因。
42.1.3引物设计
43.本试验以福式志贺氏菌的假说蛋白基因(hypothetical protein),genbank 登陆号为ae014073(4170556..4171068)设计特异引物。
44.特异引物通过在线设计特异性寡核苷酸引物工具 primerexplorerv5software(https://primerexplorer.jp/lampv5/index.html)设计完成,包括一对外引物和一对内引物;
45.一对外引物如下:
46.外引物f3:tgttggcgcatctgatgg(seq id no:1);
47.外引物b3:gccaatctcttcggaggc(seq id no:2)。
48.一对内引物如下:
49.内引物fip:
50.cgctgaagtactgctctccgcttttagagccacgactatgctgt (seq id no:3);
51.内引物bip:
52.ctggtgacaataacccggaccattttaggaggatcctgctcaagc (seq id no:4)。
53.上述外引物和内引物可用于lamp检测,上述外引物还可用作pcr反应的上、下游引物,用于福式志贺氏菌的pcr鉴定。
54.实施例2检测方法的建立
55.1.dna的提取
56.用天根生化科技(北京)有限公司细菌基因组dna小量提取试剂盒进行抽提回收,步骤如下:
57.①
取细菌培养液5ml,10,000rpm离心1分钟,尽量吸净上清。
58.②
向菌体沉淀中加入200μl缓冲液ga,振荡至菌体彻底悬浮。
59.③
向管中加入20μl proteinase k溶液,混匀。
60.④
加入220μl缓冲液gb,振荡15秒,70℃放置10分钟,溶液应变清亮,简短离心以去除管盖内壁的水珠。
61.⑤
加入220μl无水乙醇,充分振荡混匀15秒,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
62.⑥
将上一步所得溶液和絮状沉淀都加入一个吸附柱cb3中(吸附柱放入收集管中),12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。
63.⑦
向吸附柱cb3中加入500μl缓冲液gd,12,000rpm离心30秒,倒掉废液,将吸附柱cb3放入收集管中。
64.⑧
向吸附柱cb3中加入600μl漂洗液pw,12,000rpm离心30秒,倒掉废液,吸附柱cb3放入收集管中。
65.⑨
重复操作步骤8。
66.⑩
将吸附柱cb3放回收集管中,12,000rpm离心2分钟,倒掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
67.将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加200μl洗脱缓冲液te,室温放置2分钟,12,000rpm离心2分钟,将溶液收集到离心管中。
68.2.阳性质粒载体构建及获得
69.(1)靶序列pcr扩增
70.以福式志贺氏菌的基因组dna为模板,对特异基因进行pcr扩增,将其扩增产物进行琼脂糖凝胶电泳验证。
71.(2)目的产物的回收
72.从琼脂糖凝胶中切下目的片段,用天根生化科技(北京)有限公司的小量琼脂糖凝胶dna回收试剂盒进行抽提回收,步骤如下:
73.①
柱平衡步骤:向吸附柱cb2中(吸附柱放入收集管中)加入500μl 的平衡液bl,
12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱cb2 重新放回收集管中。
74.②
估计pcr反应液或酶切反应液的体积,向其中加入5倍体积的结合液pb,充分混匀。
75.③
将上一步所得溶液加入一个吸附柱cb2中(吸附柱放入收集管中),室温放置2分钟,12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱cb2放入收集管中。
76.④
向吸附柱cb2中加入600μl漂洗液pw,12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱cb2放入收集管中。加入后静置2-5分钟再离心。
77.⑤
重复操作步骤4。
78.⑥
将吸附柱cb2放回收集管中,12,000rpm离心2分钟,尽量除去漂洗液。将吸附柱cb2置于室温放置数分钟,彻底地晾干,以防止残留的漂洗液影响下一步的实验。
79.⑦
将吸附柱cb2放入一个干净的离心管中,向吸附膜中间位置悬空滴加50μl洗脱缓冲液eb,室温放置2分钟。12,000rpm离心2分钟收集dna 溶液。
80.(3)连接、转化及筛选
81.1)大肠杆菌dh5α感受态细胞的制备
82.①
挑取单个dh5α菌落,接种于3ml不含氨苄青霉素的lb培养基中, 37℃培养过夜,次日取上述菌液按比例1:100再接种于50ml lb培养基中, 37℃振荡2小时。当od600值达到0.35时,收获细菌培养物。
83.②
将细菌转移到一个50ml预冷的无菌聚丙烯管中,冰上放置10分钟,使培养物冷却。
84.③
于4℃下4100rpm离心10分钟,吸出培养液,并将管倒置l分钟以使残留的培养基流尽。
85.④
每50ml初始培养液且30ml预冷的0.1mol/l cacl
2-mgcl2溶液 (80mmol/l mgcl2,20mmol/l cacl2)重悬细胞沉淀。
86.⑤
于4℃下4100rpm离心10分钟,吸出上清液,并将管倒置l分钟以使残留的液体流尽。
87.⑥
每50ml初始培养物用2ml预冷的0.1mol/l cacl2溶液重悬细胞沉淀,分装后备用。
88.2)连接到simple载体
89.①
在微量离心管中加入1μlsimple载体和4μl目的基因的pcr产物进行混合。
90.②
37℃反应5分钟。反应结束后,将离心管置于冰上。
91.3)转化dh5α
92.①
全量(5μl)加入至50μl dh5α感受态细胞中,冰浴30分钟。
93.②
42℃加热30秒后,再冰浴2分钟。
94.③
加入37℃温浴过的lb培养基250μl,培养60分钟(37℃,200 rpm)。
95.④
取100μl涂布于含有氨苄青霉素的lb培养基上,37℃培养过夜以形成单菌落。
96.4)阳性克隆的筛选
97.挑取上述单菌落于含氨苄青霉素的lb培养基中,37℃缓慢振荡培养4 小时,以
m13f(tgtaaaacgacggccagt)和m13r(caggaaacagctatgacc)测序引物进行菌落pcr扩增。对扩增产物用1.5%琼脂糖凝胶电泳后紫外观察,将经pcr验证正确的阳性克隆送上海生物工程有限公司进行测序。
98.5)阳性质粒提取
99.挑取上述单菌落于含氨苄青霉素的lb培养基中,37℃缓慢振荡培养4 小时,进行pcr扩增。扩增引物及扩增条件同前述最优反应条件。将经pcr 确证的阳性克隆,接种于lb液体培养基,37℃,160rpm培养过夜。取每个菌株过夜培养液5ml,用天根生化科技(北京)有限公司小量质粒提取试剂盒进行质粒抽提,具体操作步骤如下:
100.①
取5ml过夜培养的福式志贺氏菌菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1分钟,尽量吸除上清。
101.②
向留有菌体沉淀的离心管中加入150μl溶液p1,使用移液器或涡旋振荡器彻底悬浮细菌沉淀。
102.③
向离心管中加入150μl溶液p2,温和地上下翻转8次使菌体充分裂解。
103.④
向离心管中加入350μl溶液p5,立即快速地上下颠倒混匀20次,充分混匀,12,000rpm离心2分钟。
104.⑤
将上一步收集的上清液用移液器转移到吸附柱cp3中(吸附柱放入收集管中),12,000rpm离心30秒,倒掉收集管中的废液,将吸附柱cp3 放入收集管中。
105.⑥
向吸附柱cp3中加入300μl漂洗液pwt,12,000rpm离心30秒,倒掉收集管中的废液,将吸附柱cp3放入收集管中。
106.⑦
将吸附柱cp3放入收集管中,12,000rpm离心1分钟。
107.⑧
将吸附柱cp3置于一个干净的离心管中,向吸附膜的中间部位滴加 50μl洗脱缓冲液tb,12,000rpm离心30秒。
108.6)阳性质粒浓度测定
109.打开thermo scientific biomate 3s紫外分光光度计,预热15分钟;选定mode方式为dsdna,将比色杯用超纯水反复洗几次后加入60μl te缓冲液调零;将te缓冲液完全吸出,然后加入待测样品(2μl样品加入58μlte缓冲液),选定稀释倍数为30倍进行测定,读取质粒dna浓度。
110.7)质粒数目换算及梯度稀释
111.阳性质粒测完浓度后,分别根据其所测浓度换算成质粒拷贝数目。质粒拷贝数目换算公式为:
[0112][0113]
式中:x为质粒浓度ng/μl;y为目的产物碱基对数;na为阿伏伽德罗常数;3829为载体碱基对数;660为碱基平均分子量。
[0114]
取已知浓度的质粒进行10倍梯度稀释到底。
[0115]
3.建立pcr鉴定体系
[0116]
(1)pcr条件优化
[0117]
pcr具体反应体系为:2
×
pcr mix 12.5μl,10μm的上游引物和下游引物(即外引物f3、外引物b3)各1.0μl,模板dna 1.0μl,加去核酸酶水补足25μl。
[0118]
(2)在pcr仪中按以下程序扩增:
[0119]
预变性94℃5分钟;94℃30秒,58℃30秒,72℃30秒,30个循环;终延伸72℃7分钟。
[0120]
(3)特异性检测
[0121]
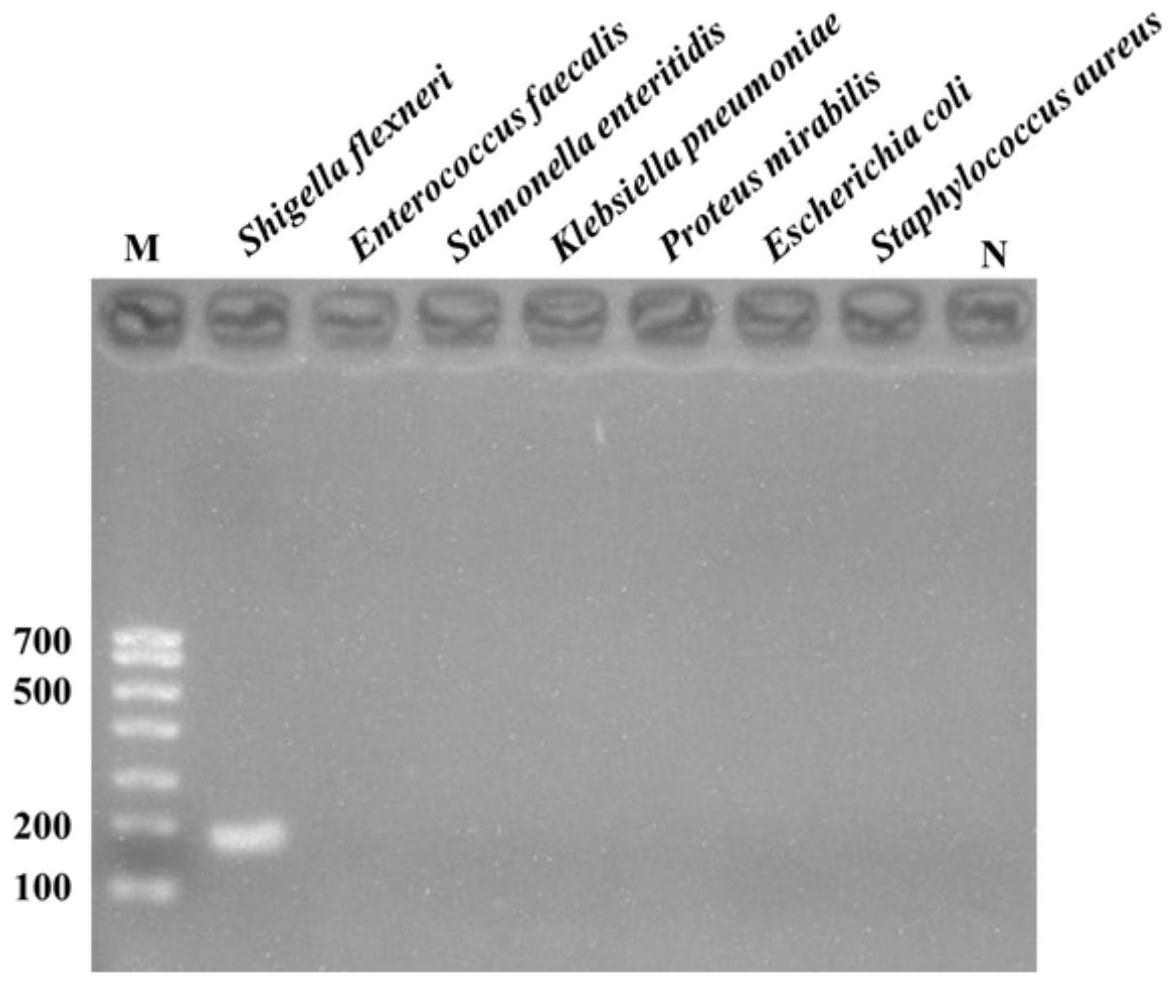
收集福式志贺氏菌分离株20株、粪肠球菌分离株12株、肠炎沙门氏菌分离株20株、肺炎克雷伯菌分离株15株、奇异变形杆菌分离株10株、大肠杆菌分离株16株、金黄色葡萄球菌分离株23株(以上菌株来自于昆明医科大学附属延安医院),使用细菌基因组提取试剂盒进行基因组提取,优化pcr反应条件后进行特异性检测,结果如图1所示。
[0122]
图1示出pcr鉴定体系的特异性检测结果;结果表明:粪肠球菌、肠炎沙门氏菌、肺炎克雷伯菌、奇异变形杆菌、大肠杆菌、金黄色葡萄球菌扩增均为阴性,福式志贺氏菌扩增均为阳性,表明本发明中所用的引物特异性良好。
[0123]
(4)灵敏度检测
[0124]
利用构建好的质粒进行10倍梯度稀释后作为模板进行pcr扩增,其反应体系和反应程序如上所述,结果如图2所示。
[0125]
图2示出pcr鉴定体系的灵敏度检测结果;结果显示:本发明中的pcr 的鉴定体系的灵敏度为7
×
102拷贝数/μl质粒。
[0126]
4.建立lamp鉴定体系
[0127]
(1)lamp反应建立和优化
[0128]
反应体系为12.5μl warmstart colorimetric lamp 2
×
master mix,内引物fip和bip各1.6μm,外引物b3和f3各0.2μm,模板dna 1.0μl,加去核酸酶水补足25μl。反应条件:65℃扩增30分钟。通过优化反应以缩减反应成本,反应总体积从5-25μl进行优化,结果如图3、图4所示。
[0129]
图3、图4示出lamp优化体系的可视化结果和琼脂糖凝胶电泳结果;结果表明:反应体积减少对扩增效果无明显影响,后续实验可以反应总体积10μl进行。
[0130]
(2)特异性检测
[0131]
收集福式志贺氏菌分离株20株、粪肠球菌分离株12株、肠炎沙门氏菌分离株20株、肺炎克雷伯菌分离株15株、奇异变形杆菌分离株10株、大肠杆菌分离株16株、金黄色葡萄球菌分离株23株(以上菌株来自于昆明医科大学附属延安医院),使用细菌基因组提取试剂盒进行基因组提取,优化lamp反应条件后进行特异性检测,结果如图5、图6所示。
[0132]
图5、图6示出lamp鉴定体系的特异性检测的可视化结果和琼脂糖凝胶电泳结果;结果表明:福式志贺氏菌扩增呈阳性,粪肠球菌、肠炎沙门氏菌、肺炎克雷伯菌、奇异变形杆菌、大肠杆菌、金黄色葡萄球菌扩增均呈阴性,说明本发明的引物组特异性良好。
[0133]
(3)灵敏度检测
[0134]
利用构建好的质粒进行10倍梯度稀释后作为模板进行lamp扩增,其反应体系和反应程序如上所述,结果如图7、图8所示。
[0135]
图7、图8示出lamp鉴定体系的灵敏度检测的可视化结果和琼脂糖凝胶电泳结果;结果表明:本发明中的lamp的鉴定体系的灵敏度为7
×
100拷贝数/μl质粒。
[0136]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进
行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
