1.本发明涉及蝎毒素生物活性多肽技术领域,具体涉及一种条斑钳蝎毒素多肽组分的制备方法及其应用。
背景技术:
2.白癜风(vitiligo)是一种病因不明的色素脱失性自身免疫性皮肤病,以表皮中功能性黑素细胞进行性的破坏、丢失引起的白斑为主要特征,治疗周期长并无特效治疗,在世界上发病率约为0.5%-2%。治疗要点主要是使皮损部位黑色素再生,从而恢复正常的皮肤颜色。目前白癜风发病机制尚未完全阐明,它的发生与功能性黑素细胞缺失密切相关,主要病理生理原因包括遗传易感性、氧化应激介导的黑素细胞损伤、黑素细胞自身免疫破坏、交感神经反应增强和儿茶酚胺/神经递质介导的黑素细胞损伤、黑素细胞粘附或黑素细胞损伤受损、以及炎症、激素等理论。越来越多的研究支持白癜风与异常的免疫反应存在密切联系、在遗传因素和环境刺激的作用下正常的皮肤免疫反应可能发生失调,并导致表皮功能性黑色素细胞(mc)的特异性损伤,最终发展为白癜风。
3.近年来很多学者支持白癜风为自身免疫疾病、并得到了广泛重视,自身免疫异常可能导致白癜风。多项研究表明,白癜风患者在其他自身免疫和炎症条件下的发病率(高达25%)更高。包括ai甲状腺疾病(aitd)、i型糖尿病、恶性贫血(pa),类风湿性关节炎(ra)、斑秃(aa),特应性皮炎(ad)、阿狄森氏病、牛皮癣、疱疹样皮炎,腹腔疾病,统性红斑狼疮(sle)等。多项研究还表明,部分中药制剂对白癜风患者的免疫系统具有良性调节作用,治疗白癜风也取得了很好的效果。因此,临床上用免疫调节剂治疗白癜风被广泛采用,他克莫司软膏作为典型的外用免疫调节剂通过影响角质形成细胞而促进黑色素细胞的生长,并辅助创造黑色素细胞迁移的环境,在临床上他克莫司对面积较小的白癜风疗效较好。从已报道的病例来看,中药确实有较好的治疗白癜风功效,而且凡是经用中药治疗见效的白癜风患者很少出现副作用及反弹现象。
4.治疗白癜风的最终目的是预防黑素细胞的持续性破坏,并提供能够刺激现有黑素细胞生长和增殖的介质,从而达到复色。黑色素是由黑素细胞(mc)产生并储存在黑素体中,然后转移到角质形成细胞中,从而决定肤色。黑色素生成是一个多步骤的生理过程,最终生成深色聚合物黑色素。在哺乳动物黑素生成途径中涉及3种主要酶;酪氨酸酶(tyr)、酪氨酸酶相关蛋白1(trp-1,又称gp75糖蛋白或gp75)和酪氨酸酶相关蛋白2(trp-2,又称多巴achrome tautomerase或dct),这三种酶共同作用可调节黑色素的类型和数量。
5.全蝎(scorpion)长期以来作为我国传统中医的一种名贵虫类药材,始载于《维吾尔药志》、《中药大辞典》、《本草纲目》和《药典》,其全躯皆可入药。中华本草-维吾尔药卷记载,全蝎具有治疗白癜风、皮肤白斑等疾病,尤其在白癜风治疗方面作用显著,具有良好的临床应用前景。全蝎的毒性成分主要来自尾部的蝎毒液,蝎毒液化学成分为蛋白质和多肽类等,其中约有10万种不同的神经毒素,已报道的仅有500余种,其蕴藏着大量结构新颖、活性独特的多肽,它是多肽新药开发的资源库,具有很大的探索空间。
6.随着科学技术的发展,从20世纪60年代末期开始,大量能作用于不同离子通道类型的蝎离子通道毒素多肽陆续得到分离和鉴定,这些工作主要由国外学者研究完成。在蝎毒的科学研究我国起步较晚,直到20世纪80年代末我国学者才开始关注我国蝎毒素的药用基础研究,分离、纯化并鉴定了抗癫痫、镇痛等活性多肽。20世纪90年代,国内武汉大学、中国科学院上海生物化学研究所及上海生理研究所等研究团队开始规模、系统开展我国蝎毒素多肽研究,在蝎毒素的产生、性质、功能与进化及其应用方面取得了较好的成绩。目前。我国蝎毒素研究处于国际领先水平,与墨西哥、比利时形成了三足鼎立的现状。
7.中国科学院动物研究所朱顺义研究员课题组从中国产条斑钳蝎毒腺组织中分离和鉴定了两个并系同源的抗微生物肽新基因,系统地完成了序列、结构、功能和进化的研究。此外,该课题组研究人员从这类毒素物种选择性的进化机制研究入手,通过选用我国宁夏产条斑钳蝎的钠通道毒素mt-5为模型,完成了系统性的定点突变分析,免疫效应分子研究领域中取得了新的进展。俄罗斯生物学家通过研究得出结论,条斑钳蝎的蝎毒可用于治疗自身免疫性疾病和某些类型的癌症,并建立了毒分子与钾通道的相互作用。petricevich等人研究表明,蝎子毒素对小鼠免疫细胞的作用是通过增加细胞因子tnf-a、ifn-g、il-6、il-1和il-10等细胞因子来实现的。eder等人研究了毒液对免疫器官(骨髓、淋巴结和脾脏)和腹膜腔的细胞性以及体外细胞增殖的影响。
8.条斑钳蝎(mesobuthus eupeus)作为我国新疆乃至中亚的特有品种,资源丰富,功效突出,但其多肽药效物质基础及其作用机理研究尚空白,这使得条斑钳蝎毒素既是当前中药药效物质研究的热点,又是民族医药和民间医药学开发多肽类新药的突破点。
技术实现要素:
9.本发明目的在于,提供一种条斑钳蝎毒素多肽组分的制备方法及应用,该方法以条斑钳蝎毒素为研究对象,电刺激法提取粗毒素,采用冷冻干燥机、凝胶色谱、离子交换色谱、透析分离制备得到条斑钳蝎毒素多肽组分。通过试验表明:本发明分离制备方法更科学化,得到了纯度较高的蝎毒素多肽组分,生产工艺更简单及合理,使产品质量有了进一步保障,为蝎毒素多肽的进一步研究提供合格的原料药,也将为治疗白癜风疾病药物的开发及蝎毒资源可持续利用提供有力的科学依据。
10.本发明所述的一种条斑钳蝎毒素抗白癜风多肽组分的制备方法,按下列步骤进行步骤:
11.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为4-6伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
12.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
13.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
14.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清
液;
15.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为30-100mg,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离得到六个多肽组分;
16.f、将步骤e中的六个多肽组分分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
17.g、将步骤f中的干燥粉末分别溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,流速为0.6-1.2ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
18.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
19.i、将步骤h中的脱盐溶液分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
20.所述方法制备的条斑钳蝎毒素多肽组分s1、s2、s3、s4、s5和s6在制备治疗白癜风药物中的应用。
21.条斑钳蝎毒素多肽组分s3和s4在制备治疗白癜风药物中的应用。
22.本发明所述的一种条斑钳蝎毒素抗白癜风多肽组分的制备方法,该方法首先按照频率为128赫兹,电压为4-6伏电刺激取毒液,采用低温真空冷冻干燥技术获得粗毒素干粉;将粗毒素在ph 6.5-8.45,20mm醋酸铵缓冲液中溶解,离心取上清液;对溶于醋酸铵缓冲液的毒素上样量为30-100m的条件下进行hw-55f凝胶色谱柱层析、在流速0.6-1.2ml/min的条件下进行cm-650m离子交换色谱层析、过滤分子量为1000da规格的透析袋透析除杂,得到六种纯化蝎毒高纯度多肽组分,分别命名为s1、s2、s3、s4、s5和s6,得率分别为:12.39%、10.46%、15.82%、18.21%、16.74%和6.51%,并对其进行抗白癜风活性筛选及分子量分布分析,活性结果表明,当样品浓度10μg/ml(n=3)时,s3和s4的相对黑色素含量分别为134.7
±
9.871%,135.6
±
7.549%,均高于阳性对照8-mop-50μm(n=3)黑色素含量133.4
±
7.1957%。质谱结果表明,s3组分主要含有3262.73、4105.36、4927.06和7333.19da分子量的多肽,s4组分主要含有3780.10、3980.33和7272.58da分子量的多肽本发明制备方法更简单实用,生产工艺更趋合理,为治疗白癜风疾病药物的开发及蝎毒资源可持续利用提供有力的科学依据。
附图说明
23.图1为本发明使用凝胶色谱纯化条斑钳蝎毒素的色谱图;
24.图2为本发明使用阳离子交换色谱纯化条斑钳蝎多肽部位的色谱图;
25.图3为本发明条斑钳蝎分离纯化的六个组分的15%sds-聚丙烯酰胺凝胶电泳图;
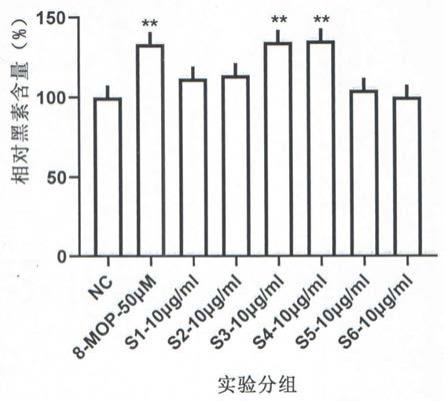
26.图4为本发明条斑钳蝎毒素凝胶过滤分离得到的6个多肽组分对黑色素含量的影响,其中nc空白对照,pc阳性对照(8-mop),与阴性对照相比,**p《0.01,***p《0.001,n=3;
27.图5为本发明经过初筛后具有抗白癜风活性的条斑钳蝎毒素多肽组分s3和s4对黑素含量梯度活性图,其中**与空白对照组(nc)比较,p《0.01;***与空白对照组(nc)比较,p《0.001;****与空白对照组(nc)比较,p《0.0001;
28.图6为本发明经过初筛后具有抗白癜风活性的条斑钳蝎毒素多肽组分s3和s4对酪氨酸酶梯度活性图,其中**与空白对照组(nc)比较,p《0.01;***与空白对照组(nc)比较,p《0.001;****与空白对照组(nc)比较,p《0.0001;
29.图7为本发明条斑钳蝎毒素凝胶过滤色谱分离的s3组分分子量测试图谱;
30.图8为本发明条斑钳蝎毒素凝胶过滤色谱分离的s4组分分子量测试图谱。
具体实施方式
31.下面结合实施例及附图对本发明作进一步详细的描述,但这些举例性实施方式的用途和目的仅用来列举本发明,并非对本发明的实际保护范围构成任何形式的任何限定,更非将本发明的保护范围局限于此。
32.实施例1
33.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为4伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
34.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
35.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
36.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
37.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为30mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
38.f、将步骤e中的六个多肽组分用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
39.g、将步骤f中的干燥粉末溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为0.8ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
40.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
41.i、将步骤h中的脱盐溶液用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
42.实施例2
43.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为5伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接
触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
44.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
45.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
46.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
47.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为50mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
48.f、将步骤e中的六个多肽组分分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
49.g、将步骤f中的干燥粉末分别溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为0.8ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
50.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
51.i、将步骤h中的脱盐溶液用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
52.实施例3
53.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为6伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
54.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
55.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h。得到总的粗毒素干粉;
56.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
57.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为100mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
58.f、将步骤e中的六个多肽组分分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
59.g、将步骤f中的干燥粉末分别溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,
ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为0.8ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
60.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
61.i、将步骤h中的脱盐溶液分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
62.实施例4
63.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为4伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
64.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
65.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
66.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
67.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为80mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
68.f、将步骤e中的六个多肽组分分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
69.g、将步骤f中的干燥粉末分别溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为0.6ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
70.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
71.i、将步骤h中的脱盐溶液分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
72.实施例5
73.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为5伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
74.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
75.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
76.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
77.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为70mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
78.f、将步骤e中的六个多肽组分分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
79.g、将步骤f中的干燥粉末溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为0.9ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
80.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
81.i、将步骤h中的脱盐溶液分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
82.实施例6
83.a、用高频弱电流刺激法刺激蝎子尾节,采用小型按摩仪采毒,将连续感应电刺激档调频到128赫兹,电压为6伏,用一个电极夹住蝎子的一个触肢,再用一个金属夹夹在蝎子后腹部第5节处,用另一个电极不断接触金属夹,便有毒液排出,若无反应,在电极与蝎体接触的部位滴上几滴生理盐水,使蝎子毒囊腺体肌肉收缩,促其排毒,得到粗毒液;
84.b、将步骤a得到的粗毒液,先用蒸馏水洗后,再放入含冰水50ml的离心管收集尾刺所排出的粗毒液;
85.c、将步骤b中提取的粗毒液,用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为48h,得到总的粗毒素干粉;
86.d、将步骤c中的粗毒素干粉,溶于20mm,ph 8.45醋酸铵溶液,震荡10min,在温度4℃静止1h,之后离心,离心温度为4℃,离心时间为10min,离心转速为8000rpm/min取上清液;
87.e、将步骤d中的上清液,用20mm,ph 8.45醋酸铵平衡的tsk hw-55f凝胶柱,上样量为60mg,凝胶柱子规格为2.5x100cm,流速为0.6ml/min,洗脱液为20mm,ph8.45醋酸铵,按分子量分离出六个多肽组分;
88.f、将步骤e中的六个多肽组分用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个多肽部位干燥粉末;
89.g、将步骤f中的干燥粉末分别溶于5ml 20mm,ph 8.45醋酸铵溶液中,用20mm,ph8.45醋酸铵溶液平衡cm-650m阳离子交换柱,离子交换柱的规格为2.5x15cm,流速为1.2ml/min,以10%-50%的氯化钠20mm醋酸铵溶液梯度洗脱,按离子强度分离得到六个高纯度的多肽部位;
90.h、将步骤g中的六个高纯度多肽部位,分别在温度4℃环境下用冷蒸水透析,每4h换一次透析溶液,共替换8次,得到六个多肽部位的脱盐溶液;
91.i、将步骤h中的脱盐溶液分别用真空冷冻干燥机冻干,冷冻干燥温度为-80℃,压力为10pa,时间为24h,得到六个高纯度多肽固体,分别命名为s1、s2、s3、s4、s5和s6。
92.实施例7
93.将实施例1-6所得到的六个多肽组分检测对细胞内酪氨酸酶活性的影响和细胞内相对黑色素含量的变化以验证条斑钳蝎毒素在治疗白癜风方面的靶点:
94.实验方法:
95.1)细胞培养:小鼠黑素瘤细胞b16(本室传代冻存),达尔伯克氏改良伊格尔培养基(dmem)+10%胎牛血清(fbs)+1%青霉素/链霉素培养细胞至饱和度达90%以上时,弃培养基,1
×
磷酸缓冲液(pbs)洗涤1次,根据培养面积大小加入0.5-2ml胰酶消化,镜下观察细胞边缘开始皱缩变圆时(约1min),培养基终止消化后轻轻吹打使细胞脱壁,细胞计数仪进行细胞计数,调整细胞密度至2.0
×
105cells/ml接种于直径150mm细胞培养皿中,置温度37℃,浓度5%co2培养箱内培养;
96.2)六个多肽组分抗白癜风活性初筛:以细胞内相对黑色素含量变化作为指标测定样品康白癜风活性,黑色素含量测定参照文献(cho,jun等.2017)的方法操作:b16黑素瘤细胞接种于6孔板中、浓度设为2
×
105个/孔,各孔加2ml细胞悬浮液;接种12h后细胞完全贴壁,弃去dmem培养基,加入全新dmem培养基并加入s1,s2,s3,s4,s5和s6六个多肽部位,每个实验组浓度为10μg/ml,并设置溶剂对照组二甲亚砜(dmso)2μl/孔和阳性对照组50μm的8-甲氧补骨脂素(8-mop),每个浓度组设置3个复孔,于温度37℃,浓度5%co2恒温培养箱中培养72h,弃去培养基,每孔加入100μl ripa裂解液,用细胞刮收集细胞至1.5ml离心管中,置于旋转仪使细胞和裂解液充分混匀40min再进行12000
×
rpm,4℃离心22min;上清用二辛可酸(bca)法检测总蛋白浓度c,在沉淀中加入190μl的1n naoh溶液,置温度80℃水浴中1h后,用酶标仪测定在波长为405nm处各实验组的吸光度值,黑色素含量采用相对值,即黑素相对含量=黑素od405/蛋白浓度c;黑素生成激活率=实验组黑素相对含量/溶剂对照组黑素相对含量
×
100%,结果见表1;
97.表1
[0098][0099]
注:**与空白对照组(nc)比较,p《0.01.
[0100]
3)活性多肽部位s3,s4不同剂量对细胞内黑色素含量影响:黑色素含量测定参照文献(cho,jun等.2017)的方法操作:b16黑素瘤细胞接种于6孔板中、浓度设为2
×
105个/孔,各孔加2ml细胞悬浮液;接种12h后细胞完全贴壁,弃去dmem培养基,加入全新dmem培养基并加入s3,s4两个多肽部位,按照浓度1、10、50μm加样,并设置溶剂对照组二甲亚砜(dmso)2μl/孔和阳性对照组50μm的8-甲氧补骨脂素(8-mop),每个浓度组设置3个复孔,于温度37℃,浓度5%co2恒温培养箱中培养72h,弃去培养基,每孔加入100μl ripa裂解液,用细胞刮收集细胞至1.5ml离心管中,置于旋转仪使细胞和裂解液充分混匀40min再进行12000
×
rpm,4℃离心22min;上清用bca法检测总蛋白浓度c,在沉淀中加入190μl的1nnaoh溶液,置温度80℃水浴中1h后,用酶标仪测定在波长为405nm处各实验组的吸光度值,黑色素含量采用相对值,即黑素相对含量=黑素od405/蛋白浓度c;黑素生成激活率=实验组黑素相对含量/溶剂对照组黑素相对含量
×
100%,结果见表2;
[0101]
表2
[0102]
[0103]
4)活性多肽部位s3,s3对细胞内酪氨酸酶活性影响测定:采用酪氨酸酶多巴速率氧化法:b16黑素瘤细胞接种于6孔板中、浓度设为2
×
105个/孔,各孔加2ml细胞悬浮液;接种12h后细胞完全贴壁,弃去dmem培养基,加入全新dmem培养基并加入s3,s4两个多肽部位,按照浓度1、10、50μm加样,作用48h,弃去培养基,每孔加入100μl含有1%脱氧胆酸钠+0.1%tritonx-100溶液的pbs缓冲液中裂解,用细胞刮收集细胞至1.5ml离心管中,放入温度﹣20℃冰箱中冷冻20min,再放置室温溶解后,温度4℃,12000rpm,离心20min,此时可以配制10mm左旋多巴(l-dopa)溶液,配置完成后避光室温放置,转移3μl上清至96孔酶标板用bca试剂检测总蛋白浓度c;转移90μl上清至96孔酶标板,再加入10μl,10mm的l-dopa,温度37℃避光孵育至各孔有浅棕褐色出现,迅速在490nm处测定od值;酪氨酸酶相对含量=酪氨酸酶od490/蛋白浓度c;酪氨酸酶相对激活率=实验组酪氨酸酶相对含量/溶剂对照组酪氨酸酶相对含量
×
100%;结果见表3;
[0104]
表3
[0105][0106]
实施例8
[0107]
将所得到经过活性筛选的两个条斑钳蝎多肽部位的s3和s4利用液质联用lc/ms分析分子量分布,具体实验方法如下:
[0108]
本实验是通过基质辅助激光解吸电离飞行时间质谱(5800maldi-tof/tof)对蝎毒素多肽组分的相对分子质量进行分析,提供确定蛋白质相对分子质量的实验数据:
[0109]
1)点样:取适量s3,s4至样品靶上,自然干燥后,再取a-氰基-4-羟基肉桂酸(chca)基质溶液点至对应靶位上并自然干燥,用相同方法在样品靶位相邻位置点标准品;
[0110]
2)校准:在正离子模式下选择线性方法对样品测试范围进行校准测试;
[0111]
3)测试样品:在正离子模式下选择线性方法测试样品分子量;
[0112]
4)质谱数据及图谱处理:基质辅助激光解析电离飞行时间质谱(maldi-tof/tof)产生的原始数据及图谱由4000series explorer v3.5软件导出。
[0113]
通过本发明所述方法获得的条斑钳蝎毒素在流速为0.3-0.6ml/min条件下进行了hw 55f凝胶色谱柱层析,分子量范围在1000-3500da规格的透析袋透析除杂,得到了六种纯化蝎毒多肽组分,分别命名为s1、s2、s3、s4、s5和s6,得率分别为:12.39%、10.46%、
15.82%、18.21%、16.74%和6.51%,并对其进行了抗白癜风活性筛选及分子量分布分析;活性结果表明:当样品浓度10μg/ml(n=3)时,s3和s4的相对黑色素含量分别为134.7
±
9.871%,135.6
±
7.549%,均高于阳性对照8-mop-50μm(n=3)黑色素含量133.4
±
7.1957%;质谱结果表明:s3组分主要含有3262.73、4105.36、4927.06和7333.19da分子量的多肽,s4组分主要含有3780.10、3980.33和7272.58da分子量的多肽;之后又利用流速为0.6-1.2ml/min的阳离子交换色谱,获得了纯度更高的多肽类化合物。本发明制备方法更简单实用,生产工艺更趋合理,为治疗白癜风疾病药物的开发及蝎毒资源可持续利用提供有力的科学依据。
[0114]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
