一种靶向pd-l1的多肽及其应用
技术领域
1.本发明是申请号为201910480489.x,名称为“一种靶向pd-l1的多肽及其制备方法和应用”的专利申请的分案申请。本发明涉及分子生物学和医药技术领域,具体涉及一种靶向程序性死亡配体-1(pd-l1)的多肽及其制备方法和应用。
背景技术:
2.随着肿瘤学、免疫学以及分子生物学等相关学科的快速发展和相互渗透,肿瘤免疫治疗已发展成为一种新的、重要的抗肿瘤治疗手段。与以往的手术治疗、化药治疗、放射治疗和靶向治疗不同,肿瘤免疫治疗通过激活人体自身免疫系统来对抗肿瘤。目前,针对免疫检查点的抑制剂在多种实体瘤的治疗中表现出了较好的临床效果,使人们认识到免疫治疗能够真正成为恶性肿瘤治疗的重要工具。肿瘤免疫治疗有多种治疗策略,包括非特异性免疫刺激剂、肿瘤疫苗、过继性免疫细胞疗法,以及单抗治疗。由于肿瘤具有极大的异质性和遗传不稳定性,其发病机制复杂,单独依靠某一种治疗手段难以达到理想的抗肿瘤效果,因此在深入研究不同治疗手段之间相互作用机制的基础上,联合肿瘤靶向治疗和不同类型免疫治疗的抗肿瘤策略有可能是未来肿瘤免疫治疗的发展方向。
3.肿瘤免疫治疗的核心是激活肿瘤患者t淋巴细胞的抗肿瘤反应,以提高其对肿瘤细胞的杀伤功能。t细胞介导的细胞免疫在识别和杀伤肿瘤细胞的过程中起着重要的作用,t细胞对肿瘤细胞有明确的靶向性和特异性,能通过识别并聚集到肿瘤抗原表达的部位而产生长程免疫应答反应,直接抑制和杀伤肿瘤细胞。树突状细胞(dendritic cell,dc)在t细胞识别过程中发挥至关重要的作用。t细胞通过t细胞受体(tcr)与肿瘤细胞表面的带有特异性抗原的主要组织相容性复合体(mhc)结合,从而识别肿瘤细胞。tcr和mhc分子的相互作用受到一系列免疫检查点的控制,可以使t细胞激活或抑制。其中,程序性死亡受体1(pd-1)和程序性死亡配体-1(pd-l1)通路是抑制性免疫检查点,它们结合可以使t细胞的免疫活性受到抑制,在免疫耐受中发挥重要作用,这也是肿瘤细胞免疫逃逸的重要原因。
4.程序性死亡配体-1(programmed death receptor ligand-1,pd-l1,又称为b7-h1)是程序性死亡因子-1(programmed death-1,pd-1)的配体,在1992年首次作为基因被发现并进行了克隆,是典型的负性协同刺激分子,其可转录诱导t细胞程序化死亡,是目前免疫学研究领域的热门对象之一。pd-l1主要表达于抗原提呈细胞、b细胞、t细胞、上皮细胞、肌细胞、内皮细胞及各种肿瘤细胞(pd-l1表达于人类多种肿瘤细胞表面,例如肺癌、黑素瘤、非小细胞肺癌、肝癌、卵巢癌、食管癌、乳腺癌等),并参与肿瘤相关的免疫反应。pd-l1属于b7家族的ⅰ型跨膜蛋白,是由290个氨基酸亚基组成的跨膜蛋白,胞外段为两个免疫球蛋白恒定区ig c和ig v样结构域。在肿瘤免疫微环境中,pd-l1作为一个代表性的负性共刺激分子,其通过与t淋巴细胞表面pd-1结合,诱导免疫受体酪氨酸抑制基序的磷酸化,在体内外均能促进抗原特异性人类t细胞克隆的凋亡,抑制t细胞的增殖分化和诱导效应t细胞的耗竭。肿瘤细胞可异常上调pd-l1以及pd-1的表达,抑制t细胞的免疫活性,造成肿瘤免疫逃逸,导致肿瘤发生、发展。高表达pd-l1的肿瘤患者预后差、生存率低。综上所述,pd-l1参与
了肿瘤的发生、发展过程,并协助肿瘤细胞逃避机体免疫系统的杀伤作用,使肿瘤可进一步恶化。pd-1/pd-l1信号通路在肿瘤免疫中起到关键性作用,同时也为肿瘤免疫治疗提供了新的分子靶标。因此,阻断pd-1/pd-l1信号通路、重新激活机体免疫系统对肿瘤的杀伤作用,改造肿瘤赖以生存的“土壤”成为了新的恶性肿瘤治疗热点。
5.近年来,针对pd-1/pd-l1的抗体药物研究比较深入,部分药物已经市场化。目前,阻断pd-1/pd-l1通路的免疫检查点抑制剂主要分为两大类:(1)针对pd-1的单克隆抗体,nivolumab和pembrolizumab;(2)针对pd-l1的单克隆抗体,bms-936559、mpdl3280a、atezolizumab、avelumab和durvalumab。在临床试验中,目前,pd-1或pd-l1单克隆抗体已经在多种实体瘤如黑色素瘤、非小细胞肺癌、肾癌、前列腺癌、结直肠癌、胰腺癌、胆管癌、肝癌、胃及食道癌、乳腺癌、小细胞肺癌等疾病中进行了临床研究,取得了显著性临床效果,能够阻止晚期转移性肿瘤的进程,有望实质性改善患者总生存期。研究数据显示,在肿瘤高水平表达pd-l1(肿瘤比例得分≥50%)的晚期非小细胞肺癌(nsclc)患者中,与标准化疗相比,keytruda单药治疗在主要终点(无进展生存期,pfs)和次要终点(总生存期,os)均表现出优越性。
6.目前的共识是pd-l1表达高,pd1或pdl1免疫药物整体效果比较好。然而多项临床试验结果提示,只有约20%的nsclc患者能从中获益,其它肿瘤的大量患者以及恶性肿瘤患者对治疗没有反应,同时存在着药物相关的不良反应,包括皮肤瘙痒、食欲不振、疲劳等,皮肤炎、结肠炎、肝炎、下垂体炎等。pd1或pdl1两种阻断剂的不良反应以及疗效之间的差异需要在临床试验中进一步探讨,用于指导临床用药,降低不良反应对特殊人群的危害,取得更好的临床疗效。因此,探寻合适的疗效检测标志物,进而精准的选择出免疫治疗潜在的获益人群成为研究的热点。pd-l1在肿瘤细胞或肿瘤基质的表达,已经被建议作为pd-1或pd-l1定向免疫治疗反应预测的潜在疗效预测标志物。但目前对pd-l1表达的检测尚未得到统一的国际标准。研究pd-l1在不同肿瘤的表达情况,以及其与患者临床病理参数、预后的相关性,可为不同肿瘤的免疫治疗提供治疗及预后相关的临床参考和依据;二者与肿瘤的密切关系决定了pd-l1是当前肿瘤诊断和免疫治疗的热门分子靶标之一,其表达水平也是肿瘤预后的指标之一。
7.到目前为止,通过手术切除肿瘤或组织活检等有创技术来检测pd-1和pd-l1的表达程度,由于用于检测抗体的品牌、检测技术、检测时的环境条件以及判定pd-l1阳性的cut-off值的不同均可导致检测结果的不一致。由于活检程序的相关风险和免疫组织化学(ihc)的缺陷,肿瘤异质性空间表达导致pd-l1表达的不敏感和肿瘤取样不完全等因素可能导致pd-l1检测出现假阳性。此外,获取样本时患者可处于基线或其他各线治疗状态也是造成检测结果差异的原因之一。这些因素不但影响了pd-l1表达水平检测的一致性,同时也会影响其检测的可靠性和可重复性。除此之外,pd-l1表达水平的动态变化也是影响判定pd-l1确切的表达状态的因素之一。因此,常规检测方法如免疫组织化学(ihc)方法、原位免疫杂交技术(fish)等来预测抗pd-1/抗-pd-l1免疫治疗效果存在一定的片面性和局限性。随着癌症免疫疗法的不断发展,需要通过分子分型优化个体患者的治疗方法,并开发非侵入性分子影像工具,最终实现对临床免疫检查点封锁的动态监测。因此,快捷、简便、动态准确识别肿瘤细胞表面pd-l1蛋白表达水平的方法对肿瘤的诊断、免疫治疗及预后评估有着重要的意义。
8.目前,在肿瘤临床治疗过程中或治疗后,无创的、可重复性、高准确性地检测肿瘤pd-1和pd-l1的表达水平及活性尚难以实现,因而迫切需要特异性的影像检测技术来指导肿瘤治疗。分子影像在免疫治疗和个性化医学中发挥越来越重要的作用。其中,分子探针的制备是分子影像的关键,只有高灵敏度和特异性的分子探针引入体内后方可与细胞内特定的靶分子发生特异性结合并产生某种信号,通过在体外通过特定的影像设备,如:正电子发射计算机断层扫描(pet-ct)、单光子发射计算机断层成像术(spect)、磁共振成像(mri)以及化学发光设备等进行采集成像,从而实现高度特异性的诊断。
9.抗体药物存在着制备繁琐、体外稳定性较差、分子较大、标记困难、穿透力弱、翻译后修饰且费用昂贵等问题,限制了其进一步应用。因此,为了提高癌症诊断和治疗的特异性和准确性,弥补抗体的缺陷,迫切需要寻求针对肿瘤标志物设计小分子探针,以作为检测和治疗癌症的有效方法。多肽类靶向小分子药物及诊断探针以成本低、分子量小、生物相容性好、穿透性强、无免疫原性、并有较快的血液清除速率、且制备简单等特点,在肿瘤靶向给药、癌症诊断等方面彰显出很强的优越性,甚至显示了替代抗体类诊疗试剂的趋势。因此,在癌症研究中针对肿瘤标志物合理设计并筛选对癌细胞的高特异亲和多肽,继而发展成为肿瘤的诊断试剂及治疗药物,是解决上述难题的有效途径。采用非侵入性方法可对整个肿瘤和相关转移灶同时成像,其可能与pd-l1表达状态中的原发性肿瘤不同,具有ihc无可比拟的优势,也不需要切除任何组织。基于靶向多肽对pd-l1的高亲和力和特异性以及其增强的组织穿透,开发针对pd-l1的多肽类小分子探针对pd-l1高表达的多种肿瘤的诊断和治疗具有重要意义。
技术实现要素:
10.为解决现有技术中存在的技术问题,本发明的目的在于提供一种靶向程序性死亡配体-1(pd-l1)的多肽,该多肽对于pd-l1具有较高的特异性和亲和力,能够与多种肿瘤免疫治疗相关的标志物pd-l1蛋白特异高效结合;本发明还提供由该肽所衍生的能够与pd-l1蛋白结合的产品及上述多肽或其衍生的产品在制备预防或治疗性药物、诊断试剂或显像制剂中的用途。
11.为实现上述目的,本发明的技术方案如下:本发明通过对pdb数据库中有关pd-1-抑制剂-pd-l1三者复合物的晶体结构解析检索归纳,发现cdr loop区的一些关键氨基酸在结合过程中起主要作用,如pd-1(val64、ile126、leu128、ala132、ile134)和pd-l1(ile54、tyr56、met115、ala121、tyr123)。在pd-l1/pd-1相互作用表面内选出了三个主要的热点。第一个热点是一个经典的疏水性口袋,该口袋由tyr56,glu58,arg113,met115和tyr123的侧链组成,并且尺寸适合容纳六元芳香环(该口袋称为ile134口袋)。第二个热点位于ile126附近,它由met115,ala121和tyr123组成,其可以与ala121的羰基末端供体基团锚定。第三个热点是容纳tyr68,gln75和thr76的一个延伸槽。本发明根据pd-1/pd-l1相互作用的上述热点氨基酸位点和分子识别理论进行肽库的设计和构建。采用氨基修饰的tentagel树脂作为固相载体,利用fmoc合成策略进行混合均分合成一珠一物肽库。利用磁珠和磁场相互作用的方法进行高通量一珠一物肽库筛选,阳性肽珠经质谱鉴定,获得了一系列能特异性结合pd-l1的活性多肽。
12.具体地,本发明提供一种靶向pd-l1的多肽,其通式为如下(1)、(2)、(3)中的任意
一种:
13.(1)nx5x4x3ex2x1,其中x1是精氨酸、谷氨酰胺、天冬氨酸、组氨酸、赖氨酸或谷氨酸;x2是谷氨酸、天冬氨酸、亮氨酸、酪氨酸、苏氨酸或甘氨酸;x3是组氨酸、赖氨酸、酪氨酸、苏氨酸、丝氨酸或谷氨酸;x4是色氨酸、天冬氨酸、酪氨酸、精氨酸、组氨酸或赖氨酸;x5是赖氨酸、苏氨酸、酪氨酸、组氨酸、脯氨酸或谷氨酸;
14.(2)x8yx7x6tx5x4x3x2x1,其中x1是精氨酸、谷氨酰胺、天冬氨酸、组氨酸、赖氨酸或谷氨酸;x2是谷氨酸、天冬氨酸、亮氨酸、酪氨酸、苏氨酸或甘氨酸;x3是组氨酸、赖氨酸、酪氨酸、苏氨酸、丝氨酸或谷氨酸;x4是丝氨酸、天冬氨酸、酪氨酸、精氨酸、组氨酸或赖氨酸;x5是赖氨酸、苏氨酸、酪氨酸、组氨酸、色氨酸或谷氨酸;x6是赖氨酸、苏氨酸、谷氨酸或酪氨酸;x7是甲硫氨酸、天冬酰胺或精氨酸;x8是精氨酸、赖氨酸、苏氨酸或丝氨酸;
15.(3)x
15
x
14
x
13
x
12
x
11
x
10
x9x8x7x6x5x4x3x2x1,其中,x1是谷氨酸、谷氨酰胺或天冬氨酸;x2是谷氨酸、天冬氨酸、组氨酸或丝氨酸;x3是谷氨酸、丝氨酸或丙氨酸;x4是苏氨酸、赖氨酸、酪氨酸、精氨酸或脯氨酸;x5是色氨酸、酪氨酸、精氨酸或组氨酸;x6是赖氨酸、苏氨酸或酪氨酸;x7是天冬酰胺、苏氨酸、谷氨酸、异亮氨酸或谷氨酰胺;x8是甲硫氨酸、天冬酰胺或精氨酸;x9是酪氨酸、丙氨酸或天冬氨酸;x
10
是精氨酸、赖氨酸、苏氨酸或丝氨酸;x
11
是苏氨酸或脯氨酸;x
12
是谷氨酰胺或赖氨酸;x
13
是苯丙氨酸或精氨酸;x
14
是组氨酸或酪氨酸;x
15
是丙氨酸或谷氨酰胺。
16.作为优选,本发明所述靶向pd-l1的多肽的氨基酸序列为如下任意一种:
17.(1)nkwtede;
18.(2)rymetwksdq;
19.(3)kynetwrsed;
20.(4)ahfqytareyrpahe;
21.(5)qyfqtkdriyhpase;
22.(6)ahrkpsarqyr pase。
23.上述靶向pd-l1的多肽对pd-l1具有高特异性和亲和力。
24.本发明中,氨基酸残基可以是l-型、d-型或l-型与d-型的混合。
25.本发明提供一种核酸,其包含编码所述多肽的核苷酸序列。
26.优选地,所述核酸包含编码氨基酸序列为nkwtede、rymetwksdq、kynetwrsed、ahfqytareyrpahe、qyfqtkdriyhpas或ahrkpsarqyrpase的多肽的核苷酸序列。
27.本发明还提供包含所述核酸的生物材料。
28.所述生物材料包括表达盒、载体、转座子、宿主细胞或转基因细胞系。
29.所述载体包括但不限于克隆载体、表达载体、质粒载体,所有包含至少一个拷贝的所述编码本发明所述靶向pd-l1多肽的核酸的载体均在本发明的保护范围内。
30.所述宿主细胞或转基因细胞系可以为来源于微生物、植物或动物的细胞或细胞系,所有含有至少一个拷贝的所述编码本发明所述靶向pd-l1多肽的核酸或包含携带至少一个拷贝的所述核酸的载体的宿主细胞或转基因细胞系均在本发明的保护范围内。
31.本发明所述的靶向pd-l1的多肽可采用本领域常规制备方法制备得到。
32.作为本发明的一种实施方式,采用fmoc固相多肽合成法制备所述靶向pd-l1的多肽。
33.本发明还提供所述多肽的衍生物,其为由所述多肽形成的二价体或多价体,所述的二价体或多价体能够靶向pd-l1。
34.优选地,所述的二价体或多价体通过连接分子经共价连接或非共价连接形成,或者通过与多聚体混合经非共价连接形成。
35.更优选地,所述共价连接的连接分子为异硫氰酸荧光素(fitc)、6-叔丁氧羰肼基烟酸(hynic)、1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(edc)和n-羟基琥珀酰亚胺(nhs)。
36.更优选地,所述的非共价连接的连接分子为亲脂性近红外染料。所述亲脂性近红外染料包括但不限于dir。
37.更优选地,所述多聚体为聚乙二醇(peg)、聚乙烯醇(pva)、环糊精、聚酰胺-胺型树枝状高分子(pamam)、聚乳酸(pla)、聚乳酸-乙醇胺(plga)中的任意一种或至少两种的组合。
38.本发明还提供所述多肽或所述多肽的衍生物的偶联物,所述偶联物为由所述多肽或所述多肽的衍生物与载体以共价或非共价的方式连接或作用得到。
39.优选地,所述载体包括荧光素、抗体、多聚物、高分子材料、纳米材料、脂质体、油性化合物、无机材料中的任意一种或多种。
40.进一步优选地,所述高分子材料包括聚酯、聚酸酐、聚酰胺磷脂聚合物胶束、聚乳酸-羟基乙酸共聚物、聚乙二醇、壳聚糖中的任意一种或多种。
41.进一步优选地,所述无机材料包括纳米金、碳材料、钙材料、磁性材料、介孔硅材料、量子点中的任意一种或多种。
42.本发明进一步提供所述多肽或编码所述多肽的核酸或含有所述核酸的生物材料或所述多肽的衍生物或所述偶联物的如下任意一种应用:
43.(1)在制备用于pd-l1/pd1介导疾病的预防或治疗的药物、诊断试剂、诊断试剂盒或显影制剂中的应用;
44.(2)在诊断、预防或治疗pd-l1/pd1介导疾病中的应用;
45.(3)在制备用于检测细胞pd-l1表达水平的试剂中的应用;
46.(4)在检测细胞pd-l1表达水平中的应用。
47.本发明中,所述pd-l1/pd1介导疾病包括肿瘤、类风湿性关节炎、hcv感染、过敏性紫癜、再生障碍性贫血、动脉粥样硬化、冠心病中的任意一种。
48.优选地,所述肿瘤为pd-l1高表达的肿瘤。所述pd-l1高表达的肿瘤包括黑色素瘤、非小细胞肺癌、肾癌、前列腺癌、神经胶质瘤、结直肠癌、胰腺癌、胆管癌、肝癌、胃癌、食道癌和乳腺癌中的任意一种。
49.本发明还提供一种药物,其包含所述多肽或所述多肽的衍生物或所述偶联物。
50.优选地,所述药物的活性成分还包含能够杀伤肿瘤细胞的制剂。
51.更优选地,所述能够杀伤肿瘤细胞的制剂为能够杀伤肿瘤细胞的化学药物、生物药物、纳米药物、放射性药物、光热治疗或光动力治疗药物中的任意一种或多种;或者,为烷化剂、抗代谢药物、抗肿瘤天然药物、抗肿瘤抗生素、激素、金属络合物或肿瘤放射靶向标记物中的任意一种或多种。
52.更优选地,所述药物还包括与所述的多肽、所述衍生物或所述偶联物相缀合或混合的载体。
53.所述载体包括但不限于用于制备靶向药物的载体。
54.所述载体包括纳米材料、脂质体或油性化合物中的任意一种,或者为由多种油性化合物组成的混合物。
55.将所述多肽或所述多肽的衍生物或所述偶联物与上述载体缀合或混合得到的药物在机体内能够更稳定地被运输到靶细胞。
56.更优选地,所述药物还可包含药学上可接受的辅料或佐剂。
57.本发明提供的靶向pd-l1的多肽具有特异、高效靶向pd-l1的作用,可以作为靶头有效提高药物或载有药物的载体(如纳米材料、脂质体等)在pd-l1阳性细胞中的含量。进一步添加药学上可接受的辅料或佐剂制备更有效的靶向抗癌药物。
58.本发明还提供一种用于pd-l1/pd1介导疾病的诊断试剂或试剂盒,其包含所述多肽或所述多肽的衍生物或所述偶联物。
59.本发明还提供一种显像制剂,包含所述多肽或所述多肽的衍生物或所述偶联物。
60.优选地,所述成像剂还包含成像剂。所述的成像剂为放射性核素、放射性核素标记物、磁共振造影剂或分子影像制剂中的任意一种。
61.更优选地,所述成相剂中,所述多肽或所述多肽的衍生物或所述偶联物与所述成像剂相偶联或混合。
62.本发明的有益效果在于:
63.本发明提供的靶向pd-l1的多肽对pd-l1具有较高的亲和力和特异性,能够特异高效地靶向pd-l1阳性肿瘤细胞,具有选择性强、纯度高、分子量小、特异性强、无免疫原性、安全可靠、可以采用化学合成的方法制备、制备方法简单易行、成本低廉等优势,能够在实践中用于:
64.(1)检测肿瘤细胞中pd-l1表达情况的小分子探针,用于制备基于pd-l1免疫治疗的预测和伴随诊断试剂,以实时监控免疫治疗的疗效以及筛查适于进行免疫治疗的患者,为实时监控肿瘤免疫治疗后的复发、转移提供了简便快捷、经济、准确的检测手段,以便及时调整治疗方案,尽早进行临床干预,防止病情进展,改善患者预后提供了新的手段。通过对pd-l1生物标志物的检测有利于制定个性化治疗方案以取得最优的治疗效果,具有较好的应用前景和临床指导意义。
65.(2)作为靶向多肽与能杀伤癌细胞的制剂相缀合或混合,用于多种肿瘤的靶向治疗和成像,或者,经优化后单独作为多肽抑制剂药物的活性成分,,阻断pd-1/pd-l1信号通路,激活免疫治疗。对于现有的基于pd-1/pd-l1阻断剂的免疫治疗中,如何在减少不良反应的同时应用到更多的恶性肿瘤治疗上,与其他免疫治疗、化疗、放疗、小分子靶向药物联合治疗提供了重要的理论和借鉴意义,具有广阔的应用前景。
66.本发明提供的靶向pd-l1的多肽可为黑色素瘤、非小细胞肺癌、肾癌、前列腺癌、神经胶质瘤、结直肠癌、胰腺癌、胆管癌、肝癌、胃癌、食道癌和乳腺癌等多种肿瘤的早期诊断和免疫治疗中检查点的动态监测等提供重要的理论和临床参考依据,对于优化个体患者的治疗方案有着重要的意义和应用价值。鉴于pd-1/pd-l1通路在其他多系统疾病中也有着重要的调节作用,本发明的多肽为类风湿性关节炎、hcv病毒感染、过敏性紫癜、再生障碍性贫血、动脉粥样硬化、冠心病等疾病的免疫治疗、适宜人群的筛选和预后检测评估等提供新的思路。
附图说明
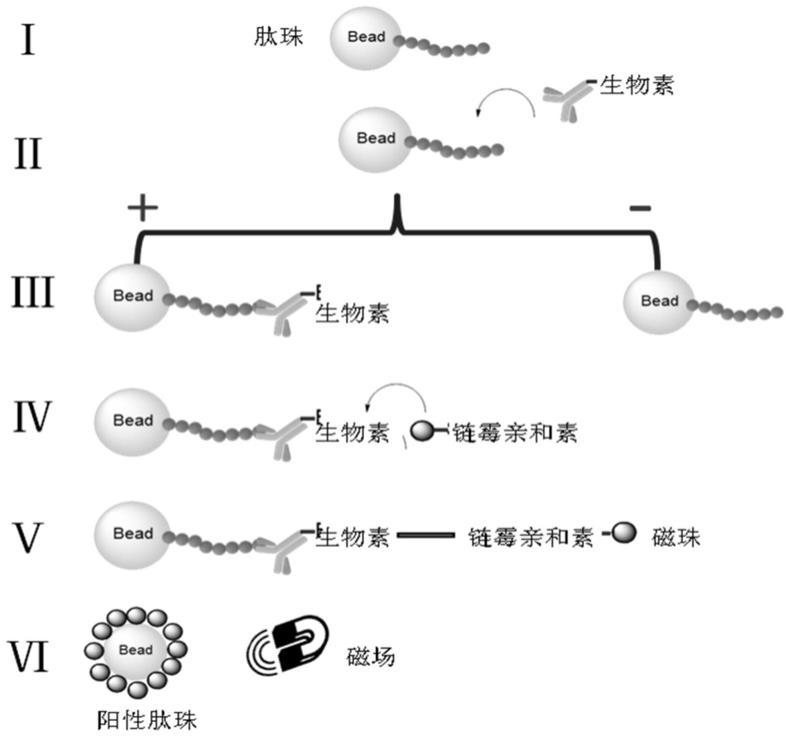
67.图1为本发明实施例1中筛选pd-l1靶向多肽的原理示意图。
68.图2为本发明实施例1中pd-l1阳性多肽-磁珠的筛选图。
69.图3为本发明实施例2中利用表面等离子共振(spri)方法检测pd-l1阳性多肽分别与人pd-l1蛋白的亲和力大小;其中,(a)-(f)分别是多肽p1、p2、p3、p4、p5、p6与人pd-l1蛋白的结合作用分析结果。
70.图4为本发明实施例6中多肽p1、p2分别与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平的特异亲和性检测;其中,(a)是多肽p1与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测;(b)是多肽p2与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测。
71.图5为本发明实施例6中多肽p3、p4分别与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平的特异亲和性检测;其中,(a)是多肽p3与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测;(b)是多肽p4与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测。
72.图6为本发明实施例6中多肽p5、p6分别与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平的特异亲和性检测;其中,(a)是多肽p5与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测;(b)是多肽p6与pd-l1高表达细胞系mda-mb-231、mc38和阴性细胞a549的细胞水平特异亲和性检测。
具体实施方式
73.下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
74.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
75.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
76.实施例1 pd-l1靶向多肽文库的构建和筛选
77.(一)实验仪器与材料
78.n-甲基吗啉(nmm),哌啶,三氟乙酸(tfa),二氯甲烷(dcm),茚三酮,维生素c,苯酚,四甲基脲六氟磷酸盐(hbtu),六氢吡啶,三异丙基硅烷(tis),乙二硫醇(edt),n,n二甲基甲酰胺(dmf),无水乙醚,树脂,甲醇,各种fmoc保护氨基酸,链霉亲和素磁珠(mb-streptavidin),生物素标记试剂盒,多肽合成管,摇床,真空水泵,旋转蒸发仪,激光共聚焦显微镜(zeiss lsm 710),上述试剂和材料均从商业途径获得。
79.(二)溶剂配制
80.脱保护溶剂的配制为六氢吡啶:n,n二甲基甲酰胺=1:4;
81.反应液的配制为n-甲基吗啉:n,n二甲基甲酰胺=1:24;
82.裂解液的配制为三氟乙酸(92.5%)、三异丙基硅烷(2.5%)、乙二硫醇(2.5%)、超纯水(2.5%);
83.茚三酮测试液的配制为茚三酮:维生素c:苯酚=1:1:1。
84.(三)pd-l1“一珠一物”多肽文库的合成
85.采用fmoc固相肽合成方法合成多肽文库,具体方法为通过混合裂分的方式将氨基酸随机地逐个偶联到固相树脂上,然后在强酸下将侧链保护基团去除,继而进行筛选。具体方法如下:
86.(1)称取400mg的tentagel-nh2树脂,按照上述固相多肽合成程序循环,依次加入200mg的met、gly依次进行反应;
87.(2)待反应完成后,把树脂均分3份,向每管分别加入100mg的glu、asp、gln与等量的hbtu进行偶联,待偶联完毕后,把3管树脂脱保护后混合,再把树脂均分为4份,向每管分别加入100mg的glu、asp、his、ser与等量的hbtu进行偶联;
88.(3)待偶联完毕后,把4管树脂脱保护后混合。再把树脂均分为3份,向每管分别加入110mg的glu、ser、ala与等量的hbtu进行偶联;
89.(4)待偶联完毕后,把4管树脂脱保护后混合。再把树脂均分为5份,向每管分别加入60mg的thr、lys、tyr、arg、pro与等量的hbtu进行偶联;
90.(5)待偶联完毕后,把5管树脂脱保护后混合。再把树脂均分为4份,向每管分别加入80mg的trp、tyr、arg、his与等量的hbtu进行偶联;
91.(6)待偶联完毕后,把4管树脂脱保护后混合。再把树脂均分为3份,向每管分别加入90mg的lys、thr、tyr与等量的hbtu进行偶联;
92.(7)待偶联完毕后,把3管树脂脱保护后混合。再把树脂均分为5份,向每管分别加入70mg的asn、glu、thr、gln、ile与等量的hbtu进行偶联;
93.(8)待偶联完毕后,把5管树脂脱保护后混合。再把树脂均分为3份,向每管分别加入120mg的met、asn、arg与等量的hbtu进行偶联;
94.(9)待偶联完毕后,把3管树脂脱保护后混合。再把树脂均分为3份,向每管分别加入80mg的tyr、ala、asp与等量的hbtu进行偶联;
95.(10)待偶联完毕后,把3管树脂脱保护后混合。再把树脂均分为4份,向每管分别加入80mg的arg、lys、thr、ser与等量的hbtu进行偶联;
96.(11)待偶联完毕后,把4管树脂脱保护后混合。再把树脂均分为2份,向每管分别加入120mg的thr、pro与等量的hbtu进行偶联;
97.(12)待偶联完毕后,把2管树脂脱保护后混合。再把树脂均分为2份,向每管分别加入180mg的gln、lys与等量的hbtu进行偶联;
98.(13)待偶联完毕后,把2管树脂脱保护后混合。再把树脂均分为2份,向每管分别加入120mg的phe、arg与等量的hbtu进行偶联;
99.(14)待偶联完毕后,把2管树脂脱保护后混合。再把树脂均分为2份,向每管分别加入180mg的his、tyr与等量的hbtu进行偶联;
100.(15)待偶联完毕后,把2管树脂脱保护后混合。再把树脂均分为2份,向每管分别加入180mg的ala、gln与等量的hbtu进行偶联,待偶联完毕后,把2管树脂脱保护后混合。经过甲醇置换和收缩步骤,真空抽干,得到加载有肽库的干燥树脂备用。
101.(四)pd-l1阳性多肽的筛选
102.(1)取干燥肽库用1
×
pbs溶胀过夜,然后用1
×
pbs洗3次,加入5%的脱脂牛奶在混旋仪上37℃对肽珠表面封闭2h,再用1
×
pbs洗3次;
103.(2)根据生物素标记试剂盒标记pd-l1蛋白,取生物素(biotin)标记的pd-l1蛋白
与多肽库混合,37℃孵育2h后用1
×
pbs洗3次;
104.(3)然后取100μl mb-streptavidin加入肽库在混旋仪上37℃避光混合孵育2h。把孵育后含多肽库ep管置于磁力架上。阳性多肽受磁力影响吸附于ep管侧壁,而阴性多肽由于重力沉降在ep管底。
105.筛选pd-l1靶向多肽的原理示意图如图1所示,当阳性多肽珠与生物素标记的受体蛋白孵育后,阳性肽珠特异性识别蛋白,标记链霉亲和素的磁球通过识别生物素而识别阳性肽珠。pd-l1阳性多肽-磁珠筛选结果如图2所示,其中虚线框内的为阳性肽珠,阳性肽珠表面因包覆一层磁珠而具有磁性因此能够被磁场捕获。经筛选获得6个pd-l1阳性多肽p1、p2、p3、p4、p5、p6,其氨基酸序列如表1所示,按表1所示的氨基酸序列经化学合成即得本发明的6条多肽p1、p2、p3、p4、p5、p6(seq id no.1~6)。按表1所示的氨基酸序列重新合成阳性多肽并在多肽的n端标记荧光,用于细胞成像验证多肽的功能,经maldi-tof鉴定和hplc纯化后用于后续试验。
106.表1 pd-l1阳性多肽的氨基酸序列
107.序列号多肽名称氨基酸序列seq id no.1p1nkwtedeseq id no.2p2rymetwksdqseq id no.3p3kynetwrsedseq id no.4p4ahfqytareyrpaheseq id no.5p5qyfqtkdriyhpaseseq id no.6p6ahrkpsarqyrpase
108.实施例2多肽p1、p2、p3、p4、p5、p6与pd-l1蛋白的亲和作用检测
109.通过表面等离子共振(spri)方法检测多肽p1、p2、p3、p4、p5和p6与pd-l1蛋白的亲和作用,具体方法如下:
110.将1mg/ml的p1,p2,p3,p4,p5,p6多肽及1
×
pbs点到芯片上,在4℃湿润条件下孵育过夜,然后用10
×
pbs清洗10min,再用1
×
pbs清洗10min,最后用去离子水清洗2次,每次10min,浸入含5%脱脂牛奶的1
×
pbs中,4℃条件下孵育过夜,然后用10
×
pbs清洗10min,1
×
pbs清洗10min,最后用去离子水清洗2次,每次10min,用氮气吹干,装芯片上机(plexeraht表面等离子共振成像系统)。
111.流动相依次通过1
×
pbs、2
×
pbs、0.625μg/ml、1.25μg/ml、2.5μg/ml、5μg/ml和10μg/ml的人pd-l1纯化蛋白,记录分析spri信号。
112.结果如图3所示,p1,p2,p3,p4,p5,p6的spri信号随着蛋白浓度的增加逐渐增强,说明本发明的p1,p2,p3,p4,p5,p6多肽对pd-l1都具有较强的结合力,亲和力达到10-8
~10-9
m,接近抗体的亲和力,可作为探针靶向表达pd-l1的多种肿瘤细胞,用于相关的研究和应用。
113.实施例3多肽p1、p2、p3、p4、p5、p6的显像制剂的制备
114.本实施例提供多肽p1、p2、p3、p4、p5、p6的显像制剂的制备,具体方法如下:
115.称取300mg的wang-glu树脂,按照固相多肽合成程序循环,先进行脱保护,然后依次加入一定数量的glu,asp,glu,thr,trp,lys,asn及等量的htbu依次进行反应。偶联反应结束后,脱保护,清洗。加入ε-氨基己酸进行反应,偶联结束后,脱保护,清洗。加入fitc进行
避光偶联反应,反应结束后,脱保护,清洗。最后向上述树脂中裂解液,脱出侧链保护基团,真空抽干,得到粗品多肽荧光偶联物,再进行hplc纯化,得到纯度达95%的多肽p1、p2、p3、p4、p5、p6的显像制剂,可用于荧光成像。
116.实施例4多肽p1、p2、p3、p4、p5、p6的偶联物的制备
117.本实施例提供多肽p1、p2、p3、p4、p5、p6的偶联物的制备,具体方法如下:
118.称取300mg的wang-glu树脂,按照固相多肽合成程序循环,先进行脱保护,然后依次加入一定数量的glu,asp,glu,thr,trp,lys,asn及等量的htbu依次进行反应。偶联反应结束后,脱保护,清洗。加入ε-氨基己酸进行反应,在吡啶/n,n二甲基甲酰胺/二氯甲烷比例为1:5:7的溶液中,将fitc与肽珠混合反应过夜。反应结束后,清洗。最后向上述树脂中裂解液,脱出侧链保护基团,真空抽干,得到粗品多肽荧光偶联物。
119.实施例5基于多肽p1、p2、p3、p4、p5、p6的试剂盒的制备
120.多肽异硫氰酸荧光素(fitc)偶联物采用固相合成方法获得,在重新合成的p1、p2、p3、p4、p5、p6多肽微珠上分别继续偶联ε-氨基己酸。在吡啶/n,n二甲基甲酰胺/二氯甲烷比例为1:5:7的溶液中,将fitc与肽珠混合反应过夜。经裂解液裂解后得到p1、p2、p3、p4、p5、p6多肽fitc偶联物,采用maldi-tof鉴定和hplc纯化用于后续实验。
121.实施例6多肽p1,p2,p3,p4,p5,p6与pd-l1高表达细胞mda-mb-231和mc38的相互作用
122.本实施例分析多肽p1,p2,p3,p4,p5,p6与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用,其中,乳腺癌细胞系mda-mb-231用含10%胎牛血清的dmem培养基培养,结肠癌细胞系mc38用含10%胎牛血清的mem/ebss培养基培养,非小细胞肺癌细胞系a549用含10%胎牛血清的rpmi 1640培养基培养,具体方法如下:
123.(1)多肽p1分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
124.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p1,4℃避光孵育20min后,用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
125.结果如图4的a所示,加入多肽p1的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p1多肽结合在pd-l1阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且其特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p1多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明p1能够特异性的靶向pd-l1,也进一步验证了图3的a中的spri数据的可靠性。
126.(2)多肽p2分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
127.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p2,4℃避光孵育20min后,
用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
128.结果如图4的b所示,加入多肽p2的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p2多肽结合在阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且其特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p2多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明多肽p2能够特异性的靶向pd-l1,也进一步验证了图3的b中的spri数据的可靠性。
129.(3)多肽p3分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
130.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p3,4℃避光孵育20min后,用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
131.结果如图5的a所示,加入多肽p2p3的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p3多肽结合在阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p3多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明多肽p3能够特异性的靶向pd-l1,也进一步验证了图3的c中的spri数据的可靠性。
132.(4)多肽p4分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
133.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p4,4℃避光孵育20min后,用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
134.结果如图5的b所示,加入多肽p4的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p4多肽结合在阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p4多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明多肽p4能够特异性的靶向pd-l1,也进一步验证了图3的d中的spri数据的可靠性。
135.(5)多肽p5分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
136.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p5,4℃避光孵育20min后,
用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
137.结果如图6的a所示,加入多肽p5的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p5多肽结合在阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p5多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明多肽p5能够特异性的靶向pd-l1,也进一步验证了图3的e中的spri数据的可靠性。
138.(6)多肽p6分别与pd-l1高表达细胞mda-mb-231和mc38及低表达细胞a549的相互作用
139.以1
×
105/ml的细胞浓度植入圆形玻底培养皿(35mm),37℃,5%co2细胞培养箱中培养24h后,弃去培养液,三种细胞中分别加入含1μmol/l hoechst 33342,4℃避光孵育15min后,用预冷1
×
pbs洗涤2次,分别加入50μm的fitc标记多肽p6,4℃避光孵育20min后,用预冷1
×
pbs洗涤3次。用激光扫描共聚焦显微镜(zeiss lsm 710)检测细胞中的荧光分布。
140.结果如图6的b所示,加入多肽p6的mda-mb-231和mc38的细胞膜上观测到很强的绿色荧光,而a549细胞没有荧光。结果表明,p6多肽结合在阳性细胞的细胞膜上,与人pd-l1阳性细胞系的识别具有专一性,而且特异性与靶标蛋白的表达量呈正相关,可以作为靶向分子用于相关的诊断和检测。相反,p6多肽对低pd-l1表达的阴性细胞a549没有观测到绿色荧光信号和抗体信号,进一步说明多肽p6能够特异性的靶向pd-l1,也进一步验证了图3的f中的spri数据的可靠性。
141.综上所述,本发明的多肽p1,p2,p3,p4,p5,p6具有靶向表达pd-l1阳性肿瘤细胞的特性,因而在实际应用中,可以将本发明的多肽p1,p2,p3,p4,p5,p6作为靶向多肽,与能够杀伤癌细胞的制剂相缀合或混合,用于肿瘤的靶向治疗和成像。
142.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
